Raport de Cercetare
Grant: IMPACTUL CRIOCONSERVARII ASUPRA SISTEMELOR ANTIOXIDANTE ALE CELULEI SPERMATICE LA SPECIA CANINA
Universitatea:
UNIVERSITATEA DE STIINTE AGRICOLE SI MEDICINA VETERINARA A BANATULUI
SCOP:
Proiectul de cercetare are ca scop studiul unor aspecte privind modificarile activitatii unor enzime antioxidante, in stresul oxidativ provocat de socul termic aplicat materialului seminal de caine in timpul crioconservarii, realizandu-se corelatii intre valorile parametrilor citomorfologici si biochimici si tehnica de crioconservare
OBIECTIVE:
Determinarea unor parametrii citologici si biochimici ai materialului seminal proaspat si crioconservat la specia canina;
Determinarea activitatii unor enzime antioxidante: catalaza si superoxid dismutaza precum si a gradului de peroxidare lipidica din plasma seminala canina;
Influenta crioprotectorilor, diluantilor si a tehnicii de crioconservare asupra sistemelor de protectie antioxidanta si a gradului de peroxidare lipidica din materialul seminal canin crioconservat;
ACTIVITATI:
Elaborarea tehnicii de crioconservare utilizand: trei diluanti diferiti (Triladyl, Biladyl si Bioxcell), trei crioprotectori (glicerol, etilenglicol, propilenglicol) in trei concentratii diferite (0,25M, 0,5M, 1M) precum si viteze de congelare diferite;
Determinarea motilitatii, viabilitatii si morfologiei materialului seminal proaspat si crioconservat;
Determinarea continutului proteic din plasma seminala a materialului seminal proaspat si crioconservat;
Determinarea activitatii catalazei si superoxid dismutazei din plasma seminala a materialului seminal proaspat si crioconservat;
Determinarea continutului de malonildialdehida din plasma seminala a materialului seminal proaspat si crioconservat.
MOTIVATIA CERCETARII:
Tema acestui proiect reprezinta un punct de plecare in caracterizarea din punct de vedere biochimic a comportamentului celulei spermatice la specia canina in timpul crioconservarii. Implicarea stresului oxidativ in scaderea calitatii materialului seminal in cadrul crioconservarii este acceptata doar partial, in literatura de specialitate datele privind cinetica si mecanismul sistemului de protectie antioxidanta sunt limitate, motiv pentru care proiectul isi propune sa faca un studiu detaliat al relatiei dintre nivelul sau intensitatea factorilor de stres oxidativ si gradul de afectare al celulei spermatice.
Faptul ca, pana in 1989, domeniul animalelor de companie a fost un domeniu prohibit in medicina veterinara din Romania, a facut ca cercetarile privind aceste specii sa inregistreze un regres. Din 1990, preocuparile specialistilor si interesul crescatorilor, au inceput din ce in ce mai mult sa se indrepte spre specia canina, care este una din cele mai importante specii din cadrul domeniului animalelor de companie
Sensibilitatea celulei spermatice conduce la obligatia ca in toata perioada de timp petrecuta in afara conditiilor naturale, adica intre momentul recoltarii si al insamantarii sa se ia toate masurile pentru a proteja spermatozoidul de agentii cu actiune daunatoare asupra viabilitatii sale
Este binecunoscut faptul ca, atat motilitatea cat si activitatea metabolica a spermatozoizilor variaza odata cu temperatura. In stare congelata, spermatozoizi sunt imobili, iar activitatea lor metabolica este complet intrerupta. Daca descresterea temperaturii se face brusc, se instaleaza socul a frigore care se concretizeaza in cresterea permeabilitatii membranei celulare si pierderea in consecinta a proteinelor, lipidelor, potasiului si a fosforului lipidic
In conditiile congelarii spermei, desi adaugarea glicerinei constituie o masura de crioprotectie, numarul spermatozoizilor care nu pot supravietui variatiei atat de largi de temperatura este foarte mare
Socul termic poate fi resimtit chiar si de sperma diluata, cu toate ca diluantii cu galbenus de ou confera o protectie considerabila, fat 141i89b a de scaderile bruste ale temperaturii. S-au efectuat numeroase studii in care s-a urmarit imbogatirea compozitiei diluantilor in vederea asigurarii protectiei optime a celulei spermatice fata de scaderile bruste ale temperaturii.
Astfel se utilizeaza:
diverse sisteme de tamponare a pH-ului
suplimentarea galbenusului de ou cu adausuri proteice , calitatea diluantului fiind imbunatatita prin adaugarea de suplimente comerciale de tip Equex sau Orvus ES
adaugarea de antioxidanti neenzimatici din clasa vitaminelor sau comerciali de tipul Sperm-Fit sau rebamipid precum si enzimatici
adaugare de fractiune prostatica
adaugare de colesterol
Socul termic al congelarii si decongelarii este unul din factorii determinanti in instalarea stresului oxidativ la nivelul celulei spermatice
In celule formarea de radicali liberi (RL) se produce pe cale endogena la nivelul mitocondriilor, peroxizomilor si lizozomilor, precum si la nivel membranar si microsomal, in cursul sintezei de prostaglandine (fig.1).
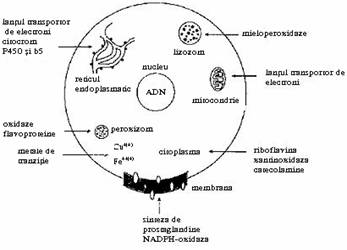
Fig. 1 Sursele celulare de radicali liberi
Sursele exogene principale de formare a RL sunt: substantele care oxideaza glutationul, radiatiile ionizante, radiatiile solare, socul termic, medicamente, aditivi, precum si unele pesticide.
Desi au o durata de viata foarte scurta, SRO actioneaza asupra tuturor produsilor biologic activi: proteine si aminoacizi, lipide, glucide si acizi nucleici.
Cele mai profunde modificari produse de SRO asupra metabolismului lipidic se datoresc peroxidarii lipidelor celulare si extracelulare, cu formare de peroxizi lipidici. Cele mai expuse la oxidare sunt lipidele ce contin in structura lor acizi grasi polinesaturati (PUFA), preponderent linoleic si arahidonic.
Modificarile majore produse de SRO sunt:
leziunile ADN ce intereseaza T, C, A, G si dezoxiriboza urmate de injurii celulare si mutatii
inhibitia activitatii nucleotid - coenzimei, modificari in starea de oxidare a NADPH
perturbarea enzimelor tiol-dependente, modificarea raportului tiol disulfuri
modificarea glicoproteinelor (depolimerizarea acidului hialuronic);
modificari ale proteinelor (cresterea turn-overului, a hidrofobicitatii, a sensibilitatii la proteoliza)
peroxidarea lipidelor, modificari in structura si functia membranei
alterarile proteinelor membranare si tulburari de transport prin membrana
In manifestarea efectele nocive ale SO sunt implicate mecanisme multifactoriale, prezentate in fig. 2.
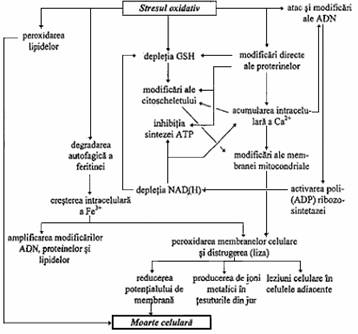
Fig. 2 Mecanismele multifactoriale implicate in stresul oxidativ la nivel celular
Cele mai sensibile componente celulare fata de actiunea SRO sunt lipidele, atat cele din sistemele lipoproteice de transport cat si cele constituente ale biomembranelor, prin catenele hidrocarbonate ale acizilor grasi constituenti, in special acizi grasi nesaturati. Acestia duc la formarea radicalilor peroxil si hidroperoxizilor care mai departe se transforma in peroxizi.
Produsii de peroxidare lipidica sunt:
produsii de clivaj ai catenelor si ai oxidarii recurente (alcani, alchene, hidroxialdehide, hidroperoxi-aldehide, malonildialdehida, compusii dicarbonilici, cetone saturate si nesaturate);
produsi de rearanjare si consecutivi (hidroxiacizi, cetoacizi, cetohidroxiacizi, dihidroxiacizi, cetodihidroxiacizi, trihidroxiacizi);
produsi ulteriori de peroxidare (cicloendoperoxizi si compusi analogi);
dimeri si polimeri;
dimeri si polimeri cuplati prin punti O-O- si C-C-
Peroxizii lipidici actioneaza in calitate de substante lezante prin modificarea proprietatilor membranei celulare si a membranei mitocondriilor si lizozomilor (cresterea fluiditatii, fragilitatii si permeabilitatii), ceea ce duce la disparitia gradientilor osmotici, chimici si electrici. In acest fel scade sau este anulata excitabilitatea celulara, perturbandu-se profund procesele metabolice cu aparitia leziunilor morfologice
Numeroase lucrari stiintifice au acordat interes cercetarilor privind influenta tehnicilor de crioconservare asupra continutului de SRO respectiv de produsi de peroxidare lipidica a materialului seminal in cazul diferitelor specii. Mecanismul de inducere a SO in timpul crioconservarii nu este pe deplin cunoscut, aprecierea instalarii acestuia facandu-se pe baza evaluarii activitatii enzimelor oxidoreducatoare: superoxid dismutaza (SOD E.C. 1.15.1.1. , catalaza (CAT E.C. 1.11.1.6. , glutation peroxidaza (GSH-Px E.C.1.11.1.9 , precum si a produsilor de peroxidare lipidica, in mod special a malonildialdehidei (MDA)
Mecanismul de actiune al sistemului antioxidant include trei nivele de protectie: prevenirea, interceptia si repararea prezentand urmatoarele caracteristici:
actiunea sinergica la diferite nivele ale lantului de formare a RL in organism ceea ce asigura posibilitatea reglarii si limitarii excesului de RL sau SRO;
concentrarea prioritara pe primul radical O2 .- si pe ultimii peroxizi;
localizare intracelulara la nivelul membranelor si citosolului, in peroxizomi, mitocondrii si extracelulara in fluide, ceea ce sporeste eficienta; sistemele antioxidante pot actiona asupra mai multor specii de RL, de exemplu vitaminele K, E sau GSH-Px;
conectarea sistemelor enzimatice antioxidante (SOD, CAT si sistemul peroxidazelor) cu principalele reactii metabolice de glicoliza, ceea ce permite o regenerare continua a substratelor; SOD si CAT functioneaza singure, atat in citosol cat si extracelular, in timp ce GSH-Px actioneaza strans legata de procesele dependente de glicoliza;
viteza crescuta de reactie (aprox. 2x10-9Ms-1) a SOD si CAT, ceea ce duce la cresterea eficientei si la posibilitatea de a actiona catalitic, independent de furnizarea unor substraturi sau coenzime;
actiune cu caracter dublu, antioxidant si prooxidant atribuit: blocarii evolutiei formarii de RL la concentratii crescute de antioxidanti, actiunii sinergice a unor cupluri de antioxidanti, derivarii propagarii RL spre alte nivele si tinte precum si captarii de ioni metalici prooxidanti
Avand in vedere implicatiile majore pe care le are utilizarea congelarii in conservarea materialului seminal, au fost realizate numeroase studii care au vizat identificarea speciilor reactive ce pot afecta ireversibil capacitatea fecundanta a spermatozoizilor, insa pana in prezent, in tara noastra nu s-a cercetat gradul de afectare a enzimelor de protectie in cazul crioconservarii materialului seminal la specia canina.
1. Elaborarea metodei de crioconservare
Materialul seminal s-a recoltat prin excitatia manuala a penisului , executandu-se miscari ferme de comprimare si masaj liniar cranio-caudal asupra bulbilor erectili ai penisului, prin traversul furoului. Consecutiv debutului erectiei furoul a fost impins in spatele bulbilor erectili, in acest stadiu fiind eliminata in jeturi prima fractiune a ejaculatului (prespermatica). Dupa incetarea miscarilor copulatorii a fost colectata a doua fractiune a ejaculatului (spermatica), si dupa o pauza de cateva secunde a treia fractiune (prostatica).
Recoltarea s-a efectuat in vas colector de sticla steril, gradat si cu pereti dublii, avand posibilitatea de a mentine constanta temperatura la 37sC cu ajutorul apei calde. Imediat dupa recoltare vasul de colectare a fost asezat pe o suprafata termostata, fiind asigurata temperatura optima pe tot parcursul manipularii materialului seminal (fig. 3)

Fig. 3 Recipient utilizat la recoltarea materialului seminal
Un mare avantaj al acestei metode de recoltare il constituie faptul ca se pot recolta separat cele trei fractiuni, insa in cursul aplicarii acestei tehnici pot interveni usoare sangerari datorate unei crescute fragilitati a vaselor peniene superficiale fapt ce nu are efecte negative asupra calitatii materialului seminal
S-au utilizat trei tipuri de diluanti: Triladyl drept martor, Biladyl cu fractiunea B modificata prin inlocuirea crioprotectorului si Bioxcell, un diluant cu proteine vegetale.
Biladyl este un diluant concentrat utilizat la diluarea in doua etape a spermei de taur precum si la alte specii, in concordanta cu reglementarile Serviciului de certificare a materialului seminal (Certified Semen Service- CSC). Diluantul se prezinta sub forma a trei fractiuni: A, B si AB. Fractiunea A contine Tris , acid citric si fructoza. Fractiunea B are aceeasi compozitie ca si fractiunea A, insa contine in plus si glicerol. Fractiunea AB contine un amestec de antibiotice: Tylosin, Gentamicina, Lincomicina si Spectinomicina necesare pentru a preveni contaminarea cu flora microbiana care se poate realiza si datorita faptului ca azotul lichid poate reprezenta o sursa de infectie
Diluantul s-a preparat conform instructiunilor elaborate de firma producatoare Minitub, Abfüll-und Labortechnick GmbH&Co. KG, Tiefenbach, Germania, avand codurile: 13500/0004, 13500/005 respectiv 13500/0006.
Prepararea fractiunii AB ( 13500/0005):
S-au adaugat 12ml apa bidistilata si sterila (distilator Millipore) la amestecul de antibiotice utilizand o seringa sterila. Fractiunea AB reconstituita contine 100mg Tylosin, 500mg Gentamicina, 300mg Lincomicina si 600 mg Spectinomicina la 0,02 ml amestec.
Prepararea fractiunii A ( 13500/0004)
S-a transvazat fractiunea A intr-un cilindru gradat de 500 ml si s-a adaugat 390ml de apa bidistilata. Peste acest amestec se adauga 100 ml galbenus de ou (galbenusul de ou provine de la gaini furajate cu porumb, ouale neavand o vechime mai mare de 3 zile) preparat astfel: s-a trecut galbenusul pe o hartie de filtru pentru indepartarea urmelor de albus, s-a punctionat membrana galbenusului lasand sa se prelinga in cilindru continutul acestuia. S-a transferat amestecul intr-un balon Erlenmeyer si s-a omogenizat cu ajutorul unui agitator magnetic, prevenind spumarea. Amestecul omogenizat s-a filtrat printr-un tifon steril, s-a portionat si s-a stocat la congelator, la -20 C.
Prepararea fractiunii B (13500/0006)
Fractiunea B a diluantului difera fata de fractiunea A doar prin prezenta crioprotectorului (glicerol). Pentru a se putea utiliza diferiti crioprotectori, s-a preparat fractiunea B utilizand fractiunea A la care s-au adaugat crioprotectorii: glicerol (G), etilenglicol (EG) si propilenglicol(PG) in diferite concentratii prezentate in tabelul nr. 1.
Tabel 1. Concentratiile molare si procentuale ale fractiunii B la utilizand diferiti crioprotectori.
|
Concentratia molara (mol/l) |
Concentratia procentuala masica ( %) |
||
|
Glicerol r 1,25 g/cm3) |
Etilenglicol r 1,113 g/cm3) |
Propilenglicol r 1,04 g/cm3) |
|
Deoarece preparatul este patent de firma si compozitia sa exacta nu este prezentata in literatura de specialitate, inlocuirea fractiunii B din Biladyl cu fractiunea A la care s-a adaugat crioprotectorul s-a efectuat numai dupa consultarea producatorului.
Crioprotectorii utilizati, G si EG au fost procurati de la firma Sigma iar PG de la Merck.
Dupa preparare fractiunea B a fost portionata in tuburi Eppendorf de 1,5 ml si stocata la -20 C.
Prepararea diluantului Triladyl
Triladyl este un concentrat utilizat la diluarea intr-o singura etapa a materialului seminal bovin, ovin si caprin, fiind folosit cu succes si la crioconservarea materialului canin. Este constituit dintr-o singura fractiune pe baza de TRIS iar ca si crioprotector glicerolul.
Diluantul s-a preparat astfel: s-a diluat 100ml de concentrat cu 300ml apa bidistilata sterila intr-un cilindru gradat de 500 ml. Se adauga 100 ml galbenus de ou preparat in modul prezentat la prepararea diluantului Biladyl. Dupa preparare diluantul a fost portionat in eprubete sterile de unica folosinta si stocat la -20sC.
Prepararea diluantului Bioxcell
Diluantul s-a preparat prin simpla diluare a continutului flaconului de Bioxcell la 500 ml apa distilata sterila intr-un cilindru gradat. Dupa preparare diluantul a fost portionat in eprubete sterile de unica folosinta si stocat la -20sC.
1.3.Determinarea osmolalitatilor solutiilor
In cursul etapelor parcurse in cursul crioconservarii unul din cele mai importante modificari pe care trebuie sa le parcurga celula spermatica este schimbarea osmolaritatii mediului. Pentru a putea evalua impactul pe care il au solutiile utilizate asupra integritatii spermatozoizilor este absolut necesara cunoasterea osmolaritatii diluantilor folositi, comparativ cu cea a plasmei seminale..
Osmolalitatea solutiilor s-au determinat cu ajutorul unui osmometru cu vaporizare sub presiune model 5520 Vapro® (Wescor Biomedical S.U.A.), valorile fiind date in tabelul nr. 2.
Tabel 2. Osmolaritatile solutiilor utilizate comparativ cu a plasmei seminale canine
|
Nr. Crt. |
Denumirea mediului |
Osmolalitatea mOsmol/l |
|
|
Plasma seminala | |||
|
Triladyl | |||
|
Bioxcell | |||
|
Fractiunea A Biladyl | |||
|
Fractiunea B Biladyl |
|||
|
Glicerol |
0,25 M | ||
|
0,5 M | |||
|
M | |||
|
Etilenglicol |
0,25 M | ||
|
0,5 M | |||
|
M | |||
|
Propilenglicol |
0,25 M | ||
|
0,5 M | |||
|
M | |||
1.4. Diluarea materialului seminal
In functie de protocolul de diluare al fiecarui diluant s-a efectuat acesta etapa conform schemei prezentata in figura 4. Fractiunea spermatica a fost impartita in trei, fiecare parte fiind diluata ulterior functie de concentratia spermatozoizilor cu volume diferite din cei trei diluanti.
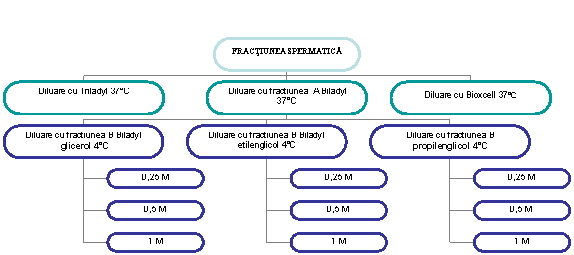
Fig. 4. Prezentarea protocolului de diluare.
Diluarea cu Triladyl
La utilizarea diluantului Triladyl aceasta etapa are loc intr-un singur pas. Adaugarea diluantului se face in picaturi, dupa ce in prealabil atat diluantul cat si instrumentarul utilizat (eprubete si pipete de unica folosinta) au fost aduse la o temperatura de 37sC prin termostatare. Diluarea se efectueaza in functie de concentratia spermatozoizilor, rata de dilutie fiind stabilita astfel incat concentratia finala sa fie de 100 x 106 spz/ ml.
Diluarea cu Biladyl
Diluarea cu Biladyl are loc in doua etape. In prima faza are loc o diluare cu fractiunea A adaugata in picaturi, la temperatura de 37sC, asigurandu-se aceleasi conditii in ceea ce priveste izotermia si sterilitatea instrumentarului utilizat.
Materialul seminal diluat cu fractiunea A se lasa timp de 30 de minute la +4sC, dupa care se va portiona in volume egale in 9 tuburi Eppendorf sterile, echilibrate termic aceasta temperatura.
Etapa a doua de dilutie se realizeaza cu fractiunea B continand cele trei tipuri de crioprotectori in trei concentratii diferite, respectandu-se raportul de 1:1 intre cele doua fractiuni ale diluantului, aceasta etapa avand loc la +4sC.
La utilizarea diluantului Bioxcell aceasta etapa are loc intr-un singur pas. Adaugarea diluantului se face in picaturi, dupa ce in prealabil atat diluantul cat si instrumentarul utilizat (eprubete si pipete de unica folosinta) au fost aduse la o temperatura de 37sC prin termostatare. Diluarea se efectueaza in functie de concentratia spermatozoizilor, rata de dilutie fiind stabilita astfel incat concentratia finala sa fie de 100 x 106 spz/ ml.
1.5. Echilibrarea la 4sC
Materialul seminal diluat a fost supus unei etape de echilibrare termica la +4sC timp de 3 ore utilizandu-se o cutie frigorifica prevazuta cu un terometru digital cu afisaj electronic, prezentat in fig.5, avand posibilitatea de a mentine temperatura constanta cu o eroare de ± 0,1sC.

Fig.5. Dispozitivul utilizat in etapa de refrigerare
1.6. Ambalarea
S-a efectuat utilizand paiete de 0,25 ml, marcate in prealabil cu datele de identificare. Toate materialele utilizate in aceasta etapa au fost au fost introduse in prealabil in incinta de refrigerare pentru echilibrare termica.
1.7. Precongelarea si congelarea
Pentru realizarea acestei etape s-a utilizat o cutie paralelipipedica de polistiren cu dimensiunile: 35 x 20 x 25cm, inchisa ermetic.
Precongelarea s-a realizat prin plasarea paietelor la o distanta fata de stratul de azot lichid de 4 cm, la o temperatura de -140sC timp de 10 minute, congelarea propiu-zisa efectuandu-se ulterior prin imersarea brusca a paietelor in azot lichid la o temperatura de - 196sC.
In cazul variatiei vitezei de precongelare s-a utilizat diluantul Triladyl pentru diluare iar plasarea paietelor s-a facut la 4, 5 respectiv 6 cm fata de stratul de azot lichid.
1.8. Decongelarea
Etapa de decongelare s-a realizat prin imersarea brusca a paietelor in baie de apa la temperatura de 36sC timp de 60 secunde. Dupa ce au fost indepartate urmele de apa de pe suprafata exterioara a paietelor, continutul acestora a fost transvazat in tuburi Eppendorf sterile, uscate si termostatate la 37sC.
2. Evaluarea motilitatii spermatozoizilor cu ajutorul analizei automate computerizate (CASA)
Este general acceptat faptul ca o analiza standardizata, precisa si reproductibila a motilitatii spermatozoizilor poate aduce informatii extrem de utile in aprecierea calitatii materialului seminal. Posibilitatea de captarea a imaginilor microscopice precum si prelucrarea computerizata a acestora a pus bazele unei noi tehnologii numita generic analiza automata computerizata a spermatozoizilor (CASA), care are ca principiu utilizarea unui program pentru a procesa semnalele electrice obtinute de o camera video digitala integrata unui microscop sau cele captate de pe o banda video
Sistemul CASA utilizat este prezentat in figura 6 si este compus dintr-un microscop cu contrast de faza Olympus cu o platina incalzitoare (Minitub-Germania) conectat la un sistem CASA ce utilizeaza pentru prelucrarea datelor programul MedeaLab versiunea 5.
Motilitatea materialului seminal proaspat s-a evaluat dupa o prealabila diluare in raport 1:5 cu un tampon fosfat salin a carui compozitie este prezentata in tabelul nr.3, aceasta etapa fiind necesara pentru a elimina miscarile pasive ale spermatozoizilor.
Prin analiza CASA s-au clasificat spermatozoizii conform criteriilor WHO [198], examinandu-se probele cu obiectivul cu contrast de faza negativa. Pentru diluarea fractiunii spermatice s-a utilizat o solutie de fosfat salin tamponat a carei compozitie este data in tabelul 3.
Tabel 3. Compozitia mediului de dilutie [198 ]
|
Nr. crt. |
Componenta |
Cantitatea (g) |
|
CaCl2 x 2H2O | ||
|
KCl | ||
|
KH2PO4 | ||
|
MgCl2 x 6H2O | ||
|
NaCl | ||
|
Na2HPO4 | ||
|
Apa bidistilata |
ad 1000ml |

Fig.6. Sistemul CASA utilizat pentru evaluarea motilitatii
3. Determinarea concentratiei spermatozoizilor
Determinarea concentratiei spermatozoizilor s-a efectuat utilizand metoda hemocitometrica [198].
4.Efectuarea testului hipoosmotic
Testul hipoosmotic permite aprecierea integritatii membranei spermatozoidului, astfel prin utilizarea unei solutii hipotonice estimandu-se capacitatea de transport membranar a fluidelor [21, 32, 53, 63, 81, 164, 167]. Testul a constat in plasarea a 0.1ml sperma in 1 ml solutie hipoosmotica urmata de o incubare la 37sC timp de 30 minute . S-a efectuat o numaratoare a spermatozoizilor balonati intr-o camera hemocitometrica utilizand un microscop cu contrast de faza .
5. Determinarea aspectului morfologic al spermatozoizilor
Morfologia spermatozoizilor s-a apreciat utilizand coloratia Spermac
Sperma proaspata a fost centrifugata 5 min. la 720g, viteza de centrifugarea optima pentru a preveni distrugerea spermatozoizilor si eliberarea enzimelor intracelulare
Proteinele din plasma seminala s-au determinat prin metoda biuret, curba de etalonare efectuandu-se cu o solutie de albumina serica bovina
Pentru determinarea activitatii SOD s-a utilizat metoda lui Winterbourn si colab. descrisa de Iordachescu . Aceasta metoda colorimetrica se bazeaza pe capacitatea SOD de a inhiba reducerea sarii de tetrazoliu- Nitro Blue Tetrazoliu (NBT), cu radicalii superoxid. O unitate enzimatica reprezinta cantitatea de enzima care produce 50% inhibitie in conditii standard. Radicalii superoxid sunt generati in mediul de reactie prin fotoreducerea riboflavinei.
S-a utilizat metoda spectrofotometrica Beers si Sizer descrisa de Iordachescu Mersul reactiei este urmarit spectrofotometric, la 240nm , prin disparitia peroxidului de hidrogen din mediul de reactie. O unitate enzimatica descompune un mmol de H2O2 intr-un minut la 25 C si pH 7,0.
9. Dozarea malonildialdehidei (MDA)
Este o metoda colorimetrica, descrisa de Carbouneanu si Penchant, ce se bazeaza pe reactia MDA cu acidul 2-tiobarbituric cu formarea unui pigment rosu, a carui intensitate este direct proportionala cu gradul de peroxidare lipidica
REZULTATE SI DISCUTII
1. Evaluarea parametrilor spermatici
In cazul materialului seminal proaspat recoltat s-au luat in lucru numai ejaculatele care corespundeau din punct de vedere calitativ, adica : o motilitate > 75%, o concentratie a spermatozoizilor >200 x106/ml si anomalii morfologice primare si secundare prezente in proportie mai mica de 10 respectiv 20%.
1.1. Motilitatea
In urma complexului proces de crioconservare se inregistreaza un important declin al motilitatii spermatozoizilor. In functie de diluantul folosit si de concentratia crioprotectorului se observa variatii importante ale acestui parametru
In tabelul 4 sunt prezentate comparativ motilitatile pe categorii WHO in cazul utilizarii crioprotectorilor in trei concentratii diferite, avand drept martor probele diluate cu Triladyl.
Tabel 4. Motilitatea la utilizarea de diferiti crioprotectori.
|
Motilitatea |
BILADYL |
TRILADYL | |||||||||
Glicerol |
Etilenglicol |
Propilenglicol |
|||||||||
0,25M |
0.5M |
1M |
0,25M |
0.5M |
1M |
0,25M |
0.5M |
1M |
|||
|
WHO a (%) | |||||||||||
|
WHO b (%) |
| ||||||||||
|
WHO c (%) | |||||||||||
|
WHO d (%) | |||||||||||
|
Motil.locala (%) | |||||||||||
|
Misc.circulare (%) | |||||||||||
|
Motilitate totala (%) | |||||||||||
Astfel, in cazul folosirii diluantului Biladyl se observa ca etilenglicolul in concentratie de 1M ca si crioprotector are efectul cel mai favorabil asupra motilitatii totale, valoarea acesteia fiind cu 6,58% si 16,14% mai mare decat in cazul utilizarii glicerolului respectiv propilenglicolului in aceeasi concentratie.
In cazul utilizarii crioprotectorilor in concentratii de 0,25M si 0,5 M se observa o scadere insemnata a motilitatii totale ajungandu-se la valori de pana la 15,24% in cazul propilenglicolului 0,25M.
Din tabelul 4 se poate observa ca valoarea motilitatii in cazul utilizarii EG in concentratie de 1M este cu 5,35% mai mare decat in cazul martorului, fapt confirmat si de alte studii ce confirma utilizarea cu mare succes a etilenglicolului ca inlocuitor al glicerolului a carui toxicitate a fost recunoscuta ca fiind implicata in scaderea calitatii materialului seminal in urma crioconservarii
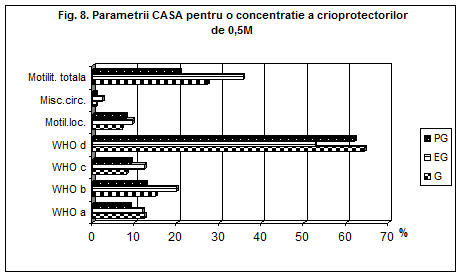
In fig. 7,8 si 9 este prezentata grafic variatia parametrilor motilitatii spermatice conform clasificarii WHO. Astfel :
categoria WHOa reprezinta procentul de spermatzoizi cu viteza mare de inaintare,
categoria WHOb reprezinta procentul de spermatozoizi cu viteza mica de inaintare,
categoria WHO c reprezinta procentul de spermatozoizi ce prezinta miscare circulara si motilitate locala,
categoria WHO d reprezinta procentul de spermatozoizi imotili.
Programul de prelucrare a datelor a permis o astfel de clasificare datorita setarilor efectuate anterior determinarilor care au stabilit :
viteza minima la 5mm/s ce clasifica un obiect ca motil,
viteza de 50mm/s ce stabileste diferentierea dintre spermatozoizii cu inaintare rapida si cei cu inaintare lenta,
linearitatea de 50% , ce reprezinta raportul dintre lungimea traiectoriei si cea mai scurta distanta dintre punctele de pornire si de oprire ale spermatozoizilor,
distanta minima restrictionata pentru motilitatea locala 2mm,
raza minima in cazul miscarilor circulare 100mm.

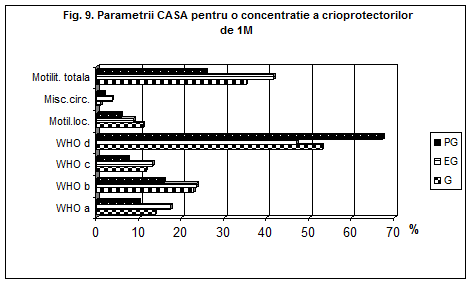
In tabelul 5 sunt prezentate rezultatele CASA in cazul utilizarii diluantului Triladyl la diferite viteze de congelare precum si la utilizarea diluantului Bioxcell.
Tabel 5. Evaluarea motilitatii la diferite viteze de congelare si la utilizarea unui diluant vegetal.
|
Motilitatea |
TRILADYL |
BIOXCELL |
||
|
4 cm |
5 cm |
6 cm |
||
|
WHO a (%) |
± 0.09 |
|||
|
WHO b (%) |
± 0.07 |
|||
|
WHO c (%) |
± 0.03 |
|||
|
WHO d (%) |
± 1.37 |
|||
|
Motil.locala(%) |
± 0.02 |
|||
|
Misc.circulare(%) | ||||
|
Motilitate totala (%) |
± 0.02 |
|||
La utilizarea diluantului Triladyl se observa ca motilitatea difera in functie de distanta la care au fost plasate paietele fata de stratul de azot lichid in etapa de precongelare. Astfel, la distanta de 5 cm se observa cea mai buna motilitate aceasta fiind cu 3,39 si 7,09 mai mare decat in cazul plasarii la 4 respectiv 6 cm.
Se observa din tabelul 5 ca cel mai nefavorabil efect asupra motilitatii il are diluantul cu proteine vegetale Bioxcell, acesta nefiind potrivit pentru crioconservarea spermei de caine utilizand tehnicile de congelare si decongelare prezentate in acest studiu.
1.2. Testul hipoosmotic si aspectul morfologic al spermatozoizilor
Rezultatele testului hipoosmotic se coreleaza pozitiv cu motilitatea in toate cazurile studiate.
In cazul utilizarii diversilor crioprotectori procentul spermatozoizilor balonati este cel mai mare in cazul concentratiei de 1M, cea mai mare valoare inregistrandu-se in cazul etilenglicolului (59,01%). La utilizarea Triladyl-ului se observa si in cazul acestui parametru ca distanta de 5cm fata de stratul de azot lichid este cea mai favorabila, obtinandu-se o valoare de 52,63%.
Cea mai defavorabila este si in acest caz utilizarea Bioxcell-ului, valorile obtinute fiind cele mai scazute (3.25%), demonstrand ca integritatea functionala si in special cea electrochimica a membranei plasmatice spermatice este puternic afectata in cazul utilizari acestui tip de diluant.
Valoarea procentului alterarilor morfologice secundare prezinta valorile cele mai ridicate la utilizarea concentratiilor cele mai mici in crioprotector, rezultate similare fiind obtinute la alte specii. Este de remarcat faptul ca cea mai mica valoare a acestui parametru se inregistreaza in cazul utilizarii etilenglicolului in concentratie 1M (26,89%), rezultat care se coreleaza cu valorile obtinute la determinarea atat a viabilitatii cat si a motilitatii.
Rezultatele obtinute sunt prezentate in tabelul 6, aspectul spermatozoizilor in cazul celor doua determinai fiind prezentat in fig. 10 si 11.
Tabel 6. Evaluarea viabilitatii si a gradului de alterare morfologica a spermatozoizilor
|
Caracteristici diluant |
Viabilitate (testul hipoosmotic) (%) |
Alterari morfologice secundare (%) |
||
|
Triladyl |
4 cm | |||
|
5 cm | ||||
|
6 cm | ||||
|
Biladyl |
G |
0,25 M | ||
|
0,5 M | ||||
|
1 M | ||||
|
EG |
0,25 M | |||
|
0,5 M | ||||
|
1 M | ||||
|
PG |
0,25 M | |||
|
0,5 M | ||||
|
1 M | ||||
|
Bioxcell | ||||
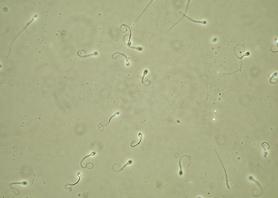
Fig. 10 Aspectul spermatozoizilor in urma efectuarii testului hipoosmotic
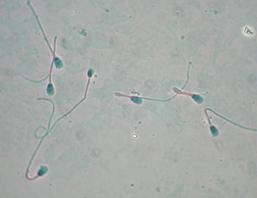
Fig. 11 Anomalii morfologice secundare aparute in urma crioconservarii
2. Evaluarea parametrilor biochimici
In urma transformarilor prin care trece celula spermatica in cadrul procesului de crioconservare membrana plasmatica poate fi afectata in masura diferita in functie de gradul de protectie care ii este asigurat in timpul acestui proces complex. Cand au loc leziuni ale membranei celulare, continutul intracelular este eliberat, determinand o crestere a concentratiei acestor componenti in mediul extracelular.
2.1. Determinarea proteinelor
In cazul determinarii concentratiei proteice din materialul seminal proaspat recoltat s-a procedat la separarea celor trei fractiuni spermatice, efectuandu-se determinarile diferentiat, rezultatele fiind prezentate in tabelul 7.
Tabel 7. Continutul proteic al plasmei seminale in cazul celor trei fractiuni ale ejaculatului
|
Parametrul |
Fractiunea prespermatica |
Fractiunea spermatica |
Fractiunea postspermatica |
|
Volum (ml) |
± 0,4 |
± 0,1 |
± 0,5 |
|
Nr. spz (106/ml) |
± 105 | ||
|
Proteine (g%) |
0,82 ± 0,28 |
3,11 ± 0,75 |
1,82 ± 0,30 |
Se poate observa ca valoarea concentratiei proteinelor este de 1,70 mai mare in fractiunea spermatica decat in cea postspermatica si de 3,79 ori mai mare decat in cea prespermatica, valori confirmate de datele din literatura de specialitate
In cazul aplicarii socului termic continutul proteic al plasmei seminale sufera modificari datorate in mare parte eliberarii proteinelor din mediul intracelular ducand la cresteri ale valorii acestui parametru odata cu alterarea parametrilor citomorfologici, observandu-se o corelatie pozitiva intre variatia continutului proteic si rezultatele testului hipoosmotic respectiv al aspectului morfologic, atat in cazul utilizarii diferitilor crioprotectori cat si in cazul variatiei vitezei de congelare, datele fiind prezentate in tabelul 8.
Analizand datele din tabelul 8 se poate remarca o crestere a continutului proteic la utilizarea concentratiilor de crioprotector care confera protectia cea mai redusa (0,25 si 0,5M), conform datelor obtinute putandu-se aprecia faptul ca la utilizarea etilenglicolului in concentratie de 1M gradul de afectare al celulei spermatice este minim, acest lucru fiind reflectat si de valorile cele mai mici ale continutului proteic (2.94%)
In cazul utilizarii diluantului Bioxcell se poate aprecia faptul ca are loc variatie extrem de importanta a continutului proteic al plasmei seminale datorita gradului mare de distrugere celulara, in acest caz inregistrandu-se o valoare foarte mare a alterarilor morfologice secundare de 37,82
Tabel 8. Variatia continutului proteic al plasmei seminale in
cursul crioconservarii
|
Caracteristici diluant |
Proteine (g%) |
||
|
Triladyl |
4 cm | ||
|
5 cm | |||
|
6 cm | |||
|
Biladyl |
G |
0,25 M | |
|
0,5 M | |||
|
1 M | |||
|
EG |
0,25 M | ||
|
0,5 M | |||
|
1 M | |||
|
PG |
0,25 M | ||
|
0,5 M | |||
|
1 M | |||
|
Bioxcell | |||
In datele existente in studiile efectuate este prezentata doar variatia continutului proteic al celulei spermatice pentru diferite specii, inregistrandu-se un declin al acestui parametru in cursul crioconservarii
2.2. Determinarea activitatii catalazei si superoxid dismutazei si a gradului de peroxidare lipidica
In cazul efectuarii determinarii parametrilor biochimici urmariti din plasma seminala a fractiunilor spermatice ale ejaculatului s-au obtinut valorile prezentate in tabelul 9.
Tabel 9. Distributia parametrilor biochimici in cazul celor trei fractiuni ale ejaculatului
|
Parametrul |
Fractiunea prespermatica |
Fractiunea spermatica |
Fractiunea postspermatica |
|
Nr. spz (106/ml) |
± 105 | ||
|
Proteine (g%) |
0,82 ± 0,28 |
3,11 ± 0,75 |
1,82 ± 0,30 |
|
Catalaza (U/mg) | |||
|
Superoxid dismutaza (U/mg) | |||
|
MDA (mmol/l) |
Din datele experimentale prezentate in tabelul 9 se poate observa ca activitatea enzimelor antioxidante, SOD si CAT in plasma seminala a fractiunii spermatice au cea mai ridicata valoare comparativ cu a celorlate fractiuni . Spre deosebire de sperma altor specii, l-a care s-a sugerat faptul ca activitatea SOD si CAT sunt in principal aduse de secretia veziculelor seminal si a prostatei , la caine, conform datelor experimentale obtinute putem trage concluziona ca aceaste enzima sunt cu preponderenta de origine testiculara si/sau epididimala .
Deoarece anionul superoxid si mai ales radicalul hidroxil sunt principalii initiatori ai procesului de peroxidare lipidica, cu deosebite implicatii in mentinerea functionalitatii membranei spermatozoizilor, s-a incercat monitorizarea acestui proces in toate cele trei fractiuni spermatice prin determinarea concentratiei MDA.
In fig. 12 este prezentata distributia procentuala atat a activitatii enzimelor antioxidante cat si a nivelului concentratiei MDA intre cele trei fractiuni ale ejaculatului. Se poate observa ca, fractiunea spermatica este cea mai afectata de stresul oxidativ, lucru confirmat si de faptul ca in aceasta fractiune produsii de peroxidare lipidica se gasesc in proportia cea mai mare.

Analizand datele din tabelul 10 se poate remarca o crestere a activitatii catalazei si superoxid dismutazei la utilizarea concentratiilor de crioprotector care confera protectia cea mai redusa (0,25 si 0,5M). Cele mai defavorabile conditii sunt la utilizarea propilenglicolului 0,25M, in acest caz inregistandu-se si valorile cele mai ridicate ale CAT (4,21U/mg) respectiv ale SOD (8,73U/mg).
La utilizarea etilenglicolului in concentratie de concentratie de 1M gradul de afectare al celulei spermatice din punct de vedere al stresului oxidativ indus de crioconservare este minim, acest lucru fiind reflectat de valorile activitatii enzimelor antioxidante CAT (3.19U/mg) respectiv SOD (7,89U/mg).
Se poate observa din tabelul 10 ca si viteza de congelare influenteaza, dar intr-o masura mai mica, atat nivelul activitatii enzimelor oxidoreducatoare cat si gradul de peroxidare lipidica, cea mai indicata fiind utilizarea in etapa de precongelare a distantei de 5 cm fata de stratul de azot lichid.
Rezultatele prezentate in tabelul 10 releva faptul ca in urma crioconservarii are loc instalarea unui stres oxidativ, a carui intensitate este invers proportionala cu concentratia crioprotectorului utilizat, valorile cele mai crescute ale MDA (41,64 mmol/l) inregistranduse in cazul utilizarii propilenglicolului in concentratie de 0,25M.
Tabel 10. Valorile activitatii enzimelor antioxidante si a concentratiei de malonildialdehida din plasma seminala a materialului seminal crioconservat
|
Caracteristici diluant |
Catalaza (U/mg) |
SOD (U/mg) |
MDA (mmol/l) |
||
|
Triladyl |
4 cm | ||||
|
5 cm | |||||
|
6 cm | |||||
|
Biladyl |
G |
0,25 M | |||
|
0,5 M | |||||
|
1 M | |||||
|
EG |
0,25 M | ||||
|
0,5 M | |||||
|
1 M | |||||
|
PG |
0,25 M | ||||
|
0,5 M | |||||
|
1 M | |||||
|
Bioxcell | |||||
Analizand datele corespunzatoare aspectului citomorfologic se poate releva faptul ca exista o corelatie negativa intre concentratia compusilor rezultati in urma lipoperoxidarii si calitatea materialului seminal, astfel in cazul utilizarii etilenglicolului in concentratie de 1M se poate observa ca unei concentratii scazute de MDA (31,14mmol/l) ii corespunde o motilitate totala de 41,66%, o viabilitate de 59,01% acestia reprezentand indicii calitativi cei mai buni comparativ cu ceilalti crioprotectori utilizati.
In cazul utilizarii diluantului Bioxcell, gradul mic de protectie pe care il asigura componentele acestui tip de diluant cu proteine vegetale, este confirmat si din punct de vedere al sistemelor de protectie antioxidanta, valorile activitatilor enzimatice cat si a MDA relevand faptul ca nivelul stresului oxidativ indus de crioconservare este cel mai ridicat in acest caz.
Variatia valorilor MDA prezentate este similara cu cea raportata de alti autori pentru diferite specii, in studiile de specialitate fiind raportata o crestere a continutului in MDA a plasmei seminale in cursul procesului de crioconservare , o crestere a gradului de peroxidare lipidica fiind corelata negativ cu motilitatea si viabilitatea spermatozoizilor.
Sunt propuse de catre unii cercetatori cateva mecanisme de scadere a motilitatii spermatozoizilor asociate cu inducerea stresului oxidativ. Peroxidarea acizilor grasi nesaturati din lipidele membranare este unul din cele mai citate mecanisme , spermatozoizii fiind in mod particular extrem de susceptibili la desfasurarea acestui proces datorita continutului ridicat de acizi grasi polinesaturati (PUFA) de la nivel membranar. Concentratia crescuta a PUFA in membrana spermatica este necesara pentru a conferi membranei fluiditatea necesara atat pentru a participa la reactiile ce au loc la fuziunea cu oocitul cat si la mentinerea integritatii structurale si functionale a celulei. Pierderea integritatii membranei celulare determina o crestere a permeabilitatii acesteia si o pierdere a capacitatii de reglare a compozitiei mediului intracelular a ionilor implicati in controlul miscarilor spermatozoizilor
Alti autori sugereaza ipoteze ca declinul motilitatii spermatozoizilor in urma incubarii cu specii reactive ale oxigenului este datorat de un nivel scazut de ATP avand ca urmare scaderea gradului de fosforilare a proteinelor axonemei, produsii de fosforilare fiind necesari pentru efectuarea miscarilor flagelului
Unele studii sugereaza ca speciile reacitve ale oxigenului sunt implicate in inhibarea procesului de fosforilare oxidativa si a glicolizei, limitandu-se astfel producerea de ATP de catre celula spermatica. Inhibitia enzimatica poate fi indusa indirect si de produsii de peroxidare lipidica printre care si MDA, concentratii mici din aceste substante fiind implicate in inhibarea unui numar mare de enzime celulare, a glicolizei anaerobe, a sintezei de proteine, ADN si ARN
Urmarind rezultatele obtinute in acest studiu se poate concluziona faptul ca stresul oxidativ are un impact foarte mare asupra indicilor spermatici si la specia canina, literatura de specialitate prezentand numeroase referiri la acest aspect, insa raportate la alte specii.
Fractiunea spermatica este caracterizata de cea mai ridicata activitate antioxidanta, inregistrandu-se continutul cel mai ridicat de CAT, acest fapt fiind in directa corelatie cu numarul de spermatozoizi si cu motilitatea acestora;
Activitatea cea mai scazuta a CAT si SOD a fost inregistrata la fractiunea prostatica, ceea ce conduce la concluzia ca, in cazul speciei canine aceste enzime ar putea avea origine testiculara si/sau epididimala;
Fractiunea spermatica se remarca prin continutul proteic cel mai ridicat, comparativ cu celelate fractiuni componente ale ejaculatului;
Dintre crioprotectorii utilizati etilenglicolul in concentratie 1M confera gradul de protectie cel mai bun, inregistrandu-se valori optime ale motilitatii si viabilitatii;
In cazul utilizarii Triladyl-ului se poate aprecia faptul ca distanta de 5 cm fata de suprafata stratului de azot in etapa de precongelare asigura conditii optime din punct de vedere al parametrilor citomorfologici;
Activitatea enzimelor antioxidante catalaza si superoxid dismutaza prezinta valorile cele mai ridicate la concentratii ale crioprotectorilor de 0,25 si 0,5M, valori ce sunt corelate pozitiv cu gradul de peroxidare lipidica;
Conform datelor obtinute se poate aprecia ca intensitatea stresului oxidativ instalat in cursul crioconservarii este cea mai mica in cazul utilizarii etilenglicolului in concentratie de 1M;
Cresterea gradului de peroxidare lipidica este corelata negativ cu valorile motilitatii si viabilitatii materialului seminal, indicand o degradare a calitatii acestuia.
Utilizarea diluantului pe baza de proteine vegetale (Bioxcell) nu asigura protectia necesara in cursul crioconservarii, observandu-se o degradare pronuntata a calitatii materialului seminal canin;
BIBLIOGRAFIE
|
Abiaka, C., Al-Awadi, F., Olusi,S. Effect of prolonged storage on the activity of superoxide dismutase, glutathione reductase and glutathione peroxidase, Clin.Chem., |
|
|
Acker, J.P., McGann, L.E. Membrane damage occurs during the formation of intracellular ice, CryoLetters, 22, (4), 241-254, 2001; |
|
|
Agarwal, A., Saleh, A.R. Oxidative stress and male infertility, from research bench to clinical practice, J.Androl., 36, (6), 737, 2002; |
|
|
Aitken, J.R. Possible redox regulation of sperm motility activation, J.Androl.21: (4), 491, 2000; |
|
|
Aitken, R.J., Clarkson, J.S., Fishel, S. Generation of reactive oxygen species, lipid peroxidation and human sperm function, Biol.Reprod., 41, 183-197, 1989; |
|
|
Aitken, J.R., Fischer, H. Reactive oxygen species generation and human spermatozoa: the balance of benefits and risk, Bioassays, 16, 259, 1994; |
|
|
Aitken, J.R., Gordon, E., Harkiss, D., Twigg, J.P., Milne, P., Jennings, Z., Irvine, D.S. Relative impact of oxidative stress on the functional competence and genomic integtrity of human spermatozoa, Biol.Reprod., 59: 1037-1046, 1998; |
|
|
Akcay, E., Tekin,N. The effect of individual properties and various extenders on dog semen cryopreservation, Ankara Universitesi Veteriner Fakultesi Dergisi, 49,(3), 207-212, 2002; |
|
|
Alamo, D., Batista,M., Gonzales,F., Rodriguez,N., Cruz,G., Cabrera,F., Gracia, A. Cryopreservation of semen in the dog: use of ultra freezers of -152sC as a viable alternative to liquid nitrogen, Theriogenology, Article in press, 2004; |
|
|
Alvarega, M.A., Landim-Alvarega, F.C., Moreira, R.M., Cesarino, M.M. Acrosomal ultrastructure of stallion spermatozoa cryopreserved with ethylene glycol using two packaging systems, Equine Vet.J., 32: (6), 541-545, 2000; |
|
|
Alvarez, J.G., Storey, B.T. Evidence for increased lipid peroxidative damage and loss of superoxide dismutase activity as a mode of sublethal cryodamage to human sperm during cryopreservation, J Androl., 13(3), 232-241, 1992; |
|
|
Alvarez, J.R., Touchstone, J.C., Blasco, L., Storey, B.T. Spontaneous lipid peroxidation and production of hydrogen peroxide and superoxide in human spermatozoa, superoxide dismutase as a major enzyme protectant against oxygen toxicity, J.Androl., 8,338, 1987; |
|
|
Anchordoguy, T., Rudolph, A., Carpenter, J, Crowe, J. Mode of interaction of cryoprotectant with membrane phospholipids during freezing, Cryobiology, 24, 324-331, 1987; |
|
|
Andersen, Helle, Nielsen, J.B., Nielsen, F., Grandjean, P. Antioxidative enzyme activities in human erythrocytes, Clin.Chem., 43(4), 562-568, 1997; |
|
|
Anzar, M., He, Liwei, Buhr, M.M., Kroetsch, T.G., Pauls, K.P. Sperm apoptosis in fresh and cryopreserved bull semen detected by flow cytometry and its relationship with fertility, Biol.Reprod., |
|
|
Asayama, K., Burr,I.M. Rat superoxide dismutase, J.Biol.Chem., 260:(4), 2212-2217, 1985; |
|
|
Bagrel, A., Nabet, F. Mesure des radicaux libres: methodes directes et indirectes, Ann.med. Nancy, 34: (2), 1995; |
|
|
Ball, B,A., Gravance, C.G., Medina, V., Baumber J., Liu, I.K. Catalase activity in equine semen, Am.J.Vet.Res., 61: (9), 1026-1030, 2000; |
|
|
Ball, B.A., Vo, A. Osmotic tolerance of equine spermatozoa and effects of soluble cryoprotectants on equine sperm motility, viability and mithocondrial membrane potential, J.Androl.22 : (6), 1061-1069, 2001; |
|
|
Barroso, G., Morshedi, M., Oehninger, S. Analysis of DNA fragmentantion, plasma membrane translocation of phosphatidylserine and oxidative stress in human spermatozoa, Hum.Reprod., 15(6), 1338-1344, 2000; |
|
|
Baumer, Julie, Ball, B.,A., Gravance,C.,G., Medina,V., Davies-Morel, Mina The effect of reactive oxygen species on equine sperm motility, viability, acrosomal integrity, mitochondrial membrane potential, and membrane lipid peroxidation, J.Androl.,21: (6), 895-902, 2000; |
|
|
Berlinguer, F., Ledda, S., Rosati, I., Bogliolo, L., Leoni, G., Naitana,S. Superoxide dismutase affects the viability of thawed european muflon semen and the heterologous ferilization using both IVF and intracytoplasmatic sperm injection, Reprod.Fertil.Dev., 15, 19-25, 2003; |
|
|
Benon, H. J., Bielski, S., Ravindra, L., Sutherland, M.K. A study of the reactivity of H2O2 with unsaturated fatty acids, J.Biol.Chem., 258(8), 4759-4767, 1982; |
|
|
Bilodeau, J.F., Blanchette, S., Cormier, N., Sirard, M.A. Reactive oxygen species-mediated loss of bovine sperm motility in egg yolk Tris extender: protection by pyruvate, metal chelators and bovine liver or oviductal fluid catalase, Theriogenology, 57(3), 1105-1122, 2002; |
|
|
Bilodeau, J-F, Chatterjee, S., Sirard, M.A., Gagnon, C. Levels of antioxidant defenses are decreased in bovine spermatozoa after a cycle of freezing and thawing, Mol.ReprodDev., |
|
|
Bize, I., Santander, G., Cabello, P., Driscoll, D., Sharpe, C. Hydrogen peroxide is involved in hamster sperm capacitation in vitro, Biology of Reproduction, 44: 398-403, 1991. |
|
|
Bonca, Gh. Cercetari privind efectul etapelor de lucru asupra integritatii spermatozoizilor de caine in timpul conservarii spermei prin congelare, Procc.of the IVthInt.Symp.ACM-V, Timisoara, 448-453, 2000; |
|
|
Bonca, Gh., Cernescu, H., Ardelean, V., Mircu, C., Igna, V., Serdean, C., Preisach, C., Preisach, H.- Rezultate preliminare privind conservarea spermei de caine prin congelare, Al XXV simp.Act. in crest. si pat. anim. dom., Cluj-Napoca, ,269-275, 1999; |
|
|
Braun, J., Hochi, Oguri, N., Sato, K., Torres-Boggino- Effect of different protein supplements on motility and plasma membrane integrity of frozen-thawed stallion spermatozoa, Cryobiology, |
|
|
Bueno, R., Costa, E.P., Guimares, J.D., Valentim,F.M. Spermazozoa quality of cryopreserved canine semen, using two extenders and two cooling procedures, Revista Brasiliera de Ciencia Veterinaria, |
|
|
Buhr, M.M., Curtis, E.F., Somnapan Kakuda, N. Composition and behavior of head membrane lipids of fresh and cryopreserved boar semen, Cryobiology, |
|
|
Burgess, C.M., Bredl, J.C., Plummer, J.M., England, G.C. Vital and ultrastructural changes in dog spermatozoa, during cryopreservation, J.Reprod.Fertil.Suppl., 57, 357-363, 2001; |
|
|
Cannio, R., Fiorentino, G., Morana, A., Rossi, M., Bartolucci, S. Oxygen: friend or foe? Archaeal superoxide dismutases in the protection of intra- and extracellular oxidative stress, Frontiers in Bioscience, 5, d768-779, 2000; |
|
|
Cardoso,R.,de C.S., Silva, A.R., Uchoa,D.C., Silva, L.D.M. da, de C.S. Cardoso, R., da Silva, L.D.M. Cryopreservation of canine semen using a coconut water extender, Ciencia Rural, 32, (4), 657-661, 2002; |
|
|
Cardoso,R.,de C.S., Silva, A.R., Uchoa,D.C., Silva, L.D.M. da, de C.S. Cardoso, R., da Silva, L.D.M. Cryopreservation of canine semen using a coconut water extender with egg yolk and three different glycerol concentration, Theriogenology, 59: (3-4), 743-751, 2003; |
|
|
Cardoso,R.,de C.S., Silva, A.R., Uchoa,D.C., Silva, L.D.M. da, de C.S. Cardoso, R., da Silva, L.D.M. Effect of freezing stages on the canine semen extended with coconut water, Revista Brasiliera de Ciencia Veterinaria, |
|
|
Cavalcanti,M.C.O., Moura, C.S., Guerra, M.M.P., Silva, S.V. Cryoprotector action of glycerol and ethylene glycol in the freezing of dog semen, Revista Brasiliera de Ciencia Veterinaria, |
|
|
Cernescu, H., Ardelean, V., Bonca, Gh. Indrumator de activitati practice la Patologia reproductiei si clinica obstetricala, Lito USAB, Timisoara, 1991; |
|
|
Chaveiro, A., Liu, J., Mullen, S., Woelders,H., Critser,J.K. Determination of bull sperm membrane permeability to water and cryoprotectants using a concentration-dependent self-quenching fluorophore, Cryobiology, 48, 72-80, 2004; |
|
|
Chen, C.S., Chao, H.T., Pan, R.L., Wei, Y.H., - Hydroxyl radical- induced decline in motility and increase in lipid peroxidation and DNA modification in human sperm, Biochem.Mol.Biol.Int., 43: (2), 291-303, 1997. |
|
|
Critser, J.K., Huse-Benda, A.R., Aaker, D.V., Arneson, B.W., Ball, G.D. Cryopreservation of human spermatozoa. III. The effect of cryoprotectants on motility. Fertil Steril. 50(2), 314-320, 1988; |
|
|
Cucuianu, M. Biochimie Clinica, Ed. Dacia, Cluj-Napoca, 1977. |
|
|
Dandekar, S.P., Nadkarni, G.D., Kulkarni, V.S., Punekar, S. Lipid peroxidation and antioxidant enzymes in male infertility, J.of Postgraduate Medicine, 48 : (3), 186-190, 2002; |
|
|
De Lamirande, E., Jiang,H., Zini, A., Kodama, H., Gagnon, C. Reactive oxygen species and sperm physiology, Reviews of Reproduction,2, 48-54, 1997; |
|
|
Dejica, D. Stresul oxidativ in bolile interne, Ed. Casa Cartii de Stiinta, Cluj-Napoca, 2000. |
|
|
Devireddy, R.M., Swanlund, D.J., Roberts, K.P., Pryor, J.l., Bischof, J.C. The effect of extracellular ice and cryoprotective agents on the water permeability parameters of human sperm plasma membrane during freezing, Hum.Reprod.,15, 1125-1130, 2000; |
|
|
Diaconescu C. Carcterizarea biochimica a plasmei seminale. Peroxidarea lipidica si radicali liberi, Teza de doctorat, Academia Romana, 2001; |
|
|
Diaz, J., Ferntndez-Arjona, M., Perandores, C., Serrano, E., Frau, C., Cortes, I., Luque, A., Carbonell, L.F. Reference intervals for biochemistry parameters for evaluation of oxidative stress in human sperm, Clin.Chem. |
|
|
Dinu, Veronica, Trutia, E., Popa Cristea, Elena, Popescu, Aurora Biochimie Medicala, Ed. Medicala, Bucuresti, 1996. |
|
|
Dobrinski, I., Lulai,C., Barth, A.D., Post, K. Effects of four different extenders and three different freezing rates on post-thaw viability of dog semen, J.Reprod.Fertil.Suppl., 47: 291-296, 1993; |
|
|
Eddy, E.M., OBrien, Deborah- The Spermatozoon, in The Physiology of Reproduction, Second Edition, E.Knobil and J.D.Neill Eds., Raven Press, Ltd., New York, 29-77, 1994. |
|
|
England, G.C. Cryopreservation of dog semen: a review, J.Reprod.Fertil.Suppl., 47: 243-255, 1993; |
|
|
England, G.C.W., Plummer, J.M. Hypo-osmotic swelling of dog spermatozoa, J.Reprod.Fert.Suppl.47, 261-270, 1993; |
|
|
England, G.C.W., Ponzio,P. Comparison of the quality of frozen thawed and cooled rewarmed dog semen, Theriogenology, 46: (1), 165-171,1996; |
|
|
Farstadt,W. Current state in biotechnology in canine and feline reproduction, Animal Reproduction Science, 60-61: 375-387, 2000; |
|
|
Farstadt,W. Assisted reproductive technology in canid species, Theriogenology, 53, (1), 175-186, 2000; |
|
|
Farstadt,W. Semen cryopreservation in dogs and cats, Animal Reproduction Science, 42: (1-4), 251-260, 1996; |
|
|
Fee, J.A., Peisachg, J., Mimsy, W.B. Superoxide dismutase. Examination of the metal binding sites by electron spin echo spectroscopy, J.Biol.Chem.256 (4), 1910-1914, 1981; |
|
|
Felszeghy, E., Abraham, A. Biochimie, Ed. Didactica si Pedagogica, Bucuresti, 1972. |
|
|
Foote, R.H., Hare, E. High catalase content of rabbit semen appears to be inherited, J.Androl. |
|
|
Fountain, D., Porcu, E., Marsella, T. Liquid nitrogen freezers: a potential source of microbial contamination of haematopoetic stem cells components, Transfusion,37, 585-591, ,1997; |
|
|
Fridovich, I. Superoxide anion radical, superoxide dismutases and related matters, J.Biol.Chem., 2272 : (30), 18515-18517, 1997; |
|
|
Fuse, H., Ohta,S., Sakamoto, M., Katayama, T. Hypoosmotic swelling test with a medium of distilled water, Arch.Androl., 30: 111-116, 1993; |
|
|
Gandini, L., Lenzi, A., Lombardo, F., Pacifici, R., Dondero, F. Immature germ cell separation using a modified discontinous Percoll gradient technique in human semen, Hum.Reprod. |
|
|
Gilmore, J.A., McGann, L.E., Liu, J., Gao,D.Y., Peter, A.T., Kleinhans, F.W., Critser, J.K. Effect of cryoprotectant solutes on water permeability of human spermatozoa, Biol.Reprod., 53, 985, 1995; |
|
|
Gluhovschi N., Buruiana, L.M. Spermiologie Litografia Institutului Agronomic Timisoara, 1977. |
|
|
Godeas C., Tramer F., Micali F., Soranzo M., Sandri G., Panfili E. Distribution and possible role of phospholipid hydroperoxide glutathione peroxidase in rat epididymal spermatozoa, Biol. Reprod., 1997, 57: (6), 1502-1508; |
|
|
|
Gunay, U. Spermatological characteristics of dog semen diluted with different extenders after freezing, Universitesi Veteriner Fakultesi Dergisi Uludag Universitesi, |
|
Guthrie, H.D., Liu, J., Critser, J.K. Osmotic tolerance limits and effects of cryoprotectants on motility of bovine spermatozoa, Biol.Reprod.,67 : (6), 1811-1816, 2002; |
|
|
Hammadeh, M.E., Dehn,C., Hippach, M., Zeginiau, T., Stieber, M., Georg, T., Rosenbaum, P., Schmidt, W. Comparison between computerized slow-stage and static liquid nitroge vapour freezing methods with respect to the deletorious effect on chromatin and morphology of spermatozoa from fertile and subfertile men, Int.J.Androl., 24: (2), 66-72, 2001; |
|
|
Hay, M.A., King, W.A., Gartley, C.J., Leibo, S.P., Goodrowe, K.L.- Canine spermatozoa- Cryopreservation and evaluation of gamete interaction, Theriogenology.,48 : 1329-1342, 1997; |
|
|
Hay, M.A., King, W.A., Gartley, C.J., Leibo, S.P., Goodrowe, K.L.- Effects of cooling, freezing and glycerol on penetration of oocytes by spermatozoa in dogs, J.Reprod.Fertil.Suppl.,51 : 99-108, 1997; |
|
|
Hsieh, Y.Y., Sun, Y.L., Chang, C.C., Lee, Y.S., Tsai,H.D., Lin, C.S. Superoxide dismutase activities of spermatozoa and seminal plasma are not correlated with male infertility, J.Clin.Lab.Anal. 16(3), 127-131, 2002; |
|
|
Hutter, J.C. Fertility of cryopreserved dog semen, Revista de Medicina Veterinaria, Buenos Aires, 83:(3), 128-131, 2002; |
|
|
Igna V. Insamantarea artificiala la Canis Familiaris, Teza de doctorat, USAMVB Timisoara, 2002; |
|
|
Iguerouada, M., Verstegen, J.P. Long-term preservation of chilled canine semen: effect of commercial and laboratory prepared extenders, Theriogenology, 55: (2), 671-684, 2001; |
|
|
Iordachescu, D., Dumitru, I.F. Biochimie practica, Univ. Bucuresti, Ed. aIIa, Bucuresti, 1988; |
|
|
Ivanova-Kicheva, M.G., Bobadov,N., Somlev,B. Cryopreservation of canine semen in pellets and in 5 ml aluminium tubes using three extenders, Theriogenology, 48 (8), 1343-1349, 1997; |
|
|
Ivanova, M., Mollova, M., Ivanova-Kicheva, M.G., Petrov, M., Djarkova, T., Somlev, B. Effect of cryopreservation on zone-binding capacity of canine spermatozoa in vitro, Theriogenology, 52,(1), 163-170, 1999; |
|
|
James,Ladha,S., Prentice,A., Jones,R. Lipid dynamics in the plasma membrane of fresh and cryopreserved human spermatozoa, Hum.Reprod., 14:(7), 1827-1832, 1999; |
|
|
Jaeger, M., Carin, M., Medale, M., Tryggvason, G. The osmotic migration of cells in a solute gradient, Biophys J., 77, 1257, 1999; |
|
|
Kalyanaraman, B., Mason, R.P., Taiern, B., Elingn, T.E. The free radical formed during the hydroperoxide-mediated deactivation of ram seminal vesicles is hemoprotein-derived, J.Biol.Chem.257(9), 4764-4768, 1982 |
|
|
Kankofer, M., Kolm, G., Aurich, J., Aurich, C. Activity of glutathione peroxidase , superoxide dismutase and catalase and lipid peroxidation intensity in stallion semen during storage at 5sC, Theriogenology ,paper in press; |
|
|
Katkov, I.I., Katkova, N., Crister, J.K., Mazur, P. Mouse spermatozoa in high concentration of glycerol: chemical toxicity vs osmotic shock at normal and reduced oxygen concentrations, Cryobiology, 37:(4), 325-338, 1998. |
|
|
Kim, Y.J., Han, JI, Yu, I., Ji, D.B. Effects of semen extender containing Equex-STM paste on post-thaw motility and viability of canine sperm, J.Vet.Clin., 19: (1), 80-85, 2002; |
|
|
Kobayashi,T., Miyazaki,T., Natori, M., Nozawa ,S. - Protective role of superoxide dismutase in human sperm motility: superoxide dismutase activity and lipid peroxide in human seminal plasma and spermatozoa, Hum.Reprod., 6, 987-991, 1991; |
|
|
Krzyzosiak, J., McMillan, G., Molan, P., Vishvanath, R.- Protein tyrosine phosphorilation during prolonged in vitro incubation of ejaculated bovine spermatozoa is regulated by oxidative state of medium, Biol.Reprod.,62, 1615-1623, 2000; |
|
|
Kocis, J.M., Kuo, W.N., Liu, Y., Guruvadoo, L.K., Langat, J.L.- Regulation of catalase: inhibition by peroxinitrite and reactivation by reduced glutathione and glutathione S-transferase, Frontiers in Bioscience, 7, a175-180, 2002; |
|
|
Kono, Y., Fridovich, I. Superoxide radical inhibits catalase, J.Biol.Chem.,257(10), 6761-6764, 1982; |
|
|
Lapointe, S., Sullivan, R., Sirard, M.A. Binding of a bovine oviductal fluid catalase to mammalian spermatozoa, Biol.Reprod., 58, 747-753, 1998; |
|
|
Lasso, J.L., Noiles, E.E., Alvarez, J.G., Storey, B.T. Mechanism of superoxide dismutase loss from human sperm cells during cryopreservation, J.Androl.., 15:(3), 225-265, 1994. |
|
|
Lehninger, A.L. Biochimie, Ed. Tehnica, Bucuresti, vol.I, 1987. |
|
|
Lenzi, A., Gandini, L., Picardo, M., Tramer, F., Sandri, G., Panfili, E. Lipoperoxidation damage of spermatozoa polyunsaturated fatty acids: scavenger mechanisms and possible scavenger therapies, Frontiers in Bioscience, 5, e1-15, 2000; |
|
|
Lewis, S.E., Sterling, E.S., Young, I.S., Thompson, W. Comparison of individual antioxidants of sperm and seminal plasma in fertile and infertile men, Fertil. Steril., 67:(1), 142-147, 1997. |
|
|
Liu, L., Trimarchi, J.R., Keefe, D.L. Involvement of mitochondria in oxidative stress-induced cell death in mouse zygotes, Biol.Reprod., 62,1745-1753, 2000; |
|
|
Lopes, S., Jurisicova, A., Sun, J-G., Casper, R.F.- Reactive oxygen species: potential cause for DNA fragmentation in human spermatozoa, Hum.Reprod., |
|
|
Love, C.C., Brinsko,S.P., Rigby, S.L., Thompson,J.A., Blanchard T.L., Varner, D.D. Relationship if seminal plasma level and extender type to sperm motility and DNA integrity, Theriogenology, Article in press, 2004; |
|
|
Mahadevan, M.M., Trounson, A.O. Biochemical factors affecting the fertility of cryopreserved human semen, Clin.Reprod.Fertil., 2(3), 217-227, 1983; |
|
|
Mann, T., Lutwak-Mann, C. Male Reproductive Function and the Composition of Semen : General Considerations, in Themes and Trends in Physiology, Biochemistry and investigative Andrology, Springer Verlag, Berlin, 1-37, 1981. |
|
|
Mann, T., Lutwak-Mann, C. Biochemistry of Seminal Plasma and Male Accesory Fluids; Application to Andrological Problems, in Themes and Trends in Physiology, Biochemistry and investigative Andrology, Springer Verlag, Berlin, 269-336, 1981. |
|
|
Manta,I., Cucuianu,M., Benga,G., Hodarnau,P. Metode biochimice in laboratorul clinic, ED.Dacia, Cluj-Napoca, 1976; |
|
|
Maridonneau, I., Braquet,P., Garay, R.P. Na+ and K+ transport damage induced by oxygen free radicals in human red cell membranes, J.Biol.Chem.258: (5), 310-3113, 1983; |
|
|
Mates, J.M, Sanchez-Jimenez, F. Antioxidant enzymes and their implications in pathophysiologic processes, Frontiers in Bioscience, 4 , d339-345, 1999; |
|
|
Mathews, K.C., van Holde, K.E. Biochemistry, The Benjamin / Cummings Publishing Company, Inc., Redwood City, 1990; |
|
|
Mazzilli, F., Rossi, T., Sabatini, L., Pulcinelli, F.M., Rapone, S., Dondero, F., Gazzangina, P.P. Human sperm cryopreservation and reactive oxygen species (ROS) production, Acta.Eur.Fertil., 26:(4), 145-148, 1995; |
|
|
Mazur, P. Freezing of living cells : mechanism and implications, Am.J.Physiol., 247, 125-142, 1984 ; |
|
|
McLaughlin,E.A,, Ford, W.C., Hull, M.G. The contribution of the toxicity of a glycerol-egg yolk-citrate cryopreservative to the decline in human sperm motility during cryopreservation, J Reprod Fertil., 95(3), 749-754,1992; |
|
|
Mialot, J.P. Pathologie de la reproduction chez les carnivores domestiques, Ed. Du Point Vstsrinaire, Maisons-Alfort, 7-27, 1984. |
|
|
Michalski, W.P. Chromatographic and electrophoretic methods for analysis of superoxide dismutase, J.Chrom.B., 684, 59-75, 1996; |
|
|
Mircu, C. Elemente de reproducere asistata la animalele domestice, Ed. Brumar, Timisoara, 2001; |
|
|
Moura,C.S, Cavalcanti,M.C.O., Guera,M.M.P., Batista,A.M., Baretto, M.B.P. In vitro evaluation test and dog semens freeze with different three extenders, Revista Brasiliera de Ciencia Veterinaria, |
|
|
Moustafal, M.H., Sharmal, R.K., Thornton, J., Mascha, E., Abdel-Hafez, M.A., Thomas, A.J., Agarwal, A. Relationship between ROS production, apoptosis and DNA denaturation in spermatozoa from patients examined for infertility, Hum.Reprod., |
|
|
Mueller, S., Riedel, H.D., Stremmel, W. Direct evidence for catalase as the predominant H2O2 removing enzyme in human erythrocytes, Blood, 90:(12), 4973-4978, 1997; |
|
|
Müller, K., Pomorski, T., Müller, P., Herrmann, A. Stability of transbilayer phospholipid asymmetry in viable sperm cells after cryotreatment, J.Cell Science, |
|
|
Nair, S.R.M., Kalathran, J., Rajasekaran,J. Effect of cryopreservation on the viability and membrane integrity of canine spermatozoa, Indian J.of Anim.Reprod., 20,(2), 142-145, 1999; |
|
|
Nehring, H., Rothe, L. Insemination of cryopreserved bull semen portions with reduced sperm numbres after dilution with to egg yolk free extenders, 15thEuropean A.I. Vets Meeting, Budapest(Hungary), Procc.cattle session, 14-23, 2003; |
|
|
Nielsen, F., Mikkelsen, B.B., Nielse, J.B., Raun Andersen, H., GrandjeanP.- Plasma malondialdehyde as biomarker for oxidative stress: reference interval and effects of life-style factors, Clin.Chem., |
|
|
Nizanski, W., Dubiel, A., Bielas, W., Dejneka, G.J. Effects of three cryopreservation methods and two semen extenders on the quality of dog semen after thawing, J.Reprod.Fertil.Suppl.57, 365-369, 2001; |
|
|
Nothling, J.O, Volkmann, D.H. Effect of addition of autologous prostatic fluid on the fertility of frozen-thawed dog semen after intravaginal insemination, J.Reprod.Fertil.Suppl.47, 329-333, 1993; |
|
|
Nuta, Gh., Busneag, C. Investigatii biochimice, Ed. Didactica si Pedagogica, Bucuresti, 1977. |
|
|
OFlaherty, C., Beorlegui, N., Beconi, M.T. Effect of natural antioxidants, superoxide dismutase and hydrogen peroxide on capacitation of frozen-thawed bull spermatozoa, Andrologia, |
|
|
OFlaherty, C., Beorlegui, N., Beconi, M.T. Reactive oxygen species requirements for bovine sperm capacitation and acrosome reaction, Theriogenology, 52: (2), 289-301, 1999; |
|
|
OFlaherty, C., Beorlegui, N., Beconi, M.T. Participation of superoxide anion in the capacitation of cryopreserved bovine sperm, Int. J.Androl., 26: (2), 109-114, 2003; |
|
|
Olson, G.E., Winfrey, P.Virginia A Comparison of Mammalian Sperm Membranes, in A Comparative Overview of Mammalian Fertilization, Bonnie S. Dunbar and Michael G. ORand Eds., Plenum Press, New York and London, 51-60, 1991, |
|
|
Parinaud, J., Le Lannour, D., Vieitez, G., Griveau, J.F., Milhet, P, Richoilley, G. Enhancement of motility by treating spermatozoa with an antioxidant solution (Sperm-Fit®) following ejaculation, Hum.Reprod.12(11), 2434-2436, 1997; |
|
|
Park, N.C., Park, H.J., Lee, K.M., Shin, D.G. Free radical scavenger effect of rebamipide in sperm processing and cryopreservation, Asian J.Androl., |
|
|
Park, J-I., Grant, C.M., Davies, M.J., Dawes, I.W. The cytoplasmatic Cu, Zn superoxide dismutase of Saccharomyces cerevisiae is required for resistance to freeze-thaw stress. Generation of free radicals during freezing and thawing, J.Biol.Chem., 273: (38), 22921-22928, 1998; |
|
|
Payne, S.R., Oliver, J.E., Upreti, G.C. Effect of antifreeze proteins on the motility of ram spermatozoa, Cryobiology, |
|
|
Pacala, N. Biologia reproductiei, Ed. Mirton, Timisoara, 2000. |
|
|
Peeker, R., Abramsson, L., Marklund, S.L. Superoxide dismutase isoenzymes in human seminal plasma and spermatozoa, Mol.Hum.Reprod., 3: (12), 1061-1066, 1997; |
|
|
Pena. A.I., Barrio, M., Quintela, L.A., Herradon, P.G. Effect of different glycerol treatments on frozen-thawed dog sperm longevity and acrosomal integrity, Theriogenology, 50,(1), 163-174, 1998; |
|
|
Pena. A.I., Lugilde, L.L., Barrio, M., Herradon, P.G., Quintela, L.A. Effects of Equex from different sources on post-thaw survival, longevity and intracellular Ca2+ concentration of dog spermatozoa, Theriogenology, 59,(8), 1725-1739, 2003; |
|
|
Pena. A., Linde-Forsberg, C. Effects of Equex, one- or two-step dilution, and two freezing and thawing rates on post-thaw survival of dog spermatozoa, Theriogenology, 54 :( 5), 859-875, 2000; |
|
|
Pena. A., Linde-Forsberg, C. Effects of spermatozoal concentration and post-thaw dilution rate on survival after thawing of dog spermatozoa, Theriogenology, 54 :( 5), 703-718, 2000; |
|
|
Perez-Pe, R., Muino-Bianco,T., Cebrian-Perez, J.A. Semen washing methods alters the viability of seminal plasma proteins to revert the cold-shock damage on ram sperm membrane, Int.J.Androl., 24: (6), 352-358, 2001; |
|
|
Phelps, M.J., Liu, J., Benson, J.D., Willoughby, C.E., Gilmore, J.A., Crister, J.K. Effects of Percoll separation, cryoprotective agents, and temperature on plasma membrane permeability characteristics of murine spermatozoa and their relevance to cryopreservation, Biol.Reprod., |
|
|
Popescu, Aurora, Cristea, Elena, Zamfirescu Gheorghiu, Marcela - Biochimie Medicala, Ed. Medicala, Bucuresti, 1980. |
|
|
Porras, A.G., Olson, J.S., Palmer, G. The reaction of reduced xanthine oxidase with oxygen. Kinetics of peroxide and superoxide formation, J.Biol.Chem., 256: (17), 9096-9103, 1981; |
|
|
Potts, R.J., Jefferies, T.M., Notarianni, L.J. Antioxidant capacity of the epididymis, Hum.Reprod.14(10), 2513-2516, 1999; |
|
|
Purdy, P.H., Graham, J.K. Effect of cholesterol-loaded cyclodextrin on the cryosurvival of bull sperm, Cryobiology, 48, 36-45, 2004; |
|
|
Raijmakers, M.T., Roelofs, H.M., Steeger, E.A., Mulder, T.P.J., Peters, W.H.M. Glutathione and glutathione S-transferases A1-1 and P1-1 in seminal plasma may play a role in protecting against oxidative damage to spermatozoa, Fertil.Steril., 79:(1), 2003; |
|
|
Rhemrev, J.P.T., Van Overveld, F.W.P.C., Haenen, G.R.M.M., Teerlink, T., Bast, A., Vermeiden, J.P.W. Quantification of nonenzimatic fast and slow TRAP in postaddition assay in human seminal plasma and the antioxidant contributions of various seminal compounds, J.Androl, |
|
|
Rigau, T., Rivera, M., Palomo, M.J., Fernandez-Novell, J.M., Mogas, T., Ballester, J., Pena, A., Otaegui, P.J., Guinovart, J.J, Rodriguez-Gil, J.E. Differential effects of glucose and fructose on hexose metabolism in dog spermatozoa, Reproduction, 123, :(4), 579-591, 2002; |
|
|
Rijsselaere, T., Van Soom, A., Maes, D., Verberckmoes, S., de Kruif, A. Effect of blood admixture on in vitro survival of chilled and frozen-thawed canine spermatozoa, Theriogenology, 61(7-8), 1589-1602, 2004; |
|
|
Rijsselaere, T., Van Soom, A., Maes, D., de Kruif, A. Effect of centrifugation on in vitro survival of fresh diluted canine spermatozoa, Theriogenology, 57: (6), 1669-1681, 2002; |
|
|
Rodrigues,B.A., Rodrigues, J.L. Effect of different concentrations of bovine serum albumin (BSA) added to Tris diluent on the viability of in vitro- cryopreserved dog semen, Arquivos da Faculdade de Veterinaria, UFRGS, 26,(2), 32-49, 1998; |
|
|
Rossi,T., Mazzilli, F., Delfino, M., Dondero, F. Improved human sperm recovery using superoxide dismutase and catalase supplementation in semen cryopreservation procedure, Cell Tissue Bank |
|
|
Rota, A., Pena, A.I., Linde-Forsberg, C., Rodriguez-Martinez, H. In vitro capacitation of fresh, chilled and frozen-thawed dog spermatozoa assessed by chlortetracycline assay and changes in motility patterns, Anim.Reprod.Sci., 57,(3-4),199-215, 1999; |
|
|
Rota, A. Studies on Preservation , Capacitation and Fertility of Dog Spermatozoa, Doctoral Thesis, Swedish University of Agricultural Sciences, Uppsala, 1998. |
|
|
Ruiz-Pensini, E., Diez, C., Lapena, A.C., Perez-Martos, A., Montoya, J., Alvarez, E., Arenas, J., Lopez-Perez, M.J. Correlation of sperm motility with mitochondrial enzymatic activities, Clin.Chem., 44 (8), 1616-1620, 1998; |
|
|
Shacter, E. Quantification and significance of protein oxidation in biological samples, Drug Met.Rev. |
|
|
Saleh, R.,A., Agarwal, A. Oxidative stress and male infertility: from research bench to clinical practice, J.Androl., 23, (6), 737-752, 2002; |
|
|
Sankarapandi, S., Zweier, J.L. Evidence against the generation of free hydroxyl radicals from the interaction of cooper, zinc- superoxide dismutase and hydrogen peroxide, J.Biol.Chem., 274: (49), 34576-34583, 1999; |
|
|
Sanocka, D., Kurpisz, M. Reactive oxygen species and sperm cells, Repr. Biol.Endocr.,2, 12, 2004; |
|
|
Santos, M.R.C., Almeida, L.E.F, Queiroz, F.J.R. Canine cooled semen extender for overnight delivery in a transport container, Revista Brasiliera de Ciencia Veterinaria, |
|
|
Santos, S.E.C., Vannucchi,C.I., Satzinger, S., Visintin, J.A., Pinheiro, L.P.L. Comparison of two cryoprotectants for freezing dog semen, Revista Brasiliera de Reproducao Animal, 25: (3), 472-473, 2001; |
|
|
Sikka, S. Oxidative stress and role of antioxidants in normal and abnormal function, Frontiers in Bioscience, e78-86, |
|
|
Silva, A.R., Cardoso,R.,de C.S., Silva, L.D.M. da, de C.S. Cardoso, R., da Silva, L.D.M. Canine semen cryopreservation with different glycerol concentrations, Revista Brasiliera de Ciencia Veterinaria, |
|
|
Silva, A.R., Cardoso,R.,de C.S., Uchoa,D.C., Silva, L.D.M. da, de C.S. Cardoso, R., da Silva, L.D.M. Effects of Tris-buffer, egg yolk and glycerol on canine semen freezing, Veterinary Journal,164: (3), 244-246, 2002; |
|
|
Silva, A.R., Cardoso,R.,de C.S., Uchoa,D.C., Silva, L.D.M. da Quality of canine semen submitted to single fractionated glycerol addition during the freezing process, Theriogenology, 59: (3-4), 821-829, 2003; |
|
|
Silva, A.R., Cardoso,R.,de C.S., Uchoa,D.C., Silva, L.D.M. da, Pinheiro, L.P.L. Effect of the cryopreservation process stages on the Tris extended canine quality, Revista Brasiliera de Reproducao Animal, 25: (3), 474-475, 2001; |
|
|
Sinha, A.K. Colorimetric assay of catalase, Anal.Biochem. 47 , 389-394, 1972; |
|
|
Sirivaidyapong, S., Cheng, F.P., Marks, A., Voorhout, .F., P., Bevers, M.M., Colebrander, B. Effect of sperm diluents on the acrosome reaction in canine sperm, Theriogenology, |
|
|
Sirivaidyapong, S., Ursem, P., Bevers, M.M., Colebrander, B. Effect of prostatic fluid on motility, viability and acrosome integrity of chilled and frozen-thawed dog spermatozoa, J.Reprod.Fertil.Suppl., 57, 383-386, 2001; |
|
|
Slatter, D.A., Paul, R.G., Murray, M., Bailey, A.J. Reactions of lipid-derivated malondialdehyde with collagen, J.Biol.Chem., 274: (28), 19661-19669, 1999; |
|
|
Soares, M.P., Rossi, C.A.R., Mezzalira,A., Cecim, M. Ethyleneglycol on canine semen cryopreservation, Ciencia Rural, 32: (4), 649-655, 2002; |
|
|
Songansen, N., Yu,I., Murton,S., Paccamonti, D.L., Eilts, B.E., Godke R.A., S.P. Leibo- Osmotic sensitivity of canine spermatozoa, Cryobiology, 44: (1), 79-90, 2002; |
|
|
Strambini, G.B., Gabellieri, E. Proteins in frozen solutions: evidence of ice-induced partial unfolding, Biophys.J., 70, 971-976, 1996; |
|
|
Ström, H.B. In Vitro Characterisation of Cryopreserved Canine Spermatozoa, Doctoral Thesis, Swedish University of Agricultural Sciences, Uppsala, 1999. |
|
|
Ström, H.B., Rota, Alessandra, Linde- Forsberg, Catharina - In Vitro Characteristics of Canine Spermatozoa Subjected to Two Methods of Cryopreservation, Theriogenology, 48:247-256, 1997. |
|
|
Stryer, L. Biochemistry, W.H. Freeman and Company Ed., San Francisco, 1975. |
|
|
Suleiman, S.A., Ali, M.E., Zaki, Z.M., Malik, E.M. Lipid peroxidation and human sperm motility: protective role of vitamin E, J. Androl., 17: (5), 530-537, 1996. |
|
|
Svingen, B.A., Bueuge, J.A., OaNeal, F., Aust, D.S. The mechanism of NADPH-dependent lipid peroxidation. The propagation of lipid peroxidation, J.Biol.Chem., 254 (13), 5892-5899, 1979; |
|
|
Szasz,F., Gabor, G., Solti, L. Comparative study of different methods for dog semen cryopreservation and testing under clinical conditions, Acta Vet.Hun., 48,(3), 325-333, 2000; |
|
|
Sztein, J.M., Noble, K., Farley, J.S., Mobraaten, L.E. Comparison of permeating and nonpermeating cryoprotectants for mouse sperm cryopreservation, Cryobiology, , (1), 28-39, |
|
|
Tardif, A.L., Farrell, P.B., Trouern-Trend, V. Computer-assisted sperm analysis for assessing initial semen quality and changes during storage at 5°C, J.Dairy Sci.80, 1606-1612, 1997; |
|
|
Thirumala, S., Ferrer, M.S., Al-Jarrah, A., Eilits, B.E., Paccamonti, D.L., Devireddy, R.V. Cryopreservation of canine spermatozoa: theoretical prediction of optimal cooling rates in the presence and absence of cryoprotective agents, Cryobiology, |
|
|
Thomassen, R., Farstadt, W., Krogenaes, A., Fougner, J.A., Berg, K.A. Artificial insemination with frozen semen in dogs: a retrospective study, J.Reprod.Fertil.Suppl. 57: 341-346, 2001; |
|
|
Tkaczuk-Wlach, J., Kankofer, M., Jakiel, G. Activity of superoxide dismutase and gluthathione peroxidase in human semen in normozoospermia and spermathopathy, Ann.Univ.M.Curie Sklodowska, 57 (2), 369-375, 2002; |
|
|
Tramer, Federica, Rocco, Francesca, Micali, F., Sandri, Gabriella, Panfili, E. Antioxidant Systems in Rat Epididymal Spermatozoa, Biology of Reproduction, 59: 753-758, 1998. |
|
|
Tselkas, K., Saratsis, P., Karagianidis, A., Samoulidis, S. Extracellular presence of reactive oxygen species (ROS) in fresh and frozen-thawed canine semen and their effects on some semen parameters, Dtsch.Tierarztl. Wochenschr.107 : (2), 69-72, 2000; |
|
|
Tsutsui, T., Hase, M., Hori, T., Komoriya, K., Shimizu, N., Nagakubo., K., Kawakami, E. Effect of addition of Orvus ES paste to frozen canine semen extender on sperm acrosome, J.Vet.Med.Sci., , (5), 537-538, |
|
|
Tulcan C., Cseh S., Cernescu H., Igna V. Chisu I., Olariu L.- Studii preliminare privind utilizarea diluantilor cu proteine vegetale la crioconservarea spermei de caine, Lucr.St.Med.Vet.Timisoara, XXXVII, 756, 2004; |
|
|
Twigg, J., Fulton,N., Gomez, E., Irvine, S., Aitken, R.J. Analysis of the impact of intracellular reactive oxygen species generation on the structural and functional integrity of human spermatozoa: lipid peroxidation, DNA fragmentation and effectiveness of antioxidants, Hum.Reprod.13 (6), 1429-1436, 1998; |
|
|
Vasilescu I. Enzimele, Ed. Academiei, Bucuresti, 1960. |
|
|
Vernet,P., Fulton, N., Wallace, C., Aitken, J.R Analysis of reactive oxigen species generating systems in rat epididimal spermatozoa, Biol.Reprod., 65, 1102-1113, 2001; |
|
|
Wang, Y., Sharma, R.K., Agarwal, A. Effect of cryopreservation and sperm concentration on lipid peroxidation in human semen, Urology, 50 (3), 409-413, 1997; |
|
|
Wang, A.W., Zhang, H., Ikemoto, I., Anderson, D.J., Loughlin, K.R. Reactive oxygen species generation by seminal cells during cryopreservation, Urology, 49 : (6), 921-925, 1997; |
|
|
Watson, P.F. Artificial Insemination and Preservation of Semen in Marshalls Physiology of Reproduction, Fourth Edition, vol. II, Reproduction in The Male, G.E. Lamming Ed., Churchill Livingstone, Edinburg, London, Melbourne and New York, 747-869, 1990. |
|
|
Woo, A.L., James, P.F., Lingrel, J.B. Sperm motility is dependent on a unique isform of the Na,K-ATP-ase, J.Biol.Chem., |
|
|
Yanagimachi, R. Mammalian Fertilization, in The Physiology of Reproduction, Second Edition, E. Knobil and J.D. Neil Eds., Raven Press, Ltd., New York, 189-317, 1994. |
|
|
Yu, I., Songansen, N., Godke, R.A., Leibo, S.P. Differences among dogs in response of their spermatozoa to cryopreservation using various cooling and warming rates, Cryobiology, 44: (1), 62-78, 2002; |
|
|
Zakhariev, Z., Iotova, M. Enzyme activity of the seminal fluid of bulls after deep freezing and incubationat 39sC, Vet.Med.Nauki.23 (10), 65-68, 1986; |
|
|
Zini, A., Laminarde, de E., Gagnon, C. Reactive oxygen species in the semen of infertile patients: levels of superoxide dismutase-like, and catalase-like activities in seminal plasma and spermatozoa, Int.J.Androl., 16, 183, 1993; |
|
|
Zorn, B., Vidmar, G., Meden-Vrtovec, H. Seminal reactive oxygen species as predictors of fertilization, embryo quality and pregnancy rates after conventional in vitro fertilization and intracytoplasmatic sperm injection, Int.J.Androl.26(5), 279-285, 2003; |
|
|
- Asymptote cool guide to cryopreservation, Asymptote Ltd., 2002; |
|
|
- Cryopreservation manual, Nalge Nunc International, 1998; |
|
|
- WHO Laboratory Manual, 3rd eddition, Cambridge University Press, 1992; |
|