Mediul contine substante inhibitoare pentru alte microorganisme fara ca acestea sa deranjeze dezvoltarea microorganismelor pe care dorim sa le selectam.
Aceste medii sunt folosite la analiza microbiologica a alimentelor, când din totalul microorganismelor aflate în produs pot fi puse în evidenta anumite grupe.
BLBV este mediul selectiv pentru bacterii coliforme si contine bulion de carne, lactoza, bila, verde briliant. Factorul selectiv este bila la care bacteriile coliforme sunt adaptate, în timp ce alte bacterii care pot sa fermenteze lactoza sunt inhibate.
Mustul de malt cu 60 % zahar reprezinta mediul selectiv pentru drojdii osmotolerante. Celelalte drojdii, neadaptate, sufera plasmoliza.
Daca într-un mediu în care exista celule de drojdie si bacterii se adauga actidiona, drojdiile sunt inhibate si se dezvolta bacteriile.
În functie de compozitie mediile de cultura pot fi:
anorganice - în care substantele nutritive se adauga sub forma de saruri; sunt destinate microorganismelor litotrofe (independente de compusii organici) - microflorei din sol.
- foarte diversificate si folosesc diferitele produse de natura organica, animala sau vegetala, care dupa sterilizare servesc pentru cultivarea microorganismelor.
Mediile organice de origine animala pot fi sub forma lichida (bulionul de carne, laptele, sângele, urina) sau sub forma solida (carnea fiarta, ficatul, ouale).
Mediile organice de origine vegetala se pot obtine în forma lichida (mustul de malt, sucuri de fructe, infuzii de plante, mustul de struguri), sau în forma solida (fructe, legume, pâine).
- medii de cultura mixte a caror sursa hidrocarbonata este de natura organica iar nutriti 414t1915e a minerala si azotata este asigurata de saruri anorganice.
Mediul Czapek este folosit pentru identificarea caracterelor morfologice ale mucegaiurilor, are o compozitie foarte bine definita. Sursa de carbon consta în zaharoza, sursa de azot este constituita din KNO3, iar fosfatii de potasiu, MgSO4 reprezinta sursele minerale.
Dupa consistenta mediilor de cultura, acestea pot fi:
medii de cultura lichide - se folosesc pentru cultivarea microorganismelor facultativ anaerobe si pentru microorganismele aerobe când li se ofera o suprafata mare de contact cu aerul sau în culturi statice prin agitare si barbotare de aer steril.
medii de cultura solide - se folosesc pentru microorganismele aerobe, pentru cresterea mucegaiurilor si sunt de obicei medii naturale, cu umiditate favorabila dezvoltarii microorganismelor.
medii de cultura solidificate - provin din medii lichide prin adaugarea unor substante de solidificare. Solidificarea se poate face cu agenti de solidificare: agar - agar (geloza), gelatina, silicagel, carboximetilceluloza.
Cel mai utilizat agent de solidificare este agar - agarul (geloza) - un polizaharid format din agaroza si agaropectina, izolat sau obtinut din alge (genul Gelidium). Din punct de vedere chimic este format din D - galactoza si 3,6 dehidrogalactoza, legate 1,3 sau 1,4. Agarul are proprietati absorbante. Pastrat în apa, nu se solubilizeaza. Prin absorbtia apei îsi mareste volumul de 16 - 17 ori. Se topeste la temperaturi mai mari de 100 C în apa si se transforma în gel prin racire la temperatura de 45 C. Pentru solidificarea mediilor se adauga 1,5 - 2 g la 100 ml mediu lichid.
Agarul nu este degradabil din punct de vedere biologic, de aceea este ideal pentru cultivarea microorganismelor. Mediile solidificate cu agar se folosesc pentru cultivarea si numararea microorganismelor deoarece pe medii solidificate celulele formeaza colonii caracteristice distincte. Agarul, în mediu foarte acid (pH < 4,5), daca este supus unor temperaturi de sterilizare, îsi pierde proprietatile de gel. În concluzie, în cazul mediului cu pH acid întâi se face sterilizarea mediului, apoi se adauga solutie acida (acid organic sau anorganic) pentru corectarea pH-ului.
Gelatina, din punct de vedere chimic, este o proteina cu structura asemanatoare colagenului obtinut din piele de porc, cartilagii si oase. În apa rece îsi mareste volumul de 3-6 ori si se fluidifica în apa calda usor iar transformarea în gel are loc foarte lent la temperaturi sub 30șC.
Pentru solidificarea mediului de cultura cu gelatina se adauga 12-15 g la 100 ml. La temperaturi ridicate de sterilizare (mai mari de 110șC), îsi pierde proprietatile de gelifiere. Mediile cu gelatina se sterilizeaza la temperaturi de 100 - 105șC. Gelatina poate fi hidrolizata enzimatic de microorganisme care produc proteaze extracelulare. Gelatina se foloseste pentru medii destinate cultivarii drojdiilor, pentru identificarea activitatii proteolitice a microorganismelor.
Ceilalti agenti de solidificare au o arie mai restrânsa de folosire, mai ales pentru mediile sintetice anorganice.
În tehnica microbiologica se folosesc medii gata preparate obtinute de firme autorizate care pot fi livrate în diferite forme (cel mai adesea se prezinta sub forma de praf sau pulbere). Pe sticla se mentioneaza compozitia mediului si cantitatea de pulbere care trebuie dozata la 1l de apa pentru obtinerea mediului de cultura. Dupa dizolvare se face sterilizarea mediului.
Mediile fermentative sunt destinate cultivarii la scara industriala a microorganismelor si majoritatea lor sunt medii lichide care se sterilizeaza mai usor. Aceste medii sunt ieftine deoarece contin o cantitate mica de substante dizolvate si se preteaza procesului de automatizare.
La obtinerea mediilor fermentative se folosesc pe scara larga produsele secundare rezultate din industria alimentara.
Ca surse hidrocarbonate se folosesc:
- melasa (produs secundar rezultat la fabricarea zaharului) ce contine 60% zahar, saruri minerale, biotina;
- zer (4,5% lactoza);
- plamezi amidonoase (se obtin prin macinarea cerealelor, fierberea, gelifierea amidonului si zaharificare);
- tarâte (20 % amidon, saruri minerale, vitamine), în mediu lichid sau solidificat. Tarâtele se amesteca cu apa si alte ingrediente.
Sursele cel mai des folosite de azot sunt::
fainuri proteice (de soia + amidon + azot proteic vegetal);
faina de peste;
îngrasamânt complex cu 16 % azot, uree, (NH4)2SO4.
Surse de factori de crestere: extract de porumb (se obtine de la înmuierea porumbului si favorizeaza fermentatia lactica), radicele de malt sub forma de extract, autolizat de drojdie, germeni de grâu, de porumb.
Diversitatea mediilor de cultura este datorata capacitatii de adaptare a numeroaselor microorganisme întâlnite în habitaturile naturale dar si faptului ca prin modificarea compozitiei mediilor de cultura se pot obtine randamente superioare în produsi de metabolism cu valoare economica.
Mediile de cultura sunt utilizate frecvent în tehnici microbiologice de laborator, pentru izolarea, cultivarea si întretinerea culturilor pure si pentru controlul microbiologic al produselor alimentare.
CAPITOLUL IV
CULTURI PURE
Cultura pura reprezinta biomasa de celule de acelasi tip provenita prin înmultire din o singura celula situata într-un mediu nutritiv steril adecvat.
În cazul în care, pe un mediu solidificat, prin dezvoltarea unei celule unice s-a obtinut o colonie, în cadrul coloniei biomasa dezvoltata reprezinta cultura pura.
Pentru perpetuarea si întretinerea puritatii culturilor, dupa obtinere, prin diferite metode de izolare a culturii pure, celule de acelasi fel se pot transfera în vase cu mediu steril, transfer care se numeste repicare si conduce la obtinerea unei culturi pure.
Obtinerea culturilor pure are o importanta deosebita pentru tehnicile microbiologice si în biotehnologii.
Izolarea în culturi pure permite identificarea si caracterizarea morfologica si fiziologica a microorganismului izolat.
Pe culturi pure se fac studii pentru selectionarea tulpinilor cu performante de biosinteza si sub forma de culturi pure se face întretinerea si conservarea culturilor valoroase. În industria alimentara, în subramurile în care microorganismele sunt folosite pentru obtinerea de produse alimentare acestea se folosesc sub forma de cultura pura, conditie obligatorie pentru a obtine produse cu o anumita calitate. Astfel, în industria prelucrarii laptelui, la fabricarea vinului, a spirtului, a berii, în panificatie, se folosesc culturi pure de microorganisme, care prezinta anumite proprietati biotehnologice.
4.1 TEHNICI GENERALE DE IZOLARE DIN MEDII
NATURALE sI OBŢINEREA CULTURILOR PURE
Pentru obtinerea culturilor pure se aplica metode fizice, metode fizico-mecanice si metode biologice. În prima etapa de izolare, stiind ca densitatea celulelor în mediul natural poate fi ridicata, se fac diluari ale suspensiilor de celule în ser fiziologic steril. Tehnica de diluare folosita este tehnica dilutiilor decimale. Se folosesc eprubete cu ser fiziologic steril ( 0,8 % NaCl) pentru a preveni turgescenta celulelor.
Metodele bazate pe tehnici de raspândire au la baza principiul raspândirii celulelor prin diluare în medii lichide sau prin diseminare mecanica pe suprafata mediilor sterile.
Metoda în strii foloseste drept suprafata de raspândire mediul înclinat din doua trei eprubete, prin transferul de celule din mediul natural, prin realizarea succesiva de striuri. Aceste metode se folosesc si în cazul în care o cultura pura este contaminata în perioada de pastrare cu microorganisme straine si aceasta trebuie sa fie salvata.
Metode scarificate
În placa Petri se repartizeaza un mediu de cultura adecvat (MMA/BCA) si dupa solidificarea mediului, cu firul ansei se recolteaza celule din mediul natural si se executa trasari pe suprafata mediului, astfel încât diversele celule ramân distantate între ele. Prin termostatare 2-3 zile, din colonia care corespunde microorganismului ce trebuie sa fie izolat, se face repicare într-o eprubeta cu mediu solid înclinat si astfel se obtine o cultura pura.
Metoda culturala Koch este folosita în special pentru izolarea de drojdii. Ca mediu de raspândire se foloseste mustul de malt cu gelatina repartizat în trei eprubete, fluidificat si mentinut la 40 C. Din mediul natural, de exemplu un must în fermentatie, se recolteaza o ansa care se introduce succesiv în cele trei eprubete, cu agitare, care sa asigure desprinderea celulelor. Dupa inoculare si uniformizare, continutul fiecarei eprubete se repartizeaza în câte o placa Petri; prin solidificare, celulele ramân fixate în gel si prin multiplicare vor forma colonii/clone izolate. În functie de densitatea celulelor recoltate initial, în placa a doua sau a treia coloniile sunt suficient de distantate (2cm), pentru a putea face izolarea din colonia adecvata a culturii pure.
Din suspensia de celule din care dorim sa facem izolarea se fac diluari în mediu steril si sub control microscopic se verifica daca s-a facut diluarea corespunzator si la o picatura de lichid se afla o celula.
Metoda Lindner este cea mai cunoscuta metoda folosita la selectarea culturilor pure de drojdii în industria fermentativa.
Pe o lamela se plaseaza cu ajutorul unui toc cu penita topografica steril o serie de picaturi. Apoi lamela se plaseaza cu picaturile în jos pe o lama cu escavatie. Apoi se studiaza la microscop si se noteaza picatura care contine o singura celula. Cu ajutorul unei hârtii de filtru sterilizata, luata cu o penseta sterila, se absoarbe picatura, prin absorbtie va trece si celula de drojdie. Dupa ce se absoarbe aceasta picatura, hârtia care contine celula se introduce într-o eprubeta care contine must de malt steril. Celula va da nastere prin înmultire în conditii favorabile la o biomasa care va reprezenta cultura pura.
Metoda Hansen consta în diluari decimale în mediu steril, dupa care se numara celulele din 1 ml dilutie si se realizeaza însamântarea pe mediu nutritiv solidificat pentru obtinerea de colonii.
Pentru izolarea culturilor de mucegaiuri se folosesc metode scarificate de antrenare a sporilor în placi cu must de malt agar. O alta metoda care ne permite obtinerea de colonii izolate de mucegaiuri este metoda inundarii. În placa Petri cu must de malt agar se adauga câtiva ml din o suspensie diluata, cu o concentratie mica de spori; dupa clatirea suprafetei mediului, lichidul se scurge iar unii spori, cei retinuti de suprafata mediului, conduc la colonii izolate.
Metoda lui Naumov izoleaza picaturi de MMA în care în prealabil s-au introdus un mediu restrâns de spori. În mediu înca fierbinte, dupa inoculare, se adauga picaturi pe capacul placii Petri, iar dupa solidificare si cultivare se alege picatura de mediu solid care prezinta o singura colonie.
Metoda cu micromanipulator este o metoda mecanica. Micromanipulatorul este alcatuit dintr-un sistem de tuburi capilare cu care se poate lucra sub microscop, cu posibilitatea de a recolta prin absorbtie în microcapilar unele celule izolate. Apoi celula este introdusa în mediu nutritiv adecvat.
Metodele biologice au la baza principiul proprietatilor diferentiate ale culturii ce urmeaza a se izola (proprietati diferentiate de ale microorganismelor asociate). Ca proprietati distincte amintim comportarea fata de temperatura, pH, relatia fata de oxigen, rezistenta la plasmoliza sau rezistenta la anumite substante chimice sau antibiotice.
Metoda Burri este metoda clasica care consta în izolarea bacteriilor aerobe de cele anaerobe prin metode biologice.
Din suspensia de microorganisme în care se afla în amestec aerobi si anaerobi se face însamântare în mediul BCA (bulion de carne cu agar) fluidificat si racit la 45 C, turnând într-un tub de sticla prevazut la partea inferioara cu un dop de cauciuc. Se acopera apoi tubul cu dop de vata si se termostateaza. În zona unde mediul este în contact cu aerul se vor dezvolta bacteriile aerobe. În restul mediului vor fi fixate bacteriile anaerobe.
Pentru a întelege modul de înmultire a microorganismelor în culturile pure este important sa cunoastem comportarea culturii într-un mediu nutritiv steril limitat cantitativ.
Daca într-un mediu nutritiv lichid (steril ) este inoculat un numar de celule X0 care apartin unei culturi pure si la diferite intervale de timp se face determinarea numarului de celule rezultat prin înmultire, se poate aprecia viteza de înmultire si se pot distinge etapele de dezvoltare ale culturii precum si valoarea nutritiva a componentelor din mediu.
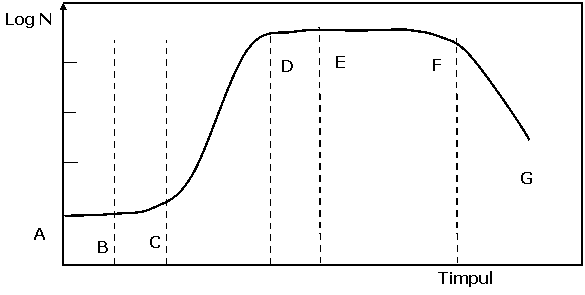
AB este faza lag sau faza de latenta în care nu are loc o crestere substantiala a numarului de celule. Aceasta este etapa în care celulele se adapteaza la conditiile de mediu, are loc o crestere importanta (de 3-10 ori) a concentratiei în acid ribonucleic. Are loc o biosinteza a enzimelor induse sau adaptive si cresterea în dimensiune a celulelor. Aceasta faza, în cazul drojdiilor, dureaza 2 ore si se poate reduce daca se repeta cultivarea celulelor pe medii cu aceeasi compozitie.
Deci cunoasterea comportarii celulelor în aceasta perioada face ca, în practica, când urmarim înmultirea celulelor, sa se recurga la cultivarea repetata a microorganismelor în medii cu aceeasi compozitie cu cea a mediului industrial în care acestea urmeaza sa fie cultivate.
BC este perioada de declansare a înmultirii - faza de accelerare a cresterii. În aceasta faza celulele cresc în dimensiune, ceea ce favorizeaza declansarea procesului de reproducere.
Dupa aceasta etapa urmeaza faza exponentiala sau faza logaritmica care are importanta deoarece în acest interval de timp are loc cresterea cu viteza maxima a celulelor.
xt = x02n - ecuatia generala de înmultire;
xt - numarul de celule la un moment t;
n - numarul de diviziuni;
x0 - numarul initial de celule inoculate.
Numeroase cercetari urmaresc sa se obtina un mediu de cultura în care faza exponentiala sa aiba o panta cât mai mare, sa dureze mai putin - conditii care se impun la obtinerea inoculului folosit industrial în toate biotehnologiile în care este important sa obtinem rapid un numar cât mai mare de celule.
Faza exponentiala va depinde de natura microorganismelor si de conditiile de mediu.
La un moment dat viteza de înmultire începe sa scada. DE reprezinta faza de încetinire a cresterii, care se explica printr-o modificare a continutului în factori de crestere.
Urmeaza faza EF - faza stationara de crestere - în care nu mai are loc o crestere a numarului de celule si daca se face o numarare globala a tuturor celulelor apare un echilibru între numarul celulelor nou formate si numarul celulelor care mor. Faza se explica prin scaderea concentratiei în substante nutritive, epuizarea din mediu a unor substante cu rol vital (bioelemente, factori de crestere), acumularea în mediu a unor substante rezultate prin catabolism care exercita un efect toxic asupra celulelor care au produs aceste substante.
Perioada stationara este succedata de perioada FG - faza de declin care consta în scaderea treptata a numarului de celule vii ca urmare a pierderii viabilitatii acestora (prin procese de autoliza).
Din punct de vedere fiziologic, fazele AB, BC, CD, DE se caracterizeaza prin cresterea celulelor si prin biosinteza produsilor primari de metabolism. Aceste faze formeaza tropofaza.
Fazele EF, FG formeaza idiofaza caracteristica perioadei în care celulele sintetizeaza produsele secundare de metabolism care nu au rol vital pentru celula (toxine, antibiotice, alcaloizi, alti compusi).
Faza stationara are importanta în practica când se urmareste prelungirea timpului aferent deoarece se doreste pastrarea în stare vie a microorganismelor din culturile pure.
În conditii de limitare a mediului nutritiv, prin acumularea unor compusi de catabolism, au loc modificari de pH si rH intracelular la valori care devin optime pentru enzimele proteolitice intracelulare. Se produce o eliberare a acestor proteaze din lizozomi si are loc moartea, inactivarea prin autoliza (solubilizarea sub actiunea enzimelor proprii).
Daca mentinem o cultura de microorganisme într-un mediu un timp îndelungat, se ajunge la o autosterilizare a mediului.
Pentru a evita moartea tuturor celulelor din cultura pura, celulele ramase vii se transfera prin repicare într-un mediu proaspat. La repicare se introduc numai celule de microorganisme nu si mediu, pentru a evita suplimentarea mediului proaspat cu substante toxice.
S-a constatat ca în faza de declin apare o usoara stimulare a cresterii numarului de celule explicabila prin aceea ca celulele vii pot sa foloseasca în nutritie substante care s-au eliberat prin liza celulelor moarte.
Cunoscând evolutia dezvoltarii în practica cultivarii microorganismelor cu importanta industriala, se aplica diferite metodologii de cultivare. Dintre utilizarile culturilor pure în care tinem cont de aceasta dinamica face parte si prepararea inoculului.
Inoculul reprezinta biomasa de celule apartinând unei culturi pure - celule vii si active folosite într-o anumita concentratie drept starter (cultura de pornire) pentru declansarea proceselor fermentative.
Pentru obtinerea cantitatii necesare de inocul, în industrie, se urmareste o înmultire succesiva a celulelor pornind de la o cultura pura în stadiu de cultivare în eprubeta si ajungând la volume folosite în productie.
Transferul celulelor în acest scop se face în volume de lichid din ce în ce mai mari, iar cantitatea de transfer este în medie :
1-3 % când preparam inocul pentru bacterii;
3-5 % când preparam inocul pentru drojdii;
5-10 % când preparam inocul pentru mucegaiuri.
Cresterea procentului de volum transferat este explicabila prin variatia dimensiunii celulelor. La prepararea de inocul transferul se realizeaza din mediul steril cu aceeasi compozitie ca a mediului ce urmeaza a fi fermentat pentru a elimina faza de adaptare.
Durata de timp între doua multiplicari succesive este echivalenta cu durata fazei exponentiale de crestere (transferul dintr-un volum mai mic într-un volum mai mare se face la sfârsitul fazei exponentiale de crestere).
Metodele discontinue (stationare) folosesc volume limitate de mediu.
Metodele continue sunt tehnici care se preteaza la automatizare, se lucreaza cu medii lichide, iar cultivarea se face pe principiul chemostatului sau turbidistatului.
Principiul chemostatului presupune mentinerea constanta a compozitiei mediului cu o rata de alimentare stabilita experimental. Concomitent se elimina mediul fermentat (cu celule) ceea ce asigura continuitatea procesului.
Când se foloseste principiul turbidistatului, continuitatea procesului este dirijata si presupune determinarea pe cale turbidimetrica a concentratiei de celule aflate la un moment dat în vasul de cultura.
În momentul în care au fost obtinute dintr-un mediu natural, în prima etapa, culturile pure se numesc izolate. Aceasta denumire însoteste cultura pâna când, pe baza studiului morfologic si fiziologic a izolatului pe mediu standard, se face identificarea pe baza criteriilor taxonomice si stim ca acest izolat apartine unei specii.
Odata identificata cultura, ea poate fi comparata cu cultura standard ce caracterizeaza specia si sunt studiate anumite proprietati ale tulpinii respective, în scopul evidentierii unor proprietati valoroase. În natura numeroase tulpini care apartin aceleiasi specii pot prezenta caractere fiziologice diferentiate.
În scopul selectarii tulpinilor cele mai valoroase dintre cele apartinând aceleiasi specii izolate din natura , în laboratorul de microbiologie se aplica metode de screening (ecranare) specifice. Prin screening se aplica criterii de selectare din ce în ce mai riguroase alegând tulpina cea mai buna.
Dupa selectare, în scopul stimularii activitatii de metabolism în sensul dorit, se practica fie metode culturale, prin care se modifica conditiile de cultivare (prin modificarea compozitiei mediului, a temperaturii, a pH-ului, a gradului de aerare, cultivare stationara, cultivare pe agitator etc). Prin metode culturale se produce o crestere însemnata a activitatii fiziologice a microorganismelor, aplicându-se tehnici pentru obtinerea de enzime, acizi, alcooli (produse de catabolism).
Stimularea activitatii fiziologice si de biosinteza a microorganismelor se poate realiza si prin metode de bioinginerie care constau în modificari în genomul celular (modificari genetice în structura acizilor nucleici), în transfer de gene, de plasmide, modificari structurale genetice. Aceste metode conduc la obtinerea de mutanti - microorganisme care au suferit transformari genotipice asociate de obicei cu transformari fenotipice (modificari de forma).
În acest scop se folosesc agenti mutageni dintre care cei mai utilizati sunt:
agenti mutageni fizici (radiatii ultraviolete, l = 250 nm) care pot produce transformari în structura secundara a acizilor nucleici;
agenti mutageni chimici (b-propiolactona, b-naftolul, antibiotice).
Prin mutatii se pot selecta agenti cu performante de biosinteza mult superiori fata de celula parentala (cantitatea de penicilina obtinuta din mutant de Penicillium este mult mai mare).
Pentru conservarea culturilor valoroase în practica de laborator se folosesc diferite tehnici care urmaresc prelungirea fazei stationare de crestere un timp cât mai îndelungat si se evita aparitia fazei de declin care poate duce la pierderea culturii. Aceasta prelungire se poate realiza astfel:
prin scaderea temperaturii fata de temperatura optima (sunt încetinite procesele de metabolism) - procedeele de pastrare în domeniul de refrigerare sau pastrarea culturilor congelate.
prin reducerea cantitatii de apa libera si mentinerea culturilor în stare uscata - procedee aplicate la conservarea bacteriilor sporulate si a mucegaiurilor.
prin privare de O2, conditie în care, dupa ce a avut loc dezvoltarea culturii în conditii de aerobioza, biomasa se acopera cu un strat de ulei de parafina (vaselina) de 1 cm înaltime deasupra culturii, care asigura pastrarea culturilor ani de zile.
Cea mai moderna tehnologie de pastrare a culturilor pure este liofilizarea. Celulele vii sunt suspendate într-un lichid protector (glicerol 10% sau amestec de 3% glutamat de sodiu, 3% dextran, 6% zaharoza în proportie de 1:1:2) si se supun congelarii astfel: se face congelarea lenta în fiole de sticla pâna la -20 C dupa care urmeaza o congelare rapida la -70 C, urmata de uscarea celulelor în vid pâna când umiditatea acestora ajunge la 5%. Apoi fiolele de sticla se efileaza si se închid ermetic.
Culturile liofilizate îsi mentin procentul de viabilitate ridicat ani de zile.
În practica de laborator, când numarul de celule este mic, se folosesc tehnici de repicare care constau în transferul celulelor din mediul epuizat pe mediu proaspat.
Culturile pure standard (cu anumite caractere) precum si culturi cu performanta în biosinteza sunt pastrate în colectii numite micoteci - întâlnite în mari laboratoare de cercetare, în laboratoare de microbiologie uzinale, în institutii de învatamânt superior.
|