Στο συγκεκριμένο πείραμα μελετάμε την αντίδραση αποχρωματισμού όταν φαινολοφθαλείνη αντιδρά σε αλκαλικό διάλυμα. Υπολογίζονται το κινητικό μοντέλο της αμφίδρομης αντίδρασης και ο θερμοτονισμός της από τον οποίο συμπεραίνεται ότ 14114p1510o ι η αντίδραση αποχρωματισμού είναι εξώθερμη (ΔΗR<0). Χρησιμοποιώντας το κινητικό μοντέλο που υπολογίστηκε, προβλέπεται η θεωρητική συμπεριφορά ενός CSTR BR CSTR PFR CSTR σε σειρά ίδιου συνολικού όγκου. Από τη σύγκριση αυτή διαπιστώνεται ότ 14114p1510o ι καθώς αυξάνει το πλήθος Ν των CSTR PFR
Σκοπός της παρούσας άσκησης είναι η μελέτη της αντίδρασης φαινολοφθαλεϊνης σε αλκαλικό διάλυμα. Υπολογίζουμε το κινητικό μοντέλο τη-ς αμφίδρομης αντίδρασης αποχρωματισμού χρησιμοποιώντας πειραματικά δεδομένα από έναν BR αντιδραστήρα ( διαγράμματα απορρόφησης συναρτήσει του χρόνου ). Επίσης υπολογίζουμε το θερμοτονισμό της αντίδρασης. Χρησιμοποιόντας το κινητικό μοντέλο βρίσκουμε τη θεωρητική συμπεριφορά ενός CSTR και το συγκρίνουμε με την πειραματική. Επαναλαμβάνουμε τη διαδικασία για έναν BR αφού προηγουμένως αφαιρέσουμε τα ρεύματα εισόδου και εξόδου του CSTR στη μόνιμη κατάσταση. Υπολογίζουμε επίσης το βαθμό μετατροπής ενός PFR σε συνάρτηση με τον όγκο του και η τιμή που βρίσκουμε συγκρίνεται με την τιμή μιας συστοιχίας CSTR που έχει συνολικά τον ίδιο όγκο με τον PFR.
Ph
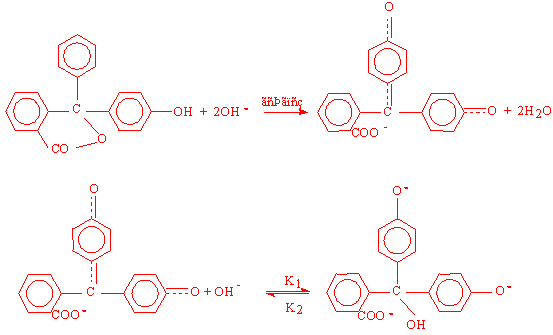
Αρχικά η φαινολοφθαλεΐνη που είναι άχρωμη μετατρέπεται ακαριαία και μη αντιστρεπτά στην κινοϊδή μορφή ( Ph PhOH
Η ταχύτητα του όλου φαινομένου καθορίζεται από την αργή αντιστρεπτή αντίδραση β και υπολογίζεται μετρώντας το ρυθμό αποχρωματισμού του διαλύματος με τη χρήση ενός ανιχνευτή ορατής ακτινοβολίας. Σύμφωνα με το νόμο των Beer Lambert nm Ph αργής αντίδρασης β δίνεται από την σχέση :
rPh = K1[Ph=][OH-] - K2[PhOH ( 1 )
Κ1 : σταθερά ταχύτητας της προς τα δεξιά αντίδρασης
Κ2 : σταθερά ταχύτητας της προς τα αριστερά αντίδρασης
[Ph ] : συγκέντρωση της κινοϊδής μορφής της φαινολοφθαλεϊνης
[ΟΗ-] : συγκέντρωση των υδροξυλίων
[PhOH
Κάνουμε την παραδοχή ότι η συγκέντρωση των [ΟΗ-] είναι σταθερή, εφ'όσον καθόλη τη διάρκεια του πειράματος είναι [ΟΗ-] » [Ph
Κ1΄ = Κ1[ΟΗ-] ( 2 )
rPh K Ph
ισορροπίας είναι rPh
0 = K Ph ![]()
![]() K PhOH
K PhOH ![]()
Κ
= ![]() =
= 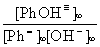 ( 4 )
( 4 )
![]() δηλώνει
τις
συγκεντρώσεις
των ιόντων στην
ισορροπία.
Είναι όμως :
δηλώνει
τις
συγκεντρώσεις
των ιόντων στην
ισορροπία.
Είναι όμως :
[PhOH ![]() Ph Ph
Ph Ph ![]() ( 5 )
( 5 )
Η εξίσωση ( 4 ) λόγω της εξισώσεως ( 5 ) γίνεται :
Κ = ![]() =
= ![]() ( 6
)
( 6
)
Arrhenius
Κ exp(-E/RT) ( 7
lnK ![]() lnK ( 7β )
lnK ( 7β )
όπου Κ0 : είναι ο προεκθετικός παράγοντας
Ε : είναι η ενέργεια ενεργοποίησης.
Ο θερμοτονισμός της αντίδρασης σε θερμοκρασία Τ δίνεται από την σχέση :
ΔΗR,T = E1 - E2 ( 8 )
Ε2 : είναι η ενέργεια ενεργοποίησης της προς τα αριστερά αντίδρασης.
BR
Οι ασυνεχείς αντιδραστήρες χρησιμοποιούνται για αντιδράσεις που γίνονται στην υγρή φάση. Οι παροχές της εισόδου των προϊόντων και της εξόδου των αντιδρώντων έχουν μηδενική τιμή. Το σύστημα θεωρείται συγκεντρωτικό, δηλαδή οι συγκεντρώσεις των συστατικών και η θερμοκρασία του αντιδρώντος μίγματος είναι ανεξάρτητες από την θέση στο χώρο του αντιδραστήρα. Η σχεδιαστική εξίσωση του συστατικού i
![]() (
9 )
(
9 )
όπου V
Ni i
ji i j
V
![]() (
10 )
(
10 )
όπου Ci i
xi i
xi ![]() (
11 )
(
11 )
όπου : Ni i
Νi=Nio+vi ( 12 )
rPh ![]() = K Ph
= K Ph
ln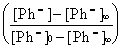 = -( K1' + K2 )t ( 14 )
= -( K1' + K2 )t ( 14 )
Beer Lambert
ln![]() )t ( 15 )
)t ( 15 )
ln![]() t
t
Κ1΄ = Κ1[ΟΗ-] ( 16 )
Κ`=![]()
![]() (
17 )
(
17 )
Beer Lambert
Κ` =![]() ( 18 )
( 18 )
lnK lnK
CSTR
Οι ομογενείς αντιδραστήρες CSTR
![]() = Fio Fie
= Fio Fie ![]() (
19α )
(
19α )
ή ![]() = Fio Fie
= Fio Fie ![]() (
19β )
(
19β )
![]() =
= ![]() +
+ ![]() ( 20 )
( 20 )
F CQ ( 21 )
Από την εξίσωση ( 20 ) τότε λόγω της εξισώσεως ( 21 ) έχουμε :
![]() =
= ![]() +
+ ![]() (
22 )
(
22 )
V Q
![]() =
= ![]() +
+ ![]() ( 23
)
( 23
)
Fie Fio ![]() (
24 )
(
24 )
Qo
![]() =
= ![]() (
25 )
(
25 )
Ph PhOH
![]() - ( K Ph K PhOH ( 26 )
- ( K Ph K PhOH ( 26 )
![]() + ( Κ1΄[Ph K PhOH ( 27 )
+ ( Κ1΄[Ph K PhOH ( 27 )
όπου : [PhOH o
PhOH Ph
[Ph oss Ph ess Ph ss K PhOH ss ( 28 )
[PhOH oss PhO ess Ph ss K PhOH ss ( 29 )
Ph PhOH
PFR
Οι PFR PFR
![]() =
= ![]() (
30 )
(
30 )
-![]() Ph K PhOH ( 31 )
Ph K PhOH ( 31 )
όπου : FPh Ph mol lt
CSTR
Συστοιχίες Ν αντιδραστήρων CSTR CSTR PFR CSTR k i
xik ![]() (
32 )
(
32 )
i
Fi k Fik riVk ( 33 )
Fi k Fio xi k ( 34 )
Fik Fio xik ( 35 )
xik = xi(k-1) + ri![]() ( 36 )
( 36 )
Το σύστημα των αλγεβρικών εξισώσεων ( 36 ) μπορεί να λυθεί διαδοχικά αν σε κάθε αντιδραστήρα γνωρίζουμε τη θερμοκρασία ,την ταχύτητα αντίδρασης, τον όγκο του κάθε αντιδραστήρα και την αρχική γραμμομοριακή παροχή. Μπορεί να δειχθεί ότι η μεταβατική απόκριση του j
x j 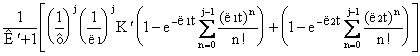 ( 37 )
( 37 )
όπου
: x j ![]()
K ![]()
[Ph ss Ph o ![]() ( 38
)
( 38
)
lt
nm
m για την μεταφορά του φωτός από το μετρητι- κό στον ανιχνευτή
Κατά την διεξαγωγή της πειραματικής διαδικασίας γίνονται πειράματα σε τρεις διαφορετικές θερμοκρασίες 33 C C C
v
v lt NaOH N NaOH
v rpm
v ml
v Τίθεται σε λειτουργία το καταγραφικό με ταχύτητα 30 cm hr
v
v
v
Volt Volt Volt
cm min
![]() ( 39 )
( 39 )
V
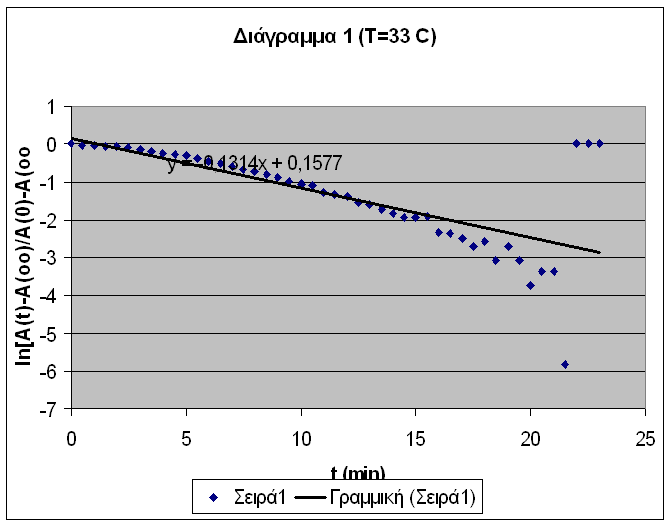
Βάσει αυτών κατασκευάζονται τα διαγράμματα 1,2 και 3. Ως θερμοκρασία κάθε πειράματος λαμβάνεται ο μέσος όρος της θερμοκρασίας στην αρχή και στο τέλος του πειράματος.
O κινητικές σταθερές υπολογίζονται βάσει των εξισώσεων ( 15 ) και
|
Τ ( οC ) |
K'=k1'/k2 |
-(k1'+k2)(min-1) |
k'1 (min-1) |
k2(min-1) |
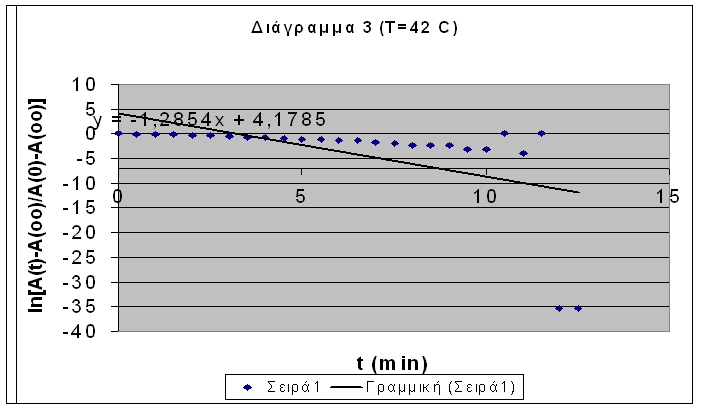
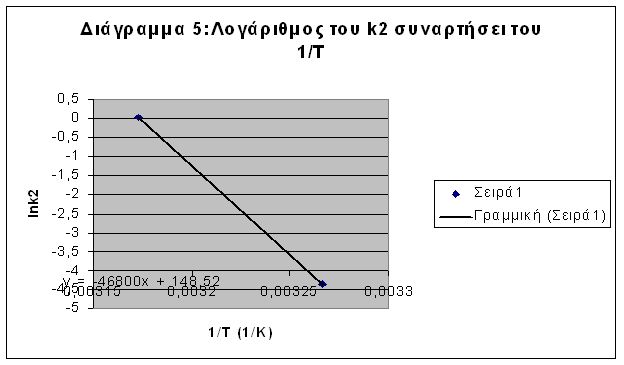
Βάσει της εξίσωσης ( 7β ) κατασκευάζεται η γραφική παράσταση του lnk lnk συναρτήσει του ( 1/Τ ) (Διαγράμματα 4 και 5 αντίστιχα). Η κλίση της ευθείας ισούται με ( -Ε/R lnk
Υπολογίζουμε ότι θα είναι:
|
Ε1/R |
E2/R |
E1 (J/mol) |
E2 (J/mol) |
|
lnK01' |
lnK02 |
K01 (min-1) |
K02(min-1) |
K1 = 0,317 exp ( -660,02/T ) min-1 ( 40 )
K2 = 7960481 exp ( -5645,5/T ) min-1 ( 41 )
R
R
Αντικαθιστώντας προκύπτει ότι ΔΗR = ( -66570,2 ) J mol <0
Δηλαδή βλέπουμε ότι η αντίδραση είναι εξώθερμη
CSTR
Δίνεται ότ 14114p1510o ι ο όγκος του αντιδραστήρα είναι V ml C Q ml min Q ml min
Ph CA PhOH CB
Οι σχεδιαστικές εξισώσεις στη μεταβατική κατάσταση προκύπτουν από τα ισοζύγια μάζας των συστατικών και δίνονται από τις εξισώσεις ( 26 ) και ( 27 ). Η λύση του συστήματος των δύο διαφορικών εξισώσεων με αρχικές συνθήκες CA CB
CA = 7,35*10-5 - 4,741*10-5exp(-t/5,89722) - 5,50354*10-6exp(-0,24668t)
CB =1,18659*10-5 - 3,79591*10-5exp(-t/5,89722) + 1,5516*10-7exp
(-0,24668t)mol m
CA
t προκύπτει
CÁs = 7,35E-5mol/m3
CBs = 1,1865 mol/m3
A
BR
CSTR σε μόνιμη κατάσταση διακόπτονται τα ρεύματα τροφοδοσίας και εξόδου και πλέον ο αντιδραστήρας λειτουργεί ως BR με αρχικές συγκεντρώσεις αυτές της μόνιμης κατάστασης του CSTR BR CSTR C
Hz t
CB CB CA CA
BR
CA0 = 7,35034E-05mol/m3
CB0 = 1,18659E-05mol/m3
K1 = 0,034 sec-1
K2 = 0,042 sec-1
PFR με μια συστοιχία CSTR
PFR
PFR
FA = CAQ0 ( 42 )
CA = CA0( 1-x ) ( 43 )
CB CA x ( 44 )
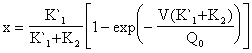
Με τη βοήθεια του υπολογισμού κινητικού μοντέλου για V lt
Q0 = 8,05 lt/min, K1` = 0,034 min-1 , K2 = 0,042 min-1
x
CSTR
CSTR για μόνιμη κατάσταση και από τον ορισμό του βαθμού μετατροπής προκύπτει
![]()
V lt Q lt min
CSTR
O V V V lt
V Q lt min
PFR
j x x x
CSTR
V V V V V lt min j = 5 η εξίσωση ( 37 ) δίνει x x x
Λόγω
του γραφικού
προσδιορισμού
των τιμών της
τάσης που
είναι ανάλογη
της
απορρόφησης
εισάγεται ένα
σφάλμα στις
τιμές ![]() . Ο
προσδιορισμός
τησ κλίσης
στις τρεις
ευθείες (
. Ο
προσδιορισμός
τησ κλίσης
στις τρεις
ευθείες (![]() -συναρτήσει
του t) έχει γίνει
με τη μέθοδο
των ελαχίστων
τετραγώνων.
Για ευθεία της
γενικής μορφής
y = Ax + B
-συναρτήσει
του t) έχει γίνει
με τη μέθοδο
των ελαχίστων
τετραγώνων.
Για ευθεία της
γενικής μορφής
y = Ax + B
CSTR
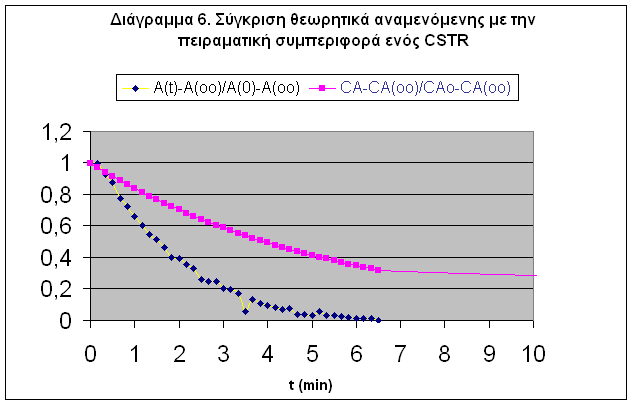
Από το διάγραμμά 6 παρατηρείται ότ 14114p1510o ι οι καμπύλες είναι της ίδιας μορφής. Δηλαδή η συγκέντρωση της Ph αυξάνεται εκθετικά με το χρόνο μέχρι την επίτευξη μόνιμης κατάστασης. Παρόλ'αυτά οι καμπύλες δεν ταυτίζονται. Αυτό οφείλεται τόσο στα πειραματικά σφάλματα των δεδομένων τιμών απορρόφησης όσο και στο μειωμένης αξιοπιστίας προσδιορισμένο κινητικό μοντέλο. Η πειραματική καμπύλη αποκρίνεται ταχύτερα από τη θεωρητική και φθάνει στη μόνιμη κατάσταση νωρίτερα. Συγκεκριμένα η πειραματική καμπύλη δείχνει ότι η μόνιμη κατάσταση πετυχαίνεται στα 300 sec sec
CSTR BR
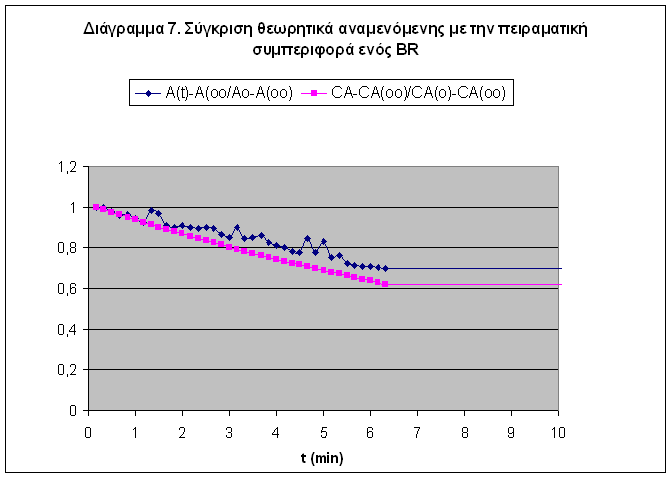
Η σύγκριση της θεωρητικής με την πειραματική συμπεριφορά του BR Ph
PFR CSTR CSTR
Ο βαθμός μετατροπής σε έναν PFR CSTR PFR CSTR CSTR CSTR PFR
Στα ίδια ακριβώς συμπεράσματα καταλήγουμε και από την παρατήρηση του διαγράμματος 9.
CSTR Ph
CSTR
Ph BR
BR
PFR CSTR
CSTR PFR
Αντιδραστήρων ", Θεσσαλονίκη 1992.
Stefanopoulos G
μετάφρασης Εργαστήριο Β΄ Χημικής Μηχανικής,
Θεσσαλονίκη 1992.
C
Όμως: ![]()
Συνεπώς Κ1΄ = 0.007 min-1
Κ2 = 0.013min-1
C
Όμως: ![]()
Συνεπώς Κ1΄ = 0.021 min-1
Κ2 = 0.062 min-1
C
Όμως: ![]()
Συνεπώς Κ1΄ = 0.261 min-1
Κ2 = 1.023 min-1
PFR CSTR
3.1 Υπολογισμός της μεταβολής του βαθμού μετατροπής ως συνάρτηση του όγκου του PFR
Ισχύουν οι σχέσεις:
FA CAQ ( 41 )
CA = CA0(1-x) ( 42 )
CB = CA0x ( 43 )
![]() K CA K CB ( 44 )
K CA K CB ( 44 )
FA = CAQ ( 45 )
Q = Q0 = Q1+Q2 =8,05 lt/min ( 46 )
H
FA CA Q x ( 47 )
Η ( 44 ) λόγω των ( 42 ), ( 43 ) και ( 47 ) γίνεται:
![]()

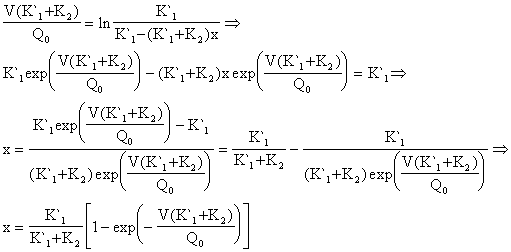
V=10 lt , Q0=8,05 lt/min , K1`=0.034 min-1 , K2=0.042 min-1
x = 0.04
![]()
CSTR
![]()
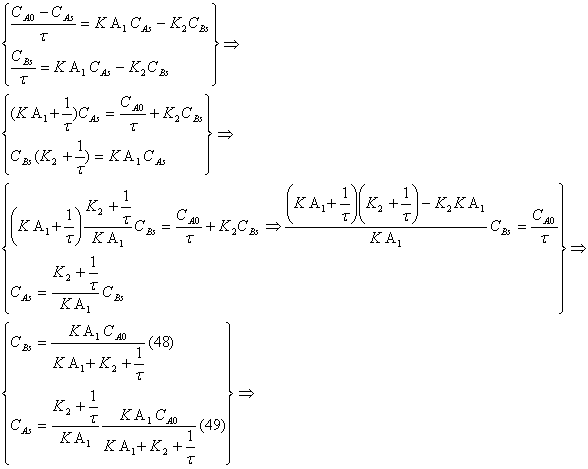
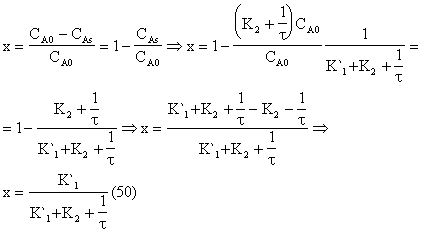
V Q lt min
x
Y CSTR
Όγκος κάθε αντιδραστήρα: V V V V lt
Ο μέσος χρόνος παραμονής σε κάθε αντιδραστήρα είναι:
= V1 / Q0 = 3,33/8,05 min
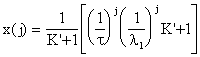
![]() ( 51)
( 51)
x j C j CA
j
X
Ο ολικός βαθμός μετατροπής της CA
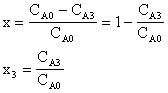
x
V V V V V V lt
Ο μέσος χρόνος παραμονής σε κάθε αντιδραστήρα είναι:
= V1/Q0 = 2/8,05 = 0,24 min
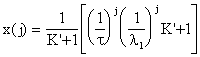
![]()
όπου x j CAj CA
A j
x(5)=0,95![]()
x x x
|