STARILE DE SOC
1. DEFINITIE, CLASIFICARE, ELEMENTE NOI DE FIZIOPATOLOGIE A SOCULUI
Termenul de soc a fost utilizat pentru prima data in 1743, in traducerea engleza a unui tratat despre ranile de razboi publicat in Franta de Henri Francois Le Dron. In decursul timpului, termenul de soc si-a imbogatit progresiv continutul, ajungand sa cuprinda stari clinice grave determinate de factori etiologici diversi, dar care au ca element comun o perturbare acuta severa a perfuziei tisulare si a metabolismului celular.
In prezent, socul poate fi definit ca un sindrom clinic acut caracterizat prin hipoperfuzie tisulara global&# 222b14c 259; sau perfuzie tisulara inadecvata nevoilor tisulare, avand ca reazultat final, in lipsa unei terapii eficace disfunctia severa a organelor vitale si apoi decesul.
Socul este un sindrom fiziopatologic sever, caracterizat prin scaderea fluxulul tisular de sange oxigenat sub nivelul critic necesar desfasurarii normale a proceselor metabolice celulare. Hipoxia tisulara consecutiva hipoperfuziei este elementul fiziopatologic esential, comun tuturor formelor de soc si care defineste socul.
In evaluarea mecanismului de producere al hipoxiei tisulare, trebuie avute in vedere toate dimensiunile fundamentale care caracterizeaza dinamica fluidelor: volumul ciurculant, presiunea de perfuzie (TA), fluxul tisular, dar si efectul circulatiei la nivel tisular, exprimat prin consumul de oxigen tisular (VO2), care reprezinta suma tuturor proceselor metabolice oxidative.
In starile de soc consumul de oxigen este redus sau inadecvat nevoilor tisulare si aceasta genereaza hipoxia si alte tulburari metabolice care produc suferinta celulara si disfunctia organelor vitale.
Reducerea consumului (VO2 < 250 ml/kg) poate fi determinata de:
1. o aprovizionare cu oxigen scazuta (DO2 < 1 000 ml/kg)
- prin scaderea fluxului (hipoperfuzie), in socul hipovolemic si cardiogen, sau
- prin maldistributia fluxului, in socul septic si anafilactic;
2. o extractie tisulara a oxigenului scazuta, in socul septic.
Rezulta ca hipoxia tisulara printr-un VO2 redus sau insuficient fata de necesar, poate fi produsa prin mecanisme diferite si se disting mai multe forme clinice de soc: hipovolemic, cardiogen, septic, anafilactic.
2. CLASIFICARE
Daca tulburarea perfuziei tisulare ce caracterizeaza socul trebuie inteleasa atat ca hipoperfuzie absoluta (scaderea fluxului sanguin tisular), cat si ca hipoperfuzie relativa in cazul socului septic (flux sanguin normal sau chiar crescut), dar oricum insuficienta pentru asigurarea unui aport de oxigen si substrat energetic corespunzator consumului, atunci problema fiziopatologica centrala a socului se poate reduce la existenta unui dezechilibru intre aportul de oxigen sistemic (DO2) si consumul de oxigen la nivel tisular (VO2).
Cauzele care produc dezechilibrul DO2/VO2 sunt multiple, dar pot fi grupate dupa mecanismele prin care actioneaza.
I. Scaderea aportului de oxigen (DO2) este determinata de reducerea debitului cardiac (indexul cardiac) prin:
1. Reducerea presarcinii (scaderea volumului de sange din ventriculul stang la sfarsitul diastolei, in contextul scaderii volumului sanguin circulant). Cauzele care determina scaderea volumului circulant sunt multiple, dar fiziopatologia fiind comuna sunt grupate sub denumirea de soc hipovolemic.
2. Reducerea performantei de pompa a cordului. Cauzele determinante ale scaderii performantei de pompa a cordului sunt diverse, dar opereaza in principal prin acelasi mecanism patogenic si sunt grupate sub denumirea de soc cardiogen.
Pe plan hemodinamic, scaderea debitului cardiac - atat prin scaderea volumului sanguin circulant cat si prin scaderea performantei de pompa cardiaca determina o reactie de tip hipodinamic manifestata clinic prin:
- semne de hipoperfuzie tisulara (semne simple, usor de cules si interpretat): tahicardie, extremitati reci, umede, scaderea presiunii arteriale medii, modificarea starii de constienta (obnubilare, agitatie);
- scaderea debitului urinar(oligurie)
- scaderea presiunii pulsului (scaderea diferentei dintre presiunea arteriala maxima si presiunea arteriala minima)
- timp de umplere capilara prelungit.
Din punct de vedere paraclinc, reactia hipodinamica se caracterizeaza prin: index cardiac (IC) scazut rezistente vasculare sistemice (RVS) crescute presiuni de umplere (PVC,PCP):
• mult scazute in socul hipovolemic
• mult crescute in socul cardiogen.
II. Cresterea consumului de oxigen (VO2) in conditiile unui DO2 normal sau chiar crescut caracterizeaza socul septic care apare frecvent ca o complicatie a infectiilor severe. Pe plan hemodinamic socul septic determina o reactie hiperdinamica manifestata clinic prin:
- tahicardie (si alte semne de SIRS) si tendinta la hipotensiune;
- presiunea pulsului crescuta;
- presiunea diastolica scazuta;
- extremitati calde;
- timp de umplere capilara normal;
- semne de sepsis.
3. Elemente noi de fiziopatologia socului
In figura de mai jos se evidentiaza faptul ca in fiziopatologia socului un rol central il au mecanismele care controleaza fluxul sanguin regional. Fluxul sanguin la nivel de organ este dependent de presiunea de perfuzie si de rezistenta vasculara a vaselor care il iriga. Hipoperfuzia si disfunctia de organ apar daca rezistenta vasculara nu poate compensa scaderea presiunii sistemice de perfiizie sau daca presiunile sistemice nu pot depasi nivelele inalte ale rezistentei date de vasele care iriga organul respectiv. La disfunctia de organ pot contribui factori care actioneaza asupra microcirculatiei (in speta asupra perfiiziei la nivel celular). Dintre acesti factori fac parte compresia microvasculara datorita edemului celular si alterarile vasomotricitatii datorita eliberarii de substante vasoactive. Factorul declansator primordial comun este perfuzia tisulara ineficienta pentru a satisface necesitatile metabolice ale celulelor.
Rolul rezistentelor vasculare sistemice si a distributiei fluxului sanguin.
Socul septic este caracterizat prin rezistente vasculare sistemice indexate (RVSI) scazute, tendinta la hipotensiune si flux sanguin inadecvat necesitatilor tisulare (debit cardiac crescut dar maldistribuit). Daca scaderea RVSI ar fi cauza patogenica a socului septic, cresterea/normalizarea RVSI prin administrarea de vasopresoare ar trebui sa se coreleze cu imbunatatirea prognosticului fapt nedemonstrat. Din contra, vasopresoarele intensifica maldistributia fluxului sanguin. Nici RVSI scazute nu se coreleaza cu decesul.
Valoarea scazuta a RVSI nu este o buna masuratoare a „socului distributiv' deoarece acestea reprezinta doar raspunsul presional la flux si nu distributia fluxului (RVSI = TAM /IC). Deoarece RVSI sunt direct corelate cu indexul cardiac adica cu fluxul total sanguin al organismului, acestea nu reflecta maldistributia fluxului in microcirculatie. Circuitele vasculare ale diverselor organelor sunt in paralel, iar rezistenta intregului sistem este mult influentata de circuitul cu cea mai mica rezistenta. Astfel, daca rezistenta dintr-un singur organ scade, in timp ce in toate celelalte organe creste, rezistentele vasculare totale calculate sunt scazute.
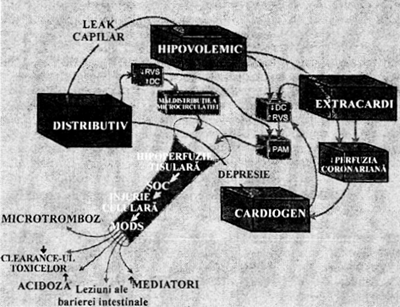
Mecanismele care controleaza fluxul sanguin
regional in fiziopatologia socului.
Deci RVSI nu sunt o buna masura pentru tonusul arteriolar sau a distributiei fluxului sanguin la nivel de microcirculatie si nu sunt un criteriu potrivit pentru terapie. Totusi vasopresoarele sunt indicate in terapia socului septic (dupa optimizarea volemiei) deoarece hipotensiunea severa scade dramatic fluxul sanguin coronarian si cel cerebral sunt dependente de presiunea de perfuzie.
Exista desigur riscul ca efectul α-adrenergic sa exacerbeze vasoconstrictia neselectiva si sa agraveze maldistributia fuxului sanguin la nivel microcirculator. Vasopresoarele utilizate cel mai frecvent in socul septic (noradrenelina, dopamina, adrenalina) au insa si efect inotrop pozitiv, deci vor creste si indexul cardiac iar efectul global asupra perfuziei/oxigenarii tisulare va depinde de reportul intre efectul pozitiv al cresterii fluxului sanguin si efectul negativ al maldistributiei. Doza optima de vasoconstrictor este cea mai mica doza necesara mentinerii unei presiuni arteriale satisfacatoare.
Rolul hipoxiei tisulare in aparitia insuficientei de organ si a decesului
Perfazia tisulara inadecvata fie ea cu flux scazut sau crescut duce la hipoxie tisulara, care daca este importanta si extinsa in timp produce disfunctie de organ, insuficienta (multipla) de organ si deces. Multe decese dupa chirurgie, trauma, sepsis sunt precedate de insuficienta multipla de organe, cea mai frecventa cauza de deces in T.I.
Cand manifestarile precoce ale socului sunt corectate prin terapie insuficienta, printr-o corectare proasta a oxigenarii tisulare, datoria de O2 rezultata poate sa nu fie recunoscuta pana la aparitia insuficientei de organ incluzand ARDS, sepsis, insuficienta acuta cardiaca, insuficienta renala, CID, insuficienta hepatica si coma.
Rolul alterarii permeabilitatii capilare in soc
In stadiile tardive al socului arata cresterea apei totale si a apei interstitiale cu contractia volumului plasmatic si a lichidului intracelular. Prezenta unei cantitati foarte mari de apa interstitiala si totala in organism nu insemna ca deficitul de volum sanguin a fost corectat deoarece hipovolemia apare frecvent in prezenta edemelor periferice masive. Cresterea de volum a interstitiului nu contribuie direct la disfunctia circulatorie, dar poate agrava problema transportului de O2 prin cresterea spatiului de difuziune a acestuia care traverseaza din spatiul intravascular spre membrana celulara.
Leakul capilar apare in stadiul tardiv al socului septic si mai putin frecvent in socul postoperator, traumatic si hemoragic. Se caracterizeaza prin hipovolemie persistenta in ciuda administrarii adecvate de lichide si prin edeme periferice importante. Leakul prin membrana capilara duce la trecerea proteinelor plasmatice si a apei in interstitii. in stadiul tardiv edemele se pot agrava in efortul mentinerii volumului plasmatic.
Se considera ca hipoxia tisulara locala si acidoza in asociere cu mediatorii biochimici initiaza leakul capilar. Cresterea cantitatii de lichid interstitial este probata de o progresie continua a edemelor periferice. Restabilirea volumului sanguin in stadiul timpuriu al socului cu mentinerea ulterioara a volumului intravascular este cea mai buna profilaxie a acestui fenomen; acestea depind de presiunea oncotica plasmatica precum si de administrarea prompta de o cantitate adecvata de lichide intravenos. Leakul capilar trebuie diferentiat de supraincarcarea cu lichide legata de expansiunea excesiva a interstitiului cu mari cantitati de cristaloizi, care cresc foarte mult spatiul interstitial si restabilesc volumul plasmatic doar temporar.
Distributia
fluidelor administrate intre plasma si apa interstitiala in
timpul resuscitarii cristaloide trebuie considerate separat de fenomenul
de leak capilar. Leakul capilar, hipervolemia si infuzia masiva de
cristaloide expandeaza spatiul interstitial, si pot duce la
aparitia edemului pulmonar si periferic, dar prin mecanisme diferite.
Leakul capilar apare cand permeabilitatea capilara crescuta permite
proteinelor plasmatice sa treaca in spatiul intravascular in
cantitati ce compromit mentinerea volumului plasmatic. Edemul
pulmonar produs prin hipervolemie sau insuficienta cardiaca se
caracterizeaza prin PCP ridicata (mai mare de
Prezenta edemului pulmonar nu inseamna neaparat ca exista supraincarcare volemica. Edemul pulmonar si cel periferic pot fi produse prin insuficienta cardiaca, valori scazute ale proteinelor prin malnutritie, insuficienta renala, hepatica, status hipermetabolic, traumatisme craniene, reactii anafilactoide, hipertermie, precum si m carcinomatoza si alte stari terminale.
Leakul capilar apare in perioada intermediara, (ziua 3-5 postoperator) la pacientii post-soc, septici si atinge un maxim in faza tardiva sau terminala.
In stadiile tardive de soc insotite de leak capilar nu exista decat o minima crestere a DO2 si nici o imbunatatire a VO2 dupa administrarea de lichide si stimulare inotropa. Dimpotriva, in faza postoperatorie imediata (primele 48 de ore) exista o imbunatatire semnificativa a ambelor variabile la administrarea de lichid si inotrop.
4. Injuria celulara
Socul afecteaza organele alterand integritatea functionala a celulelor constituente. Pentru a functiona normal celulele necesita energie. Injuria celulara este data de un deficit in livrarea substratului energetic, de o incapacitate de a utiliza nutrientii livrati, sau de incapacitatea de a produce energie din ei. Hipoperfiizia scade livrarea de nutrienti. Incapacitatea de a utiliza nutrientii livrati poate fi o consecinta secundara a hipoperfuziei, poate fi un efect toxic direct al unui agent nociv, sau poate fi mediata de citokine sau de modificarile metabolice de la nivel celular.
Perfuzia deficitara este procesul declansator.
Pe masura ce scade livrarea de oxigen si de alti nutrienti scade productia de ATP. Se produce o incetinire a proceselor de mentinere a integritatii membranelor celulare. Prima manifestare la nivel ultrastructural a leziunii hipoxice este umflarea reticulului endoplasmic.
Apoi sunt afectate sunt mitocondriile prin condensarea compartimentului interior urmata de umflarea progresiva a mitocondriei. Pe masura ce se mentine hipoxia celulara are loc distructia lizozomilor cu eliberarea enzimelor lizante care contribuie la digestia intracelulara si la depunerea intracelulara de calciu. Distructia lizozomilor poate fi punctul care marcheaza ireversibilitatea leziunii celulare, analog cu ireversibilitatea clinica. Dupa acest moment recuperarea functiei normale de aprovizionare cu nutrienti nu mai poate impiedica moartea celulara.
Alt mecanism de injurie celulara il constituie formarea de radicali liberi datorita efectului de reperfuzie sau datorita activarii neutrofilelor. Acumularea produsilor de degradare ai ATP-ului (hipoxantine) m perioada de hipoperfuzie potenteaza activitatea enzimei xantin-oxidaza, iar pe masura ce are loc procesul de reperfuzie se produce din nou livrarea de oxigen m tesutul afectat. in acest moment oxigenul este convertit in radicalul activ superoxid, care la randul lui genereaza alte specii reactive cum ar fi peroxidul de hidrogen (H2O2) si hidroxil, contribuind la leziunile ultrastructurale ale membranei si la potentiala ireversibilitate. Neutrofilele activitate genereaza deasemenea cantitati mari de superoxid si enzime proteolitice care contribuie la injuria celulara. Hipoxia tisulara precipita sau determina activarea unor cascade ce implica produsi ai acidului arahidonic - tromboxani (Tx), prostaglandine (PG), leucotriene (LT); histamina si alte amine, serotonina, sistemul complement, TNF (tumoral necrosis factor) si alte citokine, iar prin macrofagele activate elaborarea continua de antigene bacteriene, mesageri intercelulari, radicali liberi de oxigen. Acesti mediatori produsi in patul capilar acidotic si hipoxic par sa initieze sau sa intensifice ARDS si alte insuficiente de organ.
In soc hipoxia locala tisulara stimuleaza eliberarea de peptide neuroendocrine, hormoni, proteine de faza activa care modifica functia celulelor T si B, precum si a factorilor imunosupresivi. Celulele T activate si alte celule hematopoetice produc diverse citokine, inclusiv TNF si interleukine (IL 1, 2, 6, 8) . Limfocitele si monocitele activate au receptori pentru hormoni si pot sintetiza si secreta simultan aceiasi hormoni si mesageri. Activarea leucocitelor prin acestia sau prin alt mecanisme biochimice produc radicali liberi ai oxigenului, care desi au timp de viata scurt, produc leziuni tisulare majore.
S-a demonstrat ca nivelele plasmatice ale IL 1, 6, 8 si TNF cresc in cateva ore de la inducerea unei endotoxinemii si dupa perfuzia intravenoasa de bacterii . S-a demonstrat clinic si experimental activarea IL 6, 8 si TNF in sepsis sau ARDS dupa trauma . Eliberarea crescuta a fiecaruia dintre aceste citokine s-a asociat cu reactia de faza acuta si status hipermetabolic .
Secventa modificarilor fiziopatologice legate de activarea citokinelor, complementului si a altor mediatori nu este inca elucidata. Probabil ca aceste citokine, complementul si radicalii liberi ai oxigenului joaca un rol important in modularea alterarii metabolismului O2 si parametrilor hemodinamici asociati socului si sepsisului. Nivelul plasmatic al IL 6 si 8 atinge maximul la 16 ore dupa ARDS post traumatic, dar modificarile hemodinamice si ale transportului de O2 apar inaintea ARDS.
SOCUL HIPOVOLEMIC
Este forma clinica de soc cel mai frecvent intalnita si care realizeaza prototipul sindromului hemodinamic al socului. Ca si cauze sunt reprezentate mecanisme care scad volumul intravascular. Din punct de vedere hemodinamic au loc:
scaderea presiunilor de umplere diastolice
scaderea volumului sistolic
Debitul cardiac este partial mentinut prin tahicardie compensatorie are loc cresterea reflexa a rezistentei vasculare periferice si a contractilitatii miocardice, mediate prin mecanisme neuroumorale.
Daca pierderea de sange depaseste mai mult de 20-25% din volumul intravascular, aceste mecanisme compensatorii nu mai sunt eficiente rezultand hipotensiune si scaderea debitului cardiac. Hipotensiunea este de obicei evidenta dupa o pierdere acuta de sange de ml sau mai mult.
Manifestari clinice
Tahicardie cu puls filiform
Tahipnee, polipnee
Vene periferice si ale gatului colabate
Presiunea venoasa centrala este scazuta, indicand reducerea presarcinii
Hipotermie, senzatie de frig, marmorarea tegumentelor
Semne de compromitere a perfuziei periferice:
piele palida, rece, umeda
- cresterea timpului de reumplere capilara mai mare de doua secunde
scaderea diurezei o alterarea statusului mental
Scaderea debitului cardiac determina scaderea transportului de oxigen. Daca nu se intervine terapeutic si hipovolemia persista, reducerea prelungita a perfuziei diminua transportul de oxigen la tesuturi. La inceput, consumul de oxigen este mentinut prin:
cresterea extractiei de oxigen,
cresterea diferentei arterio-venoasa a continutului de oxigen.
Aceste mecanisme compensatorii pot sa devina ineficiente, instalandu-se hipoxia tisulara si acidoza lactica. Aceste doua procese produc tulburari grave ale activitatii celulare si ale peretelui microvasului. Vasoconstrictia precapilara reduce presiunea hidrostatica precapilara favorizand transferul lichidelor din interstitiu spre compartimentul vascular. Mecanismul reumplerii transcapilare reprezinta un mecanism compensator important in faza initiala a socului hipovolemic. Decompensarea microcirculatiei reduce si mai mult intoarcerea venoasa si debitul cardiac, iar tensiunea arteriala scade sub valorile critice de asigurare a irigatiei organelor vitale. Un alt mecanism important este formarea de radicali liberi in asociere cu efectul de reperfuzie.
Staza capilara
acidoza
trombozele capilare
realizeaza un cerc vicios care necorectat la timp conduce la instalarea leziunilor celulare hipoxice ireversibile. Functia cerebrala si cardiaca sunt mentinute prin devierea fluxului sanguin de la tegumente si muschi. In cazul socului hipovolemic prin pierderi lichidiene, suferinta de organ se manifesta relativ tarziu si organul cel mai afectat este rinichiul. Cauza insuficientei renale acute este hipoperfuzia renala.
Tratament
Refacerea volemiei, impreuna cu corectarea starii de hipoperfuzie, reprezinta principalele obiective ale terapiei socului hipovolemic.
Monitorizarea pacientilor in soc adeseori necesita intubatie traheala si suport ventilator mecanic, chiar daca nu prezinta insuficienta respiratorie. Prin aceasta se permite corectarea rapida a hipoxemiei tisulare prin administrarea de oxigen
Este facilitata, de asemenea, corectarea acidozei lactice.
Administrarea lichidelor trebuie sa fie agresiva pentru a preveni hipoperfuzia prelungita. Este necesara montarea a cel putin doua linii intravenoase periferice cu lumen mare. Daca este posibil, cateterizarea precoce a unei vene centrale pentru administrare de volume crescute, rapid si pentru a facilita monitorizarea hemodimanica in cazuri refractare sau complicate.
Plasarea unui cateter venos central trebuie intotdeauna verificata cu ajutorul unei radiografii toracice este de preferat evitarea plasarii cateterelor intravenoase in membrele care reprezinta leziuni majore tisulare sau osoase resuscitarea circulatorie se realizeaza cu solutii cristaloide: ringer, ringer lactat, ser fiziologic. Ele parasesc rapid patul vascular. Solutiile cristaloide se administreaza in raport de 3:1 fata de cantitatea estimataa sangelui pierdut. Pentru refacerea unui ml de sange pierdut este necesara perfuzarea a 3 ml de solutie cristaloida. Initial nu sunt recomandate solutiile de glucoza din cauza riscului producerii hiperglicemiei. solutiile saline hipertone (3% sau 7,5 %) au eficienta dovedita in refacerea volemiei si ameliorarea microcirculatiei fara acumulari mari de lichide in spatiul extravascular, reduc edemul tisular si au fost utilizate la pacientii traumatizati cu edem cerebral. Principalul lor dezavantaj este pericolul hipernatremiei, cu riscul de producere al deshidratarii cerebrale.
Solutiile coloidale utlizate sunt: sangele, plasma proaspata congelata, Dextranul, gelatinele (haemacel), amidonul hidroxietilat (HAES, HES), albúmina umana si derivatii de sange, solutiile coloidale cresc presiunea oncotica plasmática si mentin volemia timp mai indelungat si se administreaza in raport de 1:1.
- uneori, la bolnavul care se exanghineaza, se poate recurge imediat la transfuzia de sange 0 (I) Rh negativ. Acesta poate fi utilizat pana la determinarea grupului sanguin, iar administrarea va continua numai pe durata pregatirii sangelui homolog izogrup, izo Rh.
Managementul oricarei bradiaritmii/tahiaritmii hemodinamic semnificative
Medicatia inotropica
- scaderile moderate si severe ale tensiunii arteriale concomitent cu administrarea de fluide, pot fi resuscitate si cu ajutorul infuziei de catecolamine
- administrarea substantelor vasoactive este rareori necesara in socul hipovolemic, acestea intrand in discutie in fazele avansate ale socului, cand repletia volemica nu este urmata de un raspuns hemodinamic adecvat.
- ca regula generala, cata vreme volumul circulator este inadecvat, terapia inotropica si vasoactiva trebuie temporizata, deoarece aceste medicamente pot sa mascheze socul prin cresterea tensiunii arteriale far sa corecteze debitul cardiac scazut. Daca hipotensiunea nu se imbunatateste sau sunt evidente semne de insuficienta cardiaca congestiva, se va efectua monitorizarea cu cateterul Swan-Ganz. Corectarea dezechilibrelor electrolitice si acido-bazice.
- aceasta se efectueaza, in vederea restabilirii diurezei, combaterii acidozei si a tulburarilor electrolitice.
administrarea solutiilor alcaline (NaHCO3 sol. 8,4% sau 4,2%) devine necesara numai in foemele severe si persistente de acidoza (pH <7.20).
excesul de bicarbonat poate sa determine incarcarea cu sodiu si hiperosmolaritate, agravarea acidozei intracelulare cu reducerea furnizarii de oxigen la tesututi.
Prognostic
Reusita corectarii volemice si a cauzei face ca prognosticul sa fie bun, acesta depinzand de cauza, severitatea si durata starii de soc, varsta si bolile asociate. Daca socul este imediat si usor restabilit cu ajutorul volumelor intravasculare moderate este mai putin sever decat daca mentinerea presiunii sistemice a necesitat doze crescute de agenti vasopresori, chiar daca presiunea sanguina initiala a fost aceiasi in ambele cazuri. Prognosticul poate fi imbunatatit daca durata de mentinere a socului este scurtata prin recunoasterea timpurie a cauzei si corectarea agresiva a perfuziei inadecvate chiar si in stadiile compensate.
SOCUL SEPTIC
Definitii de termeni
Infectie - fenomen microbian caracterizat de un raspuns inflamator la prezenta microorganismelor sau la invazia acestora in tesuturile sterile in mod normal.
Bacteriemia - prezenta bacteriilor viabile in sange. Systemic Inflamatory Response Syndrome (SIRS) - raspunsul inflamator sistemic la o varietate de situatii clinice severe. Raspunsul se manifesta prin cel putin 2 din urmatoarele semen:
Temperatura: > 38grade C sau < 36 grade C
Frecventa cardiaca : > 90/min
Frecventa respiratorie: > 20/min sau PaCO2 < 32 mmHg
Leucocite : > 12.000 sau < 4.000/mmc sau > 10% imature
Stadializare
Sepsis - raspunsul inflamator sistemic la infectie. Se manifesta prin 2 sau mai multe din conditiile de mai sus, ca rezultat al infectiei.
Sepsis sever - sepsis asociat cu disfunctie organica, hipoperfuzie si hipoTA. Hipoperfuzia =>
- Acidoza lactica
- Oligurie
- Alterarea statusului mental.
Soc septic - sepsis + hipo TA in ciuda resuscitarii volemice adecvate. Desi debitul cardiac este frecvent crescut in socul septic, functia cardiaca si perfuzia periferica sunt anormale. Hipotensiunea indusa de sepsis reprezinta o tensiune sistolica <90 mmHg sau o reducere cu > 40 mmHg fata de tensiunea de baza fara alte cauze de hipotensiune.
Multiple Organ Dysfunction Syndrome MODS reprezinta prezenta unei modificari sau alterarea functiei unor organe la un pacient cu boala acuta (critic) la care homeostazia nu poate fi mentinuta fara interventie.
Situatii clinice predispozante pentru sepsis
SIDA
Tumori maligne
Terapie imunosupresoare
Transplantul de organe
Terapia cu radiatii
Arsuri, rani si politraumatismele
Diabetul zaharat
Varste extreme
Insuficienta hepatica
Insuficienta renala
Hiposplenism
Catetere sau dispozitive invazive
Catetere urinare mentinute perioade lungi.
Malnutritie
Sepsisul este mai frecvent determinat de infectia cu bacterii aerobe sau anaerobe , germeni gram negativi si pozitivi. Aerobii gram negativi sunt cei mai frecventi patogeni si infectia cu aceste organisme are cel mai prost prognostic.
Bacteriile cel mai frecvent intalnite:
Bacterii Gram Negative - E.coli, Klebsiella, Pseudomonas aeruginosa
■ Alte microorganisme inclusiv: micobacterii, fungi, virusuri , rickettsii si protozoare pot produce un sindrom clinic care nu permite diferenta fata de sepsisul bacterian.
Cele mai frecvente porti de intrare a infectiilor care duc la sepsis sunt:
■ Tract genito-urinar
Tract gastro. intestinal
Tract respirator
Plagi
Punctele de acces vascular.
Aspectul clinic al portii de intrare uneori poate sugera germenul cauzal.
Fiziopatologie
Mecanismul fiziopatologie al sepsisului este complex, atentia fiind indreptata catre microorganismul infectant si catre raspunsul gazdei. Acest proces inflamator implica sistemul imunitatii celulare si umorale.
Socul septic este caracterizat printr-un status hiperdinamic cu
debit cardiac crescut
rezistenta vasculara periferica scazuta
hipoxia tisulara
Acestea duc la reducerea aportului de oxigen la tesuturi prin maldistributia fluxului sanguin periferic sub actiunea endotoxinei microbiene si a mediatorilor eliberati de aceasta.
Toxinele initiatoare
Bacterii Gram-Pozitive - exotoxine : complexe formate din proteoglicani - acid teichoic;
Bacterii Gram-Negative - endotoxinele numite si lipopolizaharide sunt un initiator important al sepsisului. Aceste molecule complexe sunt formate din:
- Antigen O - oligozaharid : structura sa variaza de la o tulpina la alta;
- Antigen R (central) - relativ constant pentru o anumita specie si tulpini o Antigen L (lipid) - portiunea toxica, relativ constanta.
■ Fungi - polizaharide tip zymozan.
Mediatorii sepsisului
Citokinele sunt proteine reglatorii solubile, secretate de o varietate de celule ca raspuns la agresiune, fiind cei mai importanti mediatori in patogeneza reactiei inflamatorii si a suferintei organice din socul septic. Cele mai importante sunt considerate interieukinele IL-1, IL-6 si TNF (factorul de necroza tumorala).
Disfunctia organelor in sepsis
Cord
Efectele cardiovasculare ale sepsisului si socului septic sunt variate si raspunsul individual este dependent de functia cardiovasculara premorbida si de stadiul sepsisului. Sepsisul determina de obicei un status hiperdinamic cu:
Debitul cardiac creste
Rezistenta vasculara sistemica scade
Presiunea de umplere cardiaca scade
Depresie miocardica in ciuda DC crescut cu Fractie de Ejectie scazuta si dilatare biventriculara (depresia este reversibila o data cu rezolvarea sepsisului);
Anomalii de complianta ventriculara ca raspuns la incarcarea fluidica
Plamani
Modificari precoce:
Tahipnee si hiperventilatie
Radiografie pulmonara normala
Pot exista mici modificari ale schimburilor gazoase
Modificari tardive:
Cresterea permeabilitatii membranei alveolo-capilare duce la inundarea interstitiului pana la ARDS si sunt intrapulmonar crescut;
Scaderea compliantei pulmonare
Hipoxemie arteriala;
Radiografia pulmonara infiltrate alveolare difuze bilaterale.
Tub digestiv
Ulceratii gastrice de stress duc la hemoragie GI;
Scaderea peristalticii intestinale.
Ficat
Disfunctie hepatica duce la cresterea transaminazelor si hipoglicemie refractara
Scade nivelul factorilor de coagulare, albuminei
Colestaza, colecistita acalculoasa.
Rinichi
■ Hipoperfuzia duce la oligurie, cresterea ureei si creatininei
■ Evolutia sepsisului duce la necroza tubulara acuta si uremie
Sistemul Nervos Central
■ Alterarea statusului mental (letargie, dezorientare, obnubilare, coma) semn precoce in special la varstnici;
Encefalopatie
Sange
Supresia tuturor liniilor celulare sangvine
Alungire Timp Protrombina si APTT;
Hipofibrinogenemie
CID
Manifestari clinice
Febra - este cel mai frecvent semn. Hipotermia este asociata cu un prognostic rezervat. Apare in cazul varstelor extreme, boli debilitante sau sepsis in stadiu avansat.
Tahicardia este prezenta de obicei
Tahipnee
Semne si simptome legate de punctul de intrare:
Oligurie
Hipoxemie
Acidoza
Trombocitopenie
|
SNC |
Cefalee, convulsii, meningism Modificari neurologice focale Alterarea statusului mental |
|
Respirator |
Dispnee cu tahipnee Tuse, productie de sputa, hemoptizii Crepitante difuze ARDS |
|
Digestiv |
Durere abdominale si distensie Greturi, varsaturi, diaree, anorexie Ileus, sensibilitate focala la palpare |
|
Renal |
Durere in flancuri Sensibilitate la palpare; Hématurie, oligurie |
|
Cutanat |
Eritem, edem, limfangita, crepitatii, abcese |
Date de laborator
Nu exista un test specific!!!
ECG in 12 derivatii
Radiografie pulmonara, CT, ecografie, angiografie, scintigrafie
culturi, frotiu, antibiograma din sange, sputa, urina
grup Rh
proteina C reactiva (PCR)
echilibru acido-bazic arterial
cresc ALT, AST
creste ureea
■ hemoleucograma - leucocitoza / leucopenie si deviatie la stg;
hiperglicemie
acidoza metabolica cu cresterea lactatului
alcaloza respiratorie
trombocitopenie.
Tratamentul socului septic
Tratamentul infectiei
Terapia antimicrobiana cu spectru larg, empirica trebuie inceputa imediat pe baza suspiciunii clinice a microorganismului pana la identificarea sursei.
Obtinerea cat mai rapida a culturilor si rezultatul, ceea ce va duce la o antibioterapie tintita.
Tratamentul etiologic Are ca obiectiv
combaterea infectiei cu antibiotice si eradicarea focarelor septice.
Antibioticul va fi ales pe baza examenului bacteriologic si a
antibiogramei. In absenta acestora etiologia fiind necunoscuta iar o
infectie cu anaerobi putin probabila, se va utiliza o
combinatie de doua antibiotice: o cefalosporina de
generatia a 3-a (cefotaxima
Cateterele in punctele de infectie trebuie eliminate
Drenajul infectiilor din spatii inchise
Managementul hemodinamicii
Obiective clinice - Resuscitarea volemica trebuie efectuata la toti pacientii cu sepsis. Suportul circulator va fi orientat spre ameliorarea perfuziei de organ si a ofertei de oxigen.
TA minima > 60mmHg;
Scaderea frecventei cardiace
Debit urinar > 0,5ml/kgc/h
Imbunatatirea statusului mental;
Daca hipotensiunea sau hipoperfuzia persista se recurge la droguri vasoactive.
Pentru ghidarea tratamentului in functie de parametrii hemodinamici se impune montarea unui cateter Swan-Ganz.
C>2 suplimentar si VM pentru a mentine Sa02 > 90%;
Masa eritrocitara (MER) pentru a avea un Ht > 30%.
Tratamentul hipotensiunii arteriale
Coloizi - albumina 5%, HAES, Haemacel
Cristaloizi - Ser Fiziologic, Ringer lactat.
PAOP sa fie mentinuta intre 12-18mmHg (trebuie luata in considerare si disfunctia miocardica).
Agentii vasoactivi - nu trebuie administrati inaintea asigurarii unui volum IV acceptabil. in caz contrar se agraveaza hipoperfuzia tisulara.
- Dopamina - prima linie : stimularea - duce la cresterea contractilitatii cordului si a - duce la cresterea TA
- Noradrenalina - se poate asocia cu dopamina
- Adrenalina
- Dobutamina.
Tratamentul de suport al pacientului septic
Corticosteroizii nu s-au dovedit eficienti, putand creste numarul deceselor prin infectie secundara.
NAHCO3 in caz de acidoza lactica. Dezavantaje:
- Modifica spre stanga curba de disociere a oxiHb cu scaderea capacitatii de eliberare a O2 de catre Hemoglobina
- Acidoza intracelulara paradoxala
Anti-H2 pentru citoprotectia mucoasei gastrice
Suport nutritional - cat mai precoce :
- Enteral - are efect trofic asupra mucoasei intestinale cu scaderea riscului de translocare bacteriana
- Parenteral - complicatii metabolice si infectioase mai frecvente. Transfuziile si utilizarea eritropoetinei recombinate Profilaxia trombozei venoase profunde IOT VM:
- Protectia cailor aeriene
- Oboseala muschilor respiratori
- Hipoxemia Disfunctia renala
- Tratament de substitutie renala
- Ajustarea antibioticelor si a dozelor
- Dializa - HD nu trebuie folosita la pacienti instabili hemodinamic cu hipo-TA marcata.
La pacientii instabili : CVVHD, CAVHD, dializa peritoneala
Terapia imunomodulatoare in studiu:
Anticorpi monoclonali, antiendotoxine; Anticorpi monoclonali anti TNF; Antagonisti ai receptorilor ILI Antagonisti ai bradikininei Antagonisti ai PAF N-Acetilcisteina
SOCUL CARDIOGEN
Definitie
Este un sindrom clinic caracterizat prin scaderea debitului cardiac, determinat de o varietate de boli acute si cronice ce au drept rezultat alterarea functiei de pompa a cordului cu hipoperfuzie tisulara.
Socul cardiogen este caracterizat prin disfunctie primara miocardica si este diferit de socul hipovolemic prin faptul ca presiunile de umplere ale cordului cresc.
Etiologie
Cauzele socului cardiogen sunt bolile care lezeaza direct miocardul sau inhiba contractilitatea miocardului ceea ce determina incapacitatea cordului de a mentine un debit cardiac adecvat.
rejetul cordului transplantat
Spunem despre un soc ca este cardiogen daca :
Socul cardiogen produs prin infarct miocardic acut apare daca 40% din ventriculul sting este afectat, fiind cea mai frecventa cauza. Poate apare:
prin infarctizare masiva
prin scaderea cumulativa a functiei de pompa.
Reducerea acuta a contractilitatii miocardice determina un raspuns neuroendocrin caracterizat prin activarea sistemului nervos simpatic cu eliberarea de catecolamine in exces, datorata scaderii debitului cardiac ,a volumului de ejectie si a rezistentei vasculare periferice.
In socul cardiogen, organul de soc este cordul responsabil de initierea tulburarii hemodinamice.
Compensator creste frecventa cardiaca, contractilitatea si tensiunea arteriala precum si rezistenta vasculara periferica. Raspunsul neuroumoral creste consumul de oxigen miocardic in ciuda existentei unui miocard ischemic. Vasoconstrictia periferica in scopul centralizarii circulatiei nu este benefica intrucat cresterea postsarcinii agraveaza suferinta cardiaca. Prin urmare functia ventriculului stang se reduce si mai mult inchizandu-se un cerc vicios care sfarseste prin decesul pacientului.
Tablou clinic
Acest sindrom clinic se caracterizeaza prin: hipotensiune absoluta sau relativa care se defineste ca o TAs<90 mmHg sau o scadere cu peste 30 mmHg fata de valoarea de baza a pacientului
oligurie instalata rapid cu un debit mai mic de 20 ml/h
- alterarea functiilor mentale manifestate prin agitatie sau letargie
- vasoconstrictie cu tegumente reci, umede, puls capilar absent
- cianoza, hipoxemie
gradientul de temperatura centrala/periferica crescut
Tabloul clinic cuprinde si simptome si semne care tin de boala cauzala. In cazul infarctului de miocard sunt prezente :
durerea toracica
stare de anxietate
In infarctul de ventricul drept:
plamanii sunt curati si clari in ciuda distensiei jugularelor
ocazional aparitia unor modificari stetacustice
- zgomot de galop
- frecatura pericardica
- raluri bronsice
Incidenta exacta a socului cardiogen este dificil de definit datorita variabilitatii criteriilor de diagnostic si ratei de supravietuire in etiologia precoce a infarctului miocardic acut. El apare ca si o complicatie majora al IMA si deseori fatala.
Tratamentul are ca obiective:
refacerea debitului cardiac
refacerea presiunii de perfuzie
Mentinerea ritmului sinus al in vederea optimizarii oxigenarii miocardului.
Aceasta se poate realiza prin influentarea:
- presarcinii
- postsarcinii
- contractilitatii cordului
Socul cardiogen in evolutia infarctului miocardic acut necesita:
interventia farmacologica in vederea minimalizarii extinderii leziunilor ischemice ireversibile
interventia chirurgicala in vederea revascularizarii directe sau corectarea defectelor mecanice ale unui eveniment ischemic acut.
Alte metode adjuvante sunt dispozitivele de asistare mecanica.
Conditia esentiala pentru reusita tratamentului este monitorizarea continua a parametrilor hemodinamici prin metode invazive: masurarea presiunii venoase centrale, a tensiunii arteriale pe caleinvaziva, POAP, si a debitului cardiac cu ajutorul cateterului Swan-Ganz.
Dupa optimizarea presarcinii se impune cresterea debitului cardiac prin administrarea de inotropice sau prin reducerea postsarcinii.
Inotropice
Dopamina
Este o catecolamina endogena cu actiune inotrop pozitiva prin stimularea receptorilor alfa si beta precum si a receptorilor dopaminergici.Efectele dopaminei sunt in functie de doza:
dozele mici pana la 5 microg/kg/min stimuleaza receptorii DAI producand vasodilatatie renala, cresterea ratei filtrarii glomerulare si excretiei de sodiu, efecte astazi care devin controversate;
dozele medii de dopamina 5-10 microg/kg/min stimuleaza receptorii betal din miocard cu stimularea contractilitatii dar si a frecventei cardiace, prin aceasta crescand si consumul de oxigen miocardic;
dozele mari de dopamina >10 micro/k g/min determina activarea receptorilor alfa adrenergici care refac TA si amelioreaza perfuzia coronariana, dar datorita vasoconstrictiei periferice postsarcina creste si se mareste consumul miocardic de oxigen.
Dopamina se poate combina fie cu compusi vasodilatatori directi sau alti agenti inotropi ca si dobutamina care combina inotropismul cu vasodilatatia.
Dobutamina
Spre deosebire de dopamina care este o catecolamina endogena si precursor al adrenalinei si noradrenalinei dobutamina este un agent sintetic care stimuleaza predominant receptorii beta 1:
creste debitul cardiac si volumul bataie, imbunatateste fluxul sanguin renal si creste excretia de sodiu si apa;
este inotropicul de ales la bolnavii cu debit cardiac scazut si valori normale ale TA. Daca TA este scazuta, pentru refacerea debitului cardiac se impune asocierea cu o catecolamina care poseda proprietati alfa agoniste si atunci la inceput se prefera dopamina ale carei efecte hemodinamice variaza in raport cu doza. Daca persista hipotensiunea se prefera asocierea cu noradrenalina avand avantajul unui efect cronotrop redus.
■ Dopexamina
Are un profil hemodinamic asemanator dopaminei dar fara activitate beta ceea ce produce efecte minime cronotrope si prodisritmice
■ Noradrenalina (NA)
Tratamentul cu NA este instituit in general in tratamentul socului cardiogen dupa esecul corectiei volemice si dupa administrarea dopaminei in scopul de a mentine DC si TA adecvate. Este un agonist alfa adrenergic puternic, are efect alfa si beta adrenergic, administrarea fiind asociata in general cu cresterea debitului cardiac si a rezistentei vasculare sistemice Vasoconstrictia mediata de NA poate determina inrautatirea perfuziei renale cu aparitia azotemiei si oliguriei
■ Preparatele digitalice
Au efect inotrop pozitiv desi cresterea debitului cardiac dupa administrare este modesta comparativ cu cele de mai sus.
■ Izoproterenol
Are efecte betal si beta2 si administrarea sa nu se asociaza cu vasoconstrictie. Determina cresterea contractilitatii miocardice, a frecventei cardiace si a debitului cardiac si implicit a consumului de oxigen.
■ Inhibitorii de fosfodiesteraza: Amrinona, Milrinona, Enoximona
Au efecte inotrop pozitive si vasodilatatoare similare dobutaminei. Actioneaza prin inhibarea fosfodiesterazei cu cresterea nivelelor de AMPc determinand cresterea fosforilarii proteice de catre protein-kinaza, rezultand efectul inotrop si cronotrop pozitiv.
■ Glucagonul
Are efect inotrop pozitiv dar nemediat de receptorii beta. Administrarea lui creste DC cu aproximativ 20%. Se administreaza la cei la care nu raspund la terapia conventionala.
■ Vasodilatatoarele
Se administreaza in vederea limitarii farmacologice a zonei de infarct. Pot fi benefice daca TA este conservata si se asociaza cu inotropice daca este cazul. Au ca obiectiv optimizarea postsarcinii, iar beneficiul realizat consta in reducerea muncii inimii si scaderea cererii de oxigen miocardice
Nitratii
Sunt agenti cu activitate vasodilatatoare arteriala si venoasa care imbunatatesc perfuzia subendocardica cu scaderea extensiei infarctului. imbunatatesc fractia de ejectie a ventriculului stang si supravietuirea.
Nitroglicerina redistribuie fluxul coronarian catre subendocard fara a produce furt coronarian cum produce nitroprusiatul
■ Beta- blocantele
Scad necesarul miocardic de oxigen prin efect inotrop si cronotrop negativ. Alte efecte benefice sunt: activitate antiplachetara, regresia hipertrofiei ventriculului stang, scaderea incidentei mortii subite
■ Inhibitorii enzimei de conversie: Captopril, Enalapril. Administrati in special in IMA anterioare cu fractie de ejectie foarte scazuta, au efecte pozitive asupra hemodinamicii microcirculatiei
Blocantii de calciu - nu au efect in limitarea extensiei IMA. Diltiazemul este util in IMA nonQ
Alte masuri terapeutice. Solutia repolarizanta cu glucoza-insulina-potasiu - este utilizata frecvent in practica medicala desi eficienta terapeutica n-a fost demonstrata
Hialuronidaza - are efect antiinflamator cu modularea raspunsului imun asociat IMA, avand un rol partial in limitarea extensiei infarctului.
Sedativele si analgeticele intravenoase: benzodiazepine sau opioide. Pot reduce consumul de oxigen miocardic diminuand presarcina, tonusul vascular si descarcarea simpatica
Administrarea de oxigen - vizeaza corectarea hipoxemiei relevata de cresterea saturatiei in oxigen a hemoglobinei, masurata cu ajutorul pulsoximetrului. Corectarea acidozei metabolice precum si a dezechilibrelor electrolitice.
Tromboliza - atat cea farmacologica cat si angioplastia scad extensia infarctului si scad riscul de progresie catre soc cardiogen. Administrarea agentului trombolitic in prima ora de la IMA creste supravietuirea daca reperfuzia poate fi mentinuta. Imposibilitatea de a realiza reperfuzia de catre agentii trombolitici orienteaza spre angioplastia coronariana percutanata transluminala (PTCA).
Tratamentul chirurgical -la pacientii care nu raspund la terapia inotrop pozitiva si refacere volemica
Sisteme de asistare
Balonul de contrapulsatie intraaortica - este o masura de temporizare care:
creste perfuzia coronariana in diastola si reduce postsarcina;
scade volumul ventricular diastolic;
mentine necesarul miocardic de oxigen;
este eficient la pacientii cu ICC acuta si angina instabila.
Sisteme de asistare ventriculara stanga tot ca si metoda temporara pana la transplantul cardiac
Prognostic
Prognosticul socului cardiogen asociat cu IMA este nefavorabil. Numai o treime din bolnavii tratati supravietuiesc episodului initial. Prognosticul este mai bun in localizarea IMA la ventriculul drept. Pacientii dependenti de suportul mecanic si inotropice care pot fi transplantati au un prognostic relativ bun, cu o rata de supravietuire de 70-80% dupa 2-4 ani.
SOCUL ANAFILACTIC
Definitie
Reprezinta reactia acuta la o substanta straina la care bolnavul a fost anterior sensibilizat. Poate apare dupa:
injectii intravenoase sau intramusculare
muscaturi de insecte
administrarea unor produse din sange sau a substituentilor de plasma
expunerea la produsi ce contin latex sau expunerea la un potential alergen.
Cele mai incriminate substante sunt antibioticele si in special penicilinele precum si substantele de contrast. Alte substante care adesea mai sunt incriminate sunt reprezentate de: streptokinaze, relaxante neuromusculare, vitamina K, anestezicele locale din clasa esterilor, opioizii, thiopentone si extracte din alergeni.
Reactiile care se produc sunt:
reactii anafilactice
reactii anafilactoide
Cele doua tipuri de reactii, din punct de vedere clinic sunt nedistinctive.
Termenul de anafilaxie se utilizeaza adeseori pentru a descrie ambele reactii.
Fiziopatologie
In cazul declansarii unei reactii anafilactice are loc degranularea mastocitelor si bazofilelor proces care poate fi precipitat prin variate mecanisme:
- reactii anafilactice: sunt reactii de hipersensibilitate dupa interactiunea intre anticorpii Ig E cu un antigen adica substanta alergena;
- reactii anafilactoide: degranularea mastocitelor si eliberarea mediatorilor apare ca raspuns direct la prima expunere la antigen prin alt mecanism decat cel mediat prin Ig E .
Degranularea mastocitelor si bazofilelor elibereaza mediatori toxici ca: histamina, serotonina, bradikinina, enzime proteolitice, prostaglandine, leucotriene, tromboxani, - factorul activator plachetar, componente ale complexului complement.
Mediatorii eliberati din mastocit produc vasodilatatie, contractura musculaturii netede, eritem, urticarie, cresterea permeabilitatii capilare, edem, bronhoconstrictie. Vasodilatatia arteriolara generalizata asociata cu pierderile de plasma la nivelul capilarelor produc o hipovolemie marcata cu scaderea intoarcerii venoase, scaderea debitului cardiac si prabusirea tensiunii arteriale. In timp, maldistributia fluxului sanguin periferic produce hipoxie tisulara si acidoza lactica.
Toate aceste manifestari induc socul.
Presiunea venoasa centrala in general este scazuta, rezistenta vasculara periferica scazuta, debitul cardiac poate fi normal sau chiar crescut in functie de gradul vasodilatatiei periferice si de starea volemica.
Tablou clinic
Efectele mediatorilor se manifesta prin multiple reactii, severitatea reactiei depinzand de calea de patrundere a antigenului precum si de cantitatea lui. Peste 50% din decese apar in prima ora de la expunere. Initial bolnavul acuza:
senzatie de slabiciune;
eritem cu prurit;
rigiditate toracica, tuse;
crampe abdominale.
La aproximativ 20 de minute de la expunerea la alergen apar manifestarile:
cardio-vasculare: tahicardie, hipotensiune brutala urmata uneori de oprirea cordului.
- respiratorii :dispnee expiratorie cu edem laringian si bronhospasm, wheezirig, insuficienta respiratorie acuta
varsaturi sau diaree
reactie cutanata si mucoasa generalizata.
Alte semne insotitoare sunt: agitatie, anxietate, obnubilare, hématurie din cauza hemolizei.
Constatarea eritemului, a urticariei sau a angioedemului la un bolnav cu hipotensiune severa orienteaza diagnosticul de soc anafilactic
Tratament
In toate formele, primul gest terapeutic initiat trebuie sa fie identificarea si intreruperea imediata a administrarii alergenului suspectat. Tratamentul are ca obiective:
reducerea permeabilitatii capilare
combaterea bronhospasmului si a depresiei miocardului
inlocuirea lichidelor pierdute
Managementul cailor aeriene
Administrarea de oxigen prin canula sau prin masca faciala. Pacientul se intinde la orizontala intr-o pozitie comoda si se monitorizeaza EKG.
Daca disfunctia respiratorie persista, prezenta edemului laringian impune intubatia endotraheala, iar bolnavii in apnee sau cu stop cardiac necesita ventilatie mecanica.
Bronhospasmul si obstructia laringiana necesita si dezobstructia farmacologica, drogul de electie fiind adrenalina.
Adrenalina este medicamentul de electie deoarece in afara efectului inotrop pozitiv si vasoconstrictor periferic actioneaza si la nivelul mastocitului, inhiband eliberarea de histamina si alti mediatori ai anafilaxiei. In functie de gravitatea situatiei adrenalina se administreza in diferite doze:
- Doza de atac la adulti este: 0,5 mg (5 ml din solutia 1 %000) urmata de perfuzie continual-4 g/min
- Doza poate fi repetata la 15-20 de minute sau mai devreme daca este necesar.
Daca reactia este localizata o parte din doza de adrenalina poate fi injectata subcutan. Absorbtia locala a antigenului (venin de albina) poate fi intarziata prin aplicarea unui garou si comprese reci, precum si infiltrarea locala cu adrenalina.
Pentru corectarea hipovolemiei consecutiva vasodilatatiei acute si pierderilor de lichide in interstitiu se vor administra coloide si cristaloide in cantitati mari si in ritm rapid. Pentru monitorizarea resuscitarii volemice se poate instala un cateter venos central in vederea monitorizarii PVC.
Antihistaminicele ca difenilhidramina 50 mg i.v./i.m., romergan, precum si anti H2 de tip cimetidina 300 mg , ranitidina 50 mg , trebuie administrate precoce .Ele au rol de medicatie adjuvanta, utilitatea lor in formele severe fiind controversata.
■ Utilizarea corticosteroizilor este relativa deoarece eficienta lor este intarziata si se constituie tot ca si terapie adjuvanta. Efectul lor maxim se poate manifesta tardiv la 4-6 ore de la administrare. Dozele recomandate sunt de: 300 mg hidrocortizon la 6 ore i.v. sau 50 mg i.v. metilprednisolon pentru 24-48 h.
Tratamentul etiologic consta in eliminarea cauzei si administrarea de antihistaminice, precum si informarea pacientului asupra drogurilor responsabile de producerea acestor tipuri de reactii. in cazul anumitor veninuri este indicata imunoterapia alergenica specifica.
|