CATALIZA SI CHIMIE VERDE (2 ore)
Se estimeaza ca la ora actuala 90% dintre chimicale utilizeaza in cel putin o etapa din procesul de fabricare un catalizator. Domeniul est extrem de larg acoperind chimicale de la cele mai uzuale (precum acidul acetic sau amoniacul) la produsi de consum precum detergenti sau vitamine. Teoretic, toate chimicalele comune si procesele de implicate uti 121j94b lizeaza catalizatori. Numarul de procese din chimia fina sau farmaceutica care utilizeaza catalizatori este inca destul de mic dar legislatiile economice si de protectia mediului fac ca cercetarea in aceste domenii sa capete o importanta din ce in ce mai mare. Cel mai mare beneficiu economic adus de catalizatori este dat de activitatea foarte mare a acestora. Exista trei parametri importanti care au un impact deosebit asupra viabilitatii comerciale si caracterului verde al unui anumit catalizator:
Selectivitate - cantitatea de reactant transformat in produsul dorit ca procent din cantitatea totala de reactant transformat (un catalizator va avea un beneficiu limitat daca acesta va intensifica si viteza de formare a produsilor secundari)
Frecventa de ciclu (TOF) - numarul de moli de produs obtinut per mol de catalizator per secunda (frecventele de ciclu mici arata ca sunt necesare cantitati mari de catalizator, acest lucru ducand la costuri ridicate si eventual, cantitati mai mari de deseuri)
Numar de cicluri (TON) - cantitate de produs per mol de catalizator (acesta este corelat cu viata catalizatorilor deci, cu alte cuvinte, cu costurile procesului si deseurile formate).
Catalizatorii sunt clasificati in doua tipuri: omogeni si heterogeni, functie de starea lor de agregare in mediul de reactie. Catalizatorii omogeni se gasesc in aceeasi faza cu reactantii si sunt distribuiti uniform in mediul de reactie. In aproape toate cazurile reactiile au loc in faza lichida, catalizatorul fiind dizolvat in mediul de reactie. Catalizatorii heterogeni se gasesc in faza separata de mediul de reactie. In cele mai multe cazuri catalizatorii heterogeni sunt materiale solide iar reactantii formeaza o faza gazoasa. Reactia catalitica are loc la suprafata catalizatorului, fie pe suprafata externa, fie pe cea interna, data de existenta porilor.
Intre catalizatorii omogeni si heterogeni exista o serie de diferente care au un impact semnificativ asupra gradului de caracter "verde":
|
Omogen |
Heterogen |
|
Aceeasi faza cu mediul de reactie |
Faza solida distincta |
|
Dificil de separat |
Separare usoara |
|
Dificil / scump pentru reciclare |
Regenerare si reciclare simpla |
|
Viteze de reactie foarte mari |
Viteze mjai mici de reactie decat cele corespunzatoare catalizei omogene |
|
Nu sunt reactii controlate de difuzie |
Pot fi limitate de difuzie |
|
Rezistenti la otravuri |
Sensibilitate mare la otravuri |
|
Selectivitate ridicata |
Selectivitate adesea redusa (cel putin mai mica decat in faza omogena) |
|
Viata scurta |
Viata indelungata |
|
Adesea reactiile au loc in conditii blande |
Procese consumatoare de energie |
|
Mecanismul de reactie este adesea elucidat |
O intelegere slaba a mecanismului de reactie |
Acest tabel nu trebuie privit in linii generale pentru a vedea daca un catalizator este mai "verde" decat altul. Pentru o situatie data pot exista obiective specifice care pot fi atinse mai usor de un anumit catalizator decat de un altul. In general, in ultima instanta tinta multor cercetari in domeniu este de a combina cele mai bune caracteristici ale ambelor tipuri de catalizatori.Unul dintre obiective este de a combina viteze de reactie si selectivitati ridicate, caracteristice catalizei omogene, cu posibilitatea de a recupera si recicla catalizatoruii, caracteristic catalizei heterogene. In majoritatea cazurilor o astfel de combinatie se poate face prin asa numita "heterogeneizare" a catalizatorilor omogeni.
Prin definitie toti catalizatorii sunt fie omogeni, fie heterogeni, dar in fiecare categorie exista si alte clasificari care sunt foarte importante pentru chimia verde. Cele mai importante sunt:
catalizatori asimetrici - se utilizeaza relativ rar in procesele industriale dar acestia joaca un rol din ce in ce mai important in dezvoltarea produselor farmaceutice. Acest lucru se datoreaza faptului ca acestia ofera una dintre cle mai eficiente si mai curate (fara producere de deseuri) metode de preparare a compusilor enantiomeric puri
biocatalizatori - acesti catalizatori sunt esentiali pentru viata si joaca un rol vital in cele mai multe procese care se desfasoara atat in organisme cat si in plante. La nivel de laborator biocatalizatorii utilizati sunt, in fapt, enzimele. Acesti catalizatori ofera posibilitatea de a realiza multe transformari dificile in conditii blande si sunt extrem de utili pentru producerea de materiale enantiomeric pure. Potentialul urias al acestor catalizatori este insa stopat de dificultatile intampinate la izolarea enzimelor.
Catalizatori cu transfer de faza - au fost dezvoltati in urma cu peste 40 ani pentru a creste viteza de reactie si randamentul reactiilor in care reactantii se gasesc in doua faze separate. Din pacate, in astfel de reactii pot apare dificultati legate de transportul mic de masa, care limiteaza reactia. Catalizatorii cu transfer de masa actioneaza prin transpotul reactantilor dintr-o faza in cealalta, preintampinand astfel limitarile la transport de masa.
CATALIZA OMOGENA
In cataliza omogena, catalizatorul este distribuit molecular in mediul de reactie. Cand catalizatorul este un complex al unui metal, centrul catalitic activ il reprezinta valentele necoordinate, adica ramase libere, ale acestuia. Rezulta deci ca procesul catalitic are loc in urma interactiei moleculelor reactante cu metalul, prin intermediul acestor valente.
Catalizatorii organometalici au fost studiati intensiv, deoarece centri lor catalitici pot fi definiti si intelesi relativ usor. Din pacate insa, dificultatile intampinate in separarea si regenerarea acestora face ca utilizarea lor sa fie oarecum restrictiva. Eliminarea acestor dificultati constituie, dealtfel, obiectul multor cercetari actuale. Pe langa complecsii organometalici, care vor fi prezentati in detaliu, cataliza omogena utilizeaza, foarte frecvent, acizi si baze solubile. Astfel de catalizatori sunt suficient de ieftini ca acestia sa nu necesite recuperare, ci sa fie neutralizati si distrusi. Din punct de vedere insa al conceptelor chimiei verzi aceasta abordare este inacceptabila atata timp cat aceste operatii contribuie la formarea de cantitati imense de deseuri in industria chimica.
Abilitatea manifestata a metalelor tranzitionale de a cataliza transformarea moleculelor organice deriva dintr-o serie de trasaturi caracteristice ale acestor metale:
Accesibilitatea la o serie de stari de oxidare si numere de coordinare a metalului transitional
Abilitatea de a coordina grupari intr-o maniera specifica (efect de templat)
Capacitatea de a activa molecule mici (ex. CO, H2, HCN, etc.)
Abilitatea de a stabiliza o varietate larga de intermediari reactivi (ex. hidruri, alchil, aril, si/sau alchiliden) prin legaturi s- si/sau p
Ciclul catalitic
Fiecare proces catalitic poate fi descris printr-un "ciclu" catalitic. In multe cazuri, substanta adaugata in reactie este un precursor catalitic care este convertit in situ in catalizatorul activ:
Etapa de activare poate include disocierea ligandului si/sau o modificare in starea de oxidare a metalului. Efectele exercitate de ligand se pot concretiza asadar printr-o modificare a densitatii de electroni in pozitiile vacante, care are ca efect o "labilizare" a legaturii dintre moleculele reactante si metal, fapt care determina cresterea vitezei de reactie.
Catalizatorul activ reactioneaza cu substratul cu formarea unui intermediar catalitic care se descompune ulterior in produsi de reactie si refacerea catalizatorului. O conditie pentru ca un catalizator sa fie efficient este ca atat viteza de formare a intermediarului catalitic (k1) cat si viteza de descompunere a acestuia (k2) sa fie relativ mari.
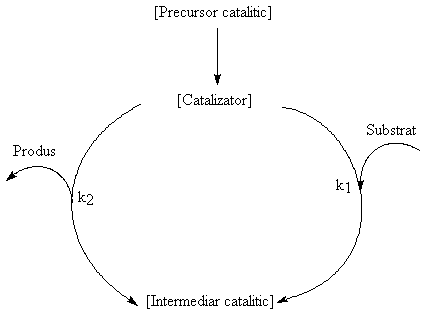
Notand catalizatorul cu C iar reactantul cu R:
k1
C + R CR
k-1
k2
CR C + P (produs de reactie)
Contributia catalizatorului este una cinetica de crestere a vitezei de reactie. In aceste conditii:
v = k2[CR]
Viteza reactiei catalitice depinde deci de viteza de formare si descompunere a produsilor intermediar activi, care iau nastere in urma interactiei reactant-catalizator:
d[CR]/dt = k1[C][R] - k-1[CR] - k2[CR]
In conditii de stationaritate:
d[CR]/dt = 0
de unde rezulta ca:
[CR] = (k1[C][R])/(k-1 + k2)
iar
v = k2 (k1[C][R]/(k-1 + k2))
Rezulta deci, ca in conditiile catalizei omogene, viteza reactiei este proportionala atat cu concentratia catalizatorului cat si cu a reactantului. In acelasi timp este obligatoriu ca valoarea constantei asociata procesului de descompunere a "complexului activ" in produsi de reactie sa fie mai mare decat cea in reactantii initiali.
Se poate aprecia deci ca activitatea unui catalizator depinde in primul rand de natura metalului (pozitia electronului distinctiv, tip de hibridizare, capacitate de cedare de electroni), dar prezenta unui anumit ligand poate modifica proprietatile metalului si deci si ale pozitiilor vacante. Acest lucru poate avea loc functie de complexitatea ligandului prin efecte de tipul celor cunoscute in chimia organica sub numele de efecte inductive sau electromere.
Etape elementare
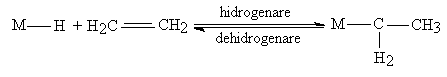
Multe dintre benefeciile verzi ale catalizei omogene, in special cea de selectivitate ridicata deriva din catacitatea de "modelare" a catalizatorilor prin utilizarea unui anumit metal tranzitional cu anumiti liganzi. Reactiile catalitice cu complecsi organometalici ai metalelor tranzitionale au loc, in general, prin urmatoarele etape elementare: 1. disocierea/coordinarea ligandului (asociata activarii precursorului catalitic), 2. aditia reactantului (coordinativa, oxidativa) sau schimb de liganzi (asociata etapei de chemosorbtie), 3. reactie catalitica (insertie sau reactie cu transfer si reactie de cuplare), 4. eliminarea produsului de reactie. Disocierea ligandului este urmata de coordinarea si activarea substratului. In cataliza organometalica, activarea substratului este urmata, in general, de insertia in legatura metal-hidrura sau metal-alchil.
Disocierea/coordinarea ligandului
(a) Heterolitic:
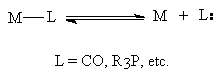
(b) Homolitic
![]()
Aditie
(a) aditie coordinativa (cand metalul este coordinativ nesaturat)
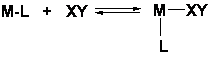
(b) Aditie oxidativa:
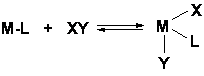
Exemple:
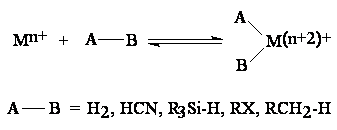
(c) schimb de liganzi (cand metalul este coordinativ saturat):
![]()
Stabilitatea acestor noi complecsi este sufficient de mica ca ei sa reprezinte doar intermediary de reactie sau complecsi active de tranzitie. In aceasta forma chemosorbita reactantii liganzi pot reacliza urmatoarele reactii:
Reactii intre liganzi
(a) Insertia sau reactie cu transfer:
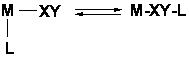
Exemple:
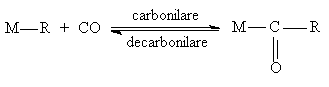
(b) Reactii de cuplare
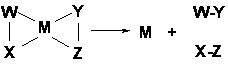
Rezulta deci ca in cataliza omogena reactiile catalitice decurg printr-un numar de 3 etape: chemosorbtie, reactie intramoleculara in complexul intermediar si desorbtia produsilor de reactie. De aici rezulta viteza de reactie mai mare.
Un "instrument" conventional pentru intelegerea fenomenului catalitic prin intermediari organometalici este regula celor 16/18 electroni, regula care indica numarul maxim de legaturi metal-ligand care se pot forma in sfera de coordinare a metalului. Aceasta regula poate fi transcrisa prin urmatoarea ecuatie matematica:
n + 2(CN)max = 18
Unde: n - numarul de electroni de valenta "d" a metalului; CN - numarul de coordinare al metalului sau numarul de legaturi s metal-ligand.
Complecsii nesaturati coordinativ (cu un numar mai mic de liganzi decat cel maxim posibil) sunt adesea catalizatori activi. Asadar, un complex cu 18 electroni (numar maxim de liganzi, care poseda configuratia unui gaz inert) trebuie sa sufere, in primul rand, o disociere pentru a crea un centru de coordinatie vacant (o nesaturare coordinative) necesar pentru activarea substratului. Numarul de electroni de valenta luati in calcul pentru un anumit metal depinde de pozitia sa in tabelul periodic si este independent de starea sa de oxidare (ex: Mn = 7, Fe = 8, Co = 9). Liganzii covalenti (ex. hidrura, alchil) si ionici (ex. clorura) pun in comun un electron pentru formarea legaturii metal-ligand iar liganzii coordinativi (ex. CO, R3P, R3N) cate doi electroni. In general vorbind, o cale mecanistica in cataliza organometalica, are loc prin formarea alternativa a unor complecsi cu 16 sau 18 electroni. Exista insa multe exceptii de la regula de 16/18 electroni.
Monoxidul de carbon (CO) este un ligand frecvent utilizat in cataliza omogena. Legatura metal-CO este destul de complexa si consta dintr-o legatura s formata orin donarea unei perechi de electroni de la carbon in orbitalul d liber si o alta legatura formata prin cederea unei perechi de electroni din orbitalul d complet ocupat al metalului in orbitalul liber p de antilegatura al carbonului.Aceste legaturi slabesc legatura C-O facand-o mult mai reactiva si capabila sa ia parte la reactii precum carbonilarea si hidroformilarea. Monoxidul de carbon (CO) ca atare nu ar putea cataliza astfel de reactii. Un exemplu de reactie catalitica care respecta principiul celor 16/18 electroni este reactia de hidroformilare a olefinelor catalizata de HCo(CO)4.
Fosfinele (de exemplu, trifenil fosfinele) sunt, probabil, cei mai utilizati liganzi in cataliza omogena. Utilizarea frecventa a acestora se datoreaza catorva caracteristici foarte importante ale acestora: i. fosfinele sunt foarte buni donori de electroni, formand astfel legaturi stabile cu multe metale tranzitionale, permitand izolarea si caracterizarea complecsilor formati; ii. o varietate mare de fosfine pot fi obtinute pe cale sintetica, fiind posibil astfel controlul efectelor sterice; aceasta caracteristica este foarte importanta cand fosfinele bidentate se utilizeaza la blocarea completa din punct de vedere steric a uneia din caile de acces a reactantului la catalizator.
Catalizatorul Wilkinson (Rh(Ph3P)3Cl) este un exemplu excelent de aplicare a catalizei omogene in hidrogenarea alchenelor, in conditii foarte favorabile energetic (de multe ori aceste reactii decurg la temperatura si presiune ambianta). In hidrogenarea olefinelor catalizata de complexul Wilkinson, Rh(Ph3P)3Cl, catalizatorul este un complex cu 16e-. In contrast cu ceea ce este de asteptat din regula celor 16/18 electroni, complexul sufera o disociere initiala a unui ligand Ph3P conducand la o specie reactiva cu 14e-. Aceasta comportare neasteptata se datoreaza volumului steric a liganzilor Ph3P care impiedica coordinarea unui ligand din exterior.

Ciclul catalitic al reactiei de hidrogenare in prezenta catalizatorului Wilkinson (RhCl(Ph3P)3)

Ciclul catalitic al reactiei de hidroformilare a olefinelor pe catalizator de cobalt
La nivel industrial hidroformilarea este un proces foarte important putand fi realizata fie in prezenta catalizatorilor pe baza de carbonil de cobalt (ciclul catalitic prezentat anterior pentru exemplificarea regulii de 16/18 electroni) fie in prezenta fosfinelor de rodiu. De importanta deosebita este hidroformilarea propenei cu gaz de sinteza (posibil obtinut din reserse regenerabile), in prezenta catalizatorilor pe baza de fosfina de rodiu. Produsul obtinut - aldehida butirica - este un amestec de n- si izo - izomeri.
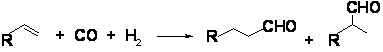
CO + H - gaz de sinteza obtinut prin oxidarea incompleta a metanului
Dintre acestia, izomerul n - este produsul dorit a fi obtinut din reactie, utilizat mai api ca materie prima pentru fabricarea butanolului (prin hidrogenare) si pentru fabricarea 2-etilhexanolului (prin condensare aldolica si hidrogenare). Butanolul este un solvent extrem de valoros in in fabricarea compusilor de acoperire a suprafetelor in timp ce 2-etilhexanolul este frecvent utilizat in productia de materiale plastice pe baza de ftalat.
Principalele elemente mecanistice ale acestui procese sunt redate in urmatoarea schema:
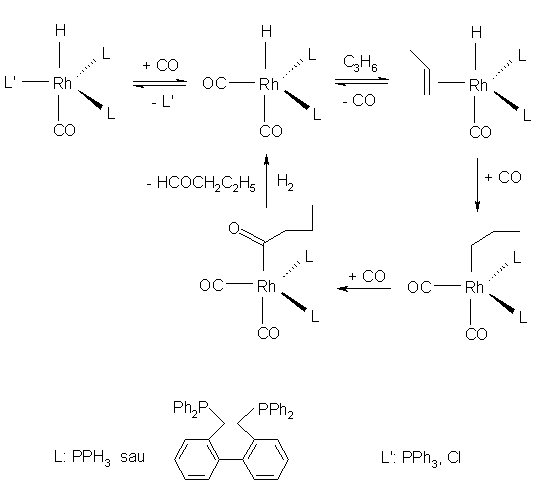
Termodinamica favorizeaza formarea izo-produsului dar impiedicarile sterice introduse de liganzi limiteaza aceasta reactie, n-izomerul urmarit fiind produs cu o selectivitate de 70-95%. Viteza de reactie este puternic influentata de concentratia de fosfina , deoarece aceasta determina cantitatea de catalizator activ existent in reactie. Concentratia de fosfina aplicata la nivel industrial este de 75 mol / mol Rh, la concentratii mai mari de aceasta limita reactia fiind inhibata prin blocarea centrilor catalitic activi. Reactia are loc in conditii relativ blande: 800C si 20-30 atm.
Deoarece aldehida butirica are un punct de fierbere relativ mic (750C) separarea catalizatorului din masa de reactie (formata din reactanti si produs de reactie) este relativ simpla. O cantitate insemnata de rodiu ramane in reactor dar inainte de a recupera propena si de a distila produsul de reactie, fluxul gazos din reactor este trecut printr-un filtru electric (adesea utilizat la nivel industrial pentru separarea picaturilor foarte fine de lichid care formeaza o "ceata" cu faza gazoasa dintr-o reactie) pentru a indeparta urmele de catalizator antrenat in vapori. Aceasta operatie asigura o recuperare completa a rodiului.
Desi recuperarea rodiului din faza de vapori este eficienta , separarea lui din produsii grei formati in cantitati mici este dificila. In timp acesti produsi grei tind sa dezactiveze catalizatorul. Solutia pentru aceasta problema a fost gasita de compania Ruhrchemie/Rhone-Poulenc. In procesul dezvoltat de ei, metalul este complexat cu liganzi de tip trifenil fosfina sulfatata, facand catalizatorii obtinuti solubili in apa. Reactia are loc in sistem bifazic format dintr-o parte inferioara apoasa continand catalizatorul si o parte superioara organica. Facand o paranteza, conceptul de cataliza bifazica implica lucrul in doua faze lichide nemiscibile: catalizatorul organometalic este solubil doar intr-una din faze in timp ce reactantii si produsii de reactie sunt continuti in cea de-a doua faza. In cele mai multe cazuri faza catalitica poate fi reutilizata iar reactantii si produsii de reactie pot fi indepartati din amestecul de reactie printr-o simpla separare de faze. Catalizatorul actioneaza la interfata dintre cele doua faze permitand reactiei sa aibe loc eficient. La sfarsitul reactiei, faza apoasa care contine catalizatorul se separa prin decantare, orice produs greu format ramanand in faza organica.
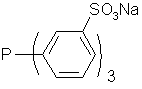
Ligand trifenil fosfina sulfatata
Un alt proces recent de carbonilare, dezvoltat de compania Shell, care utilizeaza liganzi fosfinici pentru a controla cursul reactiei este cel de obtinere a monomerului metracrilat de metil. Procesul decurge in prezenta unui catalizator bazat pe acetat de paladiu, cu liganzi fosfinici de tipul bis-fenil (6-metil-2-piridil) fosfina. Catalizatorul prezinta o selectivitate remarcabila pentru 2-carbonilarea propinei (>99.5%), in conditii relativ blande de reactie: < 1000C si 60 atm.
Beneficiul adus asupra mediului inconjurator de aceasta ruta de reactie este evident daca aceasta se compara cu ruta traditionala de fabricare a metacrilatului de metil, care utilizeaza acid cianhidric ca reactant si formeaza cantitati stoichiometrice de sulfat acid de amoniu ca deseu:
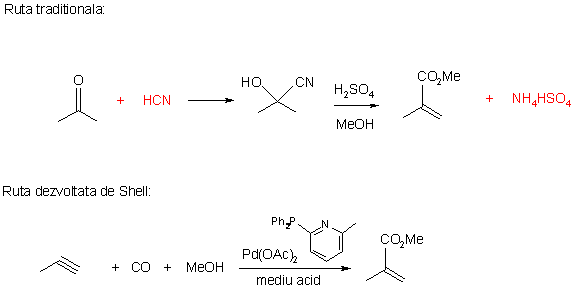
Catalizatorii pe baza de carbonil de cobalt HCo(CO)4 sunt adesea utilizati pentru hidroformilarea alchenelor cu numar mare de atomi de carbon desi reactia necesita temperaturi si presiuni mari. Principalul motiv pentru care sunt utilizati este legat de faptul ca acesti catalizatori sunt eficienti si pentru reactia de izomerizare a alchenelor, permitand utilizarea in reactie a unui amestec de alchene interne si terminale. Recuperarea catalizatorului este o problema in acest caz, implicand formarea de deseuri, pe de o parte, si complicand procesul global, pe de alta parte. O metoda de recuparare frecvent utilizata implica tratarea catalizatorului cu o baza apoasa facandu-l astfel solubil in apa, urmata de separare si tratament aditional cu acid pentru recuperarea catalizatorului activ:
HCo(CO)4 + Na2(CO3) = 2NaCo(CO)4 + H2O + CO2
2NaCo(CO)4 + H2SO4 = 2HCo(CO)4 + Na2SO4
|