CINETICA REACTIILOR CHIMICE
Consideratii teoretice
Cinetica chimica studiaza conditiile in care au loc reactiile chimice, viteza cu care acestea se desfasoara si factorii care influenteaza viteza de reactie. Reactiile chimice se pot desfasura in sisteme:
Factorii care influenteaza viteza de reactie sunt diferiti, in functie de sistemul de reactie omogen sau eterogen.
In sistemele omogene viteza de reactie este influentata de: concentratie, temperatura, presiune (in sisteme gazoase).
In sistemele eterogene un rol hotarator il au: suprafata de contact dintre substantele reactante si modul in care se produce difuzia substantelor rezultate din reactie.
Atat in sistemele eterogene, cat si in sistemele omogene viteza de reactie este influentata si de alti factori:
Natura reactantilor - influenteaza practic tipul de desfasurare a reactiei chimice;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Solventul – prin solvatarea speciilor chimice reactante se poate modifica ordinul de reactie si energia de activare;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Lumina – pentru reactiile fotochimice;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Intensitatea curentului electric - pentru reactiile electrolitice;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Catalizatorul – actioneaza asupra mecanismului de reactie si asigura o noua cale de desfasurare a reactiei, de energie mai joasa; catalizatorul se regenereaza la un moment dat in cadrul mecanismului de reactie.
Pentru reactia: ![]() R
R ![]()
![]() P
P
viteza de reactie (vr) reprezinta variatia concentratiei reactantilor (R) sau a produsilor de reactie (P) in unitatea de timp:
![]() [
[![]() ] (2.2)
] (2.2)
Conventional, viteza de reactie raportata la reactanti este negativa deoarece concentratia acestora scade in timp, iar cea raportata la produsii de reactie este pozitiva, deoarece concentratia lor creste in timp.
O reactie chimica poate decurge intr-o singura etapa sau intr-o serie de etape succesive. Aceasta serie de reactii se numeste mecanism de reactie. Viteza unei reactii chimice este determinata de etapa cea mai lenta a mecanismului de reactie. Variatia finita a concentratiei reactantilor sau produsilor de reactie, Δc intr-un interval de timp Δt reprezinta viteza medie de reactie
![]() (2.3)
(2.3)
Daca Δt este foarte mic se
obtine viteza instantanee sau viteza la un moment dat: ![]() (2.4)
(2.4)
Pentru determinarea vitezei de reactie este suficient sa se urmareasca variatia in timp a concentratiei unei singure substante din sistemul de reactie.
Pentru o reactie chimica izolata, de tipul:
aA + bB![]() cC + dD
cC + dD
dependenta vitezei de reactie de concentratie,
la temepratura constanta este data de legea vitezei: ![]() (2.6)
(2.6)
unde,
k - reprezinta constanta de viteza, iar
exponentii![]()
![]() reprezinta ordinele partiale de reactie si pot
fi numeric egali cu coeficientii stoechiometrici, a si b (molecularitatea).
reprezinta ordinele partiale de reactie si pot
fi numeric egali cu coeficientii stoechiometrici, a si b (molecularitatea).
Ordinul total de reactie, n, este dat de relatia: ![]() (2.7)
(2.7)
iar molecularitatea, m, este data de relatia: ![]() (2.8)
(2.8)
Pentru reactiile complexe, ![]() si
si ![]() difera de coeficientii stoechiometrici a si b. In cazul
reactiilor cu mecanism complex, in
expresia vitezei de reactie pot aparea chiar si substante care nu participa
direct la reactia chimica, asa cum sunt solventii.
difera de coeficientii stoechiometrici a si b. In cazul
reactiilor cu mecanism complex, in
expresia vitezei de reactie pot aparea chiar si substante care nu participa
direct la reactia chimica, asa cum sunt solventii.
Ordinul de reactie este o marime formala care se determina experimental din masuratori de viteza de reactie. El poate fi zero, un numar intreg sau un numar fractionar.
1.1 Influenta concentratiei asupra vitezei de reactie
Scopul lucrarii
Se determina ordinul partial de reactie in raport cu Na2S2O3 (tiosulfat de sodiu) pentru reactia dintre Na2S2O3 si H2SO4 (acid sulfuric).
Introducere
In reactia: Na2S-2S+6O3 + H2SO4
![]() H2S2O3
+ Na2SO4
H2S2O3
+ Na2SO4
acidul tare, H2SO4, scoate din sarea sa acidul mai slab, acidul tiosulfuric H2S2O3), care se descompune, pe masura ce se formeaza, in: sulf (S), dioxid de sulf (SO2) si apa:
H2S2O3 ![]() S0↓
+ S+4O2↑ + H2O
S0↓
+ S+4O2↑ + H2O
Sulful, greu solubil in solutia apoasa in care se desfasoara reactia devine vizibil in momentul in care apare opalescenta in sistemul de reactie. Pe masura ce reactia se desfasoara creste concentratia sulfului. Pornind de la relatia (2.3) se ia in considerare faptul ca sulful coloidal devine observabil in momentul in care concentratia acestuia atinge o anumita valoare. Acestei valori ii corespunde in toate reactiile variatia Δc a concentratiei de Na2S2O3. Se poate alege marimea c ca unitate de masura a variatiei concentratiei ( c=1). Astfel, viteza de reactie este definita de valoarea inversa a timpului scurs din momentul amestecarii reactantilor pana in momentul cand apar particule vizibile de sulf.
Viteza de reactie, vr:
· & 424d36e nbsp;
in
raport cu sulful format: ![]() (2.1.3)
(2.1.3)
· & 424d36e nbsp;
in
raport cu reactantii:![]() (2.1.4)
(2.1.4)
Constanta de viteza, k reprezinta viteza reactiei pentru care concentratia reactantilor este unitara.
Pentru a determina ordinul partial de reactie in raport cu Na2S2O3 se mentine constanta concentratia initiala a H2SO4, iar concentratia initiala a Na2S2O3 se modifica. Deoarece concentratia acidului sulfuric este suficient de mare pentru a putea fi considerata constanta, se poate scrie:
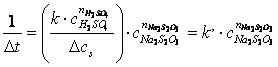 (2.1.5)
(2.1.5)
raportul se noteaza cu k’:
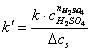 reprezinta constanta aparenta a vitezei de reactie. (2.1.6)
reprezinta constanta aparenta a vitezei de reactie. (2.1.6)
Relatia (1.1.5) se liniarizeaza prin logaritmare:
![]() (2.1.7)
(2.1.7)
Aparatura si substante: biurete, eprubete, stativ pentru eprubete, pahare Berzelius, palnii, solutii de Na2S2O3 0,1 N si de H2SO4 0,1 N.
Mod de lucru
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se prepara solutii de concentratii diferite de Na2S2O3 direct in eprubete masurand cu precizie, cu biureta, volumele de solutie. In eprubetele 1-6 se introduc pe rand cate 6, 5, 4, 3, 2 si 1 mL solutie Na2S2O3, se completeaza apoi continutul eprubetelor cu apa distilata pana la un volum total de 6 mL;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; In eprubetele 7-12 se introduc din biureta solutie de H2SO4 cate 6 mL;
Peste continutul eprubetei 1 se adauga solutia de H2SO4din eprubeta 7, se agita si se masoara variatia de timp, Δt din momentul amestecarii reactantiilor pana la aparitia opalescentei (aparitiei primelor particule de sulf coloidal). Se procedeaza la fel si cu perechile de eprubete 2-8, 3-9, 4-10, 5-11, 6-12 notandu-se valorile lui Δt.
Rezultate si calcule
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se completeaza tabelul urmator:
|
Nr. Eprb. |
a |
b |
Nr. Eprb |
c |
crel |
lg Crel |
Δt, [s] |
lg |
v=1/Dt [s-1] |
|
H2O [mL] |
Na2S2O3 [mL] |
H2SO4 [mL] |
|||||||
|
v1= |
|||||||||
|
v2= |
|||||||||
|
v3= |
|||||||||
|
v4= |
|||||||||
|
v5= |
|||||||||
|
|
v6= |
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp;
Se
calculeaza concentratia relativa, (![]() ) a Na2S2O3
pentru fiecare reactie;
) a Na2S2O3
pentru fiecare reactie;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se calculeaza viteza de reactie, v pentru fiecare reactie;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp;
Se traseaza
graficul dependentei ![]() , precum si
graficul dependentei vitezei de reactie de concentratiile solutiilor de Na2S2O3
, precum si
graficul dependentei vitezei de reactie de concentratiile solutiilor de Na2S2O3
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp;
Se
reprezinta grafic dependenta ![]() . Din panta dreptei,
. Din panta dreptei,
![]() se determina ordinul partial de reactie, n, iar din ordonata la origine constanta
aparenta a vitezei de reactie,
se determina ordinul partial de reactie, n, iar din ordonata la origine constanta
aparenta a vitezei de reactie, ![]() .
.
Interpretarea rezultatelor: Se va aprecia daca reactia este simpla sau complexa, rapida sau lenta.
1.2 Influenta temperaturii asupra vitezei de reactie la concentratie constanta
Scopul lucrarii
Se va determina energia de activare pentru reactia dintre Na2S2O3 (tiosulfatul de sodiu) si H2SO4 (acidul sulfuric).
Introducere
Vitezele reactiilor chimice sunt foarte sensibile la variatiile de temperatura. Cu putine exceptii, vitezele de reactie cresc repede cand temperatura creste. Majoritatea reactiilor isi dubleaza sau chiar tripleaza viteza la fiecare ridicare a temperaturi cu 100C in jurul temperaturii ordinare.
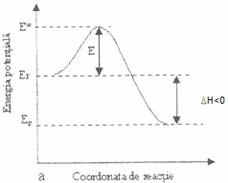 Modul in care decurge o reactie
chimica si viteza reactiei respective pot fi explicate cu ajutorul teoriei ciocnirilor. Conform acesteia
transformarea reactantilor in produsi de reactie necesita o anumita cantitate
de energie numita energie de activare. Moleculele care se ciocnesc trebuie sa
participe la ciocnire cu suficienta energie cinetica (ciocniri eficace) pentru
a atinge aceasta energie minima (energia de activare). Gruparea moleculara
formata temporar in urma atingerii energiei de activare se numeste complex
activat si prezinta energie
superioara atat fata de reactanti, cat si fata de produsi. Reprezentand grafic variatia energiei
potentiale a sistemului in functie de sensul de evolutie a reactiei (coordonata
de reactie) se obtin curbele din figurile 2.2.1 a si b.
Modul in care decurge o reactie
chimica si viteza reactiei respective pot fi explicate cu ajutorul teoriei ciocnirilor. Conform acesteia
transformarea reactantilor in produsi de reactie necesita o anumita cantitate
de energie numita energie de activare. Moleculele care se ciocnesc trebuie sa
participe la ciocnire cu suficienta energie cinetica (ciocniri eficace) pentru
a atinge aceasta energie minima (energia de activare). Gruparea moleculara
formata temporar in urma atingerii energiei de activare se numeste complex
activat si prezinta energie
superioara atat fata de reactanti, cat si fata de produsi. Reprezentand grafic variatia energiei
potentiale a sistemului in functie de sensul de evolutie a reactiei (coordonata
de reactie) se obtin curbele din figurile 2.2.1 a si b.
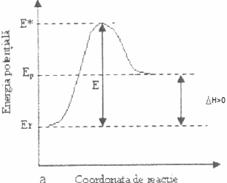
Fig. 2.2.1 Variatia energiei potentiale in reactii chimice exoterme (a) si endoterme (b)
Moleculele reactante au o energie potentiala medie Er. Prin ciocnirea moleculelor, energia potentiala a sistemului creste, deoarece trebuie sa se efectueze un lucru pentru a invinge repulsiile electrostatice ale norilor electronici ai particulelor reactante, deci o parte din energia cinetica se transforma in energie potentiala. Moleculele active formeaza complexul activat cu energie E*. Fiind instabil, cu un timp de viata foarte scurt complexul activat se transforma in produsi de reactie, cu energie potentiala medie Ep mai scazuta. Energia de activare a procesului este egala cu diferenta dintre energia complexului activat E* si energia reactantilor Er.
E = E* - Er (2.2.1)
Caldura de reactiei ![]() atat pentru reactii exoterme cat si pentru
cele endoterme este independenta de viteza de reactie si de energia de
activare.
atat pentru reactii exoterme cat si pentru
cele endoterme este independenta de viteza de reactie si de energia de
activare.
Teoria complexului activat arata ca viteza unei reactii poate fi crescuta prin:
1. Cresterea numarului de ciocniri in unitatea de timp, deci prin cresterea concentratiei substantelor reactante sau cresterea temperaturii in sistemul de reactie;
2. Cresterea energiei cinetice a particulelor in ciocnire, fapt realizabil prin cresterea temperaturii in sistemul de reactie.
Influenta temperaturii asupra vitezei de reactie este descrisa de relatia lui Arrhenius, care cu un numar mic de exceptii (relatiile: “anti-Arrhenius”), are valabilitate generala:
![]() ( 2)
( 2)
unde, constanta de viteza, k, sau viteza specifica este o marime specifica fiecarei reactii, independenta de concentratiile reactantilor, dependenta de temperatura. Unitatile in care se exprima constanta de viteza rezulta din calcul, intotdeauna urmarind sa converteasca produsul de concentratii in concentratie pe unitatea de timp (de exemplu: [mol/L·s]).
A - factor preexponential;
![]() (
(
unde: ![]() - fractiunea de
ciocniri eficace, ciocniri care conduc la reactia chimica;
- fractiunea de
ciocniri eficace, ciocniri care conduc la reactia chimica;
![]() - numarul de
ciocniri pe care moleculele le executa intr-o secunda;
- numarul de
ciocniri pe care moleculele le executa intr-o secunda;
R - constanta universala a gazelor ideale, R=8,314 [J/mol·K] (in S.I.) sau 1,987 [cal/mol·K] (in sistemul tolerat);
T- temperatura absoluta, K
Ea - energia de activare reprezinta surplusul de energie, peste valoarea medie a moleculelor active, care participa la reactia chimica.
Pentru reactia dintre tiosulfatul de sodiu si acidul sulfuric:
Na2S-2S+6O3 +
H2SO4 ![]() H2S2O3
+ Na2SO4 ( 4)
H2S2O3
+ Na2SO4 ( 4)
H2S2O3 ![]() S0↓
+ S+4O2↑ + H2O 5)
S0↓
+ S+4O2↑ + H2O 5)
Viteza de reactie este: 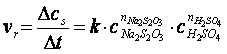
![]() ( 6)
( 6)
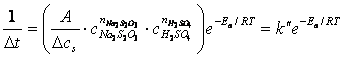 (
(
![]() este constanta aparenta a vitezei de
reactie. Prin logaritmare relatia ( 7) devine:
este constanta aparenta a vitezei de
reactie. Prin logaritmare relatia ( 7) devine:
![]() ( 8)
( 8)
 Aparatura si substante: biurete, baie termostatata Lauda
E100 Ecoline RE112 (fig. 2.2.2), eprubete, stativ pentru eprubete, termometru, solutii de
Na2S2O3 0.1N si H2SO4
0.1 N.
Aparatura si substante: biurete, baie termostatata Lauda
E100 Ecoline RE112 (fig. 2.2.2), eprubete, stativ pentru eprubete, termometru, solutii de
Na2S2O3 0.1N si H2SO4
0.1 N.
 Mod de lucru
Mod de lucru
Se lucreaza cu solutii de concentratii 0.1N de Na S O si 0.1N de H2SO4, masurand cu precizie, cu biuretele, volumele de solutii reactante. Reactiile se efectueaza la diferite temperaturi conform indicatiilor de mai jos:
Fig. 2 Baie termostatata
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; In 5 eprubete numerotate de la 1 la 5 se introduc cate 4 mL solutie Na2S2O3, masurati cu biureta;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; In alte 5 eprubete numerotate de la 6 la 10 se introduc cate 4 mL solutie H2SO4, masurati cu biureta;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp;
Cele
10 eprubete se introduc in baia termostatata. Se porneste termostatul si se
fixeaza la temperatura t1=100C prin apasarea sagetilor
sus (▲) - jos (▼). Cand termostatul indica temperatura dorita
eprubetele 1 si 6 se scot din baia cu apa si se toarna continutul eprubetei 6
peste eprubeta 1. Se agita si se masoara cu ajutorul unui cronometru timpul ![]() t scurs de la amestecarea solutiilor pana
cand solutia incepe sa se tulbure;
t scurs de la amestecarea solutiilor pana
cand solutia incepe sa se tulbure;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se fixeaza termostatul la 170C. Cand se atinge aceasta temperatura se procedeaza la fel ca in primul caz, amestecand continutul eprubetelor 2 si 7 si notand Dt
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Pe rand se masoara Dt pentru urmatoarele reactii procedand la fel cu perechile de eprubete 3-8, 4-9 si 5-10 la temperaturile stabilite in tabelul urmator.
Rezultate si calcule
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se completeaza tabelul urmator cu datele experimentale obtinute:
|
Na2S2O3 |
H2SO4 |
Temperatura |
ln [Dt] |
[s-1] |
||||
|
Nr. Eprubeta |
[mL] |
Nr. Eprubeta |
[mL] |
t [ºC] |
T [K] |
1/T [K] |
||
|
v1 = |
||||||||
|
v2 = |
||||||||
|
v3 = |
||||||||
|
v4 = |
||||||||
|
v5 = |
||||||||
Observatii: Variatia de timp ![]() t se masoara din momentul amestecarii
solutiilor pana la aparitia opalescentei (tulburarea solutiei corespunde aparitiei
primelor particule de sulf coloidal).
t se masoara din momentul amestecarii
solutiilor pana la aparitia opalescentei (tulburarea solutiei corespunde aparitiei
primelor particule de sulf coloidal).
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se calculeaza viteza de reactie v;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se traseaza pe hartie milimetrica graficul dependentei timpului de reactie de temperatura de reactie, precum si graficul dependentei vitezei de reactie de temperatura de reactie;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp; Se reprezinta grafic lnDt = f(1/T) ;
· & 424d36e nbsp; & 424d36e nbsp; & 424d36e nbsp;
Din
panta dreptei, tg α ![]() se
va calcula energia de activare, iar din ordonata la origine,
se
va calcula energia de activare, iar din ordonata la origine, ![]() se
determina constanta aparenta de viteza,
se
determina constanta aparenta de viteza, ![]() .
.
Interpretarea rezultatelor: Se constata daca valoarea energiei de activare corespunde unei reactii chimice activate termic, adica este de ordinul zecilor de mii de calorii.
|