CLASA SULFURI
8.1 Clasificare
Tipul A2X Grupa argentitului Argentit Ag2S
Grupa calcozinei Calcozina Cu2S
Tipul A3X2 Bornit Cu5FeS4
Tipul AX Grupa galenei Galena PbS
Grupa sfaleritului Sfalerit ZnS
Grupa calcopiritei Calcopirita CuFeS2
Grupa wurtzitului Wurtzit ZnS
Grupa nichelinei Pirotina Fe1-xS
Nichelina NiAs
Grupa covelinei Covelina CuS
Cinabru HgS
Realgar AsS
Tipul A2X3 Grupa stibinei Stibina Sb2S3
Bismutina Bi2S3
Tipul AX2 Grupa piritei Pirita FeS2
Grupa löllingitului Marcasita FeS2
Grupa mispichelului Mispichel FeAsS
Grupa molibdenitului Molibdenit MoS2
Tipul A3BX3 Grupa tetraedritului Tetraedrit-Tennantit (Cu, Fe)12(Sb,As)4S
8.2 Sulfuri tip AX
8.2.1 Grupa galenei
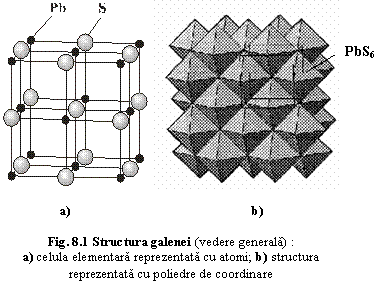 Galena PbS cu Z=4 Fm
Galena PbS cu Z=4 Fm![]() m
m
Structura: arhetipul structural "halit" în care pozitiile Na sunt ocupate de Pb, iar pozitiile Cl sunt de S (fig.8.1) (vezi si izotipism).
Structura poate fi descrisa ca o retea cubica compacta a ionilor de S cu Pb situat în toate cele 4 interstitii octaedrice (ionii de Pb ocupa colturile si centrele fetelor celulei elementare, ionii de S ocupa centrul celulei si centrele muchiilor);
Coordinarea tetraedrica (6) atât pentru Pb cât si pentru S (fig.8.1);
Legatura Pb-S: distanta Pb-S=2,97 Ĺ; criteriul electronegativitatii lui Pauling→ ~ 12% ionica;
Celula elementara: a0=5,93 Ĺ.
Proprietati fizice determinate de structura: Planele constituite din atomi de Pb si Zn sunt plane de coeziune maxima → tracht si clivaj cubic .
8.2.2 Grupa sfaleritului
Sfalerit (Zn, Fe)S Fm![]() 3m
3m
(vezi si politipism)
Structura
(fig. 8.2.) derivata din arhetipul
structural "diamant" (vezi si homeotipism). Pornind de la structura
diamantului, pozitiile de tip A sunt ocupate de S (retea cubica
centrata pe fete), iar pozitiile de tip B sunt ocupate de Zn (4
din cele 8 interstitii tetraedrice). Alternanta Zn si S în
structura de tip diamant determina scaderea simetriei de la Fd![]() 3m pentru diamant la
F
3m pentru diamant la
F![]() 3m pentru sfalerit.
3m pentru sfalerit.
Coordinarea -4 (tetraedrica) atât pentru Zn, cât si pentru S (fig. 8.2);
Legatura Zn-S: -d(Zn-S)=2,54 Ĺ <r(Zn2+)+r(S2-)=0,74+1,84=2,58 Ĺ;
>rc(Zn)+ rc(S)=1,25+1,02=2,27 Ĺ;
==> legatura covalenta-ionica: criteriul electronegativitatii Pauling ~20% caracter ionic.
 Celula
elementara: a0
Celula
elementara: a0
Chimism: Fe poate substitui pâna la 34%Zn.
Proprietati fizice
Analiza planelor atomice cu diferite orientari arata urmatoarele:
- în directia [100] (fig.8.3a) alterneaza plane de atomi de Zn cu plane de atomi de S (coeziune minima); distanta dintre plane d[100]=1,35 Ĺ;
- în directia [110] (fig.8.3b) se succed plane formate din atomi de Zn si S cu numarul maxim de legaturi cuprins în acest plan (coeziune maxima); distanta dintre plane d[110]=1,90 Ĺ;
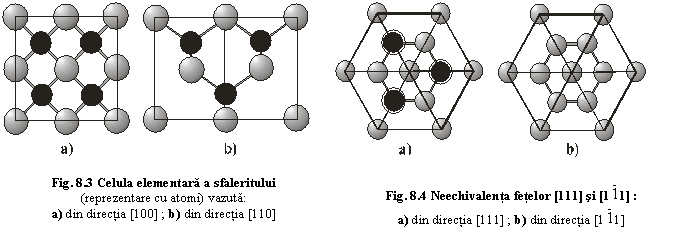 - în directiile [111] (fig.8.4a) si [
- în directiile [111] (fig.8.4a) si [![]() ] (fig.8.4b)
alterneaza plane de atomi de Zn cu plane de atomi de S (plane de densitate
reticulara maxima); vazuta din ambele directii ,
structura arata caractere diferite.
] (fig.8.4b)
alterneaza plane de atomi de Zn cu plane de atomi de S (plane de densitate
reticulara maxima); vazuta din ambele directii ,
structura arata caractere diferite.
Consecintele acestor particularitati determina urmatoarele proprietati fizice:
- clivajul dupa (plane de coeziune maxima);
- trachtul dat de combinatii de tetraedru +
si tetraedru -![]() (fetele celor doua forme de tetraedru
prezinta striatii diferite) si dodecaedru romboidal .
(fetele celor doua forme de tetraedru
prezinta striatii diferite) si dodecaedru romboidal .
8.2.3 Grupa calcopiritei
Calcopirita CuFeS2, Z=4 I![]() 2d
2d
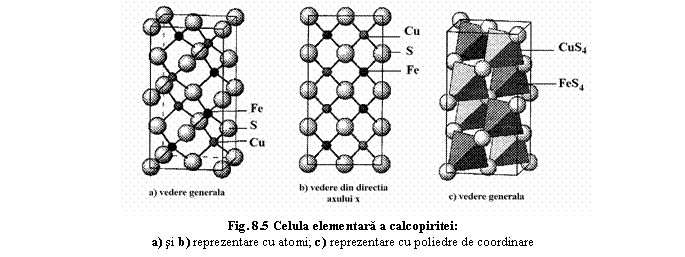
Structura deriva din structura sfaleritului prin ocuparea pozitiilor Zn alternativ de catre Cu si Fe (vezi si homeotipism).
Daca Cu si Fe ocupa statistic pozitiile Zn, vom obtine o faza minerala (Cu, Fe)S cu structura sfaleritului. Aceasta situatie este posibila la temperaturi ridicate când reteaua este relaxata si nu impune cationilor restrictii dimensionale.
La temperaturi <540°C, atomii de Cu si Fe au tendinta de a ocupa pozitii specifice, determinând
ordonarea structurii: alternarea atomilor de Cu si Fe în pozitiile Zn (fig.4). Aceasta are ca prima consecinta scaderea simetriei (cubic→tetragonal) datorita dublarii celulei elementare în directia axului z.
Coordinarea (fig.8.5c): - atomii de S coordinati tetraedric de 2 atomi de Cu si 2 atomi de Fe;
- atomii de Cu coordinati tetraedric de 4 atomi de S;
- atomii de Fe coordinati tetraedric de 4 atomi de S.
Celula elementara:
- formata din doua celule tip sfalerit suprapuse în directia axului c;
- parametrii: - a0=5,18 Ĺ (< blenda 5,40 Ĺ datorita substitutiei Zn prin Cu si Zn);
- c0=10,41 Ĺ (~ 2a0=10,36Ĺ).
Proprietati fizice determinate de structura
Vazuta din directii diferite, structura calcopiritei prezinta aproximativ aceleasi caracteristici ca si structura blendei. Similitudinea celor doua structuri, neechivalenta planelor si determina neechivalenta formelor cristalografice corespunzatoare (bisfenoid + si - care pot fi vazute ca niste tetraedre alungite în directia axului z).
Câteva observatii importante:
1. posibilitatea existentei dezordinii doar intr-o parte a structurii; la temperaturi ridicate atomii, de S sunt ordonati, în timp ce atomii de Cu si Fe sunt dezordonati;
2. ordonarea cationilor duce la scaderea simetriei;
3. explicarea structurilor de dezamestec sfalerit-calcopirita, vizibile microscopic sub forma unor incluziuni fine de calcopirita în sfalerit, deseori orientate cristalografic prin posibilitatea extensiei la temperaturi ridicate a unui compus (Zn,Cu,Fe)S cu structura sfaleritului si dezamestecul sau la scaderea temperaturii în doua faze cu structuri distincte.
8.2.4 Grupa nichelinei
Reprezentata prin doua minerale importante izotipe cu grupul spatial P63/mmc:
Nichelina NiAs cu Z=2
Pirotina Fe1-xS cu Z=2
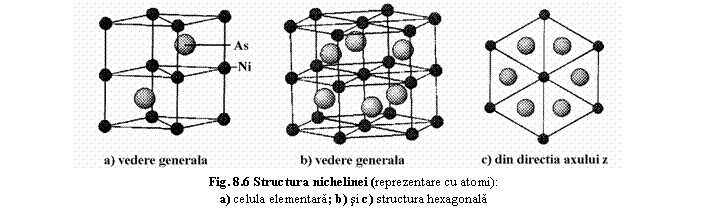
Structura (fig.8.6), descrisa prin arhetipul structural "nichelina" se bazeaza pe o împachetare
compacta a unor strate atomice care se succed în directia în directia axului z:
- stratul I=STRATUL A, constituit din atomi de Ni aflati în pozitiile A;
- stratul II=STRATUL C, constituit din atomi de As, se va suprapune peste stratul A astfel încât atomii de As se vor suprapune peste golurile de tip C ale stratului A;
- stratul III=STRAT A, constituit din atomi de Ni suprapusi peste atomii de Ni ai stratului I;
- stratul IV=STRAT B, constituit din atomi de As suprapusi peste golurile de tip B ale stratului III. Rezulta astfel o succesiune de straturi de atomi de Ni si As cu schema de împachetare: ACAB/ACAB.... în care straturile de tip A sunt constituite din Ni, iar straturile de tip B si C din As.
Legatura Ni-As
- d(Ni-As)=2,42Ĺ <r(Ni3+)+r(As3-)=2,58Ĺ;
>rc(Ni)+ rc(As)= 2,36Ĺ;
- criteriul electronegativitatii Pauling 1% legatura ionica.
Coordinarea: Ni coordinat de 6 atomi de As (octaedric), As coordinat de 6 atomi de Ni (prisma trigonala).
Celula elementara: a0=3,602Ĺ; c0=5,009Ĺ
În cazul pirotinei s-a observat faptul ca, raportul Fe:S <1 (între 6:7 si 11:12). Masuratorile de greutate specifica efectuate pe mai multe cristale au aratat exisetenta unor pozitii vacante ale Fe2+, fapt ce duce la explicarea deficitului de Fe observat. Pentru mentinerea neutralitatii structurii, unii ioni de Fe2+ sunt substituiti de Fe3+ (vezi solutiile solide de omisiune). La temperaturi ridicate, vacantele se distribuie dezordonat; la scaderea temperaturii acestea se ordoneaza, determinând scaderea simetriei (monoclinica). Parametrii celulei elementare variaza cu numarul de pozitii vacante (comprimarea parametrului c0 la cresterea acestora).
Proprietati fizice
De la aceasta structura stratificata deriva trachtul hexagonal si habitusul tabular dezvoltat dupa (0001). Sunt renumite cristalele de pirotina de la Herja, cu contur hexagonal, concrescute în agregate cu aspect de "pagode" sau "trandafiri". În plus, reteaua hexagonala compacta determina un clivaj bazal bun, macle dupa (0001) si o anizotropie optica pronuntata pe fetele de prisma.
Legatura chimica dintre Fe si S, având partial caracter ionic si partial caracter metalic conduce la o serie de proprietati specifice metalelor: luciu metalic, capacitate de reflexie ridicata si opacitate.
8.3 Sulfuri tip AX2
Grupa piritei
Pirita FeS2 cu Z=4 Pa3
Exista si o alta modificatie polimorfa a FeS2, marcasita rombica.
Structura (fig.8.7a) poate fi descrisa pornind de la structura galenei (tip halit): pozitiile Pb(Na) sunt ocupate de Fe, pozitiile S(Cl) de perechi S2 (grup molecular S22-), astfel încât centrul de simetrie al perechii S2 ocupa pozitia centrului anionului din structura tip halit.
Prezenta perechilor S2 determina scaderea simetriei comparativ cu galena.
Legaturile chimice
- legatura S-S: d(S-S)=2,14 Ĺ, mai mare decât suma razelor covalente (2rc(S)=2,04 Ĺ); explicatia pentru aceasta diferenta decurge din atragerea atomilor de S de atomii de Fe învecinati;
- legatura Fe-S: d(Fe-S)=2,26 Ĺ (fata de 2,25 Ĺ la calcopirita)
< r(Fe2+)+r(S2-)=0,74+1,84=2,60 Ĺ;
> rc(Fe)+rc(S)=1,17+1,02=2,19 Ĺ;
- criteriul electronegativitatii Pauling→ ~12% legatura ionica.
Coordinarea (fig.8.7b)
- Fe înconjurat de 6 atomi de S→ un octaedru deplasat de la directia axelor 4;
- perechile S2 înconjurate octaedric de 6 atomi de Fe.
Celula elementara: a0

Proprietati fizice
Tracht: cub si dodecaedru pentagonal ("piritoedru") . Desi prezinta un tracht cubic, cubul de pirita nu mai admite axe 4, ci axe 2; scaderea simetriei morfologice se datoreaza orientarii striatiilor de pe fete (doua fete alaturate au striatii orientate perpendicular).
Macla importanta: macla "în cruce de fier" rezultata prin întrepatrunderea a doua dodecaedre cu fete de cub cu axul de macla 4.
|