I. INTRODUCERE IN CHIMIA ANALITICA
I.1. Chimie analitica. Analiza chimica
Domeniul de studiu al chimiei este impartit in diferite ramuri distincte si bine definite cum sunt chimia anorganica, chimia organica, chimia fizica, chimia analitica, chimia biologica, s.a.
In toate domeniile chimiei si ale tehnicii, analiza chimica are un rol deosebit de important, care s-a dezvoltat odata cu acumularea cunostintelor fizico-chimice privind legi dupa care se desfasoara reactiile chimice. Cu ajutorul analizei chimice se determina compozitia substantelor, se controleaza calitatea materiilor prime necesare in diferite industrii (chimice, farmaceutice, metalurgice, materiale de constructie, s.a.), si se urmaresc procesele tehnologice. Astazi este pe deplin stabilit faptul ca de controlul riguros al diferitelor faze de fabricatie depinde nu numai de calitatea produselor obtinute, oricare ar fi ele, ci si folosirea rationala a materiilor prime.
Sarcina studierii compozitiei substantelor simple sau compuse, izolate sau in amestec, revine azi unei ramuri bine conturate a chimiei denumita Chimie analitica.
Dezvoltarea uriasa a stiintelor naturii, problemele din ce in ce mai complexe ce se pun in fata productiei, imbogatesc continutul acestei definitii, reliefand mai ales rolul nou pe care il are chimia analitica in productia industriala. Cerintele tehnologiei moderne impun ca substantele sa fie supuse unei examinari mai complexe decat simpla stabilire a compozitiei, in vederea cunoasterii tuturor proprietatilor care le caracterizeaza. Folosind un limbaj modern se poate spune ca scopul chimiei analitice este obtinerea de informatii de o anumita natura asupra substantei studiate. Aceste informatii se obtin supunand substanta unei serii de investigatii, ansamblul carora formeaza analiza chimica.
Relevand aceasta latura a problemei, chimia analitica o putem defini ca stiinta despre analiza chimica, despre metodele si procedeele de analiza, avand ca obiectiv elaborarea si interpretarea metodelor de analiza pe baza relatiilor teoretice ale chimiei si ale stiintelor auxiliare. Chimia analitica reprezinta deci edificiul aspectelor teoretice, iar analiza chimica cele aplicative. Limbajul de toate zilele nu respecta diferentierea, prin chimie analitica intelegandu-se ambele laturi. In principiu, este cu totul indiferent cum se ajunge in posesia informatiilor analitice, astfel la rezolvarea unei probleme date, chimia analitica moderna isi concentreaza toate posibilitatile utilizand toate realizarile chimiei teoretice si ale tehnicii instrumentale. Preocupandu-se atat de fundamentarea teoretica a metodelor de analiza chimica cat si de realizarea lor practica si continua lor dezvoltare, chimia analitica isi propune ca obiectiv concret, practic, sa stabileasca compozitia si structura substantelor si amestecurilor acestora.
Obiectul chimiei analitice poate fi caracterizat din punct de vedere teoretic si practic.
Din punct de vedere teoretic chimia analitica studiaza structura, proprietatile si interactiile fizico-chimice ale speciilor ce intervin in elaborarea si aplicarea metodelor de analiza chimica. In special, studiul interactiilor fizico-chimice a speciilor ce intervin in analiza chimica a dus la corelarea chimiei analitice cu chimia solutiilor apoase si neapoase. Pentru chimia analitica nu poate fi vorba de teorii pure, ci de modul in care se utilizeaza cunostintele si datele experimentale acumulate, in scopuri bine definite.
Scopul practic al chimiei analitice il reprezinta analiza calitativa si cantitativa a amestecurilor de substante de importanta practica si tehnologica cum ar fi de exemplu: analiza minereurilor, analiza si caracterizarea titeiurilor, caracterizarea analitica a reactivilor folositi in industria de medicamente, analiza catalizatorilor proaspeti si uzati, dozarea substantelor valoroase recuperabile din unele deseuri etc.
Tinand seama de scopul teoretic si practic, rezulta ca obiectivul chimie analitice consta in elaborarea de principii si teorii in vederea instituirii de metode de analiza chimica, capabile de a furniza informatii calitative, semicantitative si cantitative, referitoare la compozitia elementara, functionala si structurala al oricarui compus natural sau sintetic.
Rolul deosebit al chimiei analitice si pozitia analistului in industrie si cercetare se impune si se defineste din ce in ce mai pregnant, odata cu dezvoltarea analizelor instrumentale, proces posibil ca urmare a progresului fizicii si electronicii aplicate. In actualul context, rolul chimiei analitice si ala analistului este de a rezolva mai intai problemele noi de analiza din ce in ce mai complexe: dozarea de urme din ce in ce mai slabe, pe esantioane din ce in ce mai mici, in amestecuri din ce in ce mai complicate si mai greu de separat, in care sunt prezente elemente care altadata nu prezentau un interes marcant. Pentru a rezolva aceste probleme chimia analitica trebuie sa combine un intreg ansamblu de mijloace: proprietati chimice, previziuni asupra desfasurarii reactiilor chimice, influenta unor parametri fizici si chimice, metode de masura, o bibliografie foarte extinsa.
I.2. Importanta chimiei analitice pentru stiinta si productie
Chimia analitica are o importanta mare atat in cercetari stiintifice cat si in aplicatiile practice. Analiza chimica este de mare importanta pentru stiinta si tehnica.
Insasi cunoasterea temeinica a chimiei nu este posibila fara chimie analitica, deoarece ea prezinta si sugereaza aplicatiile practice imediate, fiind un mijloc de control si de aprecieie critica in cercetarile stiintifice din domeniiile chimiei. Edificiul modern al chimiei se sprijina pe cunostinte de natura analitica, “toate progresele chimiei fiind in legatura mai mult sau mai putin directa cu metodele analitice” (R. Fresenius, 1861).
Toate ramurile economice si ale productiei isi axeaza cercetarile si pe rezultatele analizei chimice. Analiza chimica cuprinde cel putin jumatate din preocuparile chimiei (sinteza si descompunere).
Prospectarea si exploatarea rationala a materiilor prime, organizarea productiei de bunuri materiale este imposibila fara concursul chimiei analitice. Analiza materiilor prime, urmarirea proceselor tehnologice de fabricatie si controlul calitatii produselor intermediare si finite sunt conditii de baza pentru organizarea stiintifica a productiei. Analiza chimica permite intrebuintarea mai rationala a materiilor prime si obtinerea unui maxim de randament.
Preocuparile moderne de reglare si automatizare in industria chimica, si nu numai, nu se pot materializa fara a apela la rezultatele teoretice si instrumentatia moderna a chimiei analitice. Controlul analitic intrevine pe tot parcursul fazelor de productie, de la materii prime pana la produsele finite. Nici o unitate industriala nu poate obtine produse de calitate superioara fara un control analitic riguros pe toate etapele sau fazele proceselor tehnologice. Toate stiintele naturii sunt in mod firesc in stransa legatura cu chimia analitica. In geologie, stiinte biologice, medicina, agronomie, rezolvarea problemelor zilnice, progresul si noile descoperiri sunt conditionate de investigarea intima a compozitiei si reactivitatii substantelor implicate. Importanta chimiei analitice privita prin prisma legaturilor cu domeniile stiintifice inrudite, poate fi ilustrata prin contributia sa insemnata la dezvoltarea metodelor de analiza aplicate in analiza materiilor prime, in controlul de calitate, analiza compusilor biochimici si farmaceutici, analiza mediului inconjurator, analize chimice, s.a. Cercetarile nucleare, rezultatele epocale in descoperirea de elemente si de particule noi sunt si realizari ale chimiei analitice. Necesitatea de specialisti ce au cunostinte temeinice de chimie analitica in toate domeniile stiintelor naturii, si nu numai, este fireasca deoarece chimia analitica este importanta nu numai din punct de vedere al aplicatiilor ci si pentru cercetare. Chimia analitica are un rol deosebit stiintei si tehnicii si contribuie intr-o masura insemnata la dezvoltarea multor stiinte ca: geologia, geochimia, mineralogia, biologia, agrochimia fizica, medicina, metalurgia si altele
I.3. Chimie analitica calitativa si cantitativa
Chimia analitica se ocupa cu elaborarea teoriilor si metodelor de analiza calitativa si cantitativa pentru stabilirea compozitiei si structurii substantelor, materiilor prime si a materialelor finite. Metodele de analiza chimica pot fi impartite in functie de scopul urmarit in doua mari categorii: calitative si cantitative, a caror baza teoretica este unica.
Compozitia unei substante poate fi stabilita, caracterizarea ei putand fi facuta sub doua aspecte principial diferite: calitativ si cantitativ. Sub aspect calitativ, ea are scopul de a identifica natura indivizilor chimici, atomii, ionii, radicalii, moleculele componente iar investigatiile de aceasta natura formeaza obiectul chimiei analitice calitative. Pe de alta parte, substantele pot fi studiate sub aspect cantitativ, determinand cantitatea relativa a componentilor identificati in cursul analizei calitative, preocuparile de acest fel formand domeniul chimiei analitice cantitative. Chimia analitica se imparte deci in doua ramuri mari: chimie analitica calitativa si chimie analitica cantitativa. In analiza calitativa, scopul este numai de a afla elementele, grupele de atomi sau compusi care exista intr-o substanta naturala sau produs artificial. In analiza cantitativa, scopul este de a determina masa componentilor principali, secundari sau in urme. In analiza calitativa scopul este de a determina ce constituenti sunt intr-o proba, pe cand in analiza cantitativa scopul este de a determina cat de mult din fiecare constituent se gaseste intr-o proba. Analiza calitativa identifica “ce” contine o proba de analizat iar analiza cantitativa determina “cat” dintr-o anumita substanta este prezenta in proba de analizat.
Analiza cantitativa se bazeaza pe masurarea unei proprietati care este cor 242d36c elata direct sau indirect cu cantitatea constituentului ce trebuie determinat dintr-o proba. In mod ideal, nici un alt constituent in afara de cel analizat nu ar trebui sa contribuie la masuratoarea efectuata. Din nefericire, o astfel de selectivitate este rareori intalnita. In tabelul 1.1 se rezuma etapele de baza ale unei analize.
Tabelul 1.1 Etapele unei analize
Luarea probei: - obtinerea unei probe semnificative prin metode statistice
Prepararea probei: - trecerea constituentului dorit intr-o forma adecvata pentru masurare
Alegerea procedeului analitic tinandu-se cont de urmatoarele criterii:
Metode : a) chimice;
b) fizice cu sau fara schimbari in substanta.
Conditii: a) determinate de problema analitica;
b) determinate de substanta cercetata.
Cerinte: a) rapiditate, exactitate, costuri;
b) posibilitatea de amortizare.
Masurarea
Evaluarea critica a rezultatelor – calcularea si interpretarea rezultatelor masuratorilor.
In cursul analizei sistematice a unei probe necunoscute analiza calitativa precede totdeauna analiza cantitativa deoarece alegerea procedeului de analiza cantitativa ce trebuie urmat depinde de natura si complexitatea componentilor, de raportul lor aproximativ, ca si impuritatile ce se afla in materialul de analizat. In functie de natura legaturilor existente intre diversii constituenti ai probei analizat, analiza chimica cantitativa capata un caracter specific, existand deosebiri intre procedeele utilizate in analiza compusilor organici si anorganici.
In privinta aspectelor teoretice, nu exista nici o deosebire principiala intre cele doua clase de combinatii, chimia analitica a combinatiilor anorganice si organice formand o disciplina unitara.
Pentru a realiza o analiza completa pot fi folosite mai multe procedee. O importanta parte a sarcinilor ce revin analistilor consta in alegerea metodei optime in functie de proba, alegere care este simplificata numai de o ampla documentare, precum si de o bogata experienta. In rezolvarea problemelor analitice chimistului analist i se cere adesea sa conceapa, sa repare aparate si sisteme electronice, sisteme optice, sa interpreteze spectre si alte date furnizate de instrumentele de masura, sa execute analize clasice cu mijloace simple, sa conceapa noi procedee sau sa le modifice pe cele vechi, sa separe amestecuri simple si complexe, sa purifice probe si sa elaboreze programe pentru computer. Sistemele chimice si fizice cu care se intalnesc analistii, prezentand diferite grade de complexitate, trebuie sa fie capabili sa cerceteze amestecuri organice si anorganice, compusi de natura metalurgica, biochimica, farmaceutica, din domeniul medical, s.a.
I.4. Tipuri de metode analitice
Metodele analitice pot fi grupate in mai multe moduri.
Clasificarea se poate baza pe tipul sau starea de agregare a probei, pe scopul analizei, pa marimea probei, s.a.
Metodele chimice cer un timp lung pentru executarea lor, ceea ce constituie un dezavantaj, dar dar ele se imbunatatesc mereu prin introducerea unor noi reactivi, mai ales organici, prin procedee mai rapide sau prin crearea unei aparaturi automatizate.
Pentru realizarea scopului, (analiza cantitativa si calitativa), chimia analitica utilizeaza:
metode de identificare, (pentru anioni, cationi, radicali liberi, particule elementare etc);
metode de determinare (gravimetrice, volumetrice, electrometrice, optice, termice, radiochimice, cinetice, enzimatice etc);
metode de separare (prin distilare, precipitare, complexare, extractie cu solventi, schimbatori de ioni, cromatografie, electroforeza etc) denumite metode analitice.
Metodele de identificare se ocupa numai de decelarea elementelor, ionilor, radicalilor, particulelor elementare ce exista intr-o substanta naturala sau produs artificial.
Metodele de determinare stabilesc cantitatile din fiecare component principal, secundar sau in urme aflat in proba, decelat prin analiza calitativa. Dintre metodele de determinare amintim: metodele gravimetrice, volumetrice, electrometrice, optice, radiochimice, cinetice, enzimatice, termice, electrochimice etc.
Metodele de separare pot fi utilizate pentru purificare, identificarea calitativa sau pentru determinarea cantitativa. Cele mai importante metode de separare sunt: distilarea, precipitarea, complexarea, extractia cu solventi, electroforeza, metodele cromatografice, schimbatori de ioni. Adesea este necesar sa se indeparteze impuritatile din probe inainte ca acestea sa fie supuse analizei. Metodele de separare bazate pe fenomene fizice sau chimice nu trebuie sa fie asociate numai cu indepartarea impuritatilor. Separarea componentilor dintr-un amestec poate avea o importanta calitativa sau cantitativa utila pentru purificare, pentru concentrarea unuia din componenti sau a tuturor. Multe procese tehnologice industriale anorganice sau ale compusilor organici se bazeaza pe o schema de separare. Sub aspect analitic, metodele de separare sunt deosebit de importante deoarece procedeele analitice sunt selective si conduc la rezultate corecte numai dupa izolarea componentilor probei.
La baza metodelor de analiza cantitativa stau proprietati fizice si chimice ale materiei in diferitele ei stari de agregare: formarea de precipitate, obtinerea de compusi solubili colorati, degajarea de gaze, absorbtia si emisia de radiatii s.a. si de aceea in functie de procedeele utilizate pentru masurarea variatiilor acestor proprietati apar diverse metode de analiza. Analiza cantitativa se imparte in mai multe capitole sau parti distincte dupa caracteristica metodelor aplicate.
Metodele folosite in chimia analitica, dupa tipul de proprietate cu ajutorul careia se deceleaza si se dozeaza componentii probei de analizat pot fi impartite in metode chimice si metode instrumentale( metode fizico-chimie si metode fizice).
Metodele chimice de analiza se bazeaza pe transformarea componentului de determinat intr-un compus cu proprietati specifice pe baza carora se poate stabili identitatea acestui compus si implicit a componentului ce trebuie decelat si dozat. Modificarea chimica ce are loc este cunoscuta sub denumirea de reactie analitica iar substanta care a generat aceasta modificare se numeste reactiv analitic. De obicei elementul sau ionul ce trebuie determinat se transforma intr-un precipitat caracteristic prin constitutie, culoare, proprietati chimice si usor de separat intr-un compus solubil colorat specific, intr-o substanta instabila ce se descompune intr-un component gazos usor de evidentiat. Metodele chimice de analiza cantitativa folosesc pentru determinare reactiile chimice care au loc cu formare de produsi stabili. Asa sunt reactiile de precipitare in analiza gravimetrica, reactiile de neutralizare, oxido-reducere, precipitare, cu formare de complecsi, cu formare de substante solubile dar greu disociate in analiza volumetrica. In analiza cantitativa se aleg numai reactii practic totale.
Metodele chimice se bazeaza pe diferite operatii chimice folosind sticlaria uzuala de laborator formata din aparate simple. In aceste metode se masoara masa sau volumul (gravimetria, volumetria, gaz-volumetria). Gravimetria este un procedeu analitic cantitativ, care se bazeaza pe cantarirea substantei de analizat obtinuta prin precipitare, electrodepunere sau dupa un proces de volatilizare. Metodele volumetrice cuprind procedeele bazate pe masurarea volumelor unei solutii de reactiv (sau gaz) a carei concentratie este cunoscuta si care se adauga probei intr-o proportie anumita, corespunzatoare relatiilor stoechiometrice ce se stabilesc in reactia chimica.
Metodele instrumentale (fizice sau fizico-chimice) implica utilizarea unui echipament mult mai complicat bazat pe principii electronice, optice sau termice.
Metodele fizice de analiza se bazeaza pe masurarea unui parametru fizic al sistemului care este o functie a compozitiei acestuia.. Parametrul fizic dependent de compozitia sistemului poate fi un parametru optic, electric, termic, electromagnetic etc. In cazul folosirii parametrului optic in studiul compozitiei sistemelor chimice, apar metodele optice de analiza care pot fi de emisie, absorbtie, fluorescenta, difuzie etc. Metodele optice de analiza se bazeaza pe proprietatile optice ale unui sistem (atomi, ioni, molecule simple si complexe) care sunt functie de natura atomilor, de structura combinatiilor si in interactiune cu energia radianta de o anumita lungime de unda. Metodele optice se bazeaza pe modul in care reactioneaza o proba la radiatia electromagnetica. Proprietatile optice tipice care pot fi corelate cu concentratia sunt: absorbtia sau emisia de energie radianta, difractia energiei radiante, dispersia energiei radiante si emisia intarziata de energie radianta.
Dupa natura interactiunii sistemului cu energia excitanta, in diferite domenii spectrale, se deosebesc: metode optice de absorbtie (in UV, vizibil si IR), de difuzie (nefelometrice, turbidimetrice), de difractie (cu raze X, electroni, neutroni), de emisie (UV, vizibil, raze X, de fluorescenta). In chimia analitica se utilizeaza mai mult metodele de absorbtie si emisie. Din punct de vedere al realizarii instrumentale, metodele optice de analiza inglobeaza:
a) metodele spectrometrice (de emisie, de raze X), care constau in analiza spectrului obtinut, atat in ceea ce priveste frecventa liniilor spectrale cat si intensitatea lor;
b) metodele spectrofotometrice (in vizibil ultraviolet sau infrarosu, de absorbtie atomica, fluorescenta sau fosforescenta) care se bazeaza pe masurarea cantitatii de lumina de o anumita lungime de unda absorbita de un mediu transparent;
c) metode polarimetrice ce se bazeaza pe masurarea marimii si directiei rotirii planului luminii polarizate de anumite medii alcatuite din substante cu structura asimetrica;
d) metode refractometrice si interferometrice bazate pe masurarea indicelui de refractie;
e) metode nefelometrice si turbidimetrice ce se bazeaza pe masurarea intensitatii luminii difuzate de o anumita lungime de unda;
f) metode optice de difractie (cu raze X, electroni, neutroni) ce se bazeaza pe determinarea directiei undelor difractate si care permite identificarea, dozarea si determinarea structurii substantelor anorganice si organice.
In cazul folosirii unui parametru electric in studiul compozitiei sistemelor chimice, avem de-a face cu metode electrice de analiza care pot fi:
a) conductometrice, in care se urmareste conductibilitatea electrica a sistemelor chimice;
b) dielectrometrice, care se bazeaza pe determinarea constantei dielectrice.
Folosirea unui parametru termic in studiul compozitiei sistemelor chimice a generat aparitia metodelor termice de analiza din care amintim:
a) termoanaliza prin care se urmareste temperatura de racire sau de incalzire in functie de timp;
b) analiza termodiferentiala (ATD) care consta in masurarea cantitatii de caldura cedata sau absorbita in timpul procesului de incalzire, raportata la proba inerta;
c) dilatometria in care se inregistreaza variatiile dimensiunilor sistemului in functie de temperatura.
Folosirea proprietatilor electromagnetice ale substantelor a generat o serie de metode a caror realizare instrumentala include dispozitive de generare a unor campuri electromagnetice puternice, dispozitive electronice de amplificare si de prelucrare a datelor, inregistrare si afisare a lor. Dintre aceste metode amintim spectrometria de microunde care a generat spectrometria de rezonanta electronica de spin, de rezonanta magnetica nucleara, spectrometria Mossbauer. Toate aceste metode se bazeaza, in principiu, pe absorbtia radiatiilor electromagnetice (microunde) de catre substanta, in functie de frecventa intr-un camp magnetic exterior. Schimbul de energie intre sistem si campul electromagnetic, adica absorbtia de energie, apare la o anumita frecventa, numita frecventa de rezonanta. Valoarea frecventei de rezonanta depinde foarte mult de interactiile ce se stabilesc intre electroni si nucleele inconjuratoare. Prin integrarea maximelor de absorbtie din spectrul de rezonanta obtinut se poate determina concentratia speciei chimice ce intereseaza. In aceeasi categorie pot fi incluse si metodele radiometrice de analiza in care se masoara intensitatea radiatiilor nucleare emise de speciile radioactive ale amestecurilor de substante.
Metodele fizico-chimice de analiza reprezinta tendinta cea mai actuala in chimia analitica. Aceste metode se bazeaza fie pe urmarirea unui fenomen chimic (reactie) prin metode fizice, fie prin transformarea chimica a sistemului de analizat in specii chimice cu proprietati chimice distinctive ce pot fi evidentiate si masurate, marimea masurata fiind o functie de concentratie. Metodele fizico-chimice de analiza pot fi:
a) Metode electrochimice (potentiometrice, ampermetrice, coulometrice, polarografice, s.a.) in care decelarea componentilor de dozat se face pe cale electrochimica, parametrul direct masurat fiind de natura electrica (potentialul de electrod, intensitatea de curent, cantitatea de electricitate).
Potentiometria este metoda de analiza bazata pe masurarea potentialului unui electrod introdus in solutia de cercetat. Electrodul indicator este asociat cu un electrod de referinta care poseda un potential cunoscut si constant. Masurandu-se forta electromotoare a pilei formate din cei doi electrozi, se determina concentratia speciei ionice la care electrodul indicator este sensibil.
Amperometria se bazeaza pe urmarirea intensitatii curentului electric ce trece intre doi electrozi aflati in solutie si mentinuti la un potential constant.
Coulometria este metoda de analiza electrochimica bazata pe determinarea cantitatii de electricitate ce este pusa in joc intr-o reactie chimica.
Polarografia are la baza voltametria, adica studiul relatiei curent-potential dintre doi electrozi cufundati intr-o solutie, dintre care electrodul de lucru este electrodul picator de mercur.
b) Metode cromatografice (de absorbtie pe coloana, de repartitie pe coloana, pe strat subtire, pe hartie, de lichide cu inalta presiune, prin schimb ionic, de gaze) au la baza fenomenul fizico-chimic de chemosorbtie care conduce la repartitia diferita a componentelor unui amestec intre o faza mobila si una stationara. In acest fel componentele ce migreaza in directia de deplasare a fazei mobile vor avea viteze diferite, asigurandu-se separarea lor si apoi identificarea si dozarea lor. Tot din categoria metodelor cromatografice face parte si electroforeza, in care migrarea diferentiala a componentilor fazei mobile in raport cu faza stationara se face sub influenta campului electric fiind posibile separari si atunci cand componentii nu prezinta separatii diferite intre faze.
c) Metode termice (termogravimetria TG, termogravimetria derivata GTD, analiza termodiferentiala ATD, derivatografia termica, titrarea crioscopica, titrarea termometrica, titrarea calorimetrica etc) se bazeaza pe urmarirea modificarii parametrilor termici si calorici sau a altor parametri fizici dependenti de temperatura, generate de schimbarile chimice ale sistemului de analizat. Termogravimetria TG consta in urmarirea variatiei masei probei in functie de temperatura, curbele termogravimetrice fiind utilizate pentru identificarea substantelor si dozarea lor. Metoda analizei termice diferentiale ATD se bazeaza pe modificarea entalpiei, modificare survenita in proba in cursul unei incalziri uniforme. Astfel se stabileste si se masoara cantitatea de caldura ce se absoarbe sau se degaja datorita schimbarilor fizice sau chimice ce au loc in substante solide, la variatii de temperatura. Derivatografia termica reuneste tehnicile termogravimetriei, termogravimetriei derivate si analizei termodiferentiale intr-un ansamblu unitar, inregistrand simultan toate cele trei curbe, astfel obtinand un numar de informatii mai mare ce se completeaza reciproc si care permit caracterizarea multilaterala din punct de vedere calitativ si cantitativ a substantelor. Calorimetria consta in masurarea cantitatii de caldura schimbata in cursul reactiilor chimice.
d) Metode spectroscopice – se refera in special la spectrometria de masa care a ajuns una dintre cele mai importante metode in studiul structurii substantelor anorganice si organice, analiza izotopica a elementelor sau analiza amestecurilor de substante. In aceasta metoda speciile chimice ale amestecului sunt transformatte in ioni separabili, apoi datorita raportului diferit m/e, folosind forta Lorentz ce genereaza modificarea traiectoriri liniare a ionilor in traiectorii curbe atunci cand patrund in campuri magnetice perpendiculare pe directia deplasarii. Deoarece majoritatea ionilor au sarcina electrica unitara, ionii cu aceeasi masa sunt focalizati in acelasi punct. O varianta a spectrometrului de masa o reprezinta spectrometrul de cuadipol care are o rezolutie mai mare pentru ionii cu mase mici.
In ultimii ani, progresele inregistrate in masuratorile analitice s-au dezvoltat datorita perfectionarii aparaturii de laborator. Desi in prezent principalele directii de cercetare sunt orientate in domeniul perfectionarii aparaturii, nu trebuie sa se traga concluzia ca metodele instrumentale le-au inlocuit pe cele chimice. In practica, procedeele chimice constituie adeseori o parte integranta intr-o metoda instrumentala. Astfel, in orice analiza exista etape ca: prelevarea probelor, dizolvarea, schimbarea starii de oxidare, indepartarea excesului de reactiv, ajustarea pH-ului, adaugarea de agenti de complexare, precipitarea, concentrarea, indepartarea impuritatilor etc. Unele din aceste operatii implica utilizarea metodelor de separare. Cele mai bune rezultate ale unei metode analitice se obtin folosind cuplarea tehnicilor chimice cu cele instrumentale. Fiecare metoda de analiza constituie un ansamblu de operatii ce necesita o anumita tehnica de lucru si aparatura, diferiti reactivi analitici si unele substante auxiliare asupra carora pot interveni o serie de erori care influenteaza exactitatea si precizia rezultatelor.
Metodele analitice (chimice, instrumentale) se bazeaza pe metode stoechiometrice sau pe metode nestoechiometrice.
In metodele stoechiometrice, constituentul ce trebuie analizat cantitativ intra in reactie cu reactivul analitic, conform unei ecuatii bine definite intre reactanti si produsi. Masurand cantitatea oricarui produs de reactie sau cantitatea de reactiv utilizat se poate calcula cantitatea constituentului de determinat, aplicand legea de combinare a proportiilor definite. In metodele nestoechiometrice, nu pot fi scrise reactii exacte, bine definite. In majoritatea cazurilor, metodele nestoechiometrice se bazeaza pe masurarea proprietatilor fizice care se schimba proportional cu concentratia componentului de determinat. Intrucat multe dintre aceste proprietati sunt usor masurabile, adesea cu foarte mare precizie, devine necesara numai etalonarea procedeului. Etalonarea defineste in mod empiric, relatia dintre concentratia constituentului de determinat si marimea proprietatii fizice, in anumite conditii experimentale.
In general, metodele chimice realizate in solutii, cum sunt cele gravimetrice sau volumetrice si cateva tipuri de procedee de separare, sunt stoechiometrice, in timp ce majoritatea metodelor instrumentale, incluzand procedeele optice si electrice, sunt nestoechiometrice. Indiferent de faptul ca prezinta relatii nestoechiometrice, dupa etalonare, metodele instrumentale ofera multe avantaje cum sunt: viteza mare de executie, selectivitate, sensibilitate si precizie.
In cazul unor metode chimice nestoechiometrice, este necesara, pe langa o etalonare si asigurarea reproductibilitatii. In general, nu este indicat sa se foloseasca metode chimice nestoechiometrice. Se recomanda o metoda nestoechiometrica instrumentala, sau o metoda stoechiometrica, chiar daca precizia sau sensibilitatea este mai redusa.
In tabelul 1.2 se prezinta unele metode tipice de masurare, stoechiometrice si nestoechiometrice.
Tabelul 1.2 Metode analitice stoechiometrice (S) si nestoechiometrice (N)
GRAVIMETRICE. Izolarea unui precipitat care poate fi cantarit
Agenti de precipitare anorganici (S)
Agenti de precipitare organici (S)
Electrodepunere (S)
TITRIMETRICE. Reactia substantei analizate cu solutia standard
Titrari acid-baza (S)
Titrari de precipitare (S)
Titrari complexometrice (S)
Titrari de oxidare-reducere (S)
OPTICE
A. Absorbtie de energie. Atenuarea radiatiei de catre o proba absorbanta
Colorimetrie (N)
Spectrofotometrie in ultraviolet (N)
Spectrofotometrie in infrarosu (N)
Masurarea reflectantei luminii reflectate de catre proba (N)
B. Emisia de energie. Aplicarea unei energii suplimentare (caldura, lumina etc) si observarea ulterioara a emisiei fotonice
Emisia in arc, excitarea in arc electric (N)
Flamfotometria, excitarea in flacara (N)
Fluorescenta, excitarea prin fotoni, observarea fotonilor emisi (N)
Fosforescenta. Excitarea prin fotoni, observarea emisiei intarziate de fotoni (N)
Chemiluminiscenta. Observarea fotonilor eliberati printr-o reactie chimica (N)
DE REZONANTA. Interactiunea undelor radio cu nucleele atomice intr-un camp magnetic puternic (N)
DE ANALIZA A GAZELOR
Volumetrice. Masurarea volumului unui gaz (S)
Manometrice. Masurarea presiunii gazului (S)
ELECTRICE
Potentiometria. Masurarea potentialului unei celule electrochimice (N)
Conductivitatea. Masurarea rezistentei unei solutii (N)
Coulombmetria. Masurarea cantitatii de electricitate necesara pentru a provoca o reactie pe baze cantitative (S)
Polarografia. Caracteristicile de intensitate – potential ale unei solutii continand ioni care pot fi oxidati sau redusi (N)
TERMICE. Modificarea unei proprietati fizice in functie de temperatura (N)
ALTE METODE
Fluorescenta de raze X. Excitarea probei cu raze X; observarea razelor X emise (N)
Spectrometria de masa. Masurarea numarului de ioni de mase date (N)
Refractometria. Masurarea indicelui de refractie a probei (N)
Polarimetria. Masurarea rotatiei luminii printr-o solutie (N)
Dispersia optica rotativa. Masurarea rotatiei luminii printr-o proba, ca functie de lungimea de unda (N)
Fotometria prin dispersia luminii. Masurarea cantitatii de lumina dispersata printr-o suspensie (N)
Analize de activare (radioactive). formarea de materiale radioactive artificiale; numararea particulelor (N)
In tabelul 1.3 se prezinta unitatile de baza, importante in chimia analitica, in conformitate cu Sistemul International de Unitati (in unitati SI), precum si prefixele aprobate.
Tabelul 1.3 Unitati de masura SI:
|
Marime |
Unitate si simbol |
|
Lungime |
metru, m |
|
Masa |
kilogram, kg |
|
Timp |
secunda, s |
|
Intensitatea curentului electric |
amper, A |
|
Temperatura termodinamica |
Kelvin, K |
|
Cantitatea de substanta |
mol, mol |
|
Intensitatea luminoasa |
candela, cd |
|
Presiune |
pascal, Pa |
Tabelul 1.4.Prefixe aprobate in SI:
|
tera, T |
deca, da |
nano, n |
|||
|
giga, G |
deci, d |
pico, p |
|||
|
mega, M |
centi, c |
fento, f |
|||
|
kilo, k |
mili, m |
atto, a |
|||
|
hecto |
micro, m |
|
|||
Cel mai bun criteriu pentru orice analiza este de a alege metode sau procedeul instrumental sau chimic cel mai adecvat in cazul dat. De aceea trebuie cunoscute avantajele si dezavantajele fiecarei metode de analiza. Principalele avantaje ale metodelor chimice si instrumentale sunt prezentate in continuare.
Avantajele metodelor instrumentale :
determinarea este foarte rapida;
pot fi utilizate probe mici;
pot fi cercetate probe complexe;
prezinta o sensibilitate ridicata;
dau rezultate sigure.
Avantajele metodelor chimice :
procedeele sunt simple si precise;
in general, metodele se bazeaza pe masuratori
echipamentul necesar este simplu si nu este scump.
Atat metodele chimice, cat si cele instrumentale, prezinta si o serie de limitari dintre care amintim:
Dezavantajele metodelor chimice:
uneori lipseste specificitatea;
realizarea unei analize se efectueaza, de obicei, intr-un timp destul de lung;
precizia scade odata cu micsorarea cantitatilor de proba;
sunt lipsite de flexibilitate;
sunt poluante pentru mediul inconjurator.
Dezavantajele metodelor instrumentale :
este necesara o etalonare initiala sau continua a aparatului;
sensibilitatea si precizia depind de aparatura sau de metoda chimica utilizata pentru etalonare
precizia finala se afla adesea in domeniul
costul initial si pentru intretinerea echipamentului este ridicat;
intervalul de concentratie este limitat;
in mod obisnuit, necesita un spatiu adecvat si destul de mare;
implica un personal cu pregatire speciala.
O comparatie critica asupra metodelor chimice si asupra metodelor instrumentale, in cazul rezolvarii aceleiasi probleme, poate fi de mare ajutor. In plus trebuie retinut faptul ca, aceste doua tipuri de metode se pot completa una pe alta, pentru a rezulta astfel mijloace superioare in rezolvarea diferitelor probleme chimice.
I.5. Alegerea metodelor analitice
O importanta sarcina ce revine chimistului analist practician este de a alege metoda analitica care sa conduca la cea mai buna rezolvare a scopului urmarit. Odata definit obiectivul analizei, alegerea metodei se face tinand seama de o serie de factori dintre care amintim: masa luata in analiza si domeniul de concentratie, precizia si sensibilitatea ceruta, selectivitatea si rapiditatea. In functie de masa de substanta luata in analiza, metodele analitice s-au perfectionat treptat, tinzand spre utilizarea unor cantitati cat mai mici (tabelul 1.5 si figura 1.1).
Tabelul 1.5 Clasificarea metodelor analitice in functie de masa probei
|
ANALIZA CHIMICA |
Calitatea de |
Volumul solutiei de analizat |
|||
|
Substanta luata in analiza |
Component identificat sau determinat |
||||
|
A O |
Calitativa Semicanti-tativa Cantitativa |
Macro |
>0,1 g (a) |
>0,0001g(10-4) |
>5 cm3 |
|
Semimicro |
0,1-0,01g (b) |
10-5 g |
0,5-5 cm3 |
||
|
Micro |
0,01-0,001g (c) |
10-6 g |
0,05-0,5 cm3 |
||
|
Elementara Functionala Structurala |
Ultramicro |
<0,001 g |
<10-6g |
<0,05 cm3 |
|
|
(d) |
10-6 – 10-9g | ||||
|
(e) |
10-9 – 10-12g | ||||
|
(f) |
10-12g | ||||
Legenda: A – Anorganica; O – Organica; (a) – metoda gramelor sau decigramelor; (b) – metoda centigramelor; (c) - metoda miligramelor; (d) – metoda microgramelor (ultramicroanaliza propriu-zisa); (e) – metoda nanaogramelor (submicroanaliza); (f) – metoda picogramelor (subultramicroanaliza); 1 microgram (mg) = 10-6g; 1 nanogram = 10-9g; 1 picogram = 10-12g.
Figura 1.1. Scara metodelor analitice
![]()
![]()
![]()
![]()
![]() 1 10-1 10-2 10-3 10-4 vol. minim sol.
1 10-1 10-2 10-3 10-4 vol. minim sol.
![]() (cm3)
(cm3)
![]()
![]()
![]()
![]()
![]()
![]()
![]() masa probei
masa probei
![]()
![]()
![]() 1 10-1 10-2 10-3 10-4 10-5 (g )
1 10-1 10-2 10-3 10-4 10-5 (g )
![]()
![]()
![]()
![]()
![]()
![]()
![]() macro semimicro micro submicro (ultramicro)
macro semimicro micro submicro (ultramicro)
Fiecarui domeniu de analiza chimica (macro, semimicro, micro si ultramicroanaliza) ii sunt caracteristice o serie de tehnici sau procedee de lucru, precum si o aparatura adecvata. La scara macro, reactiile se efectueaza in eprubete obisnuite sau pahare, precipitatele se separa prin filtrare. Odata cu micsorarea masei probei, aparatura si operatiile devin mai speciale. Astfel, la scara micro reactiile se efectueaza pe hartie de filtru, pe placa microscopica sau in eprubeta de centrifuga, iar precipitatele se separa prin centrifugare. La scara submicro operatiile devin cu totul speciale, reactiile se efectueaza in tuburi capilare, observarea facandu-se la microscop. La scara semimicro, in general se folosesc ustensilele utilizate la scara macro avand insa dimensiuni mai reduse. Pe langa masa probei disponibile o alta marime caracteristica unei metode de analiza este masa relativa a componentilor din proba. Prescurtarile pentru proportiile mai uzuale sunt redate in tabelul 1.6.
Tabel 1.6. Indicarea cantitatii relative a componentilor din proba
|
Raportul |
Notare |
Observatii |
|
|
in valoare absoluta |
in % |
||
|
parti pe mie |
|||
|
ppm |
parti pe milion |
||
|
ppb |
parti pe bilion |
||
Componentii prezenti in proportie mai mica decat 10-2 % se numesc microcomponenti sau urme (fig. 1.2).
Figura 1.2. Cantitatea relativa a componentilor din proba
10 1 10-1 10-2 10-3 10-4
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() %
%
component
![]()
principal secundar
![]()
![]()
![]() macro micro
(urme)
macro micro
(urme)
![]()
![]()
Cantitatile mai mari de 1% se numesc componenti principali, iar cei prezenti intre 0,01% - 1% se numesc componenti secundari. Componentii principali si cei secundari se numesc macrocomponenti.
Cantitatea relativa a unui component nu este un indiciu pentru importanta acestui component din proba.
Tehnica moderna a recunoscut importanta deosebita a unor componenti aflati in proportii extrem de mici, solicitand elaborarea de metode analitice din ce in ce mai sensibile. Chiar de la primele incercari de separare, de identificare sau de determinare s-a simtit nevoia perfectionarii metodelor analitice , in directia scurtarii timpului de executie si a micsorarii masei probei luate in analiza. Aceste tendinte au facut ca, in ultimii ani, sa se prefere metodele micro sau ultramicro-analitice, care evita consumul mare de substanta de analizat, de reactivi analitici si de timp. In prezent, atentia se indreapta spre metodele rapide si sensibile care raspund si unor tendinte de automatizare. Azi analiza calitativa si cantitativa a unor componenti de ordinul ppm si chiar ppb este o problema curenta.
In general, metodele chimice se preteaza cel mai bine la determinarea macrocantitatilor iar metodele instrumentale pentru micro cantitati (urme). Folosirea celei mai bune metode in functie de masa probei presupune experienta si o buna cunoastere a metodelor analitice.
I.6. Reactii analitice
Reactiile chimice care dau informatii de natura analitica asupra componentilor probelor de analizat se numesc reactii analitice iar substantele chimice care provoaca aceste reactii se numesc reactivi analitici. Din multitudinea de reactii chimice cunoscute azi, numai o mica parte se pot folosi in analiza chimica.
De fapt nici n-ar fi nevoie decat de o singura reactie de recunoastere (detectie) pentru fiecare specie chimica (cu toate ca si atunci ar trebui sa existe foarte multe reactii de recunoastere) daca s-ar putea realiza un caz ideal, in care printr-o singura reactie s-ar detecta o anumita specie chimica in prezenta oricaror altor specii prezente. Reactiile analitice permit identificarea, separarea sau determinarea componentilor substantelor de analizat.
Reactiile analitice fiind principalele modalitati de identificare si dozare a speciilor chimice dintr-un amestec, trebuie sa indeplineasca o serie de conditii dintre care retinem:
sa fie usor de efectuat;
sa genereze modificari usor perceptibile;
sa fie cat mai complete si instantanee;
sa fie cat mai sensibile si caracteristice pentru o anumita substanta sau pentru un grup restrans de componenti;
sa fie stoechiometrici pentru a exista o baza de calcul;
sa li se cunoasca mecanismul si conditiile de realizare etc.
Cu alte cuvinte o reactie analitica trebuie sa duca la formarea unui compus cu o proprietate care sa fie functie de concentratie: P = f(c), unde P este proprietatea analitica a compusului rezultat, iar c este concentratia compusului cercetat. Reactiile analitice se reprezinta cu ajutorul ecuatiilor chimice.
Deoarece contactul intre particulele solide, chiar si in stare foarte fin divizata, este redus si ca atare reactiile sunt lente, in majoritatea cazurilor reactiile analitice se efectueaza in solutii, lasand sa reactioneze solutia probei cu solutia unui reactiv. In primul caz vorbim de reactii pe cale uscata, iar in cel de-al doilea, de reactii pe cale umeda. Denumirea “umeda” sugereaza faptul ca de obicei se lucreaza cu solutii apoase dar in unele cazuri este avantajos ca reactiile sa se efectueze in mediu neapos, folosind un solvent oarecare, diferit de apa, de exemplu alcool, amoniac lichid, dioxan, bioxid de carbon lichid etc. Uneori solventul neapos il folosim numai pentru extragerea produsilor de reactie formati in mediu apos, pentru a le usura determinarea. Reactiile analitice se reprezinta cu ajutorul ecuatiilor chimice. Scopul reactiilor folosite in analiza calitativa este sa separe unul sau mai multi componenti prin reactii de separare si sa stabileasca prezenta sau absenta unui component prin reactii de identificare sau de recunoastere.
Reactiile de identificare sunt acele reactii prin care un component dintr-o proba de analizat poate fi identificat sigur. Reactiile de identificare trebuie sa fie in primul rand caracteristice si trebuie sa fie insotite de un efect usor de observat, cum ar fi: formarea unui precipitat, uneori intens colorat, dizolvarea unui precipitat, formarea unei solutii intens colorate, schimbare de culoare, degajarea unui gaz colorat sau intens mirositor etc.
Pentru reactiile de separare, caracteristica este ca ele sa fie cat mai complete, iar pentru cele de identificare sa fie specifice si cat mai sensibile.
In cazul reactiilor de identificare este important ca reactia sa decurga rapid, culoarea sa fie cat mai intensa, precipitatul sa se formeze in granule mari usor de observat etc.
In practica analitica, cele mai utilizate sunt cele care formeaza combinatii greu solubile (precipitate cristaline, amorfe sau gelatinoase si de preferat colorate) sau duc la formarea de combinatii complexe stabile si intens colorate.
Reactiile pe cale uscata se produc cand substanta de analizat si reactivul adecvat in stare solida sunt incalzite pana are loc reactia. Daca incalzirea se realizeaza direct in flacara poate apare o coloratie specifica generata de anumite metale in stare ionica (sarurile de sodiu coloreaza flacara in galben, cele de potasiu in violet, cele de strontiu in rosu caramiziu etc). Reactii pe cale uscata sunt si reactiile pirochimice cand prin incalzirea substantei de analizat cu reactivul specific se formeaza perle colorate (cand se foloseste boraxul, Na2B4O7 10 H2O) sau saruri microcristaloscopice (se foloseste fosfatul acid de sodiu si de amoniu, NaNH4HPO4 4H2O).
Tot in randul reactiilor pirochimice sunt incluse si topirea substantei necunoscute cu diferiti fondanti (Na2CO3 + K2CO3, Na2CO3 + KNO3, Na2CO3, KHSO4 etc) cand se obtin topituri solubile ce pot fi analizate apoi pe cale umeda. Reactiile analitice realizate pe cale uscata joaca un rol secundar in chimia analitica, fiind folosite ca teste preliminare si pentru dizolvarea unor substante greu solubile. Reactiile analitice produse pe cale umeda (in solutii) sunt folosite frecvent in chimia analitica.
Aplicarea succesiva a diferitelor reactii analitice in vederea separarii, identificarii sau determinarii unor grupe mai mari sau mai mici de compusi, definesc un mers sistematic sau o schema de analiza. Intelegerea reactiilor analitice este fundamerntala pentru a putea dezvolta si aplica metodele moderne de analiza. Criteriile de clasificare a reactiilor analitice sunt numeroase si depind de natura proceselor ce intervin, de scopul analitic urmarit, de tehnicile utilizate, de caracterul sau mediul de reactie etc. Astfel se disting:
reactii reversibile si reactii ireversibile;
reactii in faza omogena si reactii in faza eterogena;
reactii instantanee si reactii lente;
reactii pe cale umeda si reactii pe cale uscata;
reactii cu schimb de electroni, reactii cu schimb de protoni;
reactii de precipitare;
reactii cu schimb de ioni sau molecule;
reactii in eprubeta, pe lamela de microscop, pe placuta cu excavatii, pe sticla de ceas, pe hartia de filtru, in creuzet, in tub inchis, pe carbune, pe betisor de magnezita sau pe fir de platina etc.
reactii cu reactivi anorganici si reactii cu reactivi organici;
reactii de precipitare, reactii de neutralizare, reactii redox, reactii de culoare, reactii cu formare de combinatii complexe, reactii cu formare de substante volatile, reactii de mascare sau de demascare, reactii de adsorbtie, reactii cristaloscopice, reactii de fluorescenta, reactii catalitice, reactii enzimatice, reactii radiochimice etc;
reactii in mediu acid, reactii in mediu neutru sau reactii in mediu bazic.
Pentru usurinta studierii, reactiile chimice de interes analitic sunt impartite dupa natura lor in patru categorii:
reactii acid-baza;
reactii de precipitare;
reactii redox;
reactii de complexare.
Reactiile acid-baza (reactii cu schimb de protoni) numite si reactii protolitice a caror schema generala poate fi reprezentata astfel:
Acid1 + Baza2 Baza1 + Acid2,
Reactiile cu schimb de protoni cuprind reactiile de neutralizare, hidroliza si deplasare.
Reactiile de neutralizare sunt reactii protolitice in urma carora dintr-un acid si o baza se formeaza sare si apa:
HA + BOH BA + H2O
Reactiile de hidroliza reprezinta interactiile chimice care au loc intre ionii apei si ionii sarurilor si pot fi redate, in mod foarte general prin ecuatia:
Sare + Apa Acid + Baza
Hidroliza sarurilor este posibila numai atunci cand, in urma interactiei ionilor sarii cu ionii proveniti din disocierea apei, se obtine cel putin un electrolit slab sau un electrolit greu solubil.
Reactiile de deplasare sunt reactiile de tipul:
HA + BA’ BA + HA’
in care acidul tare HA deplaseaza pe altul mai slab HA’din sarurile lui sau de aceeasi tarie , dar de volatilitate diferita. Aceeasi afirmatie este valabila si in cazul bazelor. Rectiile cu transfer de protoni sunt folosite adesea in analiza cantitativa titrimetrica si in cazul metodelor electrochimice de analiza (potentiometrie, conductometrie).
Reactiile cu formare de precipitate sunt de tipul:
BA + CD CA + BD
in urma carora iau nastere substante greu solubile (CA). Aceste reactii au loc in sistem eterogen.
Scriind ionic se obtine:
(B+ + A-) + (C+ + D-) CA + (B+ + D-)
sau dupa reducerea termenilor asemenea:
C+ + A- CA
care rezuma fondul unei reactii de precipitare.
Reactiile de precipitare sunt folosite pe scara larga in metodele de separare si de identificare, in analiza gravimetrica, in titrimetria bazata pe reactii de precipitare si in metodele electrochimice de analiza.
Totdeauna, la reactiile de precipitare, numarul particulelor rezultate este mai mic decat numarul particulelor care au intrat in reactie.
Reactii cu formare de combinatii complexe de tipul:
Mn+ + xCA Cx-n [MAx] , x > n
se utilizeaza in chimia analitica atat pentru identificarea cat si pentru dozarea speciilor chimice ionice, datorita proprietatilor speciale ale combinatiilor complexe. Deoarece astfel de combinatii formeaza in special ionii metalelor tranzitionale, care in majoritate poseda electroni d sau f cu spin necompensat, ele vor fi colorate specific ceea ce permite recunoasterea lor cu usurinta. Datorita structurii lor electronice, spectrele de absorbtie sunt specifice, ceea ce permite utilizarea metodelor optice pentru recunoasterea si dozarea lor. In functie de proprietatile in solutie ale combinatiei complexe Cx-n[M(A)x] se pot folosi si metodele electrochimice de identificare si dozare. Reactiile chimice cu formare de combinatii complexe deschid o larga perspectiva folosirii metodelor instrumentale (optice si electrochimice etc) atat la dozare dar si la caracterizarea combinatiilor formate.
Reactiile cu schimb de electroni (reactii redox) sunt caracterizate prin schimbul de electroni care determina oxidarea, respectiv reducerea partenerilor de reactie. Ele pot fi reprezentate schematic:
pReducator1 + mOxidant2 = pOxidant1 + mReducator2
Datorita schimbului de electroni, generator de potential implicat in reactiile redox, in urmarirea lor pot fi folosite metodele electrochimice de tip potentiometric. O varianta a reactiilor redox, frecvent intalnita in chimia analitica, o reprezinta reactiile de autooxidare (dismutatie) in care aceeasi specie chimica se oxideaza si se reduce:
A + me- Am-
A An+ + ne-
deci,
(m+n)A nAm- + mAn+
Tipurile de reactii enumerate pot fi clasificate si dupa mecanismul implicat in desfasurarea lor. Astfel, in chimia analitica se cunosc:
reactii catalitice care isi modifica viteza de reactie ca urmare a prezentei unei substante care nu se consuma in reactie, numita catalizator. Ele pot avea loc in sistem omogen sau eterogen. Un exemplu de reactie catalizata il reprezinta oxidarea Mn2+ la Mn7+ in prezenta AgNO3 drept catalizator:
2MnSO4 + 5(NH4)2S2O8 + 8H2O 2HMnO4 + 5(NH4)2SO4 + 7H2SO4
reactii induse, in care echilibrul sistemului poate fi deplasat in directia favorabila de alte reactii. De exemplu, reactia dintre acidul oxalic si permanganatul de potasiu care decurge astfel:
5H2C2O4 + 2KMnO4 + 3H2SO4 10CO2 + 8H2O + 2MnSO4 + K2SO4
La inceput si la rece aceasta reactie are loc foarte lent dar dupa ce se mai adauga permanganat de potasiu reactia se accelereaza datorita faptului ca devine indusa de reactia:
2KMnO4 + 8MnSO4 + 7H2O 5Mn2O3 + K2SO4 + 7H2SO4
Adunand ultima reactie cu cea de dinaintea ei amplificata cu 4 pentru a consuma toti ionii Mn2+, se obtine ecuatia:
20H2C2O4 + 10KMnO4 + 5H2SO4 5Mn2O3 + 5K2SO4 + 25H2O + 40CO2
care dupa simplificare cu 5 rezulta:
4H2C2O4 + 2KMnO4 + H2SO4 Mn2O3 + K2SO4 + 5H2O + 8CO2
Insa Mn2O3 in mediu de acid sulfuric si acid oxalic reactioneaza formand sulfat de mangan conform reactiei:
Mn2O3 + 2H2SO4 + H2C2O4 2MnSO4 + 2CO2 + 3H2O
reactii paralele (sau colaterale) in care dintr-o substanta rezulta simultan alte substante. Schema generala ar fi:
![]() B + C
B + C
![]() A
A
D + E
care poate fi exemplificata cu descompunerea KClO3 la temperaturi moderate:
![]() 2KCl
+ 3O2
2KCl
+ 3O2
![]() 6KClO3
6KClO3
3KClO4 + KCl
Mai putin folosite in chimia analitica sunt:
reactiile consecutive, in care sistemul evolueaza consecutiv de la o stare la alta;
● reactiile in lant care sunt reactii activate de lumina sau caldura, ce decurg inlantuit, pana cand se intrerupe lantul de reactie;
reactiile radiochimice in care se folosesc atomii marcati pentru dozarea unor specii chimice.
O clasificare generala a reactiilor chimice folosite in chimia analitica ar putea fi facuta folosind criteriul echilibrului. Astfel, vom intalni reactii reversibile si ireversibile.
O alta clasificare care ar include toate tipurile expuse, cuprinde doua categorii mari: reactii de sinteza sau combinare si reactii de descompunere.
Bineinteles ca s-ar mai putea folosi si alte criterii. Folosind insa aceste impartiri se omit aspectele esentiale evidentiate de clasificarea reactiilor dupa natura lor, care pare a fi o clasificare mai judicioasa.
I.7. Reactivi analitici
Una din principalele conditii de realizare a unei reactii analitice o reprezinta prezenta reactivului. Reactivul este o specie chimica ce poate reactiona cu un component anumit al probei de analizat, in conditii experimentale bine stabilite.
Din aceasta definitie se vede ca pentru a putea detecta un component oarecare dintr-o proba de analizat data este necesar sa se gaseasca un reactiv cu care componentul de identificat sa poata reactiona si reactionand sa satisfaca in primul rand conditiile de exactitate si precizie. Reactivii pot fi de grupa, selectivi si specifici. Reactivii de grupa sunt acei reactivi care reactioneaza in mod analog cu un grup de ioni. Dintre acestia amintim: acidul clorhidric, hidrogenul sulfurat, sulfura de amoniu si carbonatul de amoniu. Reactivii de grupa precipita unii ioni la anumite valori ale pH-ului. Reactivii selectivi dau reactii asemanatoare cu un numar limitat de ioni. Dintre reactivii selectivi se pot enumera: hidroxidul de sodiu, solutia de amoniac, carbonatul de sodiu, fosfatul disodic etc. Reactivii specifici dau o reactie caracteristica pentru un anumit ion, de exemplu, dimetil-glioxima este reactiv specific pentru Ni2+, sulfocianura de amoniu pentru Fe3+ etc.
Reactivii analitici trebuie sa indeplineasca o serie de cerinte dintre care mentionam urmatoarele:
sa conduca la reactii analitice aproape totale sau practic totale;
sa formeze compusi greu solubili, putin disociati sau colorati;
sa nu se descompuna in timp;
sa fie specifici sau selectivi;
sa permita decelarea unor cantitati cat mai mici din componentul cautat, adica sa fie sensibili etc.
Reactivii, dupa imprejurari, indeplinesc una sau mai multe dintre functiile urmatoare:
servesc drept parteneri in reactia de recunoastere a speciilor necunoscute. In aceasta calitate se cere ca reactivul sa asigure o recunoastere rapida si certa, fiind sensibil si specific;
realizeaza mediul optim pentru reactia de recunoastere prin fixarea pH-ului (amestec tampon), prin asigurarea cantitatii necesare de sare neutra (de exemplu, pentru prevenirea peptizarii) etc;
asigura conditii pentru separarea unor componenti;
pot avea rolul de indicator, semnalizand variatia in concentratia unor ioni, respectiv a marimilor determinate de acestia.
Din aceasta categorie de reactivi in chimia analitica cel mai des se utilizeaza indicatorii de pH, redox si metalocromici.
In chimia analitica exista mai multe criterii de clasificare a reactivilor.
Unul din cele mai judicioase criterii il reprezinta clasificarea reactivilor in functie de reactiile analitice la care participa, combinate cu criteriul provenientei acestora.
Astfel exista reactivi de neutralizare, reactivi de complexare, reactivi redox, reactivi de precipitare, reactivi de culoare etc, care pot fi anorganici sau organici.
Reactivii de precipitare formeaza cu specia cautata combinatii greu solubile, fiind utilizati atat la identificari, cat si la separari si dozari. Exemplele de reactivi de precipitare anorganici sau organici sunt numeroase. Dintre reactivii de precipitare foarte importanti sunt reactivii de grupa (HCl, H2S, (NH4)2CO3 ) care reactioneaza in mod analog cu o grupa de elemente.
Indicatorii de pH sau de neutralizare cu ajutorul carora se pune in evidenta modificarea pH-ului prin modificarea unei proprietati ce este dependenta de pH. Ei servesc la determinarea punctului de echivalenta in titrimetria de neutralizare.
Indicatorii redox sunt reactivii folositi pentru determinarea punctului de echivalenta in titrarile redox. Modificarea proprietatilor indicatorilor redox se realizeaza intr-o reactie reversibila.
Reactivii de complexare sunt substante care permit formarea de combinatii complexe cu specia chimica ce trebuie dozata. In urma reactiilor de complexare se formeaza, fie precipitate greu solubile, fie combinatii solubile intens colorate, fie specii solubile incolore foarte stabile ce servesc pentru mascarea unor ioni.
Reactivii anorganici au o extindere limitata, numarul lor fiind relativ mic. In schimb reactivii organici sunt foarte raspanditi si in ontinua extindere, deoarece pot da cu ionii anorganici combinatii greu solubile sau combinatii complexe foarte stabile, deseori intens colorate. Masa moleculara mare a produsului de reactie asigura reactii de identificare si determinare sensibile. Pe de alta parte reactivitatea fiind legata de structura reactivului, aceasta determina si o specificitate ridicata. Din aceste motive reactivii organici sunt larg utilizati in reactiile analitice, cercetarea fiind indreptata spre sinteza unor combinatii noi care sa asigure o sensibilitate si specificitate din ce in ce mai mare.
Reactivii organici folositi in chimia analitica pot fi impartiti in trei categorii importante:
► reactivii organici care formeaza saruri greu solubile cu speciile ionice ce trebuie dozate. Dintre acestia mai importanti sunt acizii carbonici, acizii sulfonici, acizii organici etc. Drept exemplu amintim: reactia acidului oxalic sau oxalatului de amoniu cu ionuil Ca2+, fenilarsenic cu ionii de Zr4+, reactia radizonatului de sodiu cu ioni de Ba2+, reactia acidului antranilic cu ionii de Cu2+, Zn2+, Co2+, reactia acidului benzen sulfonic cu ionii de Fe3+, Zr4+etc.
► reactivi organici care dau combinatii greu solubile de adsorbtie cu unii hidroxizi metalici, numite lacuri, cum ar fi alizarina S (alizarin-sulfonatul de sodiu) pentru Al3+
► reactivi organici care dau combinatii complexe cu ionii metalici ai speciilor chimice ce trebuie dozate. Acesti complecsi sunt de doua categorii: complecsi propriu-zisi si complecsi interni. Daca ligandul organic este monodentat sau ocupa un singur loc de coordinare, se formeaza complecsi neciclici, ca de exemplu:
Me2+(SCN)2 + 2Py [MePy2](SCN)2
Me2+ poate fi cupru, cadmiu, zinc (cobaltul si nichelul, ca si cadmiul la rece dau complecsi de patru molecule de piridina).
Daca ligandul este polidentat, o singura molecula poate ocupa mai multe locuri de coordinare, formand complecsi interni (ciclici, chelati) caracterizati prin prezenta unor heterocicli interni. Aparitia ciclurilor stabilizeaza molecula, dand nastere fie la complecsi solubili deosebit de stabili, fie la precipitate cu solubilitate foarte redusa. Un exemplu de complex intern este precipitatul rosu matasos format de dimetil glioxima (reactivul Ciugaev, primul reactiv organic introdus in analiza chimica anorganica) cu ionul de Ni2+ :
O-----------H-O
![]()
![]()
![]()
![]()
![]() H3C-C=N-OH H3C-C=N N= C-CH3
H3C-C=N-OH H3C-C=N N= C-CH3
![]()
![]()
![]() + Ni2+ Ni +
2H+
+ Ni2+ Ni +
2H+
![]() H3C-C=N-OH H3C-C=N N= C-CH3
H3C-C=N-OH H3C-C=N N= C-CH3
![]()
![]()
O-H---------O
Din aceasta categorie de reactivi, deosebit de importanta este sarea disodica a acidului etilendiaminotetraacetic (EDTA), denumita si complexon III.
In chimia analitica calitativa complexonul III se utilizeaza in primul rand ca agent de mascare. In prezenta complexonului III ionul Ca2+ poate fi identificat in prezenta ionilor metalelor grele, acestia fiind mascati sub forma de complexonati foarte stabili, iar KI precipita numai cu ionul Ag+, restul ionilor metalici ramanand in solutie sub forma de complexonati.
In afara de aceste reactii, reactivii organici pot participa la multe alte tipuri de reactii (ca de exemplu la reactii catalitice) si contin grupari analitice functionale, al caror numar este in continua crestere.
Reactivii analitici, prin gruparile analitice functionale pe care le contin, prezinta anumite regularitati in reactiile cu cationii metalici sau cu anionii. Aceste regularitati au la baza structura electronica a ionilor, razele ionilor, potentialele ionice etc, adica au la baza acei parametri ai ionilor care sunt decisi de periodicitatea proprietatilor elementelor din tabelul periodic.
Regula omologilor analitici scoate in evidenta faptul ca unii ioni cu aceeasi sarcina dau reactii cu acelasi reactiv. De exemplu, Cu+ si Te+ au reactii asemanatoare cu mercaptobenzotiazolul, la fel cum SO42-, SeO42- si TeO42- sau C6H5-SO2H si C6H5-SeO2H prezinta multe reactii asemanatoare.
Regula orizontalei arata faptul ca ionii unor elemente aflate in aceeasi perioada prezinta reactii asemanatoare cu aceeasi reactivi. De exemplu, Fe2+, Co2+ si Ni2+ dau reactii uneori practic identice, cu multi reactivi (S2-, 1,10-fenantrolina etc); lantanoidele cu reactii atat de asemanatoare cu multi reactivi, incat insasi separarea lor, intre ele, prezinta dificultati.
Regula verticalei evidentiaza similitudinea unor reactii ale unor ioni ai elementelor aflate in aceeasi grupa (principala sau secundara si intensificarea unor proprietati odata cu cresterea numarului de ordine al elementelor.
De exemplu, PO43- si AsO43- reactioneaza practic identic cu MoO42-, la fel cum Zr4+ si Hf4+ au reactii identice cu cupferona, C6H5-AsO3H , C6H5-PO3H etc. Odata cu cresterea numarului de ordine in sistemul periodic, culoarea compusilor formati se intensifica si solubilitatea scade asa cum se poate observa in seria: ZnS (alba, Ps = 2,5 10-22), CdS (galbena, Ps = 7,9 10-27) si HgS (neagra, Ps = 1,6 10-52) sau seria CaSO4 (alb, Ps = 2,4 10-5), SrSO4 (alb, Ps = 3,2 10-7 foarte greu solubil) si BaSO4 (galben, Ps = 1,1 10-10 practic insolubil).
Exista o similitudine si in ceea ce priveste reactiile cu formare de complecsi, ca de exemplu reactiile Ti4+, Zn4+ si Hf4+ cu F- cand se formeaza TiF62-, ZnF62- si HfF62- .
Pe baza acestor reguli se pot afla conditiile in care sa se poata identifica sau determina unii ioni cu reactivii cunoscuti. La analiza unor probe cu mai multi componenti trebuie sa se caute reactivii cei mai potriviti pentru separarea si identificarea tuturor componentilor, dintre care unii se afla in proportie foarte mica (urme). Marirea exactitatii si preciziei metodelor de analiza a impus si impune cautarea unor noi reactivi cu performante superioare care sa permita identificarea tuturor componentilor probelor de analizat, inclusiv a acelora aflati in cantitati foarte mici. In acelasi timp realitatea impune analistului cautarea conditiilor experimentale in care cu reactivii si aparatura de laborator disponibila sa poata stabili corect, economic si in timp util compozitia probelor de analizat.
I.8 Specificitatea si selectivitatea reactiilor analitice
O reactie se numeste specifica cand este caracteristica pentru un ion dat permitand identificarea lui in prezenta unui amestec de alti ioni. Regretabil este faptul ca numarul reactiilor specifice este foarte mic. Daca la amestecul de K+, NH4+, Ba2+, Zn2+, As3+, Ag+, se adauga acid clorhidric, se produce o reactie specifica intre ionii Ag+ si Cl- precipitand clorura de argint alba, caracteristica ionului Ag+. Daca se adauga acelasi acid la un alt amestec format din Na+, K+, Mg2+, Ba2+, Hg22+, Ag+, Al3+, vor precipita numai ionii Hg22+ si Ag+ sub forma de cloruri greu solubile. Reactia care s-a produs intre anionul Cl- si acesti doi cationi, se numeste reactie selectiva. Reactiile selective sunt acelea care dau un efect asemanator cu mai multi ioni. In cursul unei analize chimice utilizand conditii adecvate se poate modifica selectivitatea reactiilor.
Gradul de selectivitate al unei reactii este cu atat mai ridicat, cu cat numarul ionilor cu care da acelasi efect este mai mic. Specificitatea nu este altceva decat o selectivitate marita.
Lipsa unor reactii specifice pentru fiecare ion in parte determina un aspect particular al mersului analizei calitative. Acest mers consta in izolarea prealabila a unui numar mai restrans de ioni pe grupe, cu ajutorul unor reactivi de grupa urmata de identificarea ionilor din grupa cu ajutorul unor reactii selective sau chiar specifice.
In urma efectuarii unei analize calitative se va raspunde afirmativ sau negativ in ceea ce priveste prezenta sau absenta unui component oarecare in proba de analizat. Este evident ca afirmatia pozitiva este corecta numai atunci cand componentul detectat este intr-adevar prezent in proba, iar afirmatia negativa este corecta numai atunci cand componentul cautat intr-adevar lipseste din proba. Din acest motiv se observa si se evalueaza in mod corespunzator atat reactiile negative cat si cele pozitive dar nesigure.
In cazul reactiilor negative, este util sa se controleze reactia si reactivii prin efectuarea unei probe standard, care consta in repetarea reactiei cu proba de analizat la care insa in prealabil s-a adaugat ionul de cercetat. In acest caz o eventuala reactie negativa indica, fie ca nu este bun reactivul, fie ca nu s-au asigurat conditiile de reactie (de exemplu pH-ul). Efectuarea probei standard este recomandabila ori de cate ori se folosesc reactivi care nu sunt stabili (se descompun, se oxideaza). Reactiile pozitive ce apar se verifica, controland daca reactia nu cumva se datoreaza unor impuritati din reactivii sau apa distilata folosita. In asemenea cazuri se efectueaza o proba oarba, constand in repetarea reactiei de recunoastere respectiva in conditii absolut identice doar ca in locul probei se ia o cantitate corespunzatoare de apa distilata.
Prima si ce mai importanta cale de marire a exactitatii identificarii este cautarea unor reactivi si reactii caracterizate de parametri specifici si chimici superiori. Intrucat prin fenomenul de interferenta chimica sunt afectate reactiile de identificare, putandu-se ajunge la erori sistematice reflectate prin reactii pozitive, in cazul absentei componentului cautat, si prin reactii negative, in cazul prezentei componentului respectiv, cea de-a doua cale importanta, pentru marirea exactitatii este marirea selectivitatii reactiilor de identificare pana la specificitate.
Cea de-a treia cale importanta de marire a exactitatii identificarii o constituie folosirea unor instrumente, tehnici de lucru si aparate cu performante mai mari. Astfel, la analiza unor amestecuri de ioni ai metalelor alcaline si alcalino-pamantoase, folosirea unui spectroscop, prin care se vad distinct liniile spectrale specifice fiecarui ion, mareste selectivitatea pana la specificitate. Metoda generala de ridicare a specificitatii reactiilor de identificare este aceea care duce la impiedicarea reactiei ionilor straini (interferenti) cu reactivul utilizat pentru identificarea ionul cautat.
Selectivitatea reactiilor depinde de multi factori cum ar fi: compozitia mediului (pH, complexanti, ioni straini), temperatura, modul de efectuare al reactiei etc. Variind acesti parametri, selectivitatea unei reactii se poate mari. Astfel, o reactie nespecifica in anumite conditii poate sa devina specifica, in alte conditii. De exemplu, dimetilglioxima da o reactie specifica cu Ni2+ (precipitat rosu) numai in mediu amoniacal (alcalin), in mediu acid reactia este negativa.
Principalele procedee pentru marirea selectivitatii sunt urmatoarele:
Modificarea potrivita a aciditatii mediului de reactie De exemplu, sulfurile unor cationi din grupa III analitica nu pot precipita in mediu puternic acid. Aceasta metoda se aplica la reactiile de identificare prin formare de precipitate, mai precis a acelor precipitate a caror formare nu poate avea loc decat intr-un anumit interval pH (hidroxizi, fosfati, oxalati, cromati etc). Peste anumite limite ale concentratiei ionilor H3O+, aceste precipitate nu se pot forma. De exemplu, in mediu puternic acid, H2S precipita Cu2+, Hg2+ etc. in prezenta de Fe3+, Fe2+, Co2+, Ni2+ etc. BiPO4 se formeaza in solutie 0,1n de HNO3, in timp ce AlPO4 nu se formeaza in aceste conditii. In exces de NaOH nu se poate forma Al(OH)3, dar se poate forma Fe(OH)3 si asfel, in aceste conditii, NaOH este un reactiv pentru Fe3+.
Complexarea speciilor din amestec prin formarea de complecsi foarte stabili ai speciilor interferente, astfel incat concentratia ionilor disociati din acesti complecsi sa fie sub limita de detectie a acestora cu reactivul folosit. De exemplu, la analiza amestecului Co2+ + Fe3+ cu SCN-, cei doi cationi se deranjeaza reciproc, dar dupa tratare cu NaF, deoarece FeF63- este foarte stabil, Co2+ se poate determina specific cu SCN-, deoarece complexul sau cu F- este mult mai putin stabil decat cel cu SCN-.
Identificarea Cd2+ in prezenta Cu2+ cu H2S in solutie de CN- in care se formeaza complexul [Cu(CN)4] 3- si [Cd(CN)4] 2- se bazeaza tocmai pe stabilitatea diferita a acestor doi complecsi. Complexul [Cu(CN)4] 3- este foarte stabil, in timp ce complexul [Cd(CN)4] 2- este mai putin stabil, si precipita CdS la barbotarea de H2S in solutia celor doi ioni complexati. In acest caz reactia Cd2+ cu S2- este specifica si prin faptul ca CdS se detecteaza prin culoarea sa galbena tipica.
Alegerea judicioasa a starii de valenta De exemplu, numai ionul Fe3+ reactioneaza cu SCN- dand o coloratie rosu intensa. La analiza amestecului de Al3+ si Cr3+ ambii ioni precipita cu solutie de amoniac, dar daca se oxideaza Cr3+ la CrO42- in prealabil, va precipita numai Al(OH)3.
Separarea prealabila a ionului jenant prin precipitare selectiva, dizolvare selectiva, extractie sau cu ajutorul rasinilor schimbatoare de ioni Separarea cationilor pe grupe si subgrupe se bazeaza in primul rand pe precipitarea selectiva si pe dizolvarea selectiva. In mediu acid, cationii grupelor I si II precipita cu H2S, restul ionilor ramanand in solutie. Sulfurile grupei a doua se pot imparti in doua subgrupe, pe baza solubilitatii sulfurilor subgrupei arsenului in polisulfura de amoniu, in timp ce sulfurile subgrupei cuprului sunt insolubile in acest reactiv. In subgrupa cuprului HgS se poate separa de restul sulfurilor pe baza solubilitatii reduse in HNO3 diluat. Extractia selectiva a unor ioni cu solventi nemiscibili cu apa este o metoda curenta de separare.
I.9. Sensibilitatea reactiilor analitice
In aprecierea reactiilor este deosebit de important sa se stie daca reactia este data de o cantitate mica a ionului respectiv sau pentru a obtine o reactie pozitiva este necesara prezenta unei cantitati mai mari.
La alegerea reactiilor de identificare a diferitilor componenti (specii chimice, substante), sensibilitatea reactiei este foarte importanta, ea trecand pe primul plan. O reactie are sensibilitatea mai mare cu cat permite identificarea sau determinarea unor cantitati mai mici din componentul de analizat.
Referindu-ne la sensibilitatea reactiilor analitice, se impune sa subliniem importanta concentratiei speciei chimice de analizat, pentru realizarea unei reactii sensibile, in contextul in care specia chimica de analizat este angajata intr-un echilibru de complexare, precipitare, extractie. Astfel, o substanta nu poate precipita decat dupa ce concentratia speciilor chimice constituente a depasit solubilitatea ei in conditii date. Daca substanta este foarte greu solubila va precipita la concentratii foarte mici ale ionilor constituenti, reactia fiind sensibila. Reactia de complexare dintre Fe3+ si SCN- este foarte sensibila, deoarece, chiar la concentratii mici, se formeaza complexul colorat intens rosu care este foarte stabil. Reactia dintre Co2+ si SCN- este mai putin sensibila, ea avand loc numai la concentratii relativ mari ale ionului Co2+, datorita instabilitatii complexului format.
Pentru aprecierea sensibilitatii reactiilor analitice se utilizeaza limita de recunoastere (de sensibilitatea, decelare, percepere, identificare, detectie) LS si limita de dilutie D.
Limita de sensibilitate LS reprezinta cantitatea cea mai mica dintr-un component care poate fi pusa in evidenta in mod sigur printr-o reactie analitica. Ea se exprima in micrograme, mg (1 mg 10-6g = 1g
Limita de recunoastere a ionului de Cl- cu ioni de Ag+ este 0,05 mg Cl- sau a ionilor de Na+ prin coloratia galbena a flacarii este de 10-4 mg Na+. Aceasta inseamna ca reactiile respective sunt pozitive numai daca ionii sunt prezenti in proba cel putin in cantitatile indicate. Sensibilitatea reactiilor de identificare depinde insa si de volumul solutiei in care se gaseste substanta de analizat.
Intrcat nu este indiferent daca o cantitate oarecare din substanta de identificat se gaseste in 10 cm3, 0,1 cm3, 0,01 cm3 etc., pentru exprimarea mai buna a sensibilitatii reactiilor analitice s-a introdus limita de dilutie LD (sau simplu D).
Limita de dilutie reprezinta concentratia minima a solutiei exprimata in g/cm3 la care se poate identifica sigur componentul de analizat. Ea se defineste ca raportul dintre masa substantei de identificat exprimata in grame si volumul solutiei exprimat in cm3, atunci cand identificarea este inca pozitiva.
Intre limita de dilutie D si limita de recunoastere LS potrivit definitiilor date, se poate scrie relatia (1.1):
LD = ![]() =
= ![]() =
=
= 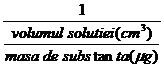 = 1:
= 1: ![]() = =
= =![]() = 1:
= 1:![]()
Limita de dilutie reprezinta volumul maxim de solutie (in cm3) in care se gaseste o cantittate de substata egala cu limita de selectivitate. Ecuatia (I.1) exprima relatia dintre limita de dilutie si cea de sensibilitate, ce permite calcularea volumului maxim de solutie in care poate fi dizolvata o masa de substanta egala cu limita de sensibilitate pentru ca reactia sa fie inca sigura. De exemplu, in reactia de identificare a Ag+ cu H2S, limita de sensibilitate este 0,01 mg Ag+, iar limita de dilutie 1: 5 105. Volumul solutiei (cm3) in care 0,01 mg Ag+ poate fi inca identificat prin formarea Ag2S, va fi:
LD = ![]() =
= ![]() ; V =
; V = 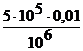 = 0,005 cm3 (1.2)
= 0,005 cm3 (1.2)
Daca limita de sensibilitate a Ag+care este 0,01 mg se gaseste intr-un volum mai mare de 0,005 cm3 nu se mai poate identifica Ag+, solutia trebuind concentrata pana ce se ajunge la concentratia minima.
In cazul identificarii Ni2+ cu dimetilglioxima in mediu amoniacal, limita de sensibilitate este 0,16 mg Ni2+, iar limita de dilutie 1:106 10-6 g/cm3. Volumul maxim de solutie (cm3) in care 0,16 mg Ni2+ poate fi pus inca in evidenta prin formarea complexului va fi :
![]() = 1:
= 1: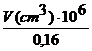 V = 0,16 cm3 (1.3)
V = 0,16 cm3 (1.3)
in caz contrar solutia trebuie concentrata. Comparand LS si D se poate aprecia sensibilitatea reactiilor analitice. Cu cat limita de recunoastere este mai mica si limita de dilutie este mai mare (concentratia limita nu este mica) cu atat reactia respectiva este mai sensibila.
Wenger si Duckert au propus ca valorile limitei de dilutie sa fie exprimate cu ajutorul logaritmilor zecimali luati cu semn negativ:
pLD = -lgLD sau pD = -lgD (1.4)
De exemplu, pentru cazul cand o reactie analitica realizata intr-un cm3 de solutie are limita de sensibilitatea (recunoastere) de 1mg, limita de dilutie va fi:
LD = 1: 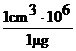 = 1:106 =
10-6 (1.4’)
= 1:106 =
10-6 (1.4’)
iar,
pD = -lgLD = 6.
In analiza calitativa se intrebuinteaza reactii care permit identificarea diferitelor specii chimice in limite de sensibilitate de la 50 la 0,001 mg si limite de dilutie de la 1:103 pana la 1:108. Reactii excesiv de sensibile cum este reactia de identificare a Na+ pe cale spectroscopica (LS = 10-4 mg) nu sunt utile, intrucat pun in evidenta substante prezente in cantitati extrem de mici fara importanta pentru caracterizarea probei.
Pentru reactiile care duc la formarea de complecsi colorati, sensibilitatea este cu atat mai mare cu cat complexul format este mai stabil, iar pentru cele care duc la formarea de precipitate, sensibilitatea este cu atat mai mare, cu cat precipitatul este mai greu solubil, si mai colorat, iar proportia in care intra ionul identificat in compozitia precipitatului este mai mica.
Notand cu v (cm3) volumul solutiei in care se gaseste o masa de substanta egala cu limita de sensibilitate LS si cu V (cm3) volumul solutiei in care se gaseste 1 gram substanta, ecuatia (1.1.) se poate scrie:
V = ![]() (1.5)
(1.5)
1/V = LD
= 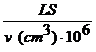 (1.6)
(1.6)
Sensibilitatea unei reactii pe baza ecuatiilor (1.5) si (1.6) se caracterizeaza prin doua marimi: prin LS si LD (sau V-1).
Conform conventiei IUPAC (Uniunea Internationala de Chimie Pura si Aplicata) sensibilitatea se exprima numeric printr-un singur parametru, anume prin LD, respectiv pLD, atribuind in prealabil valori fixe lui v din ecuatia 1.6. Aceste volume pentru diferite moduri de executie s-au fixat la urmatoarele valori: scara macro, in eprubeta – v = 5 cm3, scara semimicro – v = 1 cm3, scara micro – v = 0,1 cm3, in picaturi pe hartie de filtru sau placa de portelan – v = 0,03 cm3, microcristaloscopic – v = 0,01 cm3.
Folosind ecuatiile (1.5) si (1.6) precum si valorile corespunzatoare ale lui v din tabela de mai sus, se pot calcula limite de sensibilitate si limita de dilutie. Astfel, daca sensibilitatea unei reactii in picatura (v = 0,03 cm3) este pD = pLD = 5,3, atunci D = 1/V = 1:105,3 = 10-5,3, iar LS = 10-5,3 mg = 0,15 mg.
Metoda general admisa pentru stabilirea sensibilitatii unei reactii analitice este observarea actiunii uneia si aceleiasi cantitati dintr-un reactiv asupra unor volume egale din solutia de analizat in acceleasi conditii carora li s-au micsorat treptat concentratia in componentul de identificat. In felul acesta se stabileste concentratia minima a componentului la care se mai poate observa net si sigur, efectul urmarit pentru reactia analitica studiata. Sub concentratia minima (limita) exista domeniul concentratiilor „nesigure“cand reactiile nu sunt totdeauna reproductibile prin repetari.
Ionii straini (care in mod aparent nu participa direct la reactie) influenteaza mersul reactiilor analitice si prin urmare si sensibilitatea reactiilor de recunoastere, micsorand-o. Peste o anumita cantitate, efectul de perturbare este atat de mare, incat reactia nu mai are loc. Aceasta cantitate se raporteaza la o parte din susbtanta de cautat, definind raportul limita al reactiei:
1 parte ion cautat/parti ion jenant (cantitate maxima)
Raportul limita indica, deci, cantitatea maxima de ion jenant in prezenta caruia ionul cautat inca mai poate fi identificat prin reactia data. Sensibilitatea reactiei de recunoastere a Ni2+ cu dimetilglioxima este pD = 5,3. In prezenta fierului, la un raport limita de Ni:Fe = 1:1000, sensibilitatea scade la pD = 4,8.
Dupa Malissa, sensibilitatea reactiei in absenta ionilor straini se numeste sensibilitate absoluta (pDa sau simplu pD), iar cea in prezenta ionilor jenanti, sensibilitate practica (pDp). In exemplul de mai8 sus pD = 5,3, respectiv pDp = 4,8 (pentru Ni:Fe = 1:1000). Sensibilitatea unei reactii anlitice este influentata de o serie de factori: temperatura, pH-ul solutiei, concentratia reactantilor, succesiunea adaugarii reactivilor, grosimea stratului de solutie, intensitatea si modul iluminarii, natura celorlalti ioni din solutie etc.
Mersul reactiilor chimice fiind determinat de pozitia echilibrelor respective si de viteza cu care sistemele evolueaza spre aceste echilibre, sensibilitatea reactiilor de recunoastere va putea fi marita prin alegerea convenabila a parametrilor care determina un randament de reactie marit sau conditii mai bune de observare. Posibilitatile cele mai importante sunt urmatoarele:
alegerea judicioasa a reactivului sub diferite aspecte;
alegerea judicioasa a conditiilor de lucru;
concentrarea prealabila a solutiei de investigat;
utilizarea reactiilor de multiplicare, catalitice sau induse.
Reactivul care da o reactie mai completa cu ionul de identificat va asigura firesc o sensibilitate mai mare. In cazul reactiilor cu formare de precipitate, sensibilitatea este cu atat mai mare cu cat precipitatul este mai greu solubil, si mai colorat si cu cat proportia in care intra ionul identificat in compozitia precipitatului este mai mica. Pentru cele de culoare, sensibilitatea creste cu intensitatea coloratiei, iar pentru reactiile care duc la formarea de complecsi colorati, sensibilitatea este cu atat mai mare cu cat complexul format este mai stabil. Concentratia reactivului, pH-ul mediului, temperatura, modul de efectuare al reactiei (succesiunea adaugarii reactivilor), modul de observare sau timpul de observare afecteaza simtitor sensibilitatea reactiilor analitice.
Cresterea temperaturii creste viteza reactiilor chimice si mareste sensibilitatea reactiilor de recunoastere. De aceea, majoritatea reactiilor se efectueaza la cald, dar nu la temperaturi mai mari de 60-70 C, deoarece marirea temperaturii scade in general sensibilitatea reactiilor de precipitare sau de complexare, deoarece creste solubilitatea precipitatelor, respectiv disocierea combinatiilor complexe.
pH-ul solutiei are o influenta foarte mare pentru aproape toate reactiile analitice. Solubilitatea multor precipitate si stabilitatea multor complecsi colorati este dependenta de pH. Fiecare reactie are un pH optim la care stabilitatea produsului format este maxima asigurand o sensibilitate mare. Identificarea Ni2+ cu dimetilglioxima se poate face cu succes in mediu slab alcalin (amoniacal).
Ionii Fe3+ formeaza cu ionii SCN- complexul solubil si intens colorat in rosu, intensitatea coloratiei fiind maxima in mediu slab acid. Cresterea aciditatii scade sensibilitatea reactiei iar in mediu acid reactia nici nu are loc. Formarea sulfurilor, oxalatilor, cromatilor, fosfatilor etc. nu are loc daca pH-ul scade sub o anumita valoare. Adeseori pH-ul optim al reactiei se asigura prin utilizarea solutiilor tampon.
Cresterea concentratiei reactivului cat si a probei, de obicei favorizeaza reactiile, marind sensibilitatea. De aceea se folosesc reactivi destul de concentrati in mic exces, iar probele se dizolva intr-o cantitate mica de dizolvant pentru a obtine solutii cat mai concentrate. Uneori insa, excesul mare de reactiv poate initia reactii secundare care scad sensibilitatea. Influenta concentratiei reactivilor difera de la o reactie la alta.
De exemplu, pentru identificarea Co2+ ca [Co(SCN)4] 2- este necesar un exces de SCN- in vederea deplasarii spre dreapta a echilibrului:
Co2+ + 4 SCN- [Co(SCN)4] 2-
in timp ce pentru identificarea Hg2+ cu I- ca HgI2, un exces de reactiv va scadea mult sensibilitatea reactiei din cauza dizolvarii HgI2:
HgI2 + 2I- HgI42-
Sensibilitatea unei reactii scade deseori din cauza prezentei ionilor interferenti. Mascarea acestora prin formarea unor complecsi incolori stabili este larg utilizata in analiza chimica, avand drept consecinta cresterea sensibilitatii. Astfel, in reactia de identificare a Ni2+ cu dimetilglioxima ionii Fe3+ ce interfera sunt trecuti in complecsi solubili cu acidul tartric (sau F-). In general, pentru fiecare reactie in parte este necesar un raport limita intre ionii de identificat si ceilalti ioni pentru mentinerea sensibilitatii reactiei.
De exemplu, la identificarea ionului Co2+ cu a-nitrozo-b-naftol, se pot identifica 0,21 mg Co2+ (pe hartia de filtru) in mod sigur in prezenta Fe, daca acesta se gaseste cel mult de 1850 de ori mai mult decat Co2+ sau 0,84 mg Co2+ (pe hartia de filtru) daca fierul se gaseste de cel mult 2100 ori mai mult decat Co2+, in timp ce in solutii pure de Co2+ , limita de recunoastere a reactiei cu acelasi reactiv este de 0,05 mg Co (pe hartia de filtru). De asemenea, se pot identifica pe hartia de filtru cu dimetilglioxima, 0,8 mg Ni2+ daca Co2+ se gaseste de cel mult 1250 ori mai mult decat Ni2+, 1,7 mg Ni, daca Cu2+ se gaseste de cel mult 590 ori mai mult decat Ni2+ sau 0,1 mg Ni in prezenta a 10000ori cantitatea de Mn2+. In unele cazuri, pentru mascarea ionilor care interfera intr-o anumita reactie, se utilizeaza reactii redox. De exemplu, la identificarea molibdenului cu KSCN, ionii ferici sunt redusi cu SnCl2 la ioni ferosi. Daca reactia este lenta, sensibilitatea este functie de timpul de observare, astfel de reactii care momentan apar negative cu timpul pot deveni pozitive, dupa ce s-a format o cantitate suficienta din produs de reactie.
Desigur, sensibilitatea reactiilor analitice depinde si de modul de observare al reactiei. Aparitia unei coloratii sau a unui precipitat se poate sesiza mai usor in straturi de solutii mai apoase, observand de exemplu, solutia din eprubeta de sus in jos si nu lateral.
Tehnica de lucru are o mare influenta asupra sensibilitatii reactiilor de identificare. In general, sensibilitatea unei reactii creste de la eprubeta la placa de portelan, apoi la hartia de filtru si final la microscop. De exemplu, reactia de identificare a Fe3+ cu K4[Fe(CN)6] are limita de recunoastere 10 mg Fe3+ in eprubeta, 0,5 mg Fe3+ pe hartia de filtru si 0,002 mg Fe3+ la microscop. In cazul reactiilor pe hartia de filtru, datorita fenomenelor capilare, sensibilitatea este mult marita fata de ce din eprubeta sau placa de portelan. Modul de iluminare mareste mult sensibilitatea reactiilor de formare de precipitate, ca de exemplu la precipitarea AgCl, pentru care D = 10-5,4 la lumina obisnuita si D = 10-7,53 prin efect Tyndall. Natura solventului influenteaza fie intensitatea culorii, fie nuanta culorii solutiilor, ca de exemplu Fe(SCN)3, care este mai intens colorat in rosu in acetona decat in apa.
Marirea sensibilitatii unei reactii analitice in multe cazuri se obtine prin cresterea concentratiei in ionul de identificat (concentrarea prealabila a solutiei de investigat). Dintre procedeele de concentrare cele mai des utilizate in practica analizei calitative sunt evaporarea solutiei la un volum mic, coprecipitarea, concentrarea cu ajutorul schimbatorilor de ioni sau prin extractie.
In concluzie, se poate afirma ca reactiile cele mai importante sunt acelea care sunt sensibile si specifice. Din nefericire insa multe din reactiile analitice utilizate nu satisfac concomitent cele doua cerinte, existand reactii sensibile dar cu specificitate redusa si invers. Astfel, H2S este un reactiv sensibil pentru ionii Pb2+ dar nu este caracteristic, multi ioni metalici dand precipitate negre foarte asemanatoare. Hidroxidul de sodiu da o reactie specifica cu ionii Hg2+ dar reactia nu este sensibila. In schimb, reactia Fe3+ cu ioni de SCN- este specifica si sensibila, fiind utila pentru recunoasterea ionilor Fe3+ si SCN-. Este deosebit de important ca analistul sa faca deosebire neta intre reactii specifice si nespecifice, identificarea ionilor bazandu-se pe reactii specifice. In acest scop, se face apel la posibilitatile multiple de crestere a specificitatii si sensibilitatii reactiilor analitice. In anexele1.1 – 1.4 sunt prezentate principalele reactii folosite in analiza calitativa si cantitativa.
I.10. Caracterul statistic al limitei de recunoastere
Studiile facute de Emich, Alimorin, Kaiser si altii au scos in evidenta ca in cazul tuturor reactiilor de identificare, la incercari facute cu solutii pure din ce in ce mai diluate pana la o anumita concentratie, toate reactiile sunt pozitive.
Sub aceasta concentratie specifica fiecarui reactiv analitic, numarul reactiilor pozitive scade pe masura ce scade concentratia, iar sub o concentratie si mai scazuta toate probele sunt practic negative. S-a observat ca cu cat este mai mare numarul de probe, cu atat este mai scazuta limita concentratiei sub care toate probele sunt negative. Ca atare s-a pus in evidenta ca exista un domeniu nesigur al reactiilor de identificare si ca limitele de concentratie ale acestui domeniu sunt dependente de numarul probelor facute.
In cursul reactiei de recunoastere a speciei necunoscute A cu reactivul R reprezentata prin ecuatia generala:
A + R AR
concentratia produsului de reactie care permite detectarea speciei A, cAR din m probe paralele efectuate cu o solutie de o anumita dilutie data nu va fi aceeasi, ci din cauza erorilor accidentale (erori la masurarea volumelor, la adaugarea reactivului, fluctuatii mici ale conditiilor de lucru etc.) ea va avea valori diferite, depinzand in principiu de un numar mare de factori. CAR este deci o marime aleatoare, valorile distribuindu-se in jurul unei valori medii dupa legea distributiei normale a lui Gauss.
Efectuand cate m reactii pe rand cu concentratiile C1, C2, C3 din ce in ce mai mici, probabilitatea aparitiei rezultatelor negative creste., iar sub o anumita concentratie toate cele m probe vor fi negative. Domeniul de concentratie in care din cele m probe unele sunt pozitive iar altele negative, se numeste domeniul nesigur al reactiei. Concentratia cea mai mica ce poate fi detectata Cr este o marime determinata statistic corespunzand unei concentratii medii C, din domeniul nesigur al reactiei pentru care posibilitatea unei reactii pozitive este de 99,7%. Aceasta marime este egala cu:
Cr = C + 3d
d fiind eroarea medie patratica a determinarilor. C se calculeaza din datele unei serii de probe efectuate cu solutii din ce in ce mai diluate din domeniul nesigur al reactiei, observand numarul probelor pozitive.
I.11 Analiza calitativa
I.11.1. Identificarea componentilor dintr-o proba de analizat se poate face prin mai multe procedee chimice, care constituie de fapt ceea ce se numeste curent analiza calitativa.
In prezent in chimia analitica calitativa termenii “identificare”, “recunoastere”, “decelare”, “detectare”, “detectie” sunt sinonimi. Literatura de specialitate tinde sa generalizeze termenul “detectie”.
Notiunile chimiei analitice calitative se aplica la analiza oricaror probe de analizat, atat de natura minerala, cat si organica.
Astazi procedee specifice candva analizei anorganice, ca de exemplu, analiza polarografica etc. sunt folosite pe scara larga in analiza organica, iar procedee folosite odinioara exclusiv in analiza organica se bucura de o larga raspandire si in analiza anorganica (spectrometria IR, cromatografia etc.)
Din multimea de reactii chimice cunoscute azi, numai o mica parte se poate folosi pentru detectarea unor specii chimice.
I.11.2. Clasificarea analitica si separarea cationilor si anionilor La cercetarea unei probe care contine un amestec de specii chimice diferite, nu intotdeauna este posibila punerea in evidenta pe cale directa a fiecarei specii cu ajutorul unei reactii specifice.
Intrucat nu exista posibilitatea de a detecta o specie chimica in prezenta unui mare numar de alte specii, se apeleaza la separarea speciile chimice in grupe si apoi in cadrul acestora in subgrupe si in final, fie se ajunge la separarea fiecarei specii, fie se detecteaza fiecare specie in prezenta celorlalte specii din subgrupa respectiva. In acest fel s-a descoperit ca exista reactivi de grupa care dau reactii numai cu unele specii si pe aceasta baza se pot forma diferite grupe de specii chimice, grupe analitice.
In ceea ce priveste cationii, se cunosc de mult reactivi de grupa, ca acidul clorhidric, hidrogenul sulfurat, sulfura de amoniu, carbonatul de amoniu, iar pe baza datelor experimentale ale actiunii acestor reactivi, cationii se impart in cinci grupe analitice.
Deoarece pentru anioni n-au fost gasiti inca reactivi de grupa satisfacatori, incercarile de a elabora un mers sistematic al analizei anionilor, asemanator cationilor, n-au fost incununate de succes. Din acest motiv, anionii trebuie cautati prin reactii selective si specifice.
Pozitia unui element in sistemul periodic, determina proprietatile analitice, care sunt decise in primul rand de structura electronica a ionilor, structura care la randul ei depinde de elementul de la care provin ionii si de pozitia sa in sistemul periodic.
Cationii cu strat electronic exterior de gaz inert cu 2 sau 8 electroni sunt putin polarizabili si ei insisi sunt polarizanti slabi. Ca atare la reactia lor cu S2- paturile electronice se vor deforma foarte putin prin polarizare. Acestia nu formeaza sulfuri insolubile, nu precipita cu S2- nici in mediu acid, nici in mediu bazic. Hidroxizii acestor cationi sunt baze puternice.
Cationii cu un strat electronic incomplet de la 8 la 18 electroni sunt polarizabili ei insisi, sunt polarizanti si ca atare formeaza sulfuri greu solubile. Solubilitatea sulfurilor va depinde insa de numarul de electroni din stratul exterior, scazand rapid cu cresterea numarului de electroni, in medie cu 2-3 ordine de marime pentru fiecare electron in plus in stratul exterior. Hidroxizii acestor cationi sunt baze slabe.
Cationii cu strat exterior de 18 electroni sau cu strat electronic exterior de 18 + 2 electroni sunt usor polarizati si sunt polarizanti puternici, iar in reactia cu S2- paturile electronice exterioare se deformeaza foarte mult ducand la formarea unor sulfuri greu solubile care pot precipita si in mediu puternic acid. Hidroxizii acestor cationi sunt baze foarte slabe sau chiar amfotere.
Tabelul 1.10 Clasificarea analitica a cationilor
|
Grupa sist. periodic |
Grupe analitice |
||||
|
I |
Ag+ |
Cu2+, Au3+ |
Li+, Na+, K+, Rb+, Cs+ |
||
|
II |
Hg22+ |
Hg2+, Cd2+, |
Be2+, Zn2+ |
Ca2+, Sr2+, Ba2+, Ra2+ |
Mg2+ |
|
III |
Tl+ |
Al3+, Ga3+, Sc3+, Y3+, lantanide, actinide | |||
|
IV |
Pb2+ |
Sn2+, Sn4+ |
Ti4+, Zr4+, Hf4+, Th4+ | ||
|
V |
V5+, As3+, As5+, Sb3+, Sb5+, Bi3+ |
Nb5+, Ta5+ | |||
|
VI |
Mo6+, W6+, Se6+, Te6+ |
Cr3+, UO22+ | |||
|
VII |
Mn2+ | ||||
|
VIII |
platinice |
Fe2+, Fe3+, Co2+, Ni2+ | |||
|
Reactiv grupa |
HCl |
H2S |
(NH4)2S |
(NH4)2CO3 | |
In tabelul 1.10 se prezinta repartitia cationilor in grupe analitice in functie de pozitia lor in grupele sistemului periodic, avand in vedere clasificarea clasica a acestora. Totodata se indica reactivul cu ajutorul caruia ionii din grupa respectiva pot fi precipitati si apoi separati de ceilalti ioni care raman in solutie. Se vede ca grupa a cincea analitica nu are reactiv de grupa, iar grupele 2 si 3 au de fapt acelasi reactiv, ionul S2- in mediu puternic acid (grupa 2) si in mediu amoniacal (grupa 3).
In cadrul unui grup de cationi cu structura electronica exterioara de acelasi tip exista o modificare sistematica a proprietatilor in functie de potentialul ionic (raportul dintre sarcina electrica a ionului, Zi, si raza lui cristalografica, r). Valorile potentialului ionic Zi/r sunt in legatura cu aciditatea sau bazicitatea oxizilor, caldura de dizolvare a sarurilor, volatilitatea clorurilor etc., proprietati care prezinta mare importanta in analiza chimica. Densitatea sarcinii electrice a unui ion exprimata prin potentialul ionic, este un parametru care caracterizeaza forta campului electric creat de ion . Ca atare, proprietatile analitice ale ionilor vor depinde de valorile Zi/r. Proprietatile bazice ale hidroxizilor formati de ioni care poseda structuri electronice de acelasi tip ale stratului exterior sunt cu atat mai accentuate cu cat este mai mica valoarea potentialului ionic. De exemplu, pentru cationii cu 8 electroni exteriori, hidroxizii bazici au Zi/r < 4,7, cei amfoteri au Zi/r = 4,7-8,6 si cei acizi au Zi/r > 8,6, iar pentru cationii cu 18 electroni exteriori, hidroxizii bazici au Zi/r < 2, cei amfoteri au Zi/r = 2-6 si cei acizi au Zi/r > 6. Deci pe masura ce creste Zi/r scade caracterul bazic si creste caracterul acid al oxizilor (tabelul 1.11).
O asemenea modificare a caracterului bazic si acid se observa si in cazul sulfurilor.
Impartirea grupei hidrogenului sulfurat in subgrupa cuprului si subgrupa arsenului cu ajutorul polisulfurii de amoniu, bazata pe caracterul diferit al sulfurilor respective, poate fi pusa in legatura cu valorile potentialelor ionice. Cationii ale caror potentiale ionice au valori mici, formeaza sulfuri cu caracter bazic, insolubile in sulfura de amoniu, polisulfura de amoniu si hidroxizi alcalini, iar cationii cu potentiale ionice mai mari, formeaza sulfuri cu caracter amfoter si acid, solubile in sulfura de amoniu, polisulfura de amoniu si hidroxizi alcalini.
Scriind numai cationii comuni si tinand seama de tipul straturilor exterioare de electroni si de potentialul ionic al cationilor, se poate vedea ca exista o stransa legatura intre proprietatile analitice ale ionilor si pozitia elementelor in sistemul periodic, asa cum rezulta si din tabelul 1.12.
Tabelul 1.11. Potentialele ionice si caracterul hidroxizilor
|
Structura electronica a ionilor |
Potentialele ionice |
||
|
Hidroxizi bazici |
Hidroxizi amfoteri |
Hidroxizi acizi |
|
|
Strat exterior de 8 electroni complet | |||
|
Strat exterior de 18 electroni complet | |||
Tabelul 1.12. Corelatia dintre structura electronica a cationilor, potentialele ionice si clasificarea lor analitica
|
Numarul de electroni in stratul exterior |
Zi/r |
Cationi |
Grupa |
|
Ag+, Hg22+, Pb2+ | |||
|
Pb2+ | |||
|
Bi3+, Sn2+ |
|||
|
Sb3+, As3+ |
|||
|
Hg2+, Cd2+ | |||
|
Sn4+, Sb5+, As5+ | |||
|
Cu2+ | |||
|
Co2+, Ni2+, Fe2+, Fe3+, Mn2+, (Zn2+), Cr2+ | |||
|
2 sau 18 |
Al3+ | ||
|
Ca2+, Sr2+, Ba2+ | |||
|
Li+, Na+, K+, Rb+, Cs+, NH4+, (Mg2+) |
In tabelul 1.12 s-au trecut in paranteze doi cationi la grupele analitice de care apartin, dar care au alte valori ale parametrilor intabelati si anume Zn2+ ,care face parte din grupa a treia analitica cu toate ca are 18 electroni pe stratul electronic exterior si Zi/r cuprins intre 1,9-3,3 formal ar apartine grupei a doua analitice, cu cationii careia are inrudiri, ca de exemplu (sulfura alba, dar greu solubila chiar in mediu slab acid, fapt care impune separarea sulfurilor din grupa a doua analitica in mediu puternic acid), precum si Mg2+ care apartine grupei a cincea analitica si are doi electroni exteriori, dar are Zi/r cuprins intre 2,5 –6,2 (formal ar apartine grupei a treia analitice).
O pozitie aparte ocupa Cu2+care are 17 electroni exteriori si care formal ar trebui sa apartina grupei a treia analitice (avand proprietati analitice asemanatoare cu ale Zn2+) dar care prin numarul mare de electroni in stratul exterior are sulfura cea mai greu solubila dintre cationii cu 8-18 electroni in stratul exterior, astfel incat CuS precipita in mediu puternic acid, la pH 0,5, mediu in care ZnS nu mai poate precipita. De fapt cationii grupei 1 analitice apartin tot marii grupe a sulfurii care s-ar putea imparti in patru subgrupe:
subgrupa sulfurilor greu solubile, ai caror cationi precipita si cloruri greu solubile: Ag+, Hg22+, Pb2+;
subgrupa sulfurilor greu solubile cu proprietati amfotere si acide: Sn2+, Sn4+, Sb3+, Sb5+, As3+ si As5+ (acestea se dizolva in alcalii, sulfuri si polisulfuri);
subgrupa sulfurilor greu solubile cu proprietati bazice, careia ii apartin cationii: Hg2+, Pb2+, Bi3+, Cu2+ si Cd2+ (nu se dizolva in alcalii, sulfuri si polisulfuri);
subgrupa sulfurilor greu solubile sau hidrolizabile, dar care nu precipita in mediu puternic acid careia ii apartin Co2+, Ni2+, Fe3+, Fe2+, Mn2+, Zn2+. Acestei grupe ii apartin si Al3+ si Cr3+ ale caror sulfuri hidrolizeaza in mediu amoniacal, formand hidroxizii respectivi, greu solubili.
Prima subgrupa a sulfurilor constituie de fapt si prima grupa analitica de cationi, reactiv de grupa HCl ai carui cationi mai importanti sunt Ag+, Hg22+, Pb2+. A doua subgrupa si a treia constituie cea de-a 2-a grupa analitica, rectiv de grupa H2S dar care se va divide de fapt in subgrupa sulfobazelor (Hg2+, Pb2+, Bi3+, Cu2+ si Cd2+) si in subgrupa sulfobazelor: (Sn2+, Sn4+, Sb3+, Sb5+, As3+ si As5+).
Ultima subgrupa de sulfuri constituie de fapt cea de-a 3-a grupa analitica: Co2+, Ni2+, Fe3+, Fe2+, Mn2+, Zn2+, Al3+ si Cr3+, grupa sulfurii de amoniu. Se vede ca de fapt numai o singura grupa de cationi, cea de-a 4-a, are alt reactiv (carbonatul de amoniu) care permite separarea cationilor Ca2+, Sr2+ si Ba2+ de cationii grupei a 5-a, care nu are un reactiv de grupa comun si ai carei cationi: Li+, Na+, K+, Rb+, Cs+, NH4+ si Mg2+ trebuie identificati prin reactivi specifici.
Din tabelul 1.12 reiese clar ca toti cationii polarizabili (cu 8-18, 18 si 18+2 electroni in structurile exterioare) cu exceptia Cr3+, formeaza sulfuri stabile fie in mediu acid, fie in mediu amoniacal si numai cationii nepolarizabili (cu 2 sau 8 electroni in straturile exterioare) au alt reactiv de grupa sau nu au nici un reactiv comun.
In acelasi timp se vede si faptul ca grupele analitice stabile se sprijina de fapt pe legea periodicitatii proprietatilor elementelor chimice in functie de numarul de ordine al acestora, numar de ordine bazat pe structura straturilor electronice si pe structura nucleelor atomice.
Separarea unui amestec de cationi se realizeaza principial in felul urmator: solutia de analizat se trateaza cu HCl diluat, cand vor precipita clorurile cationilor grupei acidului clorhidric, AgCl, Hg2Cl2 si PbCl2 care sunt separate prin filtrare. In continuare, prin solutia acida (solutia clorhidrica adusa la pH 0,5 cu HCl) se barboteaza H2S gazos si vor precipita sulfurile CuS, Bi2S3, CdS, (PbS), HgS, As2S3, As2S5, Sb2S3, Sb2S5, SnS, SnS2. Dupa separarea acestor sulfuri, la solutia filtrata se adauga o solutie tampon de NH4OH/NH4Cl (pH = 8-9), apoi solutie de (NH4)2S 0,3 mol/dm3 si vor precipita sulfurile CoS, NiS, MnS, FeS, ZnS si hidroxizii Al(OH)3 si Cr(OH)3.
Se filtreaza precipitatul iar solutia rezultata se trateaza cu acid acetic si se incalzeste pana la indepartarea excesului de sulfura de amoniu. Adaugand (NH4)2CO3 in solutia adusa la mediu bazic, pH = 8-9, vor precipita BaCO3, SrCO3 si CaCO3 iar cationii grupei metalelor alcaline raman in solutie.
Pentru analiza fiecarei grupe in parte exista metodologii speciale de lucru care sunt prezentate detaliat in indrumarele de laborator. In tabelul 1.13 se prezinta schema analizei calitative a cationilor bazata pe precipitarea cu hidrogen sulfurat, iar in anexele I.1 – I.10, scheme de separare a cationilor si anionilor, reactii caracteristice si sensibile ale cationilor si anionilor si tabele orientative pentrui analiza cationilor si anionilor.
La anioni s-au observat mai putine regularitati, probabil datorita faptului ca majoritatea contin mai multi atomi si este greu sa se vada relatiile dintre legea periodicitatii si proprietatile analitice. Totusi, se cunosc unele legaturi care explica in parte comportarea anionilor.
Anionii cu oxigen sau fluor in molecula sunt slab polarizabili si ca atare polarizanti. Dintre acestia cei care sunt caracterizati de valori Zi/r mari precipita cu Ba2+, iar cei cu Zi/r mici nu precipita cu Ba2+. Anionii fara oxigen sau fluor in molecula au o putrnica tendinta de a forma legaturi covalente. Toti acestia precipita cu Ag+. Cei care au Zi/r mic formeaza saruri de argint insolubile in HNO3 concentrat, iar cei care sunt caracterizati de Zi/r mare formeaza saruri de argint care se dizolva, in majoritatea lor in HNO3 concentrat.
Tabelul 1.13 Schema analizei calitative a cationilor, bazata pe precipitarea cu hidrogen sulfurat
|
Test pentru NH4+ intr-o portiune mica a solutiei initiale. In restul solutiei se adauga HCl diluat si se centrifugheaza. |
|||||
|
Precipitatul1 AgCl,Hg2Cl2 PbCl2. Se spala si precipitatul se prelucreaza |
Solutia 1 contine cationii grupelor 2-5. La pH = 0,5 se satureaza cu H2S. Se centrifugheaza |
||||
|
Precipitatul2. HgS, PbS, Bi2S3, CuS, CdS, As2S3, Sb2S3, SnS2. Se trateaza cu KOH si se centrifugheaz |
Solutia 2 contine arsenat si cationii grupelor 3-5, HCl si H2S. Se precipita arseniul si se centrifugheaza. Se indeparteaza excesul de acid si de H2S din solutie; se adauga NH4Cl, NH3 si se trateaza cu H2S. Se centrifugheaza. |
||||
|
Precipitatul 2A . HgS, PbS, Bi2S3, CuS, CdS |
Solutia 2B HgS2-, AsO2-, AsS2-, Sb(OH)4-, SbS2-, Sn(OH)6-, SnS3- |
Precipitatul 3. NiS, CoS, Al(OH)3, Cr(OH)3, Fe2S3, MnS, ZnS |
Solutia 3 contine cationii grupelor 4-5. Se aciduleaza cu acid acetic, se fierbe pentru indepartarea H2S si se centrifugheaza. Rezidiul se arunca. Solutia se evapora. Se adauga apa, NH4Cl si (NH4)2CO3; se centrifugheaza. |
||
|
Precip.4 BaCO3, SrCO3, CaCO3, MgCO3 |
Solutia 4 contine: Mg2+, K+ si Na+ |
||||
In tabelul 1.14 se da clasificarea anionilor in cele sapte grupe analitice in functie de reactia acestora cu Ag+ si Ba2+, precum si in functie de solubilitatea acestora.
Analiza calitativa a unei probe de analizat se face in mai multe etape consecutive: analiza preliminara, solubilizarea probei, analiza cationilor, analiza anionilor, analiza organica calitativa, coordonarea si sistematizarea tuturor observatiilor si rezultatelor partiale, urmata de prezentarea compozitiei probei de analizat.
Tabelul1.14. Clasificarea anionilor in grupe analitice
|
Grupa analitica |
Anionii |
Solubilitatea sarurilor cu: |
|||
|
AgNO3 |
BaCl2 |
|
|||
|
I |
Cl-, ClO-, Br-, I-, CN-, ClO2-, SCN-, Fe(CN)64-, Fe(CN)43- |
insolubil in HNO3 concentrat |
solubile in apa |
|
|
|
II |
S2-, NO2-, CH3COO-, NCO-, HCOO- |
- solubil in HNO3 conc. - greu solubile in apa |
solubile in apa |
|
|
|
III |
IO3-, SO32-, BO2-, H2PO3-, PO32-, P2O74-, C2O42-, SeO42-, TeO32-, MoO42-, TeO42-, C4H4O62-, C2H5O73- |
albe, solubile in HNO3 concentrat |
- albe, solubile in HNO3, HCl - greu solubile in apa |
|
|
|
IV |
PO43-, S2O32-, IO43-, AsO33-, AsO43-, CrO42-, Cr2O72-, MnO4-, VO43- |
- colorate - solubile in HNO3 - greu solubile in apa |
- colorate - solubile in HNO3, HCl - greu solubile in apa |
|
|
|
V |
NO3-, ClO3-, ClO4-, MnO4-, S2O82- |
solubile in apa |
solubile in apa |
|
|
|
VI |
SO42-, F-, SiF62- |
solubile in apa |
albe, insolubile in HNO3 |
|
|
|
VII |
WO42-, SiO32-, niobic, tantanic, titanic, zirconic |
acizii sunt stabili la calcinare, se separa cu HCl din saruri alcaline solubile in apa. Calcinati cu alcalii formeaza saruri solubile |
|
||
In analiza preliminara se fac mai multe reactii cu portiuni mici din proba pentru a obtine unele indicatii asupra componentilor probei, indicatii utile in urmatoarele etape. Aceste reactii urmaresc sa se obtina informatii privind volatilizarea componentilor, solubilitatea unora dintre ei sau a probei in ansamblu, prezenta halogenilor, a metalelor usor reduse, prezenta sulfurilor, a substantelor organice etc. Toate aceste indicatii vor permite luarea unor masuri ulterioare, dar pot duce si la detectarea imediata a unor componenti volatili care in cursul analizei se regasesc mai greu sau nu se pot detecta.
In unele cazuri analiza preliminara permite sa se traga concluzii sigure referitoare la absenta unor componenti posibili ai probelor de analizat.
Solubilizarea probei este cea de-a doua etapa a analizei calitative. In aceasta etapa se incearca consecutiv sa se dizolve intreaga proba, incepand cu dizolvarea in apa distilata, apoi in solutii apoase de acizi diluati sau concentrati, prin dezagregare in topituri sau prin procedee speciale. In cursul incercarilor de solubilizare se pot obtine noi indicatii referitoare la compozitia probei, ca de exemplu, informatii privind prezenta unor oxizi, carbonati, silicati etc.
In cadrul analizei cationilor se separa pe rand grupele de cationi, iar in cadrul fiecarei grupe se separa intre ei toti cationii si dupa separare se fac reactii de detectie cu reactivi specifici. In aceasta etapa, o mare importanta prezinta separarea cantitativa a grupelor de cationi intre ele, deoarece orice cation ramas neseparat, chiar in cantitati foarte mici, dintr-o grupa separata anterior, va precipita odata cu cationii grupelor urmatoare provocand rezultate inexacte sau interferente la identificarea altora.
De exemplu, neprecipitarea totala a Bi3+, Pb2+ etc. din grupa a 2-a de cationi va duce la obtinerea unor sulfuri, PbS si Bi2S3 negre, in grupa a 3-a de cationi sau la precipitarea unor carbonati de culoare alba, in grupa a 4-a de cationi. Din acest motiv, dupa precipitarea si filtrarea precipitatelor dintr-o grupa de cationi este obligatoriu sa se verifice daca s-au precipitat cantitativ toti cationii grupei. Aceasta verificare se face printr-o noua incercare de precipitare in filtratul din care s-a facut separarea grupei si in care exista toti cationii grupelor urmatoare. Fara a se face verificarea separarii cantitative a cationilor unei grupe oarecare, nu se poate trece la precipitarea cationilor din grupa urmatoare.
Analiza anionilor incepe cu eliminarea din proba a tuturor cationilor care formeaza carbonati greu solubili (ioni ai metalelor grele, ai metalelor alcalino-pamantoase etc.)si apoi continua prin reactiile anionilor cu Ag+ si Ba2+, cand se pot stabili ce grupe de anioni exista in proba. Dupa aflarea grupelor de anioni se cauta pe rand fiecare anion din grupele identificate si din grupa a 5-a ai carei anioni nu formeaza precipitate cu Ag+ si Ba2+.
Daca in probele preliminare s-a constatat prezenta unor substante organice, cea de-a cincea etapa a analizei calitative o constituie analiza organica calitativa in cadrul careia se pot identifica atat unele elemente din moleculele de substante organice, ca de exemplu S, N, P, halogeni etc. cat si unele functii organice cum sunt –OH, -NH2, -COOH, -CHO, =CO etc.
Ultima etapa a analizei calitative este coordonarea si sintetizarea tuturor observatiilor si rezultatelor partiale, urmata de prezentarea compozitiei probei de analizat. Din prezentarea rezultatului global al analizei calitative se poate stabili imediat tipul probei de analizat si apoi alegerea celor mai potrivite metode de analiza cantitativa.
Cunoscand problemele teoretice ale chimiei analitice calitative si folosind un bun manual de analiza calitativa, se poate executa analiza calitativa a oricarei probe de analizat, folosind orice schema de separare care se potriveste mai bine scopului urmarit sau folosind scheme clasice.
I.11.3. Operatii folosite in analiza calitativa
In executarea unei analize calitative se urmareste identificarea elementelor si a gruparilor de elemente, care se gasesc intr-o proba. Analiza calitativa poate face si o apreciere cantitativa, deoarece dupa cantitatea de precipitate obtinute, raportata la acelasi volum de solutie sau de substanta solida, se poate trage o concluzie asupra proportiei in care se afla elementele prezente.
Analiza calitativa incepe cu analiza preliminara (sau analiza pe cale uscata) si continua cu analiza pe cale umeda (solutie).
A. Operatii efectuate in analiza preliminara
Analiza calitativa incepe cu o serie de probe preliminare care dau indicatii aproximative asupra probei de analizat, utile pentru alegerea dizolvantului si a celor mai potrivite scheme pentru separarea, identificarea si determinarea componentilor existenti.
Analiza preliminara consta dintr-o serie de reactii analitice efectuate cu cantitati mici de substanta in stare solida si fin pulverizata. In cazul solutiilor, acestea se evapora la sec pe baie de apa. Ele servesc, mai ales, pentru evidentierea componentilor principali din probe, deoarece reactiile utilizate nu sunt intotdeauna deosebit de sensibile.
Analiza preliminara trebuie sa preceada orice procedeu de separare, adica sa-l pregateasca, dar nu sa-l inlocuiasca.
In analiza preliminara (pe cale uscata), reactiile se fac cu proba solida si prin ele se urmareste actiunea caldurii, singure sau combinata cu diferiti reactivi asupra probei de analizat. Principalele operatii (probe preliminare ) efectuate in analiza pe cale uscata sunt:
coloratia flacarii;
incalzirea in tub inchis ;
incalzirea pe carbune;
formarea perlelor;
comportarea fata de H2SO4 diluat apoi concentrat cu si fara alcool, la cald si la rece;
incalzirea cu Na2CO3 si KNO3;
incalzirea sub o capsula de portelan.
Coloratia flacarii
Aceasta proba se efectueaza pe un fir de Pt sau pe o bagheta de MgO. Inainte de a incepe reactia este necesar ca firul de Pt sau bagheta de MgO sa fie curatate prin inmuieri succesive in HCl si incalzire la rosu, pana cand nu mai coloreaza flacara incolora a unui bec de gaz.
Coloratia flacarii se executa in felul urmator: se pune putina proba de analizat pe o sticla de ceas, se adauga pe marginea ei o picatura de HCl si si se inclina astfel incat sa se poata urmari contactul intre HCl si substanta. Cand proba de analizat contine un carbonat, se observa o efervescenta. Dupa aceea se amesteca cu firul de Pt sau bagheta de MgO, se introduce in flacara incolora a becului de gaz si se observa culoarea caracteristica aparuta. Rolul HCl este de a transforma sarurile de analizat in cloruri care sunt in majoritatea cazurilor volatile. Daca flacara colorata este studiata spectral utilizand spectroscopul sau spectrograful, un numar mare de elemente pot fi identificate dupa liniile spectrale caracteristice. In acest scop sunt tabelate in literatura de specialitate lungimile de unda ale acestor linii spectrale (in Å sau nm), ca de exemplu, in tabelul 1.15.
Incalzirea in tub inchis. Prin aceasta proba se urmareste stabilitatea, volatilitatea, reziduul obtinut, incalzindu-se proba de analizat intr-un tub inchis la un capat, deci in prezenta unei cantitati mici de aer.
Ca tub incandescent se foloseste un tub de sticla cu pereti grosi inchis la un capat, de cca 6-10 cm lungime si cu diametru de 6-10 mm.
In tubul bine curatat si complet uscat se introduce o cantitate mica din proba de cercetat.
Tubul se incalzeste intai la flacara mica tinandu-l aproape orizontal, apoi marind progresiv temperatura pana ce nu mai are loc nici o degajare de gaz sau pana ce descompunerea s-a terminat. In cazul special cand reziduul este negru, se introduce un cristal de KNO3 si se reincalzeste. Daca depozitul negru arde, inseamna ca a fost format din carbune care dovedeste ca proba contine substante organice. Daca reziduul nu arde, inseamna ca este format numai din oxizi metalici si se va dizolva in acizi. La incalzirea in tub inchis se pot observa urmatoarele fenomene: aparitia picaturilor de apa, formarea unui sublimat, schimbarea culorii, aparitia produsilor de descompunere volatili, carbonizarea etc.
Aparitia picaturilor de apa arata existenta apei adsorbite pe suprafata probei de analizat, a apei de cristalizare, a apei combinata chimic si a celei rezultata din procesele de descompunere.
Pierderea apei este insotita in multe cazuri de schimbarea culorii substantei initiale. Temperatura la care apar picaturile de apa variaza de la temperaturi joase, pana la temperaturi ridicate. Incalzirea trebuie facuta deci foarte incet la inceput, apoi se ridica treptat.
Tabelul 1.15. Culoarea flacarii si liniile spectrale caracteristice ale unor elemente
|
Culoarea flacarii |
Elementul |
Linii spectrale caracteristice (nm) |
|
galbena |
Na | |
|
violeta |
K, Rb, Cs |
K: 769,9; 766,5; 464,4 Rb: 794,8; 780 Cs: 856,1; 894,4; 621,3; 451,3; 455,5 |
|
rosu purpuriu |
Sr | |
|
rosu carmin |
Li | |
|
galben verzui |
Ba | |
|
violet albastrui |
Zn |
Degajarea de produsi volatili - unele combinatii incalzite in tub inchis, se descompun, dagajand produsi volatili caracteristici. Gazele trebuie caracterizate dupa proprietatile lor fizice si chimice. In tabelul 1.16 sunt prezentate caracteristicile mai importante ale principalilor compusi volatili rezultati prin incalzire care permit identifcarea anumitor combinatii chimice.
Formarea unor sublimate sau oglinzi metalice
Sublimate albe formeaza: As2O3; Sb2O3; Hg2Cl2; PbCl2; SeO2; saruri amoniacale, diversi compusi organici cu azot etc.
Sublimate galbene: MoO3; HgI2; S; Fe2S3; As2S3.
Sublimate negre: I2; Sb2S3; Hg; HgS; amalgame sau diversi compusi cu mercur etc.
Oglinzi metalice negre: As; Sb; Cd; Zn; aliaje de cadmiu sau zinc etc.
Incalzirea pe carbune Pe suprafata unui carbune de lemn (mangal) se realizeaza o excavatie, in care se introduce o mica cantitate de substanta de analizat fin pulverizata (cca 0,1 g) cu sau fara 0,3-0,5 g carbonat de sodiu.
Proba astfel introdusa in adancitura carbunelui se incalzeste cu o picatura de apa si apoi se incalzeste la flacara reducatoare a unui bec de gaz. Cu ajutorul unui suflator de gura flacara se conduce direct pe proba. Urmarind procesul de incalzire pe carbune se pot observa urmatoarele:
Carbunele incepe sa arda intens, la incalzirea probei atunci cand cuprinde compusi care degaja oxigen ca de exemplu: clorat, azotat, permanganat, cromat etc.
In timpul incalzirii se poate sesiza un miros specific de SO2 (daca proba contine sulf sau compusi cu sulf); de NH3 (daca proba contine compusi de amoniu); de usturoi (daca proba contine arsen sau compusi cu arsen); a ridichi (daca proba contine Se sau compusi de Se) etc.
Tabelul 1.16. Compusi volatili rezultati prin incalzire
|
Gazul rezultat |
Caracteristici mai importante |
S-a format din: |
|
O2 |
Gaz incolor, fara miros, intretine arderea |
clorati, bromati, iodati, peroxizi, azotati, oxizi de metale nobile |
|
CO2 |
gaz incolor, fara miros, tulbura apa de barita |
carbonati, oxalati (compusi organici) |
|
CO |
gaz incolor, fara miros, arde cu flacara albastra |
oxalati, formiati, alti compusi organici |
|
(CN)2 |
gaz incolor, cu miros intepator, arde cu flacara roz-pal |
cianuri |
|
HCN |
gaz incolor, cu miros tipic de migdale amare, arde cu flacara rosiatica |
cianuri |
|
SO2 |
gaz incolor cu miros intepator (de sulf ars), tulbura apa de barita, solutia sa apoasa prezinta reactie acida, albastreste hartia iod-amidonata |
sulfiti, sulfati de metale grele, sulfuri in contact cu aerul |
|
HCl |
gaz incolor, cu miros intepator, fumega cu amoniacul, solutia sa apoasa prezinta reactie acida |
cloruri |
|
H2S |
gaz incolor, cu miros de oua vechi, arde cu flacara albastra, inegreste hartia de acetat de plumb |
sulfuri si tiosulfati |
|
NH3 |
gaz incolor, cu miros caracteristic, solutia sa apoasa incoloraprezinta reactia alcalina, cu HCl formeaza fum alb |
saruri de amoniu, compusi cianici, compusi organici cu azot |
|
AsH3 |
gaz incolor, cu miros de usturoi, formeaza oglinda metalica intunecata |
arseniuri metalice, alti compusi de arsen |
|
Cl2 |
gaz verde galbui, cu miros intepator, solutia sa apoasa are reactie acida |
cloruri in prezenta de diversi oxidanti |
|
I2 |
gaz violet cu miros intepator, coloreaza hartia amidonata in albastru intens |
iodura in prezenta de oxidanti |
|
NO2 |
gaz brun, cu miros intepator, solutia sa apoasa este incolora si are reactie acida |
azotati sau azotiti |
Prin incandescenta, fara adaos de carbonat poate rezulta un reziduu caracteristic. Daca acest reziduu este alb, se umezeste cu o solutie de azotat de Co si se incalzeste la o flacara oxidanta pána la incandescenta. Masa obtinuta poate capata o culoare tipica si indica prezenta Zn – daca se coloreaza verde (verdele lui Rimman), Ti – daca se coloreaza in verde deschis, Zr – daca se coloreaza in verde masliniu, Al – daca se coloreaza in albastru deschis (albastrul lui Thenard), si este infuzibil, Mg – daca se coloreaza in roz deschis, Ca, Ba si Cr – daca se coloreaza in cenusiu.
Proba amestecata cu carbonat alcalin poate, forma la incandescenta pe carbune, un graunte metalic, paiete metalice sau reziduu nemetalic.
Pentru recunoasterea tuturor compusilor cu S se foloseste proba heparului. Pentru efectuarea acesteia, substanta de cercetat se amesteca cu carbonat alcalin si se incalzeste pana la incandescenta pe carbune, cand are loc si un proces de reducere. Topitura racita se pune pe o placa de Ag si se umezeste cu apa distilata. Daca proba contine compusi cu S, atunci se produce pe placuta de Ag (eventual de Ni) o pata neagra de NiS, conform reactiilor:
CaSO4 + Na2CO3 + 4C Na2S + CO2 + CaO + 4CO
Na2S + 2Ag + H2O + 1/2O2 Ag2S + 2NaOH
Formarea perlelor Pentru producerea perlelor se foloseste fie fosfatul acid de sodiu si amoniu, NaNH4HPO4 · 4H2O, fie boraxul Na2B4O7 · 10H2O. Mai intai se deshidrateaza fosfatul, respectiv, boraxul, pe o sarma de platina, bagheta de MgO sau mina de carbune la flacara si apoi se topeste pana ce formeaza o perla perfect curata. Se lasa picatura formata sa se solidifice partial in afara flacarii si apoi se pune putina substanta de analizat, pe sfera de fondant destul de fierbinte. Se topeste din nou. Se formeaza combinatii colorate si dupa culoarea perlei se pot trage concluzii asupra elementelor prezente. Culoarea obtinuta difera, dupa cum perla se face in flacara oxidanta sau reducatoare a becului de gaz. Perlele prezinta culori diferite, dupa cum sunt calde sau reci. Perlele de fosfat sau de borax, preparate cu aceeasi proba si in aceleasi conditii, prezinta aceeasi culoare in majoritatea cazurilor ( dar exista si unele exceptii).
Prin topire, ambii fondanti se descompun conform urmatoarelor reactii:
Na2B4O7 · 10H2O 2NaBO2 + B2O3 + 10H2O
NaNH4HPO4 · 4H2O NaPO3 + NH3 +5H2O
In flacara reducatoare au loc urmatoarele reactii:
Me(BO2)2 + C B2O3 + CO + Me.
NaMePO4 + C NaPO + CO + Me
unde Me reprezinta un metal oarecare bivalent.
Diferitele culori ale perlei in flaacara reducatoare se datoreaza metalelor respective fin dispersate in masa perlei.
In flacara oxidanta se produc reactiile:
2NaBO2 + MeO Me(BO2)2 + Na2O
B2O3 + MeO Me(BO2)2
Culoarea perlei se datoreaza deci metaboratului, respectiv fosfatului tertiar de sodiu si metal. Daca proba este alba, se face perla numai cu fosfatul monosodic deoarece substantele albe nu dau nimic cu boraxul. In tabelul 1.17 se dau coloratia perlelor de borax ale diferitelor elemente. Cand proba de analizat contine mai multi cationi ce formeaza perle colorate indicatia este neconcludenta.
Tabelul 1.17. Culoarea perlelor de borax ale diferitelor elemente
|
In flacara oxidanta |
Elementul |
In flacara reducatoare |
||
|
la cald |
la rece |
la cald |
la rece |
|
|
incolora |
incolora |
SiO2, Ti, Sn, Al, Hg, alcaline |
incolora |
incolora |
|
incolora |
alb |
Ca, Sr, Ba, Mg |
incolora |
incolora |
|
incolora |
incolora |
W |
albastra | |
|
incolora |
incolora |
Pb, Bi, Cd, Sb, Zn |
incolora |
cenusie |
|
opal |
netransparenta |
Ag |
cenusie |
|
|
albastra |
albastra |
Co |
albastra |
albastra |
|
verde |
albastra |
Cu |
rosie |
rosie |
|
verde |
verde |
Cr |
verde |
verde |
|
violeta |
violeta |
Mn |
violeta |
violeta |
|
galbena |
galbena-verde |
Mo |
brun-inchisa |
verde |
|
galbena |
verde |
U | ||
|
galbena |
galbena |
Ni |
verde |
verde |
|
galbena |
Cl |
cenusie |
||
|
galbena |
Ti | |||
|
galbena |
V |
galbena |
rosie |
|
|
rosie bruna |
galbena-deschis |
Fe |
verde |
|
|
bruna galbena |
galbena-deschis-incolora |
Bi |
incolora |
neagra-cenusie |
|
bruna |
Pt | |||
Comportarea fata de acid sulfuric concentrat
Prin aceasta proba se obtin multe indicatii asupra anionilor. Proba se executa in trei faze succesive: H2SO4 2n, H2SO4 conc. si H2SO4 + alcool.
Proba de analizat in prezenta acidului sulfuric diluat sau concentrat, la rece sau la cald, in prezenta sau absenta alcoolului, furnizeaza date despre compusul din care s-a format ( tabelul 1.18).
Inainte ca proba sa fie tratata cu acid sulfuric concentrat trebuie observat daca reactioneaza cu acid sulfuric 2n.
In caz afirmativ, este recomandabil ca substanta sa nu fie amestecata direct cu acid sulfuric concentrat, deoarece se pot produce reactii violente. Numai dupa terminarea reactiei cu acid sulfuric 2n se adauga acid sulfuric concentrat apoi se incalzeste cu precautie si se analizeaza gazele degajate.
In cazul probei cu acid sulfuric si alcool, mirosul placut ( ester acetic) indica prezenta acidului acetic, iar degajarea vaporilor care ard cu flacara verde indica prezenta borului ca B(OH)3.
Tabelul 1.18. Compusi volatili rezultati prin actiunea acidului sulfuric
|
Gazul rezultat |
Substantele din care s-a format |
Caracteristici mai importante |
|
|
H2SO4 diluat |
H2SO4 concentrat |
||
|
CO2 |
carbonati |
carbonati, oxalati, cianati | |
|
O2 |
peroxizi alcalini si alcalino-pamantosi |
peroxizi, cromati, permanganati | |
|
SO2 |
sulfiti, bisulfiti |
sulfiti, tiosulfati | |
|
H2S |
sulfuri solubile |
sulfuri | |
|
HCN |
cianuri |
cianuri |
gaz foarte toxic |
|
CH3COOH |
acetati |
acetati |
gaz incolor, cu miros de otet |
|
NO2 |
azotiti |
azotati, azotiti | |
|
Cl2 |
hipocloriti |
hipocloriti sau cloruri in prezenta de oxidant | |
|
CO |
oxalati, cianuri | ||
|
HCl |
cloruri | ||
|
HF |
fluoruri |
gaz coroziv pentru sticle, intepator, incolor |
|
|
Br2 |
bromuri in prezenta oxidantilor | ||
|
I2 |
ioduri in prezenta oxidantilor | ||
|
ClO2 |
clorati |
gaz galben cu miros intepator |
|
|
CrO2Cl2 |
cromati si cloruri |
gaz brun rosiatic cu miros intepator, se dizolva in NaOH |
|
|
Mn2O7 |
permanganati |
gaz violet, foarte instabil |
|
Comportarea fata de alcalii
O mica cantitate din proba de analizat se trateaza cu un exces de NaOH sau KOH concentrat si se incalzeste cu precautie. Daca substanta de analizat contine saruri de amoniu, cianuri sau cianati, se va degaja amoniac, care se pune in evidenta in mai multe moduri: dupa mirosul caracteristic, prin folosirea unei hartii de filtru imbibate cu reactivul Nessler sau cu azotat mercuros. In cazul reactivului Nessler se obtine o pata brun-roscata, iar cu azotat mercuros, o pata neagra. Anumite probe, in prezenta de alcalii, se pot solubiliza partial sau total cu formare de hidroxocomplecsi care la neutralizare precipita hidroxizii cu caracter amfoter. Astfel, primesc indicatii asupra prezentei: Al3+, Zn2+, Sn2+, Sn4+, Pb2+ etc.
Alte probe preliminarii
Topiturile oxidante – pentru efectuarea acestora se supun topirii cateva mg din substanta de analizat cu o cantitate de 6-10 ori mai mare de carbonat de sodiu si azotat de potasiu, intr-un microcreuzet, nacela de magnesita sau pe o placuta de portelan. Topitura verde sau verde albastrui indica prezenta Mn, iar cea galbena indica prezenta Cr.
B. Operatii efectuate in analiza pe cale umeda
In analiza chimica calitativa reactiile pe cale umeda pot fi efectuate prin diferite metode: macrochimica, semimicrochimica si microchimica.
Operatiile fundamentale in analiza pe cale umeda sunt:
dizolvarea probelor;
precipitarea;
separarea precipitatului de solutie;
spalarea precipitatului;
dizolvarea precipitatului;
incalzirea si evaporarea solutiilor;
topirea si calcinarea;
extractia cu solventi.
Dizolvarea probelor. Trecerea probelor de analizat in solutii ( dizolvarea) este o operatie importanta, care precede orice analiza, deoarece majoritatea reactiilor in analiza chimica au loc in solutie. Ea se realizeaza prin dizolvari pe cale umeda sau prin dezagregari pe cale uscata. Dizolvarea si respectiv dezagregarea probelor este uneori, o etapa dificila si de lunga durata, insa de cea mai mare importanta. Cand proba de analizat trece in solutie fara sa reactioneze cu solventul, dizolvarea este un proces fizic; in caz contrar este un proces chimic.
Alegerea procedeelor de solubilizare precum si a celor mai potriviti agenti chimici conditioneaza rapiditatea, precizia si corectitudinea efectuarii analizei.
Dizolvarea pe cale umeda Incercarea dizolvarii se efectueaza cu cantitati mici de substanta. In functie de agentii chimici in care se dizolva proba se primesc unele indicatii asupra prezentei sau absentei unor compusi. Pentru scopuri analitice, solventul cel mai potrivit este apa distilata care este si primul dizolvant cu care se incearca solubilizarea probei la rece si la cald. In acest scop se iau in eprubeta 0,01 – 0,05 g substanta solida si se adauga 2-3 cm3 apa. Se observa comportarea lor la rece si apoi la cald. Din efectele ce insotesc dizolvarea se retin: degajarea de amoniac, (daca exista azoturi sau amiduri), degajarea de SO2 (la fierbere daca exista sulfiti acizi), hidroliza si depunerea unor compusi greu solubili.
Daca dizolvarea nu este completa, se filtreaza, se evapora incet solutia limpede si se observa reziduul care indica in ce raport s-a facut dizolvarea. Daca reziduul este apreciabil se adauga din nou apa si se continua dizolvarea. In urma solubilizarii solutia obtinuta trebuie sa fie limpede.
In cazul substantelor greu solubile, pentru a evita obtinerea unor solutii diluate, se incearca dizolvarea la rece si apoi la cald in HCl diluat, HCl concentrat, HNO3 diluat, HNO3 conc., apa regala (3 parti HCl conc. + o parte HNO3 conc.).
Toate incercarile se fac pe rand cu cantitati mici de proba, adaugand reactivii mai sus mentionati in ordinea indicata. Trebuie evitata intrebuintarea unui exces de acid, deoarece indepartarea lui ulterioara ingreuneaza analiza.
In cazul dizolvarii in apa regala, excesul de acid se indeparteaza incalzind proba pe baie de apa pentru a evita pierderea substantelor volatile. Ca agenti de dizolvare se mai utilizeaza: HF conc., H3PO4 dil. si conc., CH3COOH, CCl3COOH, acidul citric, HCOOH, NaOH sau KOH.
Dezagregarea pe cale uscata Pentru aducerea in solutie a probelor care nu se dizolva pe cale umeda, se foloseste metoda de dezagregare pe cale uscata. Dezagregarea pe cale uscata consta in topirea probei de analizat cu fondanti. Produsii de topire se dizolva in apa distilata sau acizi minerali. Fondantii utilizati la dezagregari pe cale uscata se clasifica dupa actiunea chimica, in doua grupe:
fondanti cu caracter alcalin: Na2CO3, K2CO3 in absenta sau prezenta KNO3, Na2O2, borax, S cristalizat, ZnO, MgO, KOH, NaOH in prezenta sau absenta Na2O2, KCN, Na2S2O3, Na2S etc.
fondanti cu caracter acid: bisulfati si pirofosfati de sodiu sau de potasiu, B2O3, H2C2O4 etc.
In general dezagregarea cu fosfati alcalini se foloseste la probele cu caracter acid,iar cea cu fondanti acizi la cele cu caracter alcalin.
La alegerea fondantului se are in vedere atát natura probei de analizat, cat si scopul analitic urmarit.
Precipitarea – este operatia inversa dizolvarii si consta in trecerea unei substante din solutie in faza solida. Ea se face fie in scopul precipitarii unor ioni din solutie in vederea separarii prin filtarare sau centrifugare, fie in scopul identificarii unui ion din solutie. Precipitarea se face la rece sau la cald in eprubete, pahare, baloane, sticle de ceas, lame de sticla, placi de portelan sau hartii de filtru, cu reactivi gazosi, lichizi (sau in solutii) sau solid. Din substanta de analizat adusa in solutie se ia 0,5 – 2 cm3 si se adauga reactivul in picaturi pana la precipitarea completa, agitand dupa fiecare adaos de reactiv. Agitarea nu trebuie sa se faca astupand cu degetul eprubeta deoarece impuritatile aderente la deget impurifica solutia si de asemenea se pot produce accidente. Controlul precipitarii complete se face adaugand o picatura de reactiv in solutia limpede ce ramane in urma decantarii precipitatului dupa un anumit timp. Daca nu apare tulburarea (opalescenta) precipitarea este completa. Se recomanda sa se adauge un mic exces de reactiv in scopul micsorarii solubilitatii precipitatului.
In cazul cand trebuie intrebuintat un exces mai mare de reactiv acesta se specifica intotdeauna, deoarece un exces de reactiv poate uneori sa modifice conditiile de precipitare, iar uneori chiar sa impiedice precipitarea. De multe ori, precipitatul poate forma usor solutii coloidale ce determina ca solutia de deasupra precipitatului sa fie tulbure. In acest caz solul format trebuie coagulat, prin incalzirea vasului, efectuarea precipitarii la temperatura mai mare sau in prezenta unui electrolit ce coaguleaza solul ce se poate forma.
Precipitarea pe sticla de ceas, lamela de sticla sau placa de portelan se face punánd una-doua picaturi din solutia de analizat si apoi 1-2 picaturi solutie de reactiv, iar amestecarea cu o bagheta.
Separarea precipitatelor din solutie – se poate face prin filtrare sau centrifugare. In analiza calitativa filtrarea se face de obicei cu ajutorul unei palnii prin hartie de filtru. Inainte de filtrare se lasa precipitatul sa se depuna si se filtreaza intai lichidul limpede de deasupra precipitatului. Filtrarea prin creuzet filtrant este mai putin folosita. Separarea precipitatelor de solutie prin centrifugare se face utilizand o centrifuga actionata manual sau electric. In acest caz se aduce suspensia precipitatului in eprubeta de centrifugare, iar prin forta centrifuga, precipitatul se depune la fund.
Spalarea precipitatelor Substantele greu solubile retin ionii din solutie prin adsorbtie. Pentru a fi siguri de rectiile ionului precipitat efectuate in solutia obtinuta prin dizolvarea precipitatului si pentru a putea identifica in solutia obtinuta dupa filtrare ionii adsorbiti, precipitatul trebuie spalat. Spalarea se face fie numai cu apa distilata, fie cu o solutie oarecare dupa cum se arata in metoda de lucru. In general, doua - trei spalari sunt suficiente pentru analiza calitativa. Lichidul se adauga la filtratul initial.
Controlul spalarii se face luand 3-4 picaturi de filtrat si cautand cu un reactiv indicat prezenta ionului care trebuie indepartat. Absenta reactiei indica o spalare suficienta.
Dizolvarea precipitatelor – este o operatie curenta in practica analizei. Precipitatul spalat de pe hartia de filtru poate fi trecut in solutie printr-o operatie analoga spalarii, cu reactivi convenabili. Matoda cea mai utilizata consta in aducerea hartiei de filtru cu precipitat intr-o capsula de portelan sau de sticla, peste care se adauga recativul de dizolvare in portiuni mici si agitand dupa fiecare adaos cu bagheta. De multe ori, dizolvarea precipitatului este o reactie lenta, o noua cantitate se adauga dupa un anumit timp, agitand sau incalzind dupa conditiile de lucru.
Incalzirea si evaporarea solutiilor – se poate face direct pe sita de azbest la flacara mica a becului de gaz si cu multa atentie, pe baie de apa sau pe plita electrica. Cand evaporarea se face pana la sec, sursa de caldura se indeparteaza inainte de uscare pentru a evita calcinarea insotita de eventuala descompunere a reziduului.
Intrebari si probleme
1. Ce se intelege prin reactie completa, in chimia analitica?
2. Care sunt caracteristicile unei reactii stoechiometrice?
3. Pentru a putea fi folosita in masuratorile cantitative, este necesar ca o reactie sa fie stoechiometrica? Sa se explice raspunsul dat.
|