DETERMINAREA pH-ULUI CU ELECTRODUL DE STICLĂ
1. CONSIDERAŢII TEORETICE
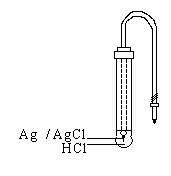 Anumite sticle speciale, sub forma unor membrane fine
care separa doua solutii, au proprietatea de a prezenta īntre
cele doua fete ale sale o tensiune electrica (de membrana)
a carei valoare depinde de diferenta de pH a celor doua
solutii. Pe aceasta proprietate se bazeaza utilizarea
electrozilor de sticla ca indicatori de pH. Fig. 21 reda sectiunea
printr-un asemenea electrod.
Anumite sticle speciale, sub forma unor membrane fine
care separa doua solutii, au proprietatea de a prezenta īntre
cele doua fete ale sale o tensiune electrica (de membrana)
a carei valoare depinde de diferenta de pH a celor doua
solutii. Pe aceasta proprietate se bazeaza utilizarea
electrozilor de sticla ca indicatori de pH. Fig. 21 reda sectiunea
printr-un asemenea electrod.
Ag/AgCl HCl
El
consta dintr-un balonas de sticla avānd proprietatea mai sus
mentionata, ata& 636g63g #351;at unei tije de sticla obisnuita.
Īn acest fel actiunea ionilor H+ este restrānsa doar la
membrana din sticla speciala, ceea ce elimina toate variatiile
cauzate de adāncimea de imersie, cu conditia ca balonasul sa fie
complet introdus īn solutie.
Fig.21. Electrod de sticla
Īn interiorul balonasului se afla solutie diluata de HCl si un electrod de referinta (intern) īn contact cu aceasta solutie, de obicei un electrod de argint-clorura de argint sau un electrod de calomel. Spatiul interior al electrodului fiind īnchis ermetic, solutia de HCl va asigura o concentratie constanta de ioni de H+ si Cl-. Ansamblul unui electrod de sticla poate fi reprezentat prin:
Ag / AgCl, HCl 0,1 M // Solutia de studiat
1 2 3
Electrod de referinta intern Membrana
Tensiunea electrica de membrana (considerānd neglijabila aparitia unei tensiuni electrice datorita difuziunii prin membrana) va avea īn conformitate cu relatia (1)
![]() (1)
(1)
expresia:
![]() (2)
(2)
din care:
εM - tensiunea electrica de membrana;
R - constanta universala a gazelor = 8,314 J·K-1·mol-1;
F - constanta lui Faraday = 96500 C/mol;
T - temperatura absoluta, īn K;
![]() - activitatea medie a cationilor H+ din
solutia de studiat;
- activitatea medie a cationilor H+ din
solutia de studiat;
![]() - activitatea medie a
cationilor H+ din solutia HCl 0,1 M.
- activitatea medie a
cationilor H+ din solutia HCl 0,1 M.
Īnlocuind
si tensiunea electrica pentru electrodul de Ag/AgCl si
tinānd cont ca ![]() este constant, tensiunea
relativa a electrodului de sticla (potential de electrod) va
avea expresia:
este constant, tensiunea
relativa a electrodului de sticla (potential de electrod) va
avea expresia:
![]() , unde
, unde ![]() se refera la solutia de cercetat.
se refera la solutia de cercetat.
Pentru 25°C, vom avea relatia:
![]() (3)
(3)
relatie ce permite calcularea pH-ului solutiei de cercetat īn urma determinarii experimentale a lui ε (prin asociere cu un electrod de referinta extern). Valoarea lui ε0 depinde de natura membranei de sticla si a electrodului de referinta intern folosit. Daca electrodul de sticla se introduce īntr-o solutie identica cu cea aflata īn interiorul sau, iar electrodul de referinta extern este identic cu electrodul de referinta intern, ar trebui ca tensiunea electrica masurata sa aiba valoarea zero. De obicei īnsa, ea prezinta o valoare diferita de zero numita potential de "asimetrie", a carui valoare depinde de natura membranei de sticla, de pregatirea electrodului, fiind īn general direct proportionala cu grosimea membranei de sticla. Cauza aparitiei acestui potential de asimetrie se atribuie īn general tensiunilor mecanice diferite la care este supusa fata interna si externa a membranei de sticla. Din cauza acestui potential de asimetrie si a faptului ca panta nu corespunde valorii teoretice, fiecare electrod de sticla trebuie īn prealabil etalonat fata de o serie de solutii etalon de pH. Etalonarea consta īn trasarea unui grafic reprezentānd potentialul electrodului (sau tensiunea electrica de element fata de un electrod de referinta) īn functie de pH. pH-ul unei solutii necunoscute se determina apoi din grafic, dupa ce īn prealabil s-a determinat potentialul de electrod, respectiv tensiunea electrica de element. Data fiind rezistenta extrem de ridicata a membrenei de sticla (de zeci sau sute de MΩ) determinarea tensiunii electrice de element necesita folosirea unui voltmetru electronic.
Electrodul de sticla poate da indicatii eronate īn solutii ce contin proteine sau alte substante coloidale care au tendinta de a adera la membrana de sticla. De asemenea nu poate fi folosit īn solutii de HF. Pentru determinarea pH-ului la temperaturi mai ridicate este nevoie de sticle mai speciale. Īn solutii neapoase, indicatiile pot fi eronate din cauza unei dehidratari partiale.
Īn pofida acestor limitari, electrodul de sticla a īnlocuit practic toate celelalte tipuri de electrozi indicator de pH. El este adaptabil unei īnregistrari si control automat. Echilibrul sau se stabileste imediat, ceea ce permite realizarea unor masuratori rapide.
2. APARATURĂ sI REACTIVI
electrod de sticla;
milivoltmetru electronic;
pahare Berzelius;
solutii tampon de pH cunoscut;
apa distilata;
solutie tampon de pH necunoscut.
3. MODUL DE LUCRU
Practic pentru determinarea pH-ului cu electrodul de sticla, se va proceda īn felul urmator:
Īn prealabil electrodul de sticla se etaloneaza.
El se introduce pe rānd īn 4-5 solutii tampon de pH cunoscut (spalānd intermediar) si asociindu-l cu un electrod de referinta (de calomel) se determina tensiunea electrica de element, U (respectiv potentialul de electrod) folosind un milivoltmetru electronic.
4. PRELUCRAREA DATELOR EXPERIMENTALE
Masuratorile experimentale se trec īn tabelul urmator:
|
Solutia |
x |
|||||||
|
pH | ||||||||
|
mV |
| |||||||
Cu datele din tabel se construieste graficul de etalonare ε (sau U) = f(pH) cu ajutorul caruia se determina pH-ul solutiei necunoscute, dupa determinarea prealabila a lui U (respectiv ε).

OBSERVAŢII: Īn domeniul dependentei liniare a potentialului electrodului de sticla īn functie de pH (relatia 3) este posibila calibrarea milivoltmetrului folosit si pentru citirea directa a unitatilor pe aceeasi scala ca si tensiunea. Modul practic de realizare a acestei calibrari īnsoteste instructiunile de folosire ale fiecarui milivoltmetru.
Raspundeti la urmatoarele īntrebari:
|