Proprietatile unui material sunt determinate de fortele de legatura dintre atomi si molecule determinate de structura atomului. Pentru a intelege natura proprietatilor fizico-mecanice ale materialelor si posibilitatile de modificare a acestor proprietati, se va face o revedere succinta a principalelor notiuni referitoare la structura atomului, fortele si legaturile interatomice si intermoleculare specifice starii solide.
Fiecare atom este alcatuit dintr-un nucleu central, inconjurat de un sistem de electroni in miscare. Nucleul contine protoni si neutroni. Protonii sunt particule cu sarcina pozitiva si masa relativa 1uam. Neutronii sunt particule neutre din punct de vedere electric, cu masa relativa 1uam. Unitatea atomica de masa (uam) se defineste ca 1/12 din masa atomului de carbon 12 si este egala cu 1,66.10-27 kg.
Electronii sunt particule cu sarcina negativa (-1,6010-19C) si masa neglijabila (9,108.10-31kg). Practic, se poate considera ca intreaga masa a atomului este concentrata in nucleu. La nucleul cel mai usor, de hidrogen, raportul dintre masa nucleului si a electronului este de ~1835. La celelalte elemente depaseste 3000. Desi nucleul contine aproape intreaga masa a atomului, el are dimensiuni foarte mici: diametrul nucleului este de ordinul a 10-15m fata de 10-10 m pentru atom.
Fiecare element chimic este caracterizat prin numarul protonilor din nucleu, numit numar atomic Z. In stare fundamentala atomul este neutru din punct de vedere electric, numarul protonilor fiind egal cu al electronilor. In anumite conditii atomul poate ceda sau capta electroni devenind ion pozitiv (cation) sau negativ (anion).
Masa atomica A a atomului este data de suma protonilor si neutronilor.
A Z + N (1)
Majoritatea elementelor chimice sunt alcatuite din mai multi izotopi naturali in proportii fixe. Izotopii sunt varietati ale aceluiasi element, cu acelasi numar de protoni si numar diferit de neutroni. Izotopii au acelasi numar atomic, dar mase diferite. De aceea, masa at 121g68b omica a unui element rezulta ca medie ponderata a maselor atomice ale tuturor izotopilor sai. Astfel fierul are patru izotopi cu masele 54, 56, 57, 58, iar masa atomica a Fe este A=55,85 uam.
Proprietatile fizico-chimice ale elementului depind de numarul electronilor, in special de structura straturilor electronice exterioare. Ca urmare, in aliaje, izotopii vor avea aceeasi comportare.
Descrierea starii sistemelor atomice si subatomice se face pe baza legilor si principiilor mecanicii cuantice. Conform modelului atomic simplificat a lui Bohr, se considera ca electronii au o miscare de revolutie in jurul nucleului pe orbite discrete, iar energia electronilor este cuantificata pe niveluri energetice grupate pe straturi si substraturi de energie. Schimbarea starii de energie a unui electron pe un nivel vecin se face prin salt si necesita absorbtia sau emisia unei cuante de energie.
Modelul atomic al lui Bohr nu a permis explicarea unor fenomene legate de comportarea electronilor in atomi si agregate atomice. Aceste deficiente s-au eliminat prin dezvoltarea mecanicii ondulatorii, ca parte a mecanicii cuantice, care a permis elaborarea unui model atomic mai precis. Modelul atomic bazat pe mecanica ondulatorie tine cont de caracterul dual, unda-particula al electronilor. In anul 1924, de Broglie a propus sa se asocieze oricarei particule in miscare o unda, a carei lungime de unda l este data de relatia
l = h /mv (2)
unde m – masa particulei; v
– viteza particulei; h –
Miscarea electronilor este descrisa de ecuatia de unda a lui Schrődinger. Solutiile matematice ale acestei ecuatii sunt functiile de unda orbitale y sau orbitali. Orbitalii definesc regiuni in jurul nucleului, cu geometrie dependenta de valoarea functiei de unda, care pot fi ocupate de electroni. Acestia nu mai sunt considerati particule care se misca pe orbite discrete bine determinate. Electronii constituie un nor difuz, iar pozitia lor se considera ca probabilitate de localizare in jurul nucleului. Probabilitatea dp de a gasi electronul intr-un element de volum dV este data de expresia:
dp = y dV (3)
cu conditia ca probabilitatea de existenta a electronului in volumul V sa fie unitara:
∫ y dV = 1 (4)
unde y y y, functia de unda este complexa), reprezinta densitatea de probabilitate.
Fiecare atom are un numar determinat de orbitali electronici, cu valori definite ale energiei. Pe baza mecanicii cuantice, starea unui electron intr-un atom se caracterizeaza prin patru numerele cuantice:
n - numarul cuantic principal, care determina marimea orbitalului;
l - numarul cuantic secundar, care fixeaza forma orbitalului;
ml - numarul cuantic magnetic, asociat cu orientarea in spatiu a orbitalului;
ms - numarul cuantic de spin, care se asociaza cu spinul electronului.
Numarul starilor permise electronilor pe straturile si substraturile energetice ale modelului Bohr se coreleaza cu numerele cuantice.
Un strat energetic cuprinde orbitalii cu acelasi numar cuantic principal n, unde n ia valori intregi si pozitive: n = 1, 2, 3,…. Straturile energetice se noteaza, incepand cu cel mai apropiat de nucleu cu cifrele 1, 2, 3… sau literele K, L, M, N,… care corespund pentru n = 1, 2, 3, 4,… Orbitalii dintr-un strat se gasesc aproximativ la aceeasi distanta de nucleu. si au aceeasi marime.
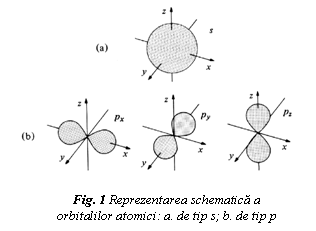
Energia orbitalilor dintr-un strat se cuantifica in functie de numarul cuantic secundar l, cu valori de la 0, la (n–1). Rezulta ca in cadrul stratului exista un numar de substraturi energetice egal cu numarul cuantic principal n. Substraturile se noteaza cu literele s, p, d, f,… care corespund numarului cuantic secundar l = 0, 1, 2, 3,…. Substraturile se deosebesc prin forma orbitalului. Asa cum reiese din figura 1, toti orbitalii s (l = 0) au simetrie sferica. Orbitalii p (l = 1) sunt constituiti din doi lobi separati de un plan nodal, in care densitatea electronilor este nula. Orbitalii de ordin superior sunt mai complecsi.
Numarul si orientarea in spatiu a orbitalilor dintr-un substrat sunt date de numarul cuantic magnetic ml cu valori de la – l la + l. Astfel in substratul s, l = 0, ml = 0, exista un singur orbital; in cazul substratului p, l = 1, ml = -1, 0, +1, exista trei orbitali diferiti px, py, pz, ale caror plane nodale sunt ortogonale intre ele (fig. 1b).
 Numarul cuantic de spin
ms se asociaza, in teoria clasica, rotatiei electronului
in jurul axei proprii, ceea ce genereaza un moment magnetic. Numarul ms
ia doua valori determinate +1/2 si –1/2, ceeace arata ca
intr-un orbital pot exista maxim 2 electroni.
Numarul cuantic de spin
ms se asociaza, in teoria clasica, rotatiei electronului
in jurul axei proprii, ceea ce genereaza un moment magnetic. Numarul ms
ia doua valori determinate +1/2 si –1/2, ceeace arata ca
intr-un orbital pot exista maxim 2 electroni.
Rezulta ca numarul de stari permise electronilor din substrat se poate calcula cu relatia 2(2l+1), unde l = 0, 1, 2, (n-1). In primul substrat pot exista 2 electroni, in al doilea 6, in al treilea 10, in al patrulea 14 etc.
Numarul starilor permise intr-un strat se calculeaza cu relatia 2n2, unde n = 1, 2, 3, 7. In primul strat pot exista 2 electroni, in al doilea 8, in al treilea 18, in al patrulea 32 etc.
Popularea orbitalilor cu electroni respecta urmatoarele reguli:
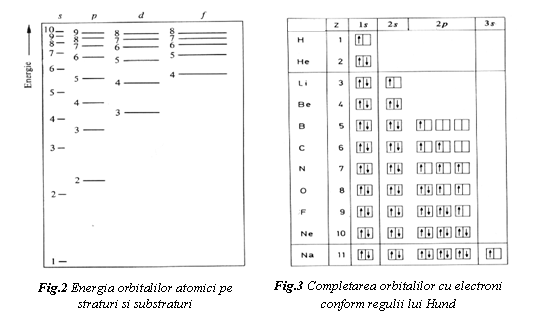
- legea minimului de energie, dupa care are loc ocuparea succesiva a orbitalilor, de la cei cu energie mai mica si mai apropiati de nucleu, la cei cu energie mai mare si mai distantati de nucleu. In figura 2 se prezinta schematic energia relativa pentru diferite straturi si substraturi;
- principiul excluziunii al lui Pauli, dupa care nu pot exista intr-un atom sau agregat atomic electroni cu toate numerele cuantice identice; acest principiu limiteaza
![]()
 prezenta intr-un
orbital a maxim doi electroni de spin opus.
prezenta intr-un
orbital a maxim doi electroni de spin opus.
In tabelul 1 se prezinta configuratia electronilor pentru primele 36 de elemente. Se remarca completarea succesiva a straturilor electronice pana la K (Z=19), la care, desi substratul 3d are 10 locuri vacante, al 19-lea electron va ocupa substratul 4s cu o energie mai mica. La Ca (Z=20) se completeaza substratul 4s cu al doilea electron. De la Sc (Z=21) la Cu (Z=29) se face completarea succesiva a locurilor vacante din substratul 3d, dupa care se ocupa substratul 4p.
Aceste elemente chimice care prezinta substraturi electronice interioare incomplete sunt numite metale tranzitionale. Ele au in stratul electronic exterior maxim 2 electroni de valenta. Substraturile electronice incomplete si energia apropiata cu a electronilor stratului de valenta le determina o serie de proprietati specifice: valenta variabila, para si feromagnetism, forte de coeziune mari, temperaturi mari de topire, capacitate de a forma carburi si nitruri. Un metalul tranzitional tipic este Fe.
- regula lui Hund, dupa care in cazul mai multor orbitali de aceeasi energie, electronii se dispun in orbitali diferiti, astfel ca spinii lor sa fie paraleli, iar interactiunea dintre electroni sa fie minima. Dupa ocuparea cu un electron a tuturor orbitalilor disponibili, se face completarea orbitalilor cu al doilea electron de spin opus. In figura 3 se prezinta completarea orbitalilor atomici cu electroni pentru primele 11 elemente din tabelul periodic.
Cu ajutorul regulei lui Hund se explica proprietatile magnetice ale materialelor. Cum suma momentelor magnetice de spin determina momentul magnetic atomic, orice substanta care prezinta electronii imperecheati va avea moment magnetic atomic nul si proprietati diamagnetice (Cu, Au, Ag). In cazul a unuia sau mai multor electroni neimperecheati momentul magnetic atomic este nenul, iar substanta va prezenta proprietati paramagnetice (Ti, Al). In anumite cazuri, momentele magnetice atomice
Tabel 1 Configuratia electronilor la primele 36 elemente din tabelul periodic
|
Element |
Simbol |
Numar atomic |
Configuratia electronilor |
|
Hidrogen |
H |
1 |
1s1 |
|
Heliu |
He |
2 |
1s1 |
|
Litiu |
Li |
3 |
1s22s1 |
|
Beriliu |
Be |
4 |
1s22s2 |
|
Bor |
B |
5 |
1s22s22p1 |
|
Carbon |
C |
6 |
1s22s22p2 |
|
Azot |
N |
7 |
1s22s22p3 |
|
Oxigen |
O |
8 |
1s22s22p4 |
|
Flor |
F |
9 |
1s22s22p5 |
|
Neon |
Ne |
10 |
1s22s22p6 |
|
Sodiu |
Na |
11 |
1s22s22p63s1 |
|
Magneziu |
Mg |
12 |
1s22s22p63s2 |
|
Aluminiu |
Al |
13 |
1s22s22p63s23p1 |
|
Siliciu |
Si |
14 |
1s22s22p63s23p2 |
|
Fosfor |
P |
15 |
1s22s22p63s23p3 |
|
Sulf |
S |
16 |
1s22s22p63s23p4 |
|
Clor |
Cl |
17 |
1s22s22p63s23p5 |
|
Argon |
Ar |
18 |
1s22s22p63s23p6 |
|
Potasiu |
K |
19 |
1s22s22p63s23p64s1 |
|
Calciu |
Ca |
20 |
1s22s22p63s23p64s2 |
|
Scandiu |
Sc |
21 |
1s22s22p63s23p6 3d14s2 |
|
Titan |
Ti |
22 |
1s22s22p63s23p6 3d24s2 |
|
Vanadiu |
V |
23 |
1s22s22p63s23p6 3d34s2 |
|
Crom |
Cr |
24 |
1s22s22p63s23p6 3d44s2 |
|
Mangan |
Mn |
25 |
1s22s22p63s23p6 3d54s2 |
|
Fier |
Fe |
26 |
1s22s22p63s23p6 3d64s2 |
|
Cobalt |
Co |
27 |
1s22s22p63s23p6 3d74s2 |
|
Nichel |
Ni |
28 |
1s22s22p63s23p6 3d84s2 |
|
Cupru |
Cu |
29 |
1s22s22p63s23p6 3d94s2 |
|
Zinc |
Zn |
30 |
1s22s22p63s23p6 3d104s2 |
|
Galiu |
Ga |
31 |
1s22s22p63s23p6 3d104s24p1 |
|
Germaniu |
Ge |
32 |
1s22s22p63s23p6 3d104s24p2 |
|
Arseniu |
As |
33 |
1s22s22p63s23p6 3d104s24p3 |
|
Seleniu |
Se |
34 |
1s22s22p63s23p6 3d104s24p4 |
|
Brom |
Br |
35 |
1s22s22p63s23p6 3d104s24p5 |
|
Kripton |
Kr |
36 |
1s22s22p63s23p6 3d104s24p6 |
prezinta o orientare domeniala comuna, determinand forme mai complexe de magnetism ca feromagnetismul (Fe, Co, Ni, Gd), anti-feromagnetism (Mn, Cr) si ferimagnetismul (feritele).
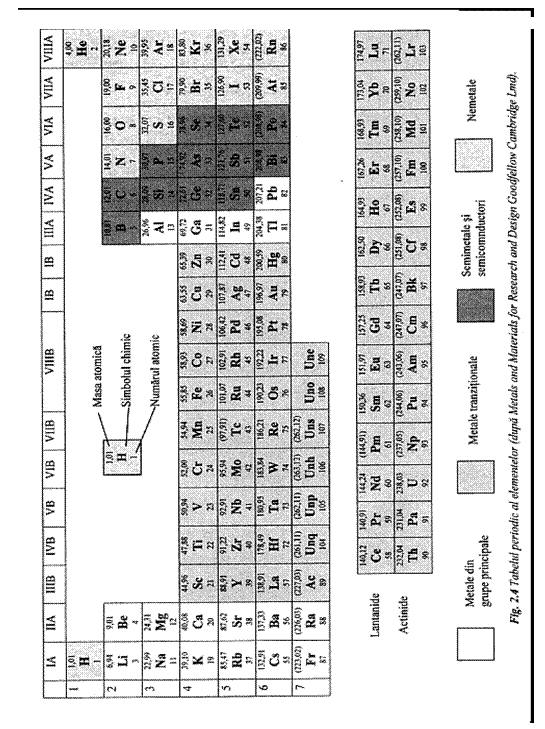
Dispunerea elementelor in tabelul periodic (fig. 4) este in concordanta cu configuratia electronica. Elementele, asezate in ordinea crescatoare a numarului atomic, sunt grupate in sapte perioade. Coloanele contin elemente cu aceeasi structura a stratului de valenta si deci cu proprietati fizico-chimice asemanatoare.
Elementele pozitionate in grupa VIIIA sunt gaze inerte, avand complete straturile electronice si configuratie stabila de octet in stratul de valenta. Grupele VIIA (halogenii) si VIA contin elementele nemetalice care au 1 sau 2 electroni de valenta in deficit fata de configuratia stabila.
Grupele principale IA si IIA contin metalele alcaline, care au 1 sau 2 electroni de valenta in exces fata de configuratia stabila. Elementele din grupele secundare IIIB pana la IIB contin metalele tranzitionale, la care sunt 1 sau 2 electroni de valenta. Elementele cu Z=21-29 au in curs de completare substratul 3d, respectiv 4d elementele cu Z= 39-47 si 5d elementele cu Z=71-80.
Pamanturile rare contin elementele cu Z=58-70, la care se constata umplerea succesiva a substratului 4f. Se presupune ca elementele transuraniene constituie un grup analog, la care se face completarea substratului 5f.
Grupele IIIA, IVA si VA au 3, 4 sau 5 electroni de valenta, ceea ce le confera caracteristici intermediare intre metale si nemetale.In perioada, metalele sunt separate de elementele nemetalice prin elementele intermediare (semimetalele si semiconductori) B, C, Si, Ge, As, Se, Te. Majoritatea atomilor metalici au maxim 3 electroni de valenta, cu un potential de ionizare scazut (sub 10 eV) si tendinta de a forma ioni pozitivi. Caracterul electropozitiv, specific metalelor, creste in perioada de la dreapta la stanga si in grupa de sus in jos. Franciul este elementul cu cele mai pronuntate caracteristici metalice.
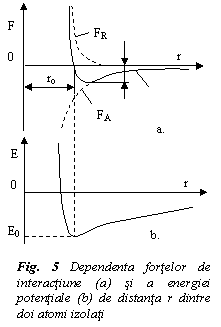
Se considera fortele de interactiune dintre doi atomi izolati, in functie de distanta r dintre atomi (fig. 5a). La distante mari fortele de interactiune sunt neglijabile. Pe masura apropierii, intre atomi se manifesta o forta de atractie FA, care depinde de tipul de legatura interatomica si o forta de respingere FR intre electronii straturilor exterioare. Forta rezultanta F este data de relatia:
F = FA + FR = Ar-m - Br-n (5)
unde A, B, m, n, au valori
dependente de material. Ambele forte cresc la micsorarea
distantei dintre atomi, la distante mari fiind preponderenta
forta de atractie, iar la distante mici forta de repulsie.
Exista o distanta de echilibru r0 la care FA=
FR, iar atomii sunt in echilibru. La separarea lor se opune
forta de atractie, iar la comprimare - forta de respingere.
Forta Fo este forta
de coeziune. Pentru a separa atomii este ![]()
 necesara aplicarea unei
forte F > Fo si de
semn contrar. La distanta de echilibru energia potentiala a
atomilor (fig. 5b) este minima, Eo, fiind necesar un aport de
energie pentru separarea sau comprimarea atomilor. Energia Eo este energia de coeziune.
necesara aplicarea unei
forte F > Fo si de
semn contrar. La distanta de echilibru energia potentiala a
atomilor (fig. 5b) este minima, Eo, fiind necesar un aport de
energie pentru separarea sau comprimarea atomilor. Energia Eo este energia de coeziune.
Presiunea si temperatura pot modifica starea de agregare. Presiunea, adaugandu-se fortelor de atractie, micsoreaza distanta intre atomi si favorizeaza condensarea sau solidificarea. Temperatura mareste energia cinetica de vibratie a atomilor fata de pozitia de echilibru. La anularea fortei de coeziune, atomii sufera o rupere partiala a legaturilor interatomice – topirea, sau totala - vaporizarea. Pentru materialele solide, marimea temperaturii de topire reflecta marimea energiei de coeziune.
In functie de marimea fortelor si energiilor de coeziune, legaturile intre atomii in stare solida sunt:
- primare sau chimice, determinate de tendinta atomilor participanti de a adopta o configuratie electronica stabila de dublet sau octet. Aceste legaturi au energii de coeziune mari Eo=1-10eV/atom si cuprind legaturile ionica, covalenta si metalica.
- secundare sau fizice, determinate de fortele de atractie dintre dipoli atomici sau moleculari. Sunt caracterizate prin energii de coeziune reduse Eo=0,01-0,1 eV/atom. Se pot manifesta la orice atomi sau molecule, dar prezenta lor este mascata de actiunea legaturilor primare puternice. In aceasta grupa intra legaturile van der Waals, a moleculelor polare si legatura de hidrogen.
Legatura ionica sau heteropolara se creaza prin transfer de electroni intre elemente cu caracter electrochimic complementar. Metalele isi cedeaza electronii de valenta nemetalelelor pentru ca atomii sa capete o configuratie stabila de gaz inert. Clorura de sodiu (NaCl) este exemplul clasic de compus ionic (fig. 6a). Natriul (Z=11) cedeaza electronul 3s pentru a ajunge la configuratia electronica de tip neon si devine ion pozitiv. Clorul (Z=17) accepta acest electron pe substratul 3p ajungand la configuratia electronica de tip argon si devine ion negativ.
Legatura ionica se datoreaza fortelor de atractie electrostatica dintre ionii de semn contrar. Este o legaturǎ nedirectionata si puternica (Eo=3-8eV/atom). Compusii ionici au temperaturi ridicate de topire, duritate, fragilitate, in general sunt izolatori termici si electrici. Se intalneste atat in halogenurile alcaline (NaCl, KCl,) si alcalino-pamantoase (MgCl2, CaCl2, BaCl2,…), cat si la majoritatea oxizilor (MgO, CaO,…). Reprezentativ este MgO, care are temperatura de topire 2800oC.
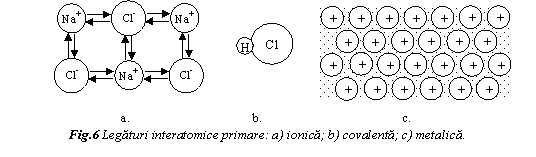 Legatura covalenta
sau homeopolara se creaza prin punerea in comun a electronilor de
valenta a elementelor cu caracter electrochimic identic sau apropiat.
De exemplu, apare la formarea moleculelor nemetalice de HCl, CH4, H2O,
H2, Cl2, NH3 si a cristalelor de C (diamant),
Si, Ge, SiC, ZnS, GaAs etc. In cazul moleculei de HCl (fig. 6b), hidrogenul
(Z=1) participa cu electronul de valenta 1s pentru a obtine configuratia electronica
stabila de tip heliu, iar clorul (Z=17) contribuie cu un electron 3p pentru a ajunge la configuratia
electronica de tip argon.
Legatura covalenta
sau homeopolara se creaza prin punerea in comun a electronilor de
valenta a elementelor cu caracter electrochimic identic sau apropiat.
De exemplu, apare la formarea moleculelor nemetalice de HCl, CH4, H2O,
H2, Cl2, NH3 si a cristalelor de C (diamant),
Si, Ge, SiC, ZnS, GaAs etc. In cazul moleculei de HCl (fig. 6b), hidrogenul
(Z=1) participa cu electronul de valenta 1s pentru a obtine configuratia electronica
stabila de tip heliu, iar clorul (Z=17) contribuie cu un electron 3p pentru a ajunge la configuratia
electronica de tip argon.
Legatura rezulta prin deplasarea electronilor de valenta in orbitali comuni atomilor participanti, numiti orbitali moleculari. Legatura covalenta este directionata in spatiu, ca urmare a formei orbitalilor atomici pentru starile s, p, d,… Legatura covalenta poate fi foarte puternica, ca de exemplu la diamant, care are temperatura de topire peste 3550oC sau slaba ca in cazul bismutului, care are temperatura de topire de 270oC.
Legatura covalenta este specifica pentru o serie de materiale ceramice (diamantul, grafitul, SiC). O legatura covalenta puternica se manifesta intre atomii ce formeaza lanturile moleculare din polimeri sau intre molecule la polimerii termorezistenti.
Legatura metalica este specifica metalelor si aliajelor lor. Electronii de valenta, aflati statistic la distante egale de mai multe nuclee sunt pusi in comun mai multor nuclee. Electronii polinucleari formeaza gazul electronic, care in absenta unui camp electric exterior, circula dezordonat in metal. Atomii deveniti cationi, au o asezare ordonata in spatiu, alcatuind scheletul ionic (fig. 6c). Ionii prezinta o miscare permanenta de agitatie termica, care se manifesta prin oscilatii in jurul pozitiei de echilibru, cu o amplitudine care creste cu temperatura.
Legatura metalica este determinata de fortele de atractie electrostatica dintre gazul electronic si scheletul ionic. Este o legatura de natura covalenta cu caracter nesaturat. Legaturile interatomice se stabilesc prin perechi de electroni de spin opus, statistic si pentru un timp limitat, pentru ca numarul starilor energetice libere este mult mai mare decat numarul electronilor de valenta. La o crestere redusa a energiei, gazul electronic se deplaseaza aproape liber in metal, ceea ce explica conductibilitatea electrica si termica ridicata a metalelor.
Este o legatura nedirectionata si mai slaba decat legatura covalenta, ceea ce asigura deformabilitatea plastica a cristalelor metalice. Energia de coeziune si temperatura de topire variaza in limite largi: dela 0,7eV/atom pentru mercur la 8,8eV/atom la wolfram, respectiv temperatura de topire variaza de la -39oC la Hg la 3410oC pentru W.
Legatura metalica este prezenta si in aliajele metalice cum sunt cristalele de solutie solida cu solvent metalic. In aliaje pot fi insa prezenti si compusi intermetalici cu legatura interatomica variata: metalica, ionica, covalenta sau mixta.
Legatura van der Waals se creaza intre dipoli atomici sau moleculari indusi. Un dipol se caracterizeaza prin asimetria dispunerii spatiale a sarcinilor electrice (fig. 7a). Orice dipol poate induce o deplasare a distributiei electronice din atomii sau moleculele vecine, de care va fi slab atras. Lichefierea sau solidificarea gazelor inerte si a moleculelor simetrice de hidrogen (H2) sau clor (Cl2) are la baza aceasta legatura. Este o legatura intermoleculara foarte slaba, cu energii de coeziune si temperaturi de lichefiere scazute. Pentru argon energia de coeziune Eo=0,08eV/molecula, iar temperatura de lichefiere este -189oC; la clor energia de coeziune este 0,32eV/molecula, iar temperatura de lichefiere este -101 oC.
Legaturile van der Waals slabe apar si intre macromoleculele polimerilor organici, ceea ce le determina capacitatea de punere usoara in forma si elasticitatea.
Legatura intre molecule polare are la baza fortele de atractie electrostatica intre dipolii permanenti prezenti in moleculele electric asimetrice. Se exemplifica prin molecula de HCl (fig. 7b). Energia de coeziune este mai mare decat in cazul dipolilor indusi.
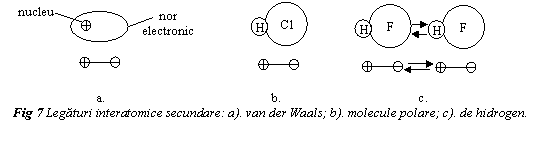 Legatura de hidrogen, este un caz particular de
legatura intre molecule polare. Apare intre molecule in care
hidrogenul este legat covalent cu fluor (HF), oxigen (H2O), azot (NH3).
Protonul de hidrogen realizeaza o punte de legatura intre doi
atomi incarcati negativ (fig. 7c). Este cea mai puternica
legatura secundara. Pentru H2O, Eo=0,52eV/molecula,
iar temperatura de topire 0oC.
Legatura de hidrogen, este un caz particular de
legatura intre molecule polare. Apare intre molecule in care
hidrogenul este legat covalent cu fluor (HF), oxigen (H2O), azot (NH3).
Protonul de hidrogen realizeaza o punte de legatura intre doi
atomi incarcati negativ (fig. 7c). Este cea mai puternica
legatura secundara. Pentru H2O, Eo=0,52eV/molecula,
iar temperatura de topire 0oC.
Formarea cristalului metalic nu modifica numarul total al starilor energetice cu un anumit numar cuantic. Energiile orbitalilor atomici, de la n atomi diferiti sunt riguros identice la distante interatomice mari. La distante mici, cei n orbitali atomici se combina si formeaza n orbitali polinucleari cu n niveluri de energie. Aparitia orbitalilor polinucleari produce diversificarea energiei nivelului atomic unic intr-o banda de energie, cu niveluri energetice apropiate. Latimea benzilor este data de numarul starilor existente in banda, egal cu numarul total de stari cu care contribuie cei n atomi. De exemplu banda s contine n stari, in timp ce banda p contine 3n stari.
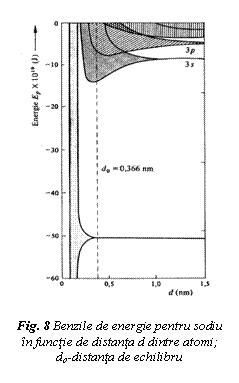 In figura 8 se prezinta benzile de energie la cristalul de sodiu.
Formarea benzilor de energie stabile si extinderea lor depinde de
distanta dintre atomi. Procesul incepe cu electronii din straturile
energetice exterioare, care sunt primii perturbati de formarea
legaturii interatomice. La distanta de echilibru nu apare formarea
benzilor pentru elecronii din substraturile apropiate de nucleu.
In figura 8 se prezinta benzile de energie la cristalul de sodiu.
Formarea benzilor de energie stabile si extinderea lor depinde de
distanta dintre atomi. Procesul incepe cu electronii din straturile
energetice exterioare, care sunt primii perturbati de formarea
legaturii interatomice. La distanta de echilibru nu apare formarea
benzilor pentru elecronii din substraturile apropiate de nucleu.
Teoria benzilor de energie se poate generaliza si la solidele nemetalice.
Structura benzilor de energie (dispunerea reciproca, densitatea starilor permise, marimea barierelor energetice), cat si gradul lor de ocupare cu electroni determina o serie de proprietati fizice ale materialelor (electrice, magnetice, termice, etc.) si stabilitatea fazelor din aliaje.
Se exemplifica proprietatile electrice ale materialelor. In figura 9a s-au prezentat schematic banda de valenta (banda de energie maxima, care contine electronii de valenta.) si banda de conductie (banda superioara, virtual libera).
Pentru ca un solid sa fie conducator de electricitate, trebuie ca electronii sa posede suficienta energie pentru a sari din banda de valenta in banda de conductie.
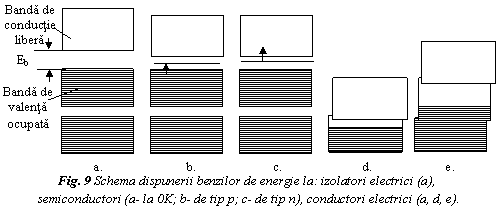
Daca banda de valenta este complet
ocupata si bariera energetica intre cele doua benzi este
larga (Eb>2eV), ea nu poate fi depasita
si solidul se comporta ca un izolator electric (fig. 9a).
Este cazul diamantului, care are bariera energetica Eb = 5,4eV.
![]()
![]() Daca banda
interzisa este mica (Ed ≈ 1eV), solidul va fi semiconductor.
Siliciu si germaniu au aceeasi structura cristalina cu a
diamantului, dar banda interzisa este 1,1 respectiv 0,7eV. La 0K aceste
trei elemente sunt izolatoare electric, deoarece electronii nu au
suficienta energie pentru a depasi bariera energetica. Dar
Si si Ge devin prin incalzire semiconductori intrinseci, deoarece
un anumit numar de electroni poate fi excitat termic in banda de
conductie. De asemenea prin impurificare cu anumite elemente devin semiconductori
extrinseci. Daca se impurifica cu elemente trivalente (Al), apare
un nivel suplimentar acceptor, pe care se deplaseaza electroni din banda
de valenta. Se creaza locuri vacante in banda de
valenta (fig. 9b), obtinandu-se semiconductorii de tip p,
care se se bazeaza pe mobilitatea golurilor. Daca se impurifica
cu elemente pentavalente (P) se creaza niveluri suplimentare donoare, care
alimenteaza cu electroni banda de conductie (fig. 9c). Se obtin semiconductorii
de tip n, bazati pe conductia electronilor.
Daca banda
interzisa este mica (Ed ≈ 1eV), solidul va fi semiconductor.
Siliciu si germaniu au aceeasi structura cristalina cu a
diamantului, dar banda interzisa este 1,1 respectiv 0,7eV. La 0K aceste
trei elemente sunt izolatoare electric, deoarece electronii nu au
suficienta energie pentru a depasi bariera energetica. Dar
Si si Ge devin prin incalzire semiconductori intrinseci, deoarece
un anumit numar de electroni poate fi excitat termic in banda de
conductie. De asemenea prin impurificare cu anumite elemente devin semiconductori
extrinseci. Daca se impurifica cu elemente trivalente (Al), apare
un nivel suplimentar acceptor, pe care se deplaseaza electroni din banda
de valenta. Se creaza locuri vacante in banda de
valenta (fig. 9b), obtinandu-se semiconductorii de tip p,
care se se bazeaza pe mobilitatea golurilor. Daca se impurifica
cu elemente pentavalente (P) se creaza niveluri suplimentare donoare, care
alimenteaza cu electroni banda de conductie (fig. 9c). Se obtin semiconductorii
de tip n, bazati pe conductia electronilor.
Conductorii electrici prezinta: a). banda de valenta incomplet ocupata suprapusa cu banda de conductie (Na si in general metalele monovalente - figura 9d); b). banda de valenta complet ocupata si suprapusa cu banda de conductie (metale bi si trivalente cum sunt Mg, Cu , Al - figura 9e); c). bariera energetica practic nula ( Sn), ceea ce asigura mobilitatea electronilor de valenta indiferent de temperatura. La metale conductivitatea electricǎ creste cu scaderea temperaturii. In apropiere de 0K, unele metale ca Pb, Ag, Ti etc. prezinta fenomenul de supraconductibilitate.
Schimbarea structurii cristaline poate modifica marimea barierei energetice, caracterul legaturii interatomice si.proprietatile electrice. Astfel, staniul α cenusiu, stabil sub 13,2°C, are structura cubica tip diamant si este semiconductor. Staniul β alb, stabil peste aceasta temperatura, are structura tetragonala cu volum centrat si este conductor electric. La temperatura ambianta oxidul de vanadiu VO2, caracterizat prin legaturi iono-covalente, este izolator. Peste 66°C legatura interatomica devine metalica, iar oxidul de vanadiu devine conductor electric.
Proprietatile electrice se pot modifica si daca se supune materialul la o presiune ridicata. Astfel substante care la presiune normala sunt izolatori electrici, la presiuni ridicate devin conductori electrici, pentru ca apropierea atomilor favorizeaza formarea orbitalilor polinucleari.
Atomul este alcatuit dintr-un nucleu central, inconjurat de un sistem de electroni in miscare. Conform mecanicii cuantice, electronii constitue un nor difuz, iar
pozitia lor se considera ca probabilitate de localizare in jurul nucleului. Orbitalii definesc regiuni in jurul nucleului, cu geometrie dependenta de valoarea functiei de unda, care pot fi ocupate de electroni.
Starea unui electron intr-un atom se caracterizeaza prin cele patru numere cuantice, care caracterizeaza marimea (n), forma (l), orientarea orbitalului (ml) si spinul electronului (ms). Ocuparea orbitalilor disponibili de catre electroni se face succesiv in ordinea crescatoare a energiei, respectand principiului excluziunii al lui Pauli si regula lui Hund. Clasamentul elementelor in tabelul periodic corespunde ordinii de completare a orbitalilor cu electroni. Proprietatile chimice ale elementelor depind de electronii orbitalilor periferici, numiti electroni de valenta.
Agregatele atomice se realizeaza din tendinta atomilor de a se dispune la distanta de echilibru, caracterizata de energia potentiala minima, numita energie de coeziune.
Legaturile dintre atomi pot fi legaturi primare puternice sau secundare slabe. Legaturile primare sau chimice sunt determinate de tendinta atomilor participanti de a adopta o configuratie electronica stabila de dublet sau octet. Legatura ionica se realizeaza intre ioni de semn opus, formati prin transfer de electroni. Este o legatura nedirectionata si puternica. Legatura covalenta se creaza prin punerea in comun a electronilor de valenta ai elementelor cu caracter electrochimic identic sau apropiat si formarea orbitalilor moleculari. Este o legatura directionata si foarte puternica. Legatura metalica este o legatura cu caracter covalent nesaturat, la care electronii de valenta sunt polinucleari si nelocalizati. Este nedirectionata si mai slaba decat legatura covalenta.
Legaturile secundare sau fizice sunt determinate de fortele de atractie dintre dipoli atomici sau moleculari. Legatura van der Waals se creaza intre dipoli atomici sau moleculari indusi. Legatura intre molecule polare are la baza fortele de atractie electrostatica intre dipolii permanenti prezenti in moleculele electric asimetrice. Un caz particular de legatura intre molecule polare il reprezinta legatura de hidrogen.
Natura legaturii dintre atomi si molecule determina in cea mai mare parte proprietatile fazelor condensate (solida si lichida). Astfel ductilitatea metalelor se datoreaza in primul rand caracterului izotrop al legaturii metalice. Fragilitatea unor materiale ceramice si organice se datoreaza caracterului orientat al legaturii covalente sau iono-covalente. Ceramicele ionice au caracter fragil, deoarece deformarea plastica prin alunecare este franata de interactiunea ionilor de acelasi semn.
Conform teoriei benzilor de energie, in agregatele atomice se produce diversificarea energiei nivelului atomic unic intr-o banda de energie, cu niveluri energetice apropiate. Structura benzilor de energie (dispunerea reciproca, densitatea starilor permise, marimea barierelor energetice), cat si gradul lor de ocupare cu electroni determina o serie de proprietati fizice ale materialelor (electrice, magnetice, termice etc.) si stabilitatea fazelor din aliaje. Izolatorii electrici prezinta o bariera energetica mare intre banda de valenta completa si cea de conductie libera. Conductorii electrici prezinta banda de valenta incompleta, suprapunerea partiala a benzii de valenta cu cea de conductie sau bariere energetice mici, ceea ce favorizeaza antrenarea usoara in conductie a unui numar mare de electroni. Semiconductorii au bariere energetice relativ mici, care pot fi depasite fie prin activare termica - semiconductorii intriseci, fie prin impurificare-semiconductorii extrinseci.
|