In toate aplicatiile practice cu celule de electrolizei (curatirea si prelucrarea suprafetelor metalice, protectia metalelor prin depuneri galvanice de metale sau straturi de conversie, in electrovopsire) cit si in cele in care intervin celule galvanice (polisare chimica) randamentul procesului de e 24524k1017y lectroliza sau de descarcare este subunitar (respectiv < 100%) datorita fenomenelor de polarizare.
Procesele de polarizare apar cand la interfata metal /solutie de electrolit trece un curent electric: curent de electroliza in celulele de electroliza sau curent de descarcare in celulele galvanice.Trecerea curentului electric modifica valoriea potentialului de electrod. Aceasta schimbare a valorii potentialului de electrod din circuitul deschis la trecerea curentului electric se numeste polarizare. Potentialul electrodului polarizat depinde de valoarea curentului ce trece la interfata metal /solutie.
Fenomenul de polarizare se studiaza analizind mecanismul reactiilor de oxidoreducere ce au loc in absenta si la trecerea curentului electric.
Principiul lucrarii Lucrarea practica se ocupa de fenomenele de polarizare la electroliza apei.
In timpul electrolizei apei, intre anod si catod apare o diferenta de potential de semn contrar tensiunii aplicate din exterior, iar cauza lui este desfasurarea unor reactii secundare la electrozi.
Apa este un electrolit slab care se disociaza potrivit reactiei:
H2O↔H+
+
Reactiile care au loc la anod si la catod in celula de electroliza la trecerea curentului electric sunt:
Catod (-): 2H+ + 2e- H2 si
Anod (+): 2OH- - 2e- H2O + 1/2 O2
La valori mici ale tensiuni aplicate, hidrogenul si oxigenul care se formeaza in stare de gaz nu se desprind de electrozi. Astfel, la catodul celulei de electroliza se acumuleaza hidrogen molecular in stare de gaz, formand electrodul de hidrogen, iar la anodul celulei de electroliza se acumuleaza oxigen in stare de gaz, formand electrodul de oxigen.
Circuitul fiind inchis, simultan functioneaza si celula de electroliza si in opozitie cu ea (legata in paralel) celula galvanica (-) (Pt) H2 / H+ OH- / O2 (Pt) (+) care determina aparitia fenomenelor de polarizare.
Polarizare celulei de electroliza este evaluata cantitativ prin de tensiunea de polarizare Ep data de relatia : Ep=Ed −Ei=0 unde Ed este tensiunea de descompunere obtinuta experimental.
iar Ei=0 reprezinta tensiunea electromotoare( t.e.m.) a pilei electrice ce determina fenomenul de polarizare cand curentul de electroliza este zero
In absenta fenomenelor de polarizare la i=0 tensiunea electromotoare a acestei pile este egala cu tensiune de descompunere, notata cu Ed= Ei=0 si este egala cu diferenta intre valoarea potentialului electrodului pe care are loc reactia catodic j si valoarea potentialului electrodului pe care are loc reactia anodica j
E d= j j
![]()
Reactiile electrochimice din pila sunt:
Catod (+): H2O + 1/2 O2 + 2e- 2OH-
Anod (-): H+ + e- 1/2 H2

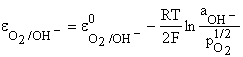 si
si
In practica tehnologica, pentru randamenta mari, tensiunea aplicata din exterior trebuie sa depaseasca valoarea tensiunii de descompunere. Tensiunea minima care trebuie aplicata la electrozi pentru ca electroliza sa se desfasoare continuu si cu randament bun se numeste tensiune de descompunere si se noteaza cu Ed.
In experiment se va determina tensiunea de descompunere in cazul electrolizei apei in solutii slab acidulate (pH = 6) sau slab alcalinizate (pH = 8)
Tensiune de descompunere se determina experimental cu ajutorul curbei care arata variatia intensitatii curentului de electroliza in functie de tensiunea aplicata din exterior.
Aparatura si substante: pahare Berzelius cu apa distilata acidulata (cu H2SO4) si cu apa distilata alcalinizata (cu NaOH), 2 electrozi inerti, sursa stabilizata de curent continuu cu rezistenta variabila, voltmetru, ampermetru.
Mod de lucru Se realizeaza montajul de electroliza ca in figura de mai jos. Se foloseste intii celula de electroliza care contine apa acidulata.
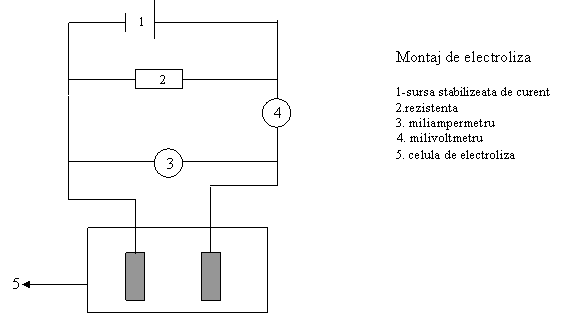
Se porneste sursa de curent continuu. Se regleaza tensiunea celulei de electroliza din potentiometrele sursei pana cand tensiunea indicata de voltmetrul din circuit este 1 V; se masoara intensitatea curentului corespunzator acestei valori pe scala cea mai potrivita a miliampermetrului. Procedand similar, se fixeaza tensiuni cu valorile: 1.2 V, 1.4 V, 1.8 V, 2.0 V, 2.2 V si 2.4 V si se citesc valorile intensitatilor curentului corespunzator fiecarei tensiuni aplicate.
Rezultate: Se completeaza tabelul de mai jos cu valorile masurate ale intensitatii curentului.
|
Electrolit\Tensiunea aplicata |
1.0 V |
1.2 V |
1.4 V |
1.6 V |
1.8 V |
2.0 V |
2.2 V |
2.4 V |
|
Apa acidulata pH=6 (H2SO4, solutie diluata) | ||||||||
|
Apa alcalinizata pH=8 (NaOH, solutie diluata) |
Se traseaza diagramele curent-tensiune pentru fiecare din cele doua solutii
Se determina tensiunea de descompunere pentru fiecare solutie, la intersectia tangentelor la cele doua ramuri ale curbei de forma conform figurii de mai jos.
![]()
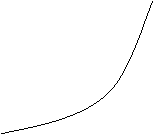
![]() I(mA)
I(mA)
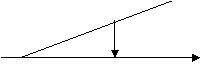
Ed E (V)
Interpretarea rezultatelor
Se calculeaza tensiunea de descompunere in absenta fenomenelor de polarizare.Ed pentru cele doua pH-uri ale apei.
Se cevalueaza din grafic tensiunea de descompunere pentru cele doua solutii apoase.
Tema de casa
Se calculeaza tensiunea de polarizare cu ajutorul formulei: Ep=Ed grafic − Edcalculat
Se dau:2.303 (RT/F) = 0.059

![]()
![]()
 pH + pOH = 14
pH + pOH = 14
|