Pasivarea spontana a materialelor metalice
În solutii diluate metalul se dizolva dupa mecanismul coroziunii metalelor în acizi si viteza de coroziune creste odata cu concentratia acidului.
Desi expusa într-un electrolit în conditii în care coroziunea este posibila termodinamic, o suprafata metalica devine pasiva când ramâne vizibil neschi 17317p157r mbata pentru o perioada de timp nedefinita; pasivarea consta în inhibarea cinetica a procesului de coroziune.
În stare de pasivitate metalele sunt practic imune la coroziune si, din punct de vedere electrochimic, se comporta ca metalele nobile inatacabile. Trecerea unui metal din stare activa în stare pasiva este conditionata de atingerea parametrilor critici de pasivare: iCR si ep, fie prin polarizare anodica de la o sursa exterioara de curent, fie prin reducerea unui oxidant, prezent în mediul de coroziune, care îndeplineste anumite conditii.
Un metal expus într-o solutie corosiva sufera pe suprafata lui doua procese: oxidarea metalului si reducerea agentului oxidant din solutie. Pentru un metal care prezinta tranzitia activ pasiv, acest fapt poate fi ilustrat prin suprapunerea curbei de reducere catodica a oxidantului peste curba anodica a metalului.
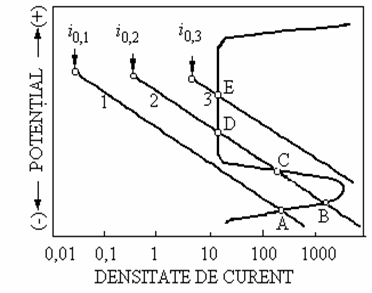
Fig. 9.10. Efectul densitatii curentului de schimb al reactiei catodice de coroziune (controlata de transferul de sarcina) asupra stabilitatii starii pasive
Cele trei curbe catodice reprezinta procese de reducere controlate de polarizatia de transfer de sarcina (comportare Tafel), având diferite densitati ale curentului de schimb, i0. Considerând cazul (1), aplicarea teoriei potentialului mixt (Wagner si Traud) indica existenta unui singur potential stabil în punctul A, în care este îndeplinita conditia ca viteza totala de reducere sa fie egala cu viteza totala de oxidare. În cazul (2) exista trei puncte (B, C si D), în care este îndeplinita aceasta conditie. Totusi, punctul C nu reprezinta o stare stabila, fiind situat în domeniul de tranzitie. Deci, numai potentialele corespunzatoare punctelor B si D sunt stabile pentru acest sistem. Punctul B este situat în domeniul activ si corespunde unei viteze de coroziune ridicate, în timp ce punctul D este situat în domeniul pasiv si viteza de coroziune corespunzatoare este foarte mica. Pentru cazul (3) exista un singur potential stabil, corespunzator punctului E, situat în domeniul pasiv.
Exemplele de mai sus indica existenta a trei posibilitati distincte: 1) sistemul metal/mediu este stabil numai în stare activa, 2) sistemul metal/mediu este stabil fie în stare activa, fie în stare pasiva si 3) numai starea pasiva este stabila. Din punct de vedere al rezistentei la coroziune, cazul (3) este cel mai favorabil, deoarece un sistem metal/mediu corosiv se va pasiva spontan.
Se observa ca pasivarea spontana este dependenta de pozitia relativa a curbei de reducere catodica si maximul curbei de dizolvare a metalului. Un metal prezentând tranzitia activ-pasiv, se va pasiva spontan daca densitatea curentului catodic la potentialul de pasivizare, ic (ep este egala sau mai mare decât densitatea curentului critic de pasivizare, iCR
Acest criteriu poate servi la definirea unui indice de pasivare, P, conform relatiei:
Pentru un proces catodic controlat de transferul de sarcina, indicele de pasivare, poate fi calculat cu relatia:
în care: i0,c - densitatea curentului de schimb a reactiei catodice de coroziune; hP - polarizatia catodica la eP; bc - panta Tafel a reactiei catodice.
În cazul unui proces catodic controlat de difuzie, P depinde numai de iCR si iL (densitatea curentului limita de reducere a oxidantului) si este independent de potential:
Indicele de pasivizare poate fi utilizat ca o masura cantitativa a tendintei la pasivizare a unui metal într-un mediu corosiv. Daca P 1, metalul se pasivizeaza spontan; daca P < 1, metalul nu poate sa treaca spontan din stare activa în stare pasiva, desi poate sa existe o regiune pasiva stabila. Daca P creste de la 0 la 1, tendinta de pasivizare spontana creste proportional.
1.6. Factori externi care influenteaza viteza de coroziune
Principalele
caracteristici ale solutiei de electrolit care influenteza
viteza coroziunii omogene sunt: pH-ul,
continutul în O2 dizolvat, prezenta acceleratorilor sau
inhibitorilor de coroziune, concentratia, viteza de curgere si
temperatura.
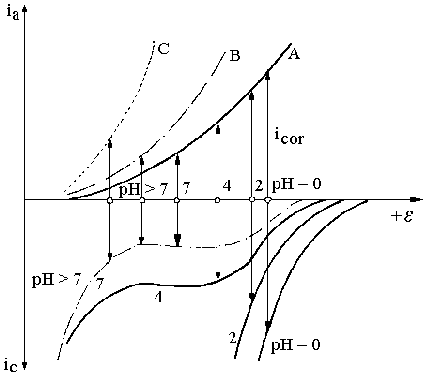
Fig. 9.11. Dependenta de pH a vitezei de coroziune a unui metal care se corodeaza cu degajare de H2 si cu reducere de O2: A - curba partiala anodica la dizolvarea metalului, fara participarea ionilor OH-; B si C - sub influenta catalitica a ionilor OH- asupra reactiei anodice.
Influenta pH-ului asupra vitezei de coroziune depinde de natura metalului, de solubilitatea produselor de coroziune si de cinetica reactiei de degajare a H2 pe suprafata metalica.
Astfel, pH-ul are influenta directa asupra potentialelor de echilibru ale principalelor reactii catodice de coroziune degajarea H2 si reducerea O2 dizolvat care scad cu 0,059 V la cresterea pH-ului cu o unitate. Astfel, scaderea pH-ului va creste tendinta termodinamica si va determina cresterea vitezei de coroziune.
Curbele de polarizare catodice corespund reactiilor de reducere a ionilor H+, de reducere a O2 si descarcarea moleculelor de apa cu degajare de H2.
În solutii puternic acide si agitate, la pH 3, reactia de reducere a ionilor H+ este controlata de polarizatia de transfer de sarcina, si o dependenta exponentiala leaga densitatea curentului de degajare a H2 de polarizatie (curbele 1 si 2). La pH 4, în solutii netamponate, reactia este controlata de polarizatia de difuzie, viteza reactiei este limitata, potentialul catodic se deplaseaza spre valori mai electronegative, astfel încât devine posibila descarcarea moleculelor de apa cu degajare de H2 (curba 4). Reactia de reducere a O2 dizolvat este controlata de difuzia O2 la suprafata metalului (curba 7).
Curba de polarizatie anodica partiala A corespunde cazului când viteza de dizolvare a metalului nu depinde de pH si potentialul de coroziune se deplaseaza spre valori mai negative simultan cu scaderea vitezei de coroziune odata cu cresterea pH-ului. La pH 7 viteza de coroziune este data de curentul limita de reducere al O2 deoarece curentul limita de reducere a ionilor H+ este neglijabil.
Când reactia anodica este catalizata de ionii OH , curba A se deplaseaza în directia potentialelor negative odata cu cresterea pH-ului, ceea ce duce la aparitia a doua posibilitati: fie curba ocupa pozitia B, adica se mentine dependenta vitezei de coroziune de pH în solutii neutre sau slab alcaline, fie curba ocupa pozitia C, când pentru valori ridicate ale pH-ului ionii metalului pot forma hidroxocomplecsi cu ionul OH- si viteza de coroziune începe din nou sa creasca pe seama degajarii H2 din descarcarea moleculelor de apa (2H2O + 2e H2 + 2OH-).
Influenta oxigenului dizolvat. Interes deosebit prezinta cazurile coroziunii în solutii apoase neutre (6 pH 8), carora le apartin majoritatea mediilor agresive naturale. La temperaturi obisnuite, pe de o parte reactia de degajare a H2 pe seama reducerii ionilor H+ practic lipseste, iar pe de alta parte, potentialul de coroziune capata valori la care descarcarea moleculelor de apa cu degajare de H2 este suficient de mica. În plus, potentialul de coroziune se situeaza suficient de departe de potentialul de echilibru al O2, astfel încât si curentul anodic de degajare al O2 poate fi neglijat. În acest caz, diagrama de coroziune va fi determinata practic numai de curba de ionizare a metalului si curba de reducere a oxigenului dizolvat.
Densitatea curentului de schimb, ![]() , chiar pe metale libere de filme oxidice, are valori foarte
mici (10-10 10-13 A/cm2),
ceea ce face ca la polarizatii mici sa predomine cinetica de transfer
de sarcina; la polarizatii catodice mari, datorita
solubilitatii reduse a O2 în apa, va domina cinetica
de difuzie.
, chiar pe metale libere de filme oxidice, are valori foarte
mici (10-10 10-13 A/cm2),
ceea ce face ca la polarizatii mici sa predomine cinetica de transfer
de sarcina; la polarizatii catodice mari, datorita
solubilitatii reduse a O2 în apa, va domina cinetica
de difuzie.
În cazul metalelor cu potentiale de echilibru suficient de electronegative, chiar în medii aproape neutre, trebuie luata în consideratie si degajarea H2 din descarcarea catodica a H2O.
Curba catodica C este suma curentilor partiali de reducere
ai O2, ![]() si de degajare a H2,
si de degajare a H2,
![]() , pe seama descarcarii apei.
, pe seama descarcarii apei.
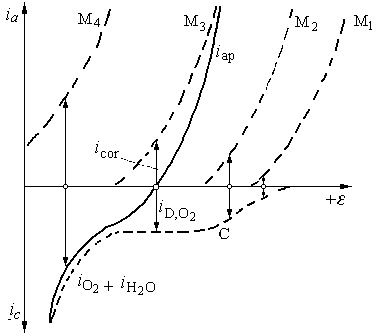
În figura 9.12 sunt
reprezentate 4 pozitii tipice ale curbelor partiale de polarizare
anodica ale dizolvarii metalului. Curba M1, careia îi
corespunde un potential de coroziune la care viteza de reducere a O2,
![]() , este mica în comparatie cu densitatea curentului
limita de difuzie,
, este mica în comparatie cu densitatea curentului
limita de difuzie, ![]() .
.
Fig. 9.12. Diagrama de coroziune a unui metal în solutii neutre: C curba catodica partiala de reducere a O2 si descarcarea simultana a H2O cu degajare de H2; M curbe partiale de dizolvare anodica a metalului; M1 în domeniul cineticii de transfer de sarcina a O2; M2 în domeniul cineticii combinate a reducerii O2; M3 în domeniul cineticii de difuzie a O2; M4 în domeniul descarcarii H2O.
Curba M2 corespunde cazului, când potentialul de coroziune se stabileste în domeniul de potentiale, la care apare deja frânarea determinata de transferul de masa, fara sa se atinga curentul limita de difuzie, adica în domeniul cineticii combinate a reactiei de reducere a oxigenului.
Pentru curba M3, potentialul de coroziune se
stabileste în domeniul densitatii curentului limita de
difuzie al oxigenului, ![]() si viteza de
coroziune este data de relatia:
si viteza de
coroziune este data de relatia:
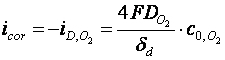 (9.56)
(9.56)
daca molecule de O2 se reduc pâna la ionii OH . Acest caz corespunde coroziunii fierului si otelului nealiat în solutii neutre.
Curba continua, iap, reprezinta curba de polarizare totala a sistemului de coroziune, care poate fi obtinuta pe cale experimentala.
În fine, curba M4 corespunde cazurilor când potentialul de coroziune este suficient de negativ, când alaturi de reducerea O2 are loc si degajarea H2 din apa, ceea ce va intensifica viteza de coroziune, cu deosebire în solutii alcaline.
În conditiile unui control de difuzie, viteza de coroziune este
direct proportionala cu concentratia oxigenului dizolvat, ![]() . La rândul ei concentratia oxigenului dizolvat scade
odata cu marirea concentratiei totale a solutiei si a
temperaturii si creste cu presiunea.
. La rândul ei concentratia oxigenului dizolvat scade
odata cu marirea concentratiei totale a solutiei si a
temperaturii si creste cu presiunea.
Influenta acceleratorilor de coroziune. Sunt considerati acceleratori acei compusi care, adaugati într-o solutie apoasa corosiva (care contine H+ sau O2 dizolvat), determina intensificarea vitezei de coroziune.
Principalii acceleratori ai vitezei de coroziune sunt: agentii de complexare, ionii de halogen, în special Cl-, ionii metalelor cu doua valente, cum sunt: Fe3+, Fe2+.
Ionii de Cl- actioneaza ca activatori ai reactiei anodice, determinând deplasarea potentialului de coroziune spre valori mai negative si cresterea vitezei de coroziune. În prezenta lor mecanismul reactiei de dizolvare a metalului se modifica, implicând formarea de specii intermediare adsorbite, (MCl)ads, care pot împiedica aparitia straturilor pasive.
La valori ridicate de pH, gradul de adsorbtie al ionilor Cl pe suprafata metalului este mic, din cauza competitiei cu ionii OH . Daca pH-ul scade, adsorbtia de OH este mai mica si în consecinta creste adsorbtia ionilor Cl , care intensifica viteza de coroziune.
Prezenta ionilor Cl- în solutie intensifica coroziunea metalelor active, îngreunând formarea filmului pasiv, precum si a metalelor pasive, prin inducerea coroziunii pitting.
Agentii de complexare (NH3, ionul CN , substante organice) actioneaza ca acceleratori anodici, deoarece formarea combinatiilor complexe, determina scaderea concentratiei de echilibru a ionilor metalici, deplasând potentialul în sens negativ, ceea ce are ca efect scaderea stabilitatii termodinamice a metalului si intensificarea reactiei anodice a procesului de coroziune.
În prezenta ionului CN , chiar metalele nobile devin active datorita formarii cianurilor complexe.
Ionii de Fe2+ si Fe3+ actioneaza ca
acceleratori catodici în solutii acide, determinând intensificarea
deosebita a coroziunii omogene, în special în prezenta oxigenului
dizolvat. În absenta ionilor Fe2+, Fe3+ în
solutie pe metal se stabileste potentialul de coroziune, ecor,1,
la care densitatea curentului de coroziune, icor,1, este egala
cu suma densitatilor curentilor catodici de reducere a
oxigenului, ![]() si a ionilor de
hidrogen, iH.
si a ionilor de
hidrogen, iH.
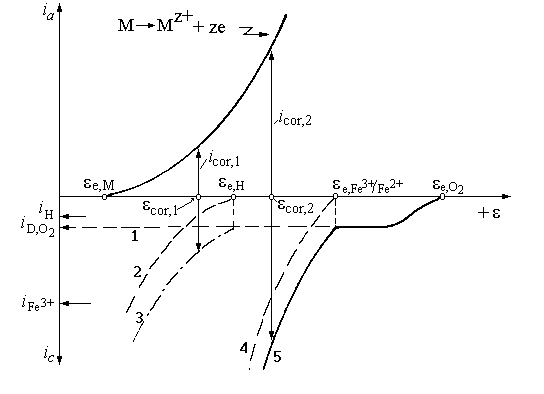
Ionii Fe3+
se reduc în procesul catodic (curba 4), conform reactiei: Fe3+
+ e Fe2+, pentru care i0
are valori însemnate ( 10 A/m2), ceea ce
face ca etapa electrochimica sa fie foarte rapida. În plus,
reactia nu este frânata nici de polarizatia de difuzie,
concentratia ionilor Fe3+ fiind nelimitata, deoarece ionii
Fe2+ rezultati în procesul de reducere pot fi reoxidati.
Fig. 9.14. Influenta ionilor Fe3+, Fe2+ asupra coroziunii unui metal în solutii acide aerate: 1 reducerea O2; 2 degajarea H2; 3 suma (1 + 2); 4 reducerea Fe3+; 5 suma (1 + 4).
În prezenta ionilor Fe3+ în solutie, potentialul de coroziune al metalului se deplaseaza spre valori mai electropozitive, ecor,2, la care viteza de coroziune a crescut la icor,2 pe seama maririi vitezei reactiei catodice, determinata de reducerea ionilor Fe3+.
În functie de aciditatea solutiei si pozitia potentialului de coroziune, ecor,2, fata de reactia hidrogenului, acesta din urma poate sau nu sa participe la procesul catodic. Pentru simplificarea diagramei s-a prezentat cazul neparticiparii ionilor de hidrogen la procesul catodic, în prezenta ionilor Fe2+, Fe3+.
Astfel, coroziunea fierului în solutii acide aerate este stimulata chiar de ionii Fe2+ rezultati în procesul primar de coroziune, care pot fi oxidati la Fe3+ de catre oxigenul prezent procesul de coroziune fiind autocatalitic.
Temperatura afecteaza într-o masura însemnata coroziunea omogena.
În cazul reactiilor controlate de transferul de sarcina constanta de viteza este functie de energia de activare prin factorul exp( Ea/RT). Astfel energia de activare, Ea, a reactiilor de transfer de sarcina, trebuie sa fie comparabila cu energia de activare a reactiilor chimice obisnuite si în aceste conditii se poate astepta o dependenta puternica a vitezei de coroziune de temperatura.
Deoarece si coeficientul de difuzie se afla într-o dependenta exponentiala de temperatura, pentru multe procese de coroziune s-a observat o dependenta exponentiala de temperatura a vitezei de coroziune, care poate fi aproximata cu ecuatia lui Arrhenius:
![]() (9.60)
(9.60)
În cazul coroziunii cu reducere de oxigen, temperatura are un rol mai complex. Pe de o parte intensifica transferul de sarcina si difuzia oxigenului la suprafata metalului, iar pe de alta parte reduce solubilitatea oxigenului.
Influenta concentratiei si a vitezei de curgere a mediului de coroziune asupra vitezei de coroziune depinde de caracteristicile metalului si ale solutiei, precum si de tipul de control al sistemelor de coroziune.
|