EXTRACTIA ENZIMELOR
Este evident ca pentru a putea intelege in detaliu comportarea unei enzime intr-un sistem complex in care exista ea in mod obisnuit - asa cum sunt organitele celulare (mitocondrii, lizozomi, ribozomi etc.), celule, tesuturi, organe parti sau intregul organism – este necesar sa incercam in primul rand sa-i intelegem proprietatile in cel mai simplu sistem posibil. In cele mai multe cazuri, cand enzima este exocelulara, sistemul simplu este constituit dintr-o solutie enzimatica care contine si mici cantitati de ioni, molecule tampon, cofactori, etc. In alte cazuri, insa, cum sunt cele in care enzimele sunt endocelulare, componente a unor organite celulare sau sunt legate de membranele celulare izolarea enzimei este un proces mai complicat, deoarece enzima poate fi inactivata daca in mediu nu exista unii componenti aditionali specifici.
Strategia de alegere a sursei enzimatice
Pentru studierea proprietatilor structurale sau/si biochimice ale unei enzime trebuie aleasa sursa care raspunde cel mai bine cerintelor de izolare cu o
Ø abundenta enzime;
Ø disponibilitatea si pretul de cost;
Ø localizarea intracelulara;
Ø caracterizarea sursei;
Ø studii comparative.
In toate etapele de alegere a sursei trebuie sa se aibe in vedere si stabilitatea enzimei si posibilele dificultati in manipularea sursei.
Metode de extractie
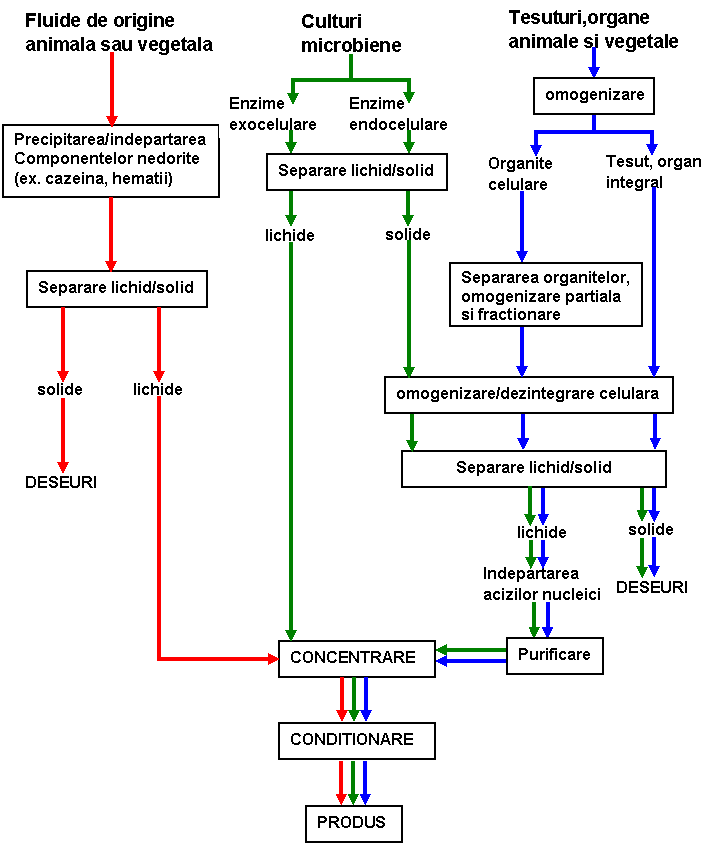
Exista numeroase metode de extractie a enzimelor extracelulare (medii in care acestea se afla in afara celulelor) cat si endocelulare (enzimele se afla in interiorul celulelor) In ultimul caz sunt necesare metode speciale de spargere a celulelor. Alegerea metodei de extractie este dependenta de natura tesutului, organismului sau mediului utilizat ca sursa enzimatica.
Astfel unele materiale biologice permit obtinerea de solutii clare sau aproape clare de proteine, enzime, prin simple procedee de filtrare sau centrifugare deoarece enzimele sunt, in aceste cazuri, libere in solventul (in majoritatea cazurilor apa) materialului biologic respectiv. In aceasta categorie putem aminti ca exemple urmatoarele: urina, laptele, serul sanguin, sucul unor fructe, veninul de sarpe, mediile extracelulare rezultate dupa cultivarea microorganismelor sau a celulelor animale sau vegetale. Alegerea unei astfel de surse prezinta avantajul ca materialul de la care se porneste procedeul de extractie contine un numar relativ mic de componente, iar proteinele extracelulare sunt relativ stabile. Unele dintre aceste surse, cum este urina sau supernatantele culturilor de celule, datorita dilutiei existente, trebuie supuse unor operatii de concentrare inainte de inceperea purificarii efective.
In cazul unor surse este, insa, necesara extractia proteinei cu o anumita activitate enzimatica dintr-un tesut sau dintr-un anumit tip de celula. In aceste cazuri, alaturi de proteina de interes sunt eliberate un numar mare de alte molecule contaminante, printre care si enzime proteolitice, enzime care fac destul de dificila purificarea proteinei de interes. Astfel, extractia si purificarea unei proteine particulare dintr-o sursa solida implica cel mai adesea un compromis intre gradul de recuperare (randament) si puritatea acesteia (factor de purificare).
Dezintegrarea celulelor sau tesuturilor si eliberarea continutului acestora in mediul de extractie se poate realiza printr-o serie de metode specifice. In anumite cazuri se prefera sau este necesara dezintegrarea tesuturilor si prepararea unor populatii omogene de celule intacte inainte de ruperea membranelor celulare.
Alegerea metodei de dezintegrare depinde de sursa si de tipul de tesut sau organ utilizat ca sursa de izolare a enzimei. In urma dezintegrarii celulare se obtin omogenate celulare care contin componentele celulare suspendate in mediul de extractie. Principalele metode utilizate pentru dezintegrarea celulelor sunt :
|
Metoda |
Principiul de baza |
|
Metode blande |
|
|
Liza celulara |
Ruperea osmotica a membranei celulare |
|
Digestia enzimatica |
Ruperea peretilor celulari; eliberarea continutului celular in mediu. |
|
Omogenizator Potter- Elvehjem |
Celulele sunt dezintegrate intr-un spatiu ingust existent intre pistil si peretii de sticla; membranele celulare sunt rupte datorita fortelor care apar; |
|
Metode moderate |
|
|
Omogenizator cu cutite (Warning blendor) |
Membranele sunt taiate cu ajutorul unor lame care se rotesc |
|
Mojarare in prezenta de nisip, alumina sau perle de sticla |
Membranele sunt indepartate prin actiunea abraziva a particulelor de nisip sau alumina |
|
Metode severe |
|
|
Presare (French press) |
Celulele sunt fortate sa treaca prin orificii mici la presiuni foarte mari astfel incat fortele de rupere afecteaza integritatea membranelor |
|
Decompresiune exploziva |
Celulele sunt echilibrate cu un gaz inert la presiune mare, ceea ce determina ruperea membranelor si eliberarea continutului celular |
|
Macinare cu bile (bead mill) |
Vibratiile rapide realizate cu ajutorul perlelor de sticla conduc la indepartarea peretilor celulari |
|
Ultrasonicare |
Tratarea suspensiilor celulare cu frecvente sonice determina ruperea membranelor |
|
Inghet-dezghet repetat |
Ruperea legaturilor de hidrogen si a celor hidrofobe realizate intre enzime si alte componente precum si a membranelor ca urmare a inghetarii apei. |
Se recomanda pe cat posibil utilizarea unor metode de dezintegrare blande, care sa nu afecteze enzima de interes si sa nu determine eliberarea enzimelor degradative din organite celulare de tipul vacuolelor sau/si a lizozomilor.
Separarea, extractia enzimelor
O extractie, separare, o purificare de succes, este determinata, pentru o enzima, o substanta, de evaluarea corecta a proprietatilor specifice ale acesteia.
Pentru alegerea procesului de separare trebuie sa se tina cont in primul rand de sursa enzimatica si de principalele caracteristici ale enzimelor, ce pot fi exploatate in procesele de separare si anume:
Ø dimensiunea;
Ø sarcina electrica;
Ø solubilitatea si
Ø prezenta unor situsuri specifice de legare.
Procesele, etapele fiecarui proces, utilizate pentru separarea, extractia si daca este cazul purificarea unei enzime, trebuie astfel alese incat sa fie cat mai convenabile pentru enzima de interes.
Pentru realizarea unei extractii, indiferent daca este vorba de omogenat global sau din fractii subcelulare si indifferent de natura sursei, prima etapa este omogenizarea totala sau partiala a sursei. O schema generala ce trebuie urmata in acest scop este prezentata in fig nr.:1 In functie de natura sursei, metodele de omogenizare sunt diferite.
Extractia enzimelor din sangele mamiferelor
Sangele poate fi pastrat in mai
multe feluri. Majoritatea enzimelor raman in stare activa pentru o perioada de
cel putin o luna, daca 1 ml sange se adauga 0,15 ml de amestec acid – citrat –
dextroza (ACD), cu un continut de 0,8 g de acid citric, 2,2 g de citrat
trisodic si 2,45 g de dextroza la 100 ml solutie. Amestecul ACD trebuie adaugat
chiar daca sangele a fost prelevat pe anticoagulanti de tipul heparinei sau
Pentru a obtine ser, sangele este prelevat in absenta anticoagulantilor in tuburi de sticla. Dupa formarea cheagului de sange, se centrifugheaza, supernatantul limpede fiind serul.
|
|
 Ø
sonicarea;
Ø
sonicarea;
Ø mojararea in prezenta agentilor abrazivi perioade lungi de timp;
Ø agitarea in prezenta perlelor de sticla;
Ø inghet – dezghet repetat;
Ø aplicarea unor presiuni mari (French press).
Gradul de rupere al peretilor celulari poate fi monitorizat prin examinare microscopica. Daca suspensia celulelor dezintegrate contine agregate gelatinoase de acizi nucleici este indicata sonicarea acestora inainte de centrifugare.
Pe langa problemele ridicate de prezenta peretelui celular dur, drojdiile si alti fungi contin cantitati mari de enzime proteolitice. Acest dezavantaj poate fi minimalizat prin selectia sau constructia unor mutante deficitare in productia de proteinaze sau prin represarea sintezei acestora prin cresterea pe medii care nu contin substraturi proteice. Daca acest lucru nu este posibil este necesara adaugarea de inhibitori ai proteinazelor.
Metode de omogenizare a tesuturilor mamiferelor
Omogenizarea tesuturilor mamiferelor este relativ usoara deoarece cele mai multe dintre acestea nu au peretii celulari rigizi. Extractiile se realizeaza in mod obligatoriu din tesuturi proaspete sau pastrate la – 800C. Inainte de pastrare tesuturile proaspete trebuie inghetate rapid in azot lichid (- 1960C). Inainte de a fi prelucrate/omogenizate este necesar ca probele de tesut sa fie spalate cu o solutie salina de concentratie 1,8% pentru indepartarea sangelui contaminant.
In mod obisnuit tesutul este taiat in bucati mici, maruntit apoi omogenizat cu ajutorul unor aparate numite omogenizatoare de tip Waring Blender sau Potter-Elvehjem. In general tesuturile mai tari, cum sunt muschii scheletici sau cei ai inimii, sunt tocate si omogenizate cu aparate de tip Waring Blender care este prevazut cu cutite metalice. Tesuturile moi, cum sunt cele de ficat sau creier sunt omogenizate cu aparate de tip Potter-Elvehjem. Acesta este format dintr-un pistil de Teflon sau sticla care este atasat la o tija de metal si introdus intr-un vas de sticla grunjos pe interior. In spatiul ingust dintre sticla si pistil se introduce o cantitate corespunzatoare de tesut si mediu de extractie. Pistilul este rotit rapid (in medie cu 1000 rpm), miscare care determina dezintegrarea tesuturilor si celulelor.
Omogenizarile cu astfel de aparate trebuie realizate la rece pentru a preveni incalzirea probelor.
Extractia enzimelor prin procesul de omogenizare se realizeaza in cele mai multe cazuri timp de 30 de minute. Omogenatul obtinut este centrifugat si extractul clar obtinut este extractul proteic total (EPT).
Pentru realizarea unei extractii prin omogenizare se folosesc medii extractive. Mediile de extractie utilizate sunt diverse si se aleg in functie de tesutul ce se omogenizeaza de natura enzimei si de localizarea intracelulara a enzimei de interes.
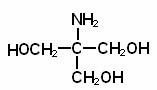
Taria ionica a mediilor de extractie se alege in functie de solubilitatea enzimeleor de interes. Astfel enzimele usor solubile se extrag in medii cu tarii ionice mici (de exemplu creatin kinaza din muschi este extrasa cu o solutie de KCl 0,01 M), iar cele mai greu solubile in medii cu tarii ionice mari. In cazul in care se doreste dezintegrarea organitelor subcelulare se utilizeaza medii de extractie izotonice. Solutiile izotonice realizeaza aceiasi presiune osmotica ca cea datorata continutului celular si contin in general 0,3 moli ۰L-1 specii dizolvate. Astfel de solutii sunt cele de zaharoza sau manitol tamponate cu Tris [Tris(hidroximetil)aminometan)] sau Hepes [acid 4-(2-hidroxietil)-1-piperazinetan sulfonic] la pH = 7,4zaharoza
Tris Hepes
Unele enzime nu pot fi eliberate in mediu dupa dezintegrare cu ajutorul omogenizatoarelor. De exemplu mitocondriile nu sunt dezintegrate complet prin astfel de metode. In astfel de situatii se procedeaza fie la sonicare pe perioade de timp de pana la 1 minut, fie la aditia unor cantitati mici de detergenti (Triton X-100, deoxicolat de sodiu). De exemplu Triton X-100 in concentratie de 0,1% (w/v) creste solubilizarea 5-nucleotidazei si adenozin kinazei din multe tesuturi.
Unele enzime exista 626f56g in tesuturile animale sub forme interconvertibile, dintre care unele sunt mai putin active. In astfel de cazuri se recomanda alegerea mediului si conditiilor de extractie adecvate pentru obtinerea formei active. De exemplu, forma activa a glicogen fosforilazei, forma a, poate fi obtinuta daca extractia se realizeaza la pH = 6,2 si in prezenta ATP – ului, Mg2+, Ca2+ si F-. In aceste conditii fosforilaza fosfataza, enzima care converteste forma a la forma inactiva b, sunt inhibate, iar fosforilaza kinaza, enzima care catalizeaza conversia la forma a este activata. Fosforilaza b poate fi extrasa in prezenta activatorului sau alosteric AMP-ul.
Metode de omogenizare a materialelor biologice vegetale
Extractia enzimelor din plante ridica probleme speciale datorita:
HS-CH2-CH2-OH
2 – mercaptoetanol polivinilpirolidona
Observatie
Contaminarea EPT – ului cu acizi nucleici poate fi estimata prin masurarea absorbtiei la 260 si la 280 nm. Daca raportul absorbantelor se apropie de valoarea 1, contaminarea cu acizi nucleici este mare.
Interactiile proteine – acizi nucleici pot fi slabite prin cresterea tariei ionice a mediului si ca un rezultat precipitare fie a acizilor nucleic fie a proteinelor.
Acizii nucleici pot fi indepartati prin metode de precipitare cu sulfat de protamina (concentratie finala de 0,2 – 0,4 g la 100 ml), streptomicina (concentratie finala de 1 – 2 g la 100 ml) sau MnCl2 (50 mM). O alta alternativa este aditia de deoxiribonucleaza I (10 mg/ml), enzima care degradeaza ADN-ul.
Proteinele se precipita in general prin intermediul sulfatului de amoniu pana la o concentratie de 0,2 M. Dupa realizarea extractiei sulfatul trebuie indepartat din mediu acest lucru efectuandu-se de obicei prin dializa.
Izolarea organitelor celulare
Izolarea organitelor celulare este necesara atunci cand enzima de interes are o localizare intracelulara. Avand in vedere faptul ca, formele moleculare ale enzimelor pot avea proprietati cinetice si moleculare diferite, studiul uneia dintre forme, cu o localizare intracelulara caracteristica, nu poate fi realizat decat prin separarea fractiei subcelulare in care aceasta se gaseste.
Au fost puse la punct mai multe procedee de separare a organitelor celulare dintre acestea cele mai utilizate fiind:
Ø Separarea organitelor celulare prin centrifugare diferentiata
Ø Separarea organitelor celulare prin centrifugare izopicnica
Separarea organitelor celulare prin centrifugare diferentiata.
Dupa liza peretilor celulari, organitele celulare din depozitele celulare ale microorganismelor sau tesuturile animale/vegetale pot fi separate prin cresterea treptata a fortei centrifugale. In aceasta tehnica fractiile sedimentate la diferite valori ale fortei centrifugale aplicate, contin diferite organite celulare.
Sedimentarea diferitelor componente ale unui amestec, intr-un camp centrifugal se poate caracteriza prin ecuatia:
![]()
in care:
Exprimarea conditiilor de centrifugare se poate face prin Forta centrifugala relativa (
g = (1,118x10-5) R S2
unde g este forta centrifugal, R raza rotorului in cm si S viteza centrifugii in rotatii per minut.
Integritatea organitelor obtinute se poate evalua prin studii de microscopie electronica.
Puritatea organitelor celulare separate poate fi testata biochimic, prin determinarea activitatii enzimelor marker specifice pentru fiecare formatiune intracelulara. De exemplu, prezenta unei activitati succinat dehidrogenazice, enzima exclusiv mitocondriala, in preparatele nucleare, indica o contaminare a acestora cu mitocondrii.
De exemplu unele enzime marker sunt pentru:
Factori ce influenteaza extractia
Solubilizarea propriu-zisa a unei proteine se realizeaza prin tratarea sursei biologice dezintegrate cu un volum dintr-un anumit mediu de extractie, in diferite conditii experimentale. Alegerea metodei optime de extractie a unei enzime dintr-o sursa biologica necesita o serie de experimente preliminare prin care se stabilesc conditiile optime de extractie, respectiv: metoda de dezintegrare, mediul optim de extractie, raportul optim de extractie (raportul dintre g de tesut si ml mediu de extractie), timpul optim de extractie si temperatura optima de extractie.
Este important ca in timpul procesarii sursei enzimatice si a prelucrarii pana la preparatul enzimatic dorit sa se retina in acesta maximum de activitate enzimatica.
Problemele majore care apar pe parcursul extractiei, purificarii unei proteine sunt:
Solutiile tampon sunt caracterizate prin indicele de tamponare (value buffer) care se defineste ca fiind raportul dintre adaosul de acid tare sau baza tare, exprimat in echivalenti la litru si variatia corespunzatoare a pH-ului si arata capacitatea de tamponare a solutiilor tampon, deci:
![]()
unde: dn este numarul de echivalenti de acid sau baza tare adaugat dpH – variatia de pH la adaosul de acid sau baza tare.
Maximul capacitatii de tamponare apare atunci cand pH
– ul mediului este egal cu valoarea pKa si sistemele tampon au o
capacitate buna de tamponare pe un domeniu de pH egal cu pKa ![]() 1.
1.
Din punctul de vedere al tariei ionice, notata cu μ se calculeaza ca jumatate din suma termenilor obtinuti prin inmultirea concentratiilor, c (molalitati sau molaritati), ale fiecarui ion din solutie, cu patratul valentei sale, Z. Astfel, pentru o solutie continand mai multe specii de ioni, notati cu indicii 1, 2, 3, … n, taria ionica a tuturor ionilor din solutie va fi:
![]()
Majoritatea proteinelor au solubilitate maxima la tarii ionice moderate, cuprinse inttre 0,05 si 0,1 M, valori care sunt alese daca capacitatea de tamponare a sistemului tampon este suficienta in aceste conditii.
Deoarece solutiile tampon sunt in general solutii destul de diluate, in evaluarea celor mai bune tampoane pentru extractia unei enzime de interes se utilizeaza legea dilutiei sau
legea lui Ostwald. Aceasta
arata dependenta constantei de disociere, de gradul de disociere si de concentratie: ![]()
Extractia proteinelor din tesuturi sau celule poate conduce la obtinerea unor solutii de enzime foarte concentrate. In unele compartimente celulare, cum ar fi de exemplu matricea mitocondriala, concentratia proteinelor este de peste 500 mg/ml. Pentru a putea determina activitatea enzimelor, concentratia proteica trebuie redusa la 5 mg/ml in extractele celulare si la 5 mg/ml in solutia unei enzime pure.
In practica s-a constatat insa ca multe enzime isi pierd rapid activitatea daca sunt pastrate in solutii diluate. Acest efect poate fi contracarat prin introducerea unei proteine „inerte”, cum este albumina serica bovina, in concentratie de 1 – 10 mg/ml. Introducerea acestei proteine poate preveni pierderea activitatii enzimatice datorate adsorbtiei pe suprafata veselei utilizate sau degradarii prioritare a acesteia de catre enzimele proteolitice coprezente. Dilutia extractelor proteice poate avea ca efect si disocierea unor cofactori de apoenzima, fenomen care poate determina pierderea activitatii catalitice. Pentru ca acest efect sa poata fi compensat, se recomanda introducerea cofactorului in sistemul tampon utilizat pentru extractie.
Cateva tampoane utilizate pentru extractia proteinelor sunt prezentate in tabelul Utilizarea unor tampoane cu capacitate slaba de tamponare pentru cantitati mari de proteine necesita verificare pH – ului mediului, intrucat proteinele actioneaza ca sisteme tampon. Tampoanele utilizate pentru extractia proteinelor au in general concentratii cuprinse intre 20 si 100 mM (concentratia unui tampon se refera la concentratia tuturor speciilor componente).
Tabel….
Sisteme tampon utilizate pentru extractia proteinelor
|
Tampon |
Valori pKa |
|
Acid acetic/Acetat de sodiu |
|
|
Acid acetic/Acetat de amoniu |
|
|
Acid carbonic/Bicarbonat de sodiu |
|
|
Acid carbonic/Bicarbonat de amoniu |
|
|
Acid citric/Citrat de sodiu |
|
|
fosfat monosodic/fosfat disodic |
|
|
Tris - HCl |
|
|
Tris - fosfat |
|
![]() Tris
: Tris (hidroximetil) aminometan
Tris
: Tris (hidroximetil) aminometan
Unele dintre tampoanele clasice prezentate in tabelul …prezinta unele dezavantaje. Tampoanele fosfat tind sa precipite ionii bivalenti de Mg, Ca, Fe si alti cationi polivalenti. Fosfatul, un metabolit important, inhiba unele enzime cum sunt: kinazele, dehidrogenazele, carboxipeptidazele, ureaza, aril sulfataza, fosfoglucomutaza si altele. Tampoanele care contin pirofosfat precipita cationii polivalenti si au tendinta de a forma complexe, iar cele pe baza de citrat precipita ionii bivalenti de calciu. Astfel de tampoane nu trebuie utilizate in extractia enzimelor pentru care prezenta cationilor respectivi este esentiala in manifestarea functiei lor catalitice.
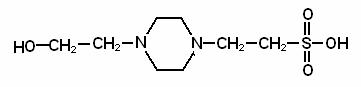
O alternativa mai buna pentru inlocuirea tampoanelor pe baza de fosfati sunt tampoanele de tip Mops [acid 3-morfolinopropan-1 sulfonic] sau Bes [acid N,N-bis(2-hidroxietil)-2-aminoetanesulfonic], tampoane pentru care baza conjugata are sarcina – 1.
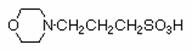
![]()
Mops Bes
Alegerea unui tampon adecvat este un factor esential in extractia unei enzime. pH – ul din interiorul unor organite subcelulare poate diferi de cel exterior din tesut. De exemplu cel din afara organitelor este 7 in timp ce pH – ul din interiorul vacuolelor si lizozomilor este de aproximativ 5. Capacitatea de tamponare a tampoanelor utilizate in astfel de situatii trebuie sa tina seama de acest lucru atunci cand astfel de formatiuni sunt supuse dezintegrarii.
De asemenea in cele mai multe cazuri in extractele obtinute, procesele metabolice continua, fapt care afecteaza pH – ul. Astfel degradarea glicogenului in extractele musculare poate produce o scadere cu o unitate a pH – ului mediului in timp de o ora, scadere datorata acumularii de acid lactic.
Detergentii
In multe cazuri proteinele care trebuie extrase sunt legate de membrane sau se gasesc sub forma de agregate. Pentru solubilizarea unor astfel de proteine interactiile hidrofobe in care acestea sunt implicate trebuie diminuate prin utilizarea detergentilor sau a agentilor caotropici.
Detergentii sunt molecule amfipatice. Cand concentratia lor in mediu creste, ei pot forma micele, la asa numita concentratie critica micelara. Deoarece micelele formate ingreuneaza purificarile prin procedee cromatografice, trebuie utilizate concentratii sub valoarea celei critice micelare.
Citiva dintre detergentii care se utilizeaza frecvent pentru extractia enzimelor sunt prezentati in tabelul…
Tabel….
Detergenti utilizati pentru solubilizarea proteinelor
|
Detergent |
Caracter ionic |
Efect asupra proteinelor |
Concentratie critica micelara |
|
|
mM |
% (w/v) |
|||
|
Tween 80 |
neionic |
Denaturant slab |
|
|
|
Triton X – 100 |
neionic |
Denaturant slab |
|
|
|
Nonidet P – 40 |
neionic |
Denaturant slab |
|
|
|
Dodecil sulfat de sodiu( |
anionic |
Denaturant puternic |
|
|
|
Octil glucozid |
neionic |
Denaturant slab |
|
|
|
CHAPS |
Zwiter-ioni |
Denaturant slab |
|
|
Unii detergenti nu denatureaza proteinele globulare
sau nu interfera cu activitatile biologice ale acestora, in timp ce altii, cum
ar fi
Detergentii trebuie utilizati cu discernamant in extractia enzimelor. Pentru unele enzime detergentii reprezinta singura posibilitate de solubilizare din formatiunile celulare in care sunt incluse, iar pentru altele detergentii sunt agentii denaturanti puternici. In cazul unor enzime utilizarea detergentilor este necesara nu numai la extractie, ci si pe tot parcursul procedeelor de purificare, la finalul purificarii obtinandu-se complexe detergent – enzima.
Fenomene de oxidare
Gruparile tiol ale resturilor de cisteina din structura proteinelor pot suferi modificari pe parcursul procedeelor folosite pentru extractia acestora. In interiorul celulelor, catenele laterale ale resturilor de cisteina, metionina, sunt mentinute in forma redusa (-SH) datorita mediului reducator existent. In urma dezintegrarii, celulele devin expuse oxigenului si apare tendinta ca gruparile SH sa formeze punti disulfurice sau sa fie oxidate. Protejarea gruparilor SH contra oxidarii se realizeaza prin includerea in mediul de extractie a unor agenti reducatori ca: mercaptoetanolul, 1,4-ditioeritritol (DTE) si 1,4-ditiotreitol (DTT). Structura acestor agenti reducatori este prezentata in tabelul . de obicei concentratii cuprinse intre 1 si 25 mM sunt suficiente in protejarea gruparilor tiolice din structura proteinelor, fara a produce scindarea puntilor disulfurice.
Tabel..
Structura unor agenti reducatori
|
Agent |
Structura |
|
2 - mercaptoetanol |
HS-CH2-CH2-OH |
|
1,4-ditioeritritol (DTE) |
HSCH2-HCOH-HCOH-CH2SH (cis) |
|
1,4-ditiotreitol (DTT) |
HSCH2-HCOH-HOCH-CH2SH (trans) |
2 – mercaptoetanolul este un lichid dens, cu un miros neplacut si toxic. Prezenta acestuia in concentratii de 10 – 20 mM in mediul de extractie asigura protectia gruparilor tiol din structura proteinelor pe o perioada de 24 ore. Ditiotreitolul si ditioeritritolul, substante reducatoare puternice, realizeaza protectia gruparilor tiol la concentratii mai scazute ale acestora in mediu (1 mM). Principalul dezavantaj al ditiotreitolului este pretul sau de cost ridicat.
Un agent reducator ce se gaseste in toate plantele este acidul ascorbic. Utilizarea lui este insa limitata doar la produse farmaceutice sau alimente deoarece trebuie adaugat in cantitati mult mai mari decat agentii mentionati anterior si are un pret de cost ridicat.
Un studiu intreprins asupra stabilitatii solutiilor agentilor reducatori a evidentiat ca acestia sunt putin stabili la valori ridicate de pH, la temperaturi ridicate si in prezenta unor concentratii mici de ioni de Ca2+. Includerea in solutiile de acid etilendiamino tetraacetic (EDTA) le mareste stabilitatea.
Prezenta ionilor metalici
O serie de enzime necesita pentru a-si indeplini rolul catalizator prezenta in mediu a unor ioni metalici, in cantitati sub foarte mici, urme, cum sunt a - amilaza (Ca2+), alcool dehidrogenaza (Zn2+), peroxidaza (Fe3+), carbonic anhidraza (Zn2+) sau a altor ioni, majoritatea bivalenti.
Prezenta acestor ioni peste o anumita limita sau a ionilor metalelor grele (Cd, Pb, Hg, Ni) in mediu poate deteriora functia biologica a unor enzime.
Unii ioni au actiune toxica deoarece reactioneaza cu gruparile tiol din structura proteinelor sau intensifica oxidarea acestora in prezenta oxigenului. Metalele grele pot proveni din tesutul utilizat ca sursa biologica, din sticlarie sau din reactivi.
Protectia contra efectelor
induse de metalele grele se realizeaza prin introducerea in mediul de extractie
a unor agenti de chelatare ai acestora. Cel mai utilizat agent de chelatare
este EDTA, care la concentratii ![]() 1 mM in mediul de extractie minimalizeaza
efectele metalelor grele, capacitatea de chelatare a acestora crescand cu
cresterea pH –ului. Avand in vedere ca EDTA este un tampon, se recomanda aditia
sarii disodice a acestuia inainte de ajustarea pH – ului final al mediului.
1 mM in mediul de extractie minimalizeaza
efectele metalelor grele, capacitatea de chelatare a acestora crescand cu
cresterea pH –ului. Avand in vedere ca EDTA este un tampon, se recomanda aditia
sarii disodice a acestuia inainte de ajustarea pH – ului final al mediului.
In cazul in care prin introducerea de EDTA se poate afecta chiar metalul implicat in activitatea enzimatica, fie EDTA este introdus in mediu in cantitati mici, fie mediul de extractie se suplimenteaza cu ionul metalic respectiv. Suplimentul de ion metalic trebuie realizat cu reactivi foarte puri pentru a se evita o potentiala contaminare cu metale grele.
Formarea radicalilor liberi
Extractele celulare preparate prin ultrasonicare sunt supuse actiunii radicalilor liberi care apar ca urmare a scindarii moleculelor de apa la temperaturi locale ridicate induse in aceasta metoda de dezintegrare. Studiile intreprinse au aratat ca efectele nedorite induse de ultrasunete asupra proteinelor pot fi minimalizate prin sonicare unor suspensii avand concentratii celulare mari in prezenta in mediu a unor compusi de tipul zaharurilor sau a N2O, compusi cu actiune protectoare contra radicalilor liberi.
Prezenta enzimelor proteolitice
Una dintre cel mai dificile probleme care apare atat in timpul extractiei cat si pe parcursul purificarii enzimelor este controlul degradarii acestora de catre enzimele proteolitice endogene mai ales in cazul surselor bogate in enzime proteolitice (de exemplu tesuturile animale ca ficatul, splina sau rinichii). Degradarea proteolitica a unei enzime este evidentiata prin urmatoarele constatari experimentale :
Ø Enzima este izolata cu un randament scazut;
Ø Pierderea activitatii enzimatice la incubarea enzimei;
Ø Obtinerea unei rezolutii slabe prin electroforeza in gel de poliacrilamida in prezenta de dodecil sulfat de sodiu (SDS – PAGE), datorata unei heterogenitati la nivelul masei moleculare a enzimei;
Ø Discrepante intre proprietatile enzimei raportate in alte cercetari si cele determinate experimental.
Exista o serie de strategii care minimalizeaza sau suprima proteoliza nedorita. Acestea includ : manipulari la temperaturi scazute la care actiunea proteazelor este incetinita; alegerea ca sursa biologica a unor tesuturi cu putini lizozomi sau a unor tulpini microbiene deficitare in enzime proteolitice; extractia rapida a omogenatului proaspat intr-o solutie apoasa a unui polimer in sistem bifazic; adsorbtia proteazelor pe adsorbanti prin interactii hidrofobe. Inhibarea proteazelor se poate realiza si prin ajustarea pH – ului mediului la o valoare la care acestea nu actioneaza, cu conditia ca aceasta valoare de pH sa nu afecteze stabilitatea proteinei supusa purificarii.
Totusi, cea mai utilizata metoda implica utilizarea, in etapele de extractie si in cele ulterioare, de inhibitori ai enzimelor proteolitice. Inhibitorii reactioneaza si modifica ireversibil unele resturi de aminoacizi implicate in functia enzimelor proteolitice. Cateva exemple de astfel de substante sunt :
Ø
Masuri de protectie. Inhibitorii cum sunt PMSF si DIP sunt foarte toxici
si trebuie manipulati cu mare atentie. O alternativa mai putin periculoasa este
inlocuirea lui prin 3,4 – dicloroisocumarina (
Ø Solubilitate. Unii inhibitori, prezentati in tabel, sunt putin solubili in apa si de aceea se prepara solutii stoc in solventi organici. Volumul din solutiile stoc care se adauga in mediul de extractie trebuie sa fie cit mai mic pentru a minimaliza efectul denaturant al solventilor organici;
Ø Stabilitatea. Inhibitorii sunt instabili in solutii apoase avand timpi de injumatatire redusi. Acest dezavantaj poate fi inlaturat prin adaugarea repetitiva de volume mici din solutiile stoc la extractele proteice.
Contaminarea cu microorganism (mai ales bacterii si virusuri)
O modalitate de a evita cresterea bacteriana in solutiile proteice este utilizarea solutiilor tampon care au fost in prealabil sterilizate si filtrate. Unele tampoane, cum ar fi cele pe baza de fosfat, acetat si carbonat, la pH neutru sunt medii bune de dezvoltare a microorganismelor. Tampoanele cu pH – uri sub 3,0 si cele cu pH peste 9,0 nu permit in mod normal cresterea microorganismelor cu exceptia unor mucegaiuri.
Pentru prevenirea contaminarii bacteriene se recomanda adaugare de agenti antibacterieni la solutiile tampon. Cei mai eficienti agenti bacteriostatici sunt : azida de sodiu in concentratie de 0,001 M, mertiolatul in concentratie 0,005 M si unii alcooli, ca de exemplu butanolul in concentratie de 1%. Azida prezinta dezavantajul ca este o substanta nucleofila care leaga metalele. In cazul in care aceste substante interfera in determinarile de activitate enzimatica sau in separari cromatografice se recomanda adaugarea lor doar la solutiile proteice supuse conservarii.
Formarea de spuma poate duce la distrugerea conformatiei enzimei de interes. Evitarea sau micsorarea cantitatii de spuma ce poate aparea in procesul de separare/extractie a proteinelor este de adaugare a unor antispumanti inerti cum sunt de exemplu uleiul alimentar sau Tween.
PURIFICAREA ENZIMELOR
Comportamentul ideal al unei enzime are loc in conditiile sale naturale de existenta, deci in celula, tesut, mediu de cultura etc. Totusi dupa alegerea unui surse optime si separarea proteinei de interes intr-un Extract Proteic Total (EPT) de cele mai multe ori enzima se purifica mai mult sau mai putin in functie de scopul sau scopurile pentru care a fost izolata. Astfel enzimele se purifica pentru numeroase motive cum sunt de exemplu:
Separarea prin membrane
Procesele de filtrare prin membrane au la baza fenomene de difuziune. Astfel sub influenta unui gradient de concentratie moleculele unei substante dintr-o solutie trec in solutia mai diluata datorita miscarilor de agitatie moleculara formind un flux de difuziune (Fig.– a). Osmoza este o miscare neta a solventului (apa) prin membrana selectiva datorita diferentelor de concentratie a solutului de cele doua parti ale membranei, adica trecerea apei din partea mai diluata spre cea mai concentrata pana cand presiunea din ambele parti este echilibrata(Fig.– c). In procesul de ultrafiltrare sub actiunea presiunii prin membrana trec atat molecule de solvent cat si molecule de mici dimensiuni (Fig.– c). Fenomenul de difuziune al unui solvent intr-o solutie, de care este separat printr-o membrana semipermeabila, genereaza o presiune osmotica, definita ca presiunea de exces care trebuie aplicata solutiei, pentru a preveni trecerea solventului in solutia mai concentrata
Aceste fenomene au condus in ultimul timp la dezvoltarea unor proceduri de izolare si purificare nu numai ieftine ci si superioare calitativ.
Dializa
Procesul de dializa se utilizeaza in biotehnologii in special pentru procese de desalinizare. Moleculele de solut destul de mici pentru a trece prin porii membranei vor difuza din partea cu concentratie ridicata in cea cu concetratia scazuta. Trasatura principala a procesului de dializa este diferenta de concentratie a solutului care va determina miscarea acestuia spre egalizarea concentratiei, nefiind necesare pompe sau vid pentru a determina aceasta migrare.
Acest procedeu este larg folosit mai ales in laborator deoarece desi nu este scump necesita un timp de lucru destul de mare.
De exemplu in procesele de purificare a proteinelor adeseori se utilizeaza precipitarea cu saruri neutre. Pentru indepartarea sarurilor proteinele precipitate sunt introduse in saci de dializa, formati din membrane specifice, acestia sunt inchisi etans si apoi scufundati in volume mari de apa distilata sau solutii tampon adecvate. Moleculele mari de proteine nu trec prin porii membranei, raman in interiorul sacului, in timp ce moleculele mici de sare difuzeaza in apa sau tampon pana la atingerea unui echilibru. Se observa ca sarurile nu au fost eliminate complet din sacul de dializa dar concentratia lor a scazut foarte mult. Pentru eliminarea practic totala a sarurilor sacul de dializa se pune in solutii proaspete de tampon sau apa pana se ajunge la purificarea dorita (fig.).
In prezent exista si sisteme, comerciale, care contin o membrana intre doua spatii, un spatiu pentru proba ce se va dializa si un spatiu pentru tamponul fata de care se face dializa si care este mai mare deoarece tamponul (apa) fata de care se dializeaza se afla intr-un volum de 200-300 ori mai mare (fig.).
Pe langa desalifiere, este necesar ca in procesele de purificare sa fie indepartate si alte molecule. De exemplu in lucrul cu proteine si acizi nucleici este adeseori necesar sa fie indepartati agentii reducatori (ditiotreitol, 2-mercaptoetanol), liganzi care nu au reactionat, reactivi de marcare sau conservanti.
De asemenea acest procedeu se foloseste si atunci cand este necesar sa se schimbe tamponul in care se afla proba.
Ultrafiltrarea
Prin ultrafiltrare, un proces asemanator dializei rezultat din diferente de presiune, se separa compusii in functie de greutatea lor moleculara.
In procesele de ultrafiltrare fluidele sunt trecute dintr-un tanc de prelucrare in modulul de ultrafiltrare care contine membrana specifica prin care moleculele mari nu pot trece. Solutia ce contine moleculele ce nu trec prin membrana se numeste reject sau retentat. Solutia apoasa care a trecut prin membrana se numeste permeat. Modul in care are loc un proces de ultrafiltrare este prezentat in fig.
Fluxul solventului este proportional cu presiunea/forta ce se aplica asupra lui. Ecuatia care reda aceasta curgere este:
jv= Lp∆p (1)
unde jv este volumul de solvent pe unitatea de suprafata si pe unitatea de timp, Lp este permeabilitatea membranei, iar ∆p este scaderea presiunii pe membrana. Fluxul solventului este acelasi cu viteza solventului dar se foloseste termenul de flux pentru a se accentua paralelismul cu ecuatiile de transport pentru procesele de difuzie si electroforeza. Aceasta ecuatie este o alta forma a legii lui Darcy care exprima viteza de curgere intr-un process de filtrare printr-un pat poros:
v = ![]() (2)
(2)
unde k este
De fapt ecuatia (1) este un artifact istoric reflectand evolutia ultrafiltrarii de la membrane de separare si nu de la filtrarea conventionala. In general aceasta nu reprezinta o ecuatie exacta deoarece neglijeaza presiunea osmotica existenta. Forta reala ce se aplica solutiei deriva din variatia de presiune ce se aplica din care se scade presiunea osmotica si efectul datorat trecerii prin membrana a unei cantitati de solut. Deci o ecuatie mai aproape de realitate este:
jv= Lp(∆p-σ∆Π) (3)
unde σ este “coeficient de reflectie”, iar ∆Π este diferenta de presiune osmotica. Atunci cand membrana reflecta toti solutii σ=1, iar daca prin membrane trec usor si solutii si solventul σ=0. Aceasat ecuatie este ecuatia fundamentala pentru procesele de ultrafiltrare.
Membranele disponibile in prezent pentru procese de ultrafiltrare au diametrul porilor de la 1Å la 100Å si pot separa particule cu greutati moleculare de la 1.000 la 1.000.000 daltoni. Ca o regula membranele utilizate sunt anizotropice, formate dintr-un strat subtire de 0,1 – 0,5 µ si reprezinta un filtru care se ataseaza pe o substructura, relativ, groasa (20 µm – 1mm), poroasa care imbunatateste rezistenta mecanica a filtrului.
Filtrele extrem de subtiri permit realizarea unor viteze mari ale fluxului ceea ce permite virtual ca blocajul membranei sa poata fi evitat. Totusi adeseori la suprafata membranei se formeaza un strat secundar de molecule care poate conduce la considerabile schimbari in vitezele de curgere. Pentru a se pastra un strat de grosime minima posibila, solutia este pompata cu o viteza inalta in curent laminar sau turbulent pe langa si prin membrana astfel incat sa se asigure transportul inapoi in solutie a moleculelor colectate la suprafata membranei. Aceasta viteza conduce insa la o crestere considerabila a fortelor de forfecare care pot eventual inactiva enzimele sensibile. S-a constatat insa ca pierderile de activitate sunt totusi relativ scazute mai ales daca concentratiile de proteine sunt destul de scazute.
Aplicatiile ultrafiltrarii pot fi grupate in procese de fractionare, concentrare sau desalifiere.
Fractionarea reprezinta separarea particulelor mari de cele mici.
In concentrare solventul este trecut prin filtru, iar solutul este concentrat la suprafata membranei. Se reduce astfel volumul initial al probei si speciile cu greutate moleculara mare sunt concentrate in asa numitul retentat.
In desalifiere sarurile cu greutate moleculara mica sunt indepartate din proba in permeat. Acest process este denumit si diafiltrare. Indepartarea sarurilor sau inlocuirea lor cu altele se realizeaza prin inlocuirea permeatului permanent cu apa sau un tampon adecvat. Ecuatiile utilizate pentru evaluarea concentratiilor de sare din solutia ce se prelucreaza sunt:
Ecuatiile de mai sus se utilizeaza doar in cazul in care schimbul de solutii are loc intr-un mod continuu. Exista evident si alte modalitati de schimb ca de exemplu in trepte discrete.
Eficienta indepartarii unui contaminant este adesea considerata folosindu-se procentul de rejectie, care este procentul contaminantului particular care nu trece prin membrana sau este rejectata de catre membrana.
Principiul ultrafiltrarii este simplu, eficace, nepoluant si economic. Aceste calitati fac din ultrafiltrare una dintre cele mai convenabile metode de purificare si concentrare in biotehnologii.
Osmoza inversa
Osmoza inversa se bazeaza pe procesul de osmoza. Pentru a intelege procesul de osmoza sa consideram doua solutii de macromolecule, una concentrata cealalta diluata separate printr-o membrana semipermeabila. Osmoza implica miscarea selectiva a solventului (apa) din partea mai diluata spre latura mai concentrata. Ca rezultat solventul ce trece in solutia mai concentrata o va dilua si nivelele din cele doua capilare se vor diferentia , mai inalt fiind cel in care a trecut solventul. Cresterea nivelului in capilar va determina o crestere a presiunii in aceasta solutie si va incetini procesul de dilutie pana la echilibrarea presiunilor cand trecerea solventului se opreste. Aceasta presiune ce poate fi masurata experimental se numeste presiune osmotica. In procesul de osmoza inversa prin aplicarea unei presiuni asupra solutiei mai concentrate se forteaza trecerea apei in sens invers spre solutia diluata (fig.).
Desi procesul de osmoza inversa era folosit doar in industria vinului in prezent este inteles si larg folosit in diferite domenii.
Prin osmoza inversa pot fi concentrati toti compusii care au o greutate moleculara mai mare de 150 – 250 Daltoni asa cum sunt: bacteriile, saruri organice, glucide, proteine, coloranti, saruri etc.
Deoarece cei mai multi dintre contaminanti nu trec prin membrane specifice o data cu apa, prin acest procedeu se poate obtine apa pura. Membranele utilizate in mod obisnuit in acest scop sunt realizate din celuloza – triacetat, celuloza – diacetat sau membrane realizate din poliamide aromatice.
Membranele utilizate pentru osmoza inversa sunt mult mai restrictive decat cele utilizate pentru ultrafiltare.
Prin particularitatile sale osmoza inversa este deosebit de importanta pentru purificarea apei fiind utilizata in tehnicile moderne aplicabile in acest scop.
Desi ultrafiltrarea si osmoza inversa sunt similare ele sunt diferentiate prin unele criterii cum sunt cele prezentate in tabelul nr.
Tabel
Criterii care diferentiaza ultrafiltrarea de osmoza inversa
(Präve, P si colab., 1989)
|
Criteriu |
Ultrafiltrare |
Osmoza inversa |
|
Dimensiunea particulelor retinute |
Greutate moleculara > |
Greutate moleculara < |
|
Presiunea osmotica |
neglijabila |
Considerabila, poate ajunge la 800 – 1000 N/cm2 |
|
Presiunea de lucru |
Pana la 100 N/cm2 |
Mai mare de 100 N/cm2 si poate ajunge la 1500 N/cm2 |
|
Procese principale |
Separare dupa dimensiunea moleculara; efectul de sita; materialul membranei nu are nici o influenta caracteristica importanta fiind dimensiunea porilor. |
Transport prin difuzie; materialul membranei poate afecta proprietatile de transport. |
Gel-filtrarea
|
Fig. 1 Reprezentarea unui proces de cromatografie lichida |
In purificarea enzimelor un loc important este ocupat de procesele de cromatografie. Cromatografia reprezinta o familie de tehnici de separare bazata pe diferitele interactiuni ale biomoleculelor cu cele doua faze: stationara si mobila. Asa cum sugereaza si denumirea, faza stationara reprezinta o faza fixa, imobila, iar faza mobila este un lichid sau un gaz care trece prin faza stationara si preia, elueaza, moleculele. Interactia diferita a moleculelor cu cele doua faze permite separarea lor datorita |
vitezelor lor de miscare, de iesire din coloana cromatografica. Metodele, tehnicile cromatografice sunt extrem de numeroase, de variate. Purificarea biomoleculelor, a proteinelor in special, se realizeaza in in mare masura prin metode cromatografice pe coloana, utilizandu-se un lichid ca faza mobila. Schema generala a unei separari printr-o coloana cromatografica este prezentata in fig.1. Cele mai utilizate tehnici pentru purificarea enzimelor, proteinelor, sunt tehnicile de gel filtrare, cromatografia de schimb ionic si cromatografia de afinitate.
Gel filtrarea (GF) denumita si Cromatografia de permeatie prin gel (GPC) sau Cromatografia de excludere moleculara (SEC) foloseste asa numitele site moleculare sau site structurale. Metoda se bazeaza pe diferentele de marime si structura ale biomoleculelor. Moleculele mici intra in porii matricei fiind retinute in faza stationara in timp ce moleculele mari trec prin coloana cu viteze diferite in functie de greutatea lor moleculara si structura lor (fig.2.).
Separarea depinde nu numai de dimensiunea si de forma moleculelor, dar si de structura gelului si a porilor care depind la randul lor de gradul de imbibare a gelului. Prin aceasta metoda se pot separa la scara enzime, acizi nucleici, carbohidrati si peptide. Este o metoda foarte potrivita pentru bioprodusii sensibili la schimbari de pH, ioni metalici, cofactori sau conditii severe de mediu.
Pentru acest tip de separari paturile cromatografice trebuie sa fie poroase si inerte. Deoarece matricea acestor paturi este constituita in majoritatea cazurilor dintr-un gel inert inalt hidratat metoda este cel mai adesea cunoscuta ca gel filtrare.
= marca Amersham Pharmacia Biotech; 2= marca Bio-Rad Laboratories, INC; 3= marca Pharmacia LKB.
Gradul de separare dintre diferitele macromolecule/molecule depinde de o serie de factori: volumul probei, raportul dintre volumul probei si volumul coloanei, dimensiunile coloanei, dimensiunea particulelor de gel, distributia particulelor, densitatea patului cromatografic, dimensiunea porilor din particule, viteza de curgere, vascozitatea probei si solventului.
Eficienta, succesul unei gel filtrari depinde in primul rand de conditiile alese astfel incat sa se realizeze o selectivitate suficienta si picuri cat mai inguste si fara efecte de asimetrie, varfuri asimetrice “cu coada” sau “frontale”, capacitate de separare slaba sau elutii tarzii.
Separabilitatea a doua componente este caracterizata prin Rezolutia cromatografica RS si se exprima prin:
|
Rs =
|
V1, V2 reprezinta volumele de elutie a doua varfuri
adiacente; W1, W2 largimile la baza varfurilor
respective; (V2 - V1) distanta dintre cele doua
varfuri; |
Parametrii utilizati pentru exprimarea rezolutiei sunt reprezentati in fig..
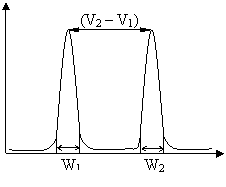
Fig…. Rezolutia a doua varfuri cromatografice
Aceasta rezolutie reprezinta o punte intre teorie si practica, si caracterizeaza succesul unei separari. Acest concept de rezolutie se aplica oricarei metode cromatografice ce se limiteaza la varfuri de tip Gauss.
Alegerea celui mai potrivit gel pentru separarea unor biomolecule se realizeaza prin asa numita curba de selectivitate pentru fiecare matrice posibil a fi utilizata intr-un proces de gel filtrare.
Selectivitatea gel filtrarii depinde numai de distributia si dimensiunea porilor. Daca se se efectueaza un grafic raportand Kav fata de logaritmul greutatii moleculare a unor proteine standard se obtine curba de selectivitate pentru fiecare mediu utilizat pentu gel filtrare. Aceste curbe se folosec pentru alegerea celui mai potrivit mediu pentru o separare data. In cazul unei alegeri corespunzatoare a mediului de filtrare si a conditiilor de lucru pentru anumite proteine curba obtinuta este o dreapta (fig ). In general curba de selectivitate este liniara pe un domeniu al valorilor Kav intre 0,1 si 0,7. Aceasta parte a curbei este utilizata pentru determinarea domeniului de fractionare pentru un gel.
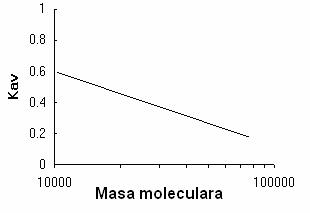
Fig..Relatia dintre Kav si logaritmul masei moleculare.
Domeniul de fractionare defineste pentru un gel domeniul de mase moleculare care au acces partial la porii matricei. Din curba de selectivitate se poate de asemenea determina si limita de excludere care arata dimensiunea moleculelor care pot fi eluate cu volumul liber accesibil tuturor moleculelor sau volumul spatiului gol.
Gel filtrarea este utilizata mai ales la nivel de laborator sau pilot dar poate fi utilizata in anumite cazuri si la scara mare.
Aplicatiile gel filtrarii pot fi:
3. Metode bazate pe polaritatea enzimelor
Cromatografia de schimb ionic (IEC = ion exchange chromatography, IEX = Ionenaustauschchromatographie).
Cromatografia de schimb ionic se utilizeaza inca din secolul 19 (1850), cand Thomson H. si Way, J.T. din Anglia au utilizat argila pentru separarea ionilor de amoniu de ionii de calciu, iar in 1927 s-a utilizat pentru prima oara o coloana de zeolit mineral pentru separarea ionilor de calciu si magneziu de ionii sulfat. Tehnica moderna a cromatografiei de schimb ionic isi are radacinile insa in perioada celui de-al doilea razboi mondial; cand se lucra la realizarea unor metode de separare a elementelor transuranice. Aceste tehnici au condus mai tarziu la dezvoltarea IEC pentru separarea de bioprodusi dar si compusi anorganici.
Astazi cromatografia de schimb ionic (IEC, IEX) este una dintre metodele utilizate curent in purificarea proteinelor in functie de sarcina lor electrica. Separarea proteinelor prin cromatografie de schimb ionic depinde de adsorbtia reversibila a moleculelor incarcate electric catre ionii de semn opus ai matricei.
Succesul utilizarii IEC rezida in faptul ca este o tehnica cu larga aplicabilitate, este o metoda simpla si controlabila, ofera posibilitatea obtinerii unor rezolutii inalte si capacitati de ridicare la scara fara dificultati.
IEC utilizeaza atat faze stationare solide cat si lichide spre deosebire de celelalte metode care se pot ridica la scara folosind aproape numai suporturi solide. O data cu dezvoltarea sintezei polimerilor sintetici s-a realizat si un numar mare de schimbatori de ioni care se folosesc astazi pe scara industriala nu numai pentru purificarea unor bioprodusi ca antibioticele sau enzimele dar si pentru decolorarea sau demineralizarea solutiilor native ale bioprodusilor sau pentru depoluarea/epurarea unor ape reziduale.
In cromatografia de schimb ionic materialele utilizate pentru realizarea paturilor cromatografice, numite si rasini, au numeroase molecule incarcate electric, pozitiv sau negativ, prin grupari legate covalent de suportul de baza al matricei.
Rasinile incarcate pozitiv vor atrage si vor lega reversibil ionii negativi, adica anionii, de aceea ele se numesc schimbatori anionici sau anioniti. In acelasi mod rasinile incarcate negativ se vor numi schimbatori cationici sau cationiti.
Cand rasina este suspendata in tampon gruparile incarcate se asociaza usor prin legaturi ionice cu ionii de sarcina opusa din tampon, ca de exemplu ionii clorurii de sodiu. Acesti ioni, care formeaza cu matricea legaturi slabe sunt numiti ioni mobili de schimb.
In general
schimbatorii de ioni sunt polimeri insolubili in apa ce contin grupari
functionale incarcate negative sau pozitiv. Cationitii au in general grupari
functionale de tipul: - SO![]() ,
-OPO
,
-OPO![]() si –COO-. Majoritatea anionitilor contin grupari amoniu tertiare sau
cuaternare: -NHR
si –COO-. Majoritatea anionitilor contin grupari amoniu tertiare sau
cuaternare: -NHR![]() si -NR
si -NR![]() .
.
Cateva exemple de astfel de rasini sunt prezentate in tabelul..
Table..
Exemple de rasini schimbatoare de ioni
|
|
Gruparea functionala |
|
Schimbatori anionici |
|
|
Dietilaminoetil (DEAE) |
O-CH2-CH2-N+H(CH2CH3)2 |
|
Cuaternar aminoetil (QAE) |
O-CH2-CH2-N+(C2H5)2(CH2-CHOH-CH3) |
|
Amoniu cuaternar (Q) |
-O-CH2-CHOH-CH2-O-CH2-CHOH-CH2-N+(CH3)3 |
|
Schimbatori cationici |
|
|
Carboximetil (CM) |
-O-CH2-COO- |
|
Sulfopropil (SP) |
-O-CH2-CHOH-CH2-O-CH2-CH2-CH2SO |
|
Metilsulfonat (S) |
-O-CH2-CHOH-CH2-O-CH2-CHOH-
CH2SO |
Comportarea proteinelor intr-o coloana cu schimbatori de ioni se modifica datorita incarcarii electrice a schimbatorilor dar si a propriei sarcini nete. pH-ul solutiei, valoarea pK a fiecarei catene laterale si mediul inconjurator influenteaza sarcina fiecarei catene laterale si apoi a intregii proteine. Relatia dintre pH, pK si sarcina fiecarui aminoacid poate fi descrisa prin relatia lui Henderson-Hasselbach.
In general, daca pH-ul solutiei creste are loc o deprotonare a gruparilor acide si bazice din proteine. Astfel gruparea carboxil este convertita la anioni carboxilat (R-COOH →R-COO-) iar gruparile amoniu la grupari amino (R-NH3+ → RH2).
pI este valoarea de pH la care proteinei este neutra. Cand pH>pI proteina are o sarcina neta negativa, cand pH<pI proteina are o sarcina neta pozitiva.
In etapa de separare trebuie sa se tina cont de incarcarea cu sarcini a compusului ce urmeaza a fi purificat. De exemplu sarcina proteinelor este dependenta de structura lor primara adica de compozitia in aminoacizi. Astfel daca sarcina neta a unei proteine este pozitiva, la o valoare de pH = 7 a eluentului, proteina se va lega de sarcinile negative ale fazei stationare, ca de exemplu gruparile carboxil.
Astfel daca o solutie bruta de proteine este trecuta printr-o coloana care atasate covalent grupari functionale incarcate de exemplu negativ, proteinele cu sarcini opuse se vor lega de aceste grupari in timp ce proteinele cu aceiasi sarcina vor fi eluate. Proteina legata va fi apoi eluata fie prin adaugarea de saruri fie prin schimbarea valorii de pH. Ionii din sare vor
neutraliza sarcinile proteinei si ea va fi eluata din coloana.
In general un proces ce utilizeaza cromatografia de schimb ionic pentru purificarea unor molecule decurge in 5 etape (fig…):
Modificarea valorilor de pH permite un control mai fin al procesului de eluare a proteinelor dintr-o solutie complexa, luandu-se in calcul valorile izoelectrice (valori de pH – pI – la care proteinele sunt neutre). Cu cat valoarea pH-ului scade, proteinele devin tot mai pozitive datorita cresterii concentratiei de H+ din mediu. Astfel daca avem o proteina incarcata negativ legata de sarcinile pozitive ale fazei stationare la o valoare de pH = 7, scaderea valorii de pH la 5 va determina elutia tuturor proteinelor cu valori de pI cuprinse intre 5 si 7 (Fig….). Acele proteine care au pI mai mari de 7, au sarcina pozitiva in momentul cand sunt introduse in coloana si vor fi eluate imediat in timp ce cele cu valori ale pI mai scazute decat 5 vor avea o sarcina negativa si la pH = 5 si vor ramane legate de coloana. Prin scaderea valorii de pH in mod lent folosind diferite tampoane, este posibil sa se separe fractii proteice cu valori de pI scazand progresiv. La o schimbare brusca de pH se vor elibera mai multe proteine in acelasi timp si se vor obtine probe mai putin pure.
Din acest motiv si
pentru a realiza rezolutii inalte adeseori se pastreaza valoarea pH-ului
Explicatiile prezentate sugereaza ca pe baza pI al unei proteine se poate prevedea comportarea ei, si in consecinta alegerea schimbatorului adecvat. In practica insa conditiile de separare se determina prin experimentare si evaluarea erorilor deoarece proteinele prin caracterul lor amfoter deviaza gradientul de pH ce se aplica si de aici modificarea comportamentului preconizat. In fapt la alegerea schimbatorului trebuie sa se tina cont si de niste limite de eroare de o parte si alta a pI moleculei de interes.
Cromatofocusarea
Cromatofocusarea este o tehnica derivata din cromatografia de schimb ionic si a focusarii izoelectrice (dezvoltata in perioada 1977 – 1981).
In tehnica de cromatofocusare proteinele sunt adsorbite pe schimbatorul de ioni la limita superioara a domeniului de pH aplicat si apoi se aplica un gradient de pH descrescator prin adaugarea de acid tamponului amfolit, un tampon special format dintr-un amestec de de substante amfolite (electroliti amfoterici) cum sunt poliaminoacizii, care au diferite sarcini si deci diferite puncte isoelectrice (fig…). Echilibrarea coloanei cu un astfel de tampon duce in mod automat la formarea unui gradient interior de pH pe coloana de schimbator.
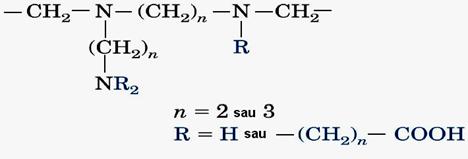
Fig…Formula generala a substantelor amfolite
Proteinele sunt eluate din coloana in ordinea valorii lor de pI. De exemplu pe un schimbator anionic cand pH-ul este mai mic decat pI al proteinei, aceasta va migra si in acest proces pH-ul din jurul proteinei creste cu distanta fata de varful coloanei. Cand a parcurs o distanta suficienta, incat pH-ul sa devina mai mare decat pI, proteina devine incarcata negativ si se leaga de schimbator. Prin dezvoltarea gradientului tamponului de elutie, pH-ul va scadea din nou sub valoarea pI si proteina se va desprinde alunecand in coloana pana cand pH-ul este din nou mai mare de pI proteinei, ceea ce va duce la o noua legare a sa de schimbator.
In acest proces apare, datorita rezistentei opuse de faza stationara la schimbarea valorii de pH prin tamponul de elutie, o legare repetitiva a proteinei de schimbator. Acest fenomen si prezenta gradientului interior de pH permite separarea chiar a unor proteine cu aceiasi sarcina electrica neta dar cu o distributie diferita a sarcinilor la exteriorul proteinei.
Factorii ce influenteaza separarile prin cromatofocusare sunt in principal: sarcinile electrice de la suprafata proteinelor, natura fazei stationare, capacitatea de legare a proteinelor la gruparile incarcate electric din structura fazei stationare , capacitatea de tamponare a fazei mobile si formarea gradientului de pH.
Cromatofocusarea are o rezolutie foarte inalta putand separa proteine a caror pI difera doar cu 0,02 unitati. Din cauza, insa, a costurilor ridicate aceasta tehnica se utilizeaza in general la scara mica si in ultimele etape de purificare.
Electroforeza
Electroforeza reprezinta migrarea cu diferite viteze a bioprodusilor (proteine, acizi nucleici,) sub influenta unui camp electric. Aceasta migrare are loc datorita incarcarii diferite, dimensiunii, formei si a coeficientilor de difuzie a substantelor dizolvate.
Primele experimentari de electroforeza au fost raportate la inceputul secolului 19 (in 1809) de catre omul de stiinta rus Ruess care a observat migrarea unor particule de argila sub influenta unui camp electric. A trebuit sa treaca mai mult de un secol (in 1933) pentru ca o aplicatie concreta de electroforeza sa fie dezvoltata si sa fie brevetata de catre Harsanyi. Totusi primele studii teoretice asupra fenomenului de electroforeza au fost efectuate abia in 1940 si raportate in 1944 (Hamaker si Verwey).
Marea flexibilitate a tehnicii electroforetice a facut ca aceasta sa se dezvolte prin utilizarea a diferite materiale ca mediu electroforetic (ceramici, metale, polimeri), numeroase tehnici si posibilitatea de separare a numeroase categorii de compusi.
Aplicatiile electroforezei la nivel industrial datorita productivitatii ridicate, pretului scazut si posibilitatea de automatizare, se realizeaza in special pentru acoperirea cu metale, vopsire (in industria automobilelor, nichelare, ..), emailare si fabricarea de produse sanitare.
In ceea ce priveste insa caracterizarea, separarea, purificarea biomoleculelor, procesele de electroforeza sunt utilizate, mai ales la nivel de laborator. Astfel separarea si purificarea proteinelor, se realizeaza folosind mici cantitati de probe, iar proteinele se comporta in functie de greutatea lor moleculara si a incarcarii electrice. Electroforeza permite de asemenea masurarea greutatilor moleculare prin compararea cu proteine marker.
Mecanismele prin care au loc procesele electroforetice au fost studiate si explicate prin numeroase teorii care se aplica in general sistemelor coloidale.
O problema majora care face ca aceasta metoda sa nu fie inca utilizata la nivel pilot sau industrial este fenomenul de incalzire care apare ca urmare a trecerii curentului electric. Cantitatea de caldura eliberata este proportionala cu patratul curentului. Daca se lucreaza cu valori mici de curent, incalzirile sunt mici si separarile sunt foarte lente. Efectul acestor incalziri se poate corela cu numarul lui Rayleigh :
Ra = ![]()
unde l este lungimea caracteristica, g este acceleratia datorata gravitatiei, μ este vascozitatea, α este difuzia termica si ∆ρ/∆z este variatia densitatii per lungime determinata de incalzire. Pentru a avea o electroforeza convenabila este necesar ca Ra sa aibe o valoare mica. In laborator acest lucru se obtine prin efectuarea electroforezei in gel. Acesta are o vascozitate ridicata si elimina curentii de convectie care determina incalzirea si cel mai
utilizat gel este
cel de poliacrilamida (
Un aparat de electroforeza este relativ simplu (fig…).
Probele proteice sunt amplasate in godeuri in varful gelului de poliacrilamida (electroforeza verticala) care se afla prins intre doua placi de sticla ca un sandvici. Intr-unul dintre godeuri se pune o proba marker sau martor. Gelul este apoi suspendat intr-un tampon adecvat si se aplica la fiecare capat cate un electrod – sus catodul (―) si jos anodul (+). Tensiunea care se aplica este de obicei de 200 V. Proteinele incarcate negativ vor migra prin gel in functie de greutatea lor moleculara. Deoarece proteinele mai mari leaga mai mult SDS, deci vor avea o incarcare negativa mult mai mare, ne asteptam sa migreze mai repede decat cele mici, mai putin incarcate, dar de fapt nu este asa deoarece poliacrilamida functioneaza ca o sita moleculara ce impiedica migrarea proteinelor mari, totusi sarcina foarte mare ajuta la o migrare mai rapida decat daca moleculele ar avea o sarcina mai mica (fig…).
Dupa electroforeza, diferitele componente din proba pot fi separate prin decuparea portiunilor corespunzatoare de gel si prelucrate mai departe.
Cromatografia hidrofoba
In solutii apoase hidrocarburile hidrofobe, molecule nepolare, tind sa se asocieze intre ele formand agregate care precipita. In cazul proteinelor caracterul hidrofob este determinat de portiunile nepolare din molecule cum sunt de exemplu catenele laterale formate din aminoacizi ca valina, leucina izoleucina, fenil-alanina si triptofanul. In mod obisnuit acesti aminoacizi se orienteaza spre interiorul moleculei de proteina participand la plierea acestora.
Interactiile hidrofobe au o importanta majora in sistemele biologice. Ele sunt implicate nu numai in procesele de pliere ale proteinelor globulare dar si in asocierea subunitatilor proteice, in legarea unor molecule mici la proteine, in procesele de reglare si transport prin membrane. Prezenta catenelor laterale hidrofobe permit proteinelor sa se lege de molecule non-polare. Aceste proprietati sunt utilizate pentru separarea proteinelor prin cromatografie hidrofoba (HIC = Hydrophobic Interaction Chromatography).
Interactia
specifica cu alte biomolecule prin situsuri specifice de legare sau
trasaturi structurale
Cromatografia de afinitate
Prima utilizare a unei tehnici cromatografice de afinitate dateaza din 1910 dar cea care a devenit metoda moderna de azi a fost publicata pentru prima data in 1967 de catre Axen si colaboratorii. Inceputul metodei instrumentale se situeaza in 1978 cand Ohlson a demonstrat pentru prima oara posibilitatea utilizarii ca suport a unor microparticule rigide.
Cromatografia de afinitate acopera o larga varietate de metode de purificare a enzimelor. Factorul comun al acestor metode este interactia, mai mult sau mai putin specifica, dintre enzima si un ligand imobilizat.
Ligandul imobilizat este reprezentat de efectori biospecifici pentru izolarea si/sau purificarea de molecule complementare printr-un proces inalt selectiv de adsorbtie si desorbtie. Acestia sunt in mod obisnuit substratul sau inhibitorul competitiv al enzimei de interes.
Liganzii se pot imparti in doua mari categorii: specifici care leaga doar o specie (de exemplu anticorp/antigen) si generali care leaga un grup specific de molecule. In acord cu aceasta, o sistematizare dupa tipurile de liganzi este prezentata in tabelul…
Tabel…
Liganzi specifici pentru diferite categorii de biomolecule
|
Molecule |
Liganzi |
|
Enzime |
Substrat, inhibitor, cofactor |
|
Anticorpi |
Antigen, virus, celula |
|
Lectina |
Polizaharid, glicoproteina, receptor celular |
|
Acizi nucleici |
Secventa de baza complementara, histona, acid nucleic, polimeraza, proteina legata |
|
Hormoni |
Receptor, proteina transportoare |
Cand intr-o coloana de cromatografie de afinitate se introduce un amestec multicomponent, de ligandul imobilizat se va lega numai molecula complementara. De exemplu daca ligandul este substratul sau inhibitorul unei enzime de interes, numai acea enzima se va lega de acesta, celelalte substante fiind indepartate prin procesul de elutie. Compusul de interes legat se poate recupera prin schimbarea conditiilor de elutie astfel incat legaturile formate sunt desfacute si bioprodusul eluat. Eluarea compusului de interes se poate realiza in general prin:
Ø Elutia cu un compus catre care substanta ce se purifica are o afinitate mai mare decat fata de ligand;
Ø Cu o solutie cu o inalta tarie ionica;
Ø Prin schimbarea valorii de pH;
Ø Prin schimbarea temperaturii.
Astfel aceasta metoda este utilizata in special pentru obtinerea unor compusi de inalta puritate. Este utilizata in completare cu alte metode cand in mod special se doreste sa se separe proteine care au aceiasi specificitate dar incarcare electrica net diferita sau greutati moleculare diferite.
Principul general al cromatografiei de afinitate este prezentat in figura… Solutia bruta de proteine este trecuta printr-o coloana ce contine un suport care are atasate, prin legaturi covalente, molecule ligand specifice pentru proteina de interes. Proteinele care recunosc ligandul se leaga de acesta, iar celelelte sunt eluate. Cand toate proteinele nelegate sunt eluate, proteina legata poate fi eluata de exemplu prin adaugarea unei solutii ce contine ligand liber. Acesta va intra in competitie cu substratul de care este legata proteina si o va elibera.
Aceasta metoda este utilizata nu numai la separarea unor enzime apropiate ca masa moleculara si activitate dar si pentru purificarea unor antibiotice, vitamine, celule specifice etc.
O forma a cromatografiei de afinitate, larg utilizata astazi, este cromatografia de imunoafinitate. In aceasta metoda antigenele sau anticorpii sunt imobilitzati pe un suport solid pentru purificarea de anticorpi respectiv antigene. Acest tip de cromatografie de afinitate insa este foarte scumpa si nu poate fi folosita pe scara mare. In plus adesea performantele nu sunt foarte bune datorita efectelor de legare non-specifice. Totusi cromatografia de imunoafinitate este la baza a numeroase teste medicale cum sunt de exemplu testele de glicemie sau detectarea alergenilor in mediu sau alimente.
Elutia de afinitate
Cromatografia covalenta utilizeaza interactiile dintre grupe functionale specifice. Metoda se aplica in special pentru purificarea proteinelor si peptidelor care contin resturi de cisteina si/sau metionina. Gruparile tiol, unele dintre cele mai reactive grupari din proteine, pot participa la un numar mare de reactii. Procesul redox prin care gruparile tiol trec reversibil in grupari disulfidice sta la baza purificarii proteinelor prin reactii covalente. Interactiile dintre compusii de separat si faza stationara sunt de tip covalent.
Un material cromatografic utilizat frecvent in aceasta metoda este Tiol-Sepharose 4B care are atasat la matricea de agaroza grupari de tip tiopiridil prin intermediul glutationului in calitate de grupare de distantare:
Resturile de cisteina din proteina reactioneaza, in prima etapa, cu gruparea tiopiridil formand o disulfura mixta. In etapa a doua, la tamponul de elutie se adauga un agent tiolic in stare redusa ca de exemplu 2-mercaptoetanolul sau ditioeritriolul :
|
HS-CH2-CH2-OH 2 – mercaptoetanol |
HSCH2-HCOH-HCOH-CH2SH 1,4-ditioeritritol (DTE) |
Aceasta metoda a fost utilizata in special pentru purificarea papainei si ureazei (fig….).
Evaluarea proceselor de separare
Bioprodusii obtinuti cu ajutorul unui agent biologic, microorganisme, celule animale, plante, celule vegetale, organe animale, enzime etc. sunt supusi unor procese de izolare, purificare si concentrare specifice fiecarui bioprodus in parte. Alegerea etapelor individuale de prelucrare a produsului brut, pentru obtinerea preparatului final dorit, este guvernata atat de proprietatile produsului de interes dar si de proprietatile compusilor existenti in mediul de cultura, compusi care acompaniaza produsul de interes si care in cele mai multe cazuri trebuie indepartati. Pentru evaluarea unui proces complex de separare, purificare sau/si concentrare, principalii parametri utilizati, pentru fiecare nivel de productie (micropilot, pilot, industrial la diferite niveluri) al etapei, sunt :
Productia etapei:
Productia unei etape se exprima in cantitati (de exemplu g sau kg) sau unitati (de exemplu unitati de activitate) obtinute in functie de conditiile de lucru si documentele care permit sa se concluzioneze asupra procesului si echipamentului utilizat.
Cuantificarea productiei se exprima prin valori procentuale conform ecuatiei:
P % = ![]()
![]() •
100
•
100
Proces = purificare, separare, extractie, cncentrare, etc.
Prin calcularea productiei se realizeaza si evaluarea pierderilor de bioprodus in timpul etapei respective.
Puritatea bioprodusului de interes dupa purificare, imbogatire sau concentrare se calculeaza prin ecuatii de forma :
![]() ;
;
![]() ;
;
![]() etc.
etc.
Factorul de imbogatire este definit, dupa determinarea puritatii bioprodusului, conform relatiei:
![]()
In mod obisnuit, evaluarea factorului de imbogatire si a productiei procentuale pentru o etapa de prelucrare permit stabilirea eficientei tehnologiei utilizate in etapa respectiva. Produsul dintre factorul de imbogatire si productia procentuala pentru o etapa reprezinta eficienta etapei respective.
Parametrii tehnici si stiintifici nu sunt suficienti pentru evaluarea unei etape, este nevoie sa se ia in considerare si aspectele economice implicate, in special costurile de manopera, de realizare a bioprodusului. In acest sens este necesar ca pentru pretul de productie a unui bioprodus sa fie luate in calcul: costurile materialelor brute si auxiliare, costurile de personal, costurile de energie, costurile de reparatii, deprecierile, pierderile, costurile pentru tratamentul deseurilor si cheltuieli de regie. Toate aceste costuri trebuie adunate si raportate la valoarea de productie a etapei. Astfel preturile de productie pot fi calculate, integrand parametrii tehnici si economici ai unei etape, prin relatii de forma:
![]() sau
sau ![]()
Evaluarea intregului proces de prelucrare si conditionare a unui bioprodus se obtine din evaluarile etapelor individuale. Astfel productia procentuala totala se obtine prin multiplicarea productiilor procentuale per etape, iar pretul total de cost al bioprodusului final se afla prin insumarea tuturor tipurilor de costuri si raportarea sumei la productia totala.
Evaluarea tehnica si economica a unui proces pe etape permite nu numai optimizarea procesului dar si o adaptare imediata prin interventie adecvata in etapele de prelucrare corespunzatoare.
Modalitati de verificare a puritatii preparatelor proteice
Puritatea preparatelor proteice poate fi verificata cu ajutorul unor teste specifice. Unele dintre metodele de purificare pot fi utilizate la scara analitica pentru a verifica daca un preparat proteic este omogen. Testele analitice pot fi utilizate pentru a demonstra prezenta unei impuritati, fara a dovedi absenta acestora. Cateva dintre testele de puritate cele mai utilizate sunt: ultracentrifugarea, electroforeza si focusarea izoelectrica, analiza aminoacizilor de la extremitatea N-terminala, curbele de solubilitate si cristalizarea.
Ultracentrifugarea
Proba de proteina este introdusa in eprubetele unei ultracentrifugi, eprubete gradate care sunt prevazute cu un sistem optic care urmareste variatia indicelui de refractie din timp in timp. In cazul proteinelor pure curbele de variatie a indicelui de refractie pe parcursul ultracentrifugarii prezinta un singur pic. Curbe de sedimentare cu mai multe picuri apar in cazul proteinelor impure. Ultracentrifugarea nu este un criteriu satisfacator de puritate in detectarea unor cantitati mici de proteine, de impuritati sub 5%. Testul nu reprezinta un criteriu absolut de puritate deoarece intr-un pic pot sedimenta doua sau mai multe proteine care au mase moleculare foarte apropiate. De asemenea ultracentrifugarea nu poate fi utilizata in aprecierea puritatii enzimelor care sufera fenomene de asociere-disociere. Astfel o enzima care sufera acest gen de fenomene de agregare are cele doua forme in echilibru conform reactiei:
nA D An
Molecula stabila de enzima poate fi un monomer, dimer, trimer etc,(A), iar procesul de agregare va duce, in functie de marimea proteinei, la forme agregate foarte mari.
Un exemplu in acest sens este glutamat dehidrogenaza din ficat bovin. Enzima este alcatuita din sase catene polipeptidice, cu masa moleculara a hexamerului de 336000 Da. Agregatul pe care il formeaza va avea masa moleculara mai mare ca 2x106.
Deplasarea echilibrului sistemului depinde de concentratia enzimei, agregarea fiind favorizata la concentratii mari ale acesteia. La orice concentratie de enzima, coexista cele doua specii ale enzimei, astfel incat la ultracentrifugare se obtin doua maxime corespunzatoare celor doua forme cu mase moleculare diferite.
Electroforeza
Electroforeza nativa poate fi utilizata pe tot parcursul procedeelor de purificare pentru a se urmari indepartarea proteinelor contaminante. Pentru evaluarea puritatii unei proteine metoda trebuie aplicata la diferite valori de pH. Obtinerea cate unei singure benzi proteice la un pH acid si la unul bazic este un indiciu pentru omogenitatea proteinei.
Imobilizarea enzimelor
Izolarea si purificarea enzimelor, in particular a celor intracelulare, este relativ destul de scumpa. De aceea s-a cautat ca pierderea lor prin utilizarea in procese batch sa fie inlocuita prin identificarea posibilitatilor pentru utilizarea lor repetata sau chiar in sistem continuu. Realizarea acestor cerinte se poate efectua prin „imobilizarea enzimelor”. Retinerea enzimelor intr-o faza insolubila a determinat realizarea a numeroase cercetari deoarece prin apropierea starii de existenta a enzimelor cu cea din celule permite o mai buna cunoastere a comportarii lor reale „in vivo”. Astazi se stie ca cele mai multe dintre enzime in stare naturala, „in vivo”, nu se afla in stare libera ci legate la nivelul membranelor celulare sau a organitelor din celule. De asemenea in sol, enzimele eliberate de catre microorganisme actioneaza legate de compusii argilosi sau humici. Astfel daca din punct de vedere biochimic putem caracteriza si intelege functionarea enzimelor in solutie nu inseamna ca vom sti in mod clar si comportamentul lor in situ.
Din punct de vedere practic, imobilizarea enzimelor ofera o serie de posibilitati. Astfel dezvoltarea realizarii de enzime imobilizate a condus si la realizarea de tehnici de imobilizare a celulelor si/sau microorganismelor, realizari deosebit de importante pentru biotehnologie deoarece acestea au aplicatii diverse. Cateva aplicatii principale ale tehnicilor de imobilizare sunt:
F Enzime imobilizate: izomerizarea glucozei, producerea de acid 6-aminopenicilanic, hidroliza lactozei, sinteza unor aminoacizi (lizina, alanina), separarea formelor D si L ale aminoacizilor, hidroliza proteinelor si poliglucidelor, producerea de acrilamida, analiza unor componenti/contaminanti ca de exemplu alergenii;
F Microorganisme imobilizate: tratamentul apelor si efluentilor (filtre bacteriene, denitrificare, metanizare), sinteza de aminoacizi (acid aspartic, alanina, fenilalanina, triptofan), producerea de etanol, sinteza hidroxifenilglicina, izomerizarea glucozei;
F Celule animale imobilizate: producerea de vaccinuri, producerea de anticorpi monoclonali, producerea de hormoni.
In ultimele decenii au fost puse la punct o serie de metode de imobilizare.
Prin imobilizarea enzimei se intelege limitarea gradului de „libertate” al moleculei proteice datorita legarii sale de un suport prin intermediul altor functii decat cele care fac parte din situsul activ al enzimei.
Enzimele imobilizate prezinta o serie de avantaje care permit utilizarea lor in biotehnologiile actuale: separarea usoara din amestecul de reactie, reciclarea catalizatorului, stabilitatea lui, conducerea in sistem continuu a unui proces, reglarea vitezei de reactie, modificarea controlata a proprietatilor si chiar a specificitatii enzimelor, obtinerea unui bioprodus de puritate avansata, posibilitatea de studiu a aspectelor fundamentale a enzimologiei si biologiei moleculare.
Desi exista si o serie de dezavantaje (sterilizarea reactoarelor, limitari difuzionale, modificarea proprietatilor enzimatice, colmatarea de suporturi si reactoare), avantajele le compenseaza si determina utilizarea lor la nivel industrial.
Principalele cai de imobilizare sunt de includere sau de legare a enzimelor in diferite suporturi insolubile sau care devin insolubile dupa ce se combina cu enzima. Aceste cai pot fi de: adsorbtie, incluziune si legare covalenta.
Indiferent de modul prin care se realizeaza imobilizarea trebuie sa se asigure conditii in care stabilitatea conformatiei native a enzimei (temperaturi scazute, pH optim de actiune etc.) sa fie mentinuta si suportul trebuie sa: nu denatureze enzima, sa fie el insusi rezistent la modificarile de pH sau temperatura si sa posede proprietati hidrofile.
Pana acum nu exista inca procedee si conditii standard care sa poata fi aplicate tuturor enzimelor tocmai datorita caracterului personal al fiecareia, astfel incat modul in care trebuie sa se realizeze imobilizarea pentru o enzima data se stabileste in mare masura empiric.
Adsorbtia este un procedeu de legare reversibila a enzimei pe un suport insolubil, realizandu-se conform principiilor cromatografiei de acest tip. Enzimele pot fi adsorbite ca rezultat al interactiilor, de tip secundar, fizice si ionice, intre grupari functionale ale enzimelor si ale suportului.
In acest caz este vorba de un fenomen de repartitie a moleculelor de enzime intre faza solida si cea lichida, un fenomen care se afla si la baza fractionarii enzimelor prin cromatografie de repartitie.
Metoda de imobilizare a proteinelor prin adsorbtie este prima metoda utilizata in acest scop de catre Nelson si Griffin, in 1916, care au adsorbit invertaza pe carbune activ si gel de hidroxid de aluminiu. Acest model de adsorbtie este utilizat mai ales in studii de laborator ca model al functionarii biocatalizatorilor din sol.
Tipuri de interactii in procesul de adsorbtie.
Interactiile enzima – suport implica, intr-un mod mai mult sau mai putin complex legaturi cu nivel energetic scazut. Aceste interactii pot fi :
Parametrii principali.
Principalii parametrii care influenteaza eficacitatea imobilizarii sunt :
Izoterma lui Freundlich : m = k1C![]()
Izoterma lui Langmuir : m = ![]()
unde m = masa de enzima adsorbita, C = concentratia de enzima la echilibru, iar k1 si k2 sunt constante.
Principalele tipuri de suporti.
Ca suporti adsorbanti de enzime, poate fi utilizat un numar foarte mare de compusi. Ei pot fi suporti minerali sau organici.
i. Suporti minerali.
v Argile: alumino-silicatii de tip bentonita a caror forma de foite permit adsorbtia interlamelara a enzimelor. Schimbarea in reteaua cristalina a ionilor de Al3+ cu cationi divalenti (Mn2+, Mg2+,..) determina incarcarea negativa a adsorbantului fapt ce permite o interactie ionica intre foliile de adosrbant si enzime. Capacitatea de adsorbtie a argilelor este foarte mare dar utilizarea lor este limitata de starea lor de neuniformitate.
v Sticla poroasa, silice poroasa: ofera capacitatea unei bune retentii aliata cu excelente proprietati mecanice. De asemenea este posibila optimizarea porozitatii in raport cu marimea proteinei. S-a aratat ca diametrul optim al porilor este aproximativ egal cu dublul lungimii celei mai mari axe a moleculei de enzima. Sticlele poroase sunt diponibile cu suprafete de adsorbtie de la 0,2 m2/g la 450 m2/g, ceea ce corespunde la diametre de pori variind de la 5000 nm la 7 nm.
Interactia enzima/sticla poroasa se efectueaza prin legaturi ionice intre sarcinile negative ale gruparilor silanol (Si – OH) disociate ( fapt ce determina caracterul acid al acestui tip de suprafata) si sarcinile pozitive ale proteinei. De asemenea sunt posibile legaturi prin punti de hidrogen cu gruparile silanol nedisociate cum se arata in figura:
Alte materiale cum sunt materiale ceramice, hidroxilapatita, oxizi si hidroxizi ai metalelor, cuartul, etc., sunt de asemenea utilizate ca adsorbati pentru enzime.
ii. Suporti organici
v Schimbatorii de ioni utilizati pentru purificarea de enzime pot fi folositi si pentru imobilizarea acestora. In scopul imobilizarii se folosesc atat schimbatori anionici (DEAE-celuloza, Dowex-2, Amberlite IRA 93, Amberlite IRA 900), cat si schimbatori cationici (CM-celuloza, fosfo-celuloza, citrat-celuloza, Dowex-50 Amberlite IRC 50). Alegerea suportului este functie de pH-ul la care se efectueaza reactia si de punctul izoelectric al enzimei. Pentru evitarea denaturarii enzimei se prefera suporturi cu grupari schimbatoare slabe. Cele tari pot determina valori de pH extrem in micro-mediul din jurul gruparilor functionale. Acest tip de suporturi se gasesc disponibile pe piata in mari cantitati ceea ce face posibila ridicare la scara a metodei.
v Colagenul. Proprietatile adsorbante ale acestei proteine au permis punerea la punct a diferite metode de imobilizare prin adsorbtie pe colagen de enzime.
v Alti suporti pot fi celuloza, amidonul , taninurile, poliuretanul etc.
iii. Imobilizarea prin punti metalice se poate aplica atat suportilor anorganici cat si organici. In aceste metode suportilor utilizati (argile sau organici cum este celuloza) li se adauga pentru activare unele saruri metalice care vor stabili cu enzima punti metalice sau chelati. Sarurile metalice utilizate pot fi TiCl4, TiCl3, SnCl4, SnCl2, ZrCl4, VCl3, FeCl2, si FeCl3. Suportul solid este mentinu timp de 5 – 10 minute in solutia sarii metalice si apoi uscat la 450C. Sarea care nu a reactionat este eliminata prin spalare. Enzima este apoi imobilizata prin simpla punere in contact cu suportul astfel activat.
Simplitatea acestei metode si varietatea de suporturi utilizabile permit usoara sa extrapolare. O problema de care trebuie insa sa se tina cont este aciditatea puternica a solutiilor de cloruri, in special a celei de titan, care pot provoca degradarea suportilor si a enzimei.
Avantaje si dezavantaje
Avantaje
Prin acest procedeu s-a aplicat la scara industriala adsorbtia acilazei, pe DEAE-Sephadex si a fost utilizata pentru separarea amestecului racemic DL de metionina de catre firma Tanabe Seiyaku, Japonia. Procedeul a condus la un castig economic de 40% in raport cu utilizarea enzimei libere.
Incluziunea consta in includerea mecanica, de obicei ireversibila, a moleculelor de enzima intr-o matrice insolubila. Modalitatile prin care este inclusa enzima intr-un suport insolubil pot fi grupate in doua categorii principale : includerea in reteaua tridimensionala a suportului sau delimitarea, printr-o membrana semipermeabila, enzimei in interiorul unui volum. Prima categorie este cunoscuta ca polimerizarea enzimei, iar cea de-a doua incapsularea enzimei.
2.1 Imobilizarea prin polimerizare.
In aceasta metoda preparatul enzimatic este dispersat in solutia de monomeri pentru a forma un amestec omogen (solutie sau emulsie). Polimerizarea monomerilor conduce la formarea unor retele in interiorul carora este prinsa enzima.
Prin procese de polimerizare si/sau copolimerizare se pot obtine produsi cu forme geometrice diferite a purtatorului: granule mici de genul unor bile poroase, tuburi, fibre, filtre poroase, membrane semipermeabile etc. ( fig.).
Polimerizarea moleculelor de enzima, in prezenta unui agent corespunzator, permite obtinerea unui produs cu masa moleculara mare si solubilitate mica. De exemplu Sumner a obtinut ureaza insolubilizata prin adaugarea unor cantitati mici de NaCl la o solutie de enzima in alcool 30% si mentinerea amestecului la 00C timp de 1 – 2 zile. S-a aratat ca preparatul rezultat contine un numar de punti disulfurice intermoleculare.
Una dintre cele mai cunoscute metode de obtinere a unei enzime incluse prin polimerizare intr-o retea tridimensionala este cea de copolimerizare a acrilamidei cu N,N-metilen-bis-acrilamida, ultima servind ca agent de inretelare (fig. ) realizandu-se asa numitul proces de reticulare a polimerului.
In acest caz reactia de
polimerizare, care se realizeaza prin intermediul radicalilor, este initiata
prin aditia de persulfat de potasiu (K2S2O8),
riboflavina, radiatii ultraviolete, radiatii X sau gama si accelerata prin
adaugarea de N,N,N’,N’ – tetrametiletilendiamina (T
Adeseori proteina, pentru copolimerizare cu acrilamida si N,N-metilen-bis-acrilamida, este functionalizata adica este activata prin adaugarea in structura ei a unor functiuni cu capacitate ridicata de a copolimeriza. De exemplu, in molecula enzimei pot fi introduse duble legaturi prin acilare cu clorura de acriloil (CH2=CH–CO–Cl), iar preparatul obtinut este introdus in amestecul de copolimerizare.
Metoda conduce la un gel activ enzimatic, a carui activitate creste cu scaderea dimensiunilor particulelor de gel datorita cresterii suprafetei de contact.
Aceasta metoda este larg utilizata in analiza biochimica si anume pentru prepararea fazei stationare pentru fractionarea biomoleculelor prin electroforeza.
Pe langa gelul foarte cunoscut de poliacrilamida se utilizeaza numeroase alte reactii de polimerizare cu formare de geluri cum sunt:
In particular, metoda imobilizarii bazata pe incorporarea enzimei in complexe polielectrolitice permite ca prin modificarea pH-ului sau a tariei ionice a solutiei sa aiba loc transformarea complexului suport-enzima dintr-o forma insolubila intr-una acvo-solubila si invers.
2.2. Incapsularea consta in captarea solutiei de enzima intr-un compartiment limitat de o membrana selectiva care nu lasa sa treaca decat moleculele mici.
Incapsularea consta fie prin formarea unei membrane in jurul unei micropicaturi de emulsie ce contine enzima conducand la realizarea unei microcapsule (fig. ) fie prin
retinerea moleculelor de enzima intr-un macrovolum separat de mediul inconjurator de membrana semipermeabila (fig. – A si B).
Procedura de realizare a microcapsulelor consta in copolimerizarea unui monomer hidrofob cu un monomer hidrofil. Monomerul hidrofil este dizolvat impreuna cu enzima intr-o faza apoasa care se afla in emulsie intr-o faza organica. Adaugarea monomerului hidrofob in faza organica determina copolimerizarea la interfata prinzand enzima in interiorul microcapsulei ce se formeaza.
De exemplu o solutie apoasa ce contine o enzima si un monomer hidrofil (1,6 – diaminohexan) este emulsionata, in prezenta unui agent tensioactiv cu rol de stabilizator, cu o solutie organica formata din cloroform si ciclohexan. La adaugarea monomerului hidrofob (clorura de sebacoil) are loc reactia de copolimerizare la interfata ce conduce la formarea unei membrane polimerice de nylon dupa reactia :
NH2 – (CH2)6 – NH2 Cl – CO – (CH2)8 – CO – Cl
|
1,6 – diaminohexan |
|
clorura de sebacoil |
- NH – (CH2)6 – NH – CO – (CH2)8 – CO – NH – (CH2)6 – NH – CO – (CH2)8 – CO –.
Microcapsulele formate sunt recuperate prin centrifugare. Diametrul lor depinde de finetea emulsiei si poate varia de la cativa microni la sute de microni.
Aceasta tehnica a fost larg dezvoltata in special pentru rezolvarea unor necesitati medicale adica realizarea unor enzime imobilizate care sa poata fi injectate, administrate, fara a crea probleme de natura imunitara (respingere) si de distrugere a enzimelor de interes de catre enzimele proteolitice din mediu. Necesitatile terapeutice au condus astfel si la utilizarea a numeroase alte tipuri de membrane pentru formarea de microcapsule cum sunt poliuretanii, poliureea, poliesterii etc. sau molecule amfifile ca de exemplu lecitinele sau lipozomii. Astazi nanotehnologiile utilizeaza astfel de tehnici pentru a se realiza microcapsule sau alte tipuri de compusi terapeutici a caror membrane sunt realizate din substante biodegradabile (carbon de exemplu) care nu determina nici un fel de reactii secundare.
Realizarea de macrovolume separate de mediul inconjurator de membrane semipermeabile poate asigura retinerea enzimei intr-un volum determinat (fig) in vederea utilizarii sale intr-unproces continuu. Astfel de sisteme sunt in mod particular interesante pentru realizarea de biosenzori enzimatici (membranele plane) sau de reactoare enzimatice (fibre tubulare). Astfel de sisteme sunt deosebit de utile pentru hidroliza unor macromelecule (amidon, celuloza, proteine) deoarece produsii de hidroliza sunt suficienti de mici pentru a trece prin membrana semipermeabila si sunt recuperati in efluenti. In plus produsii de reactie fiind indepartati din mediu nu determina inhibarea enzimei.
Astazi numeroase firme utilizeaza aceste procedee pentru realizarea de sisteme utilizate in procese enzimatice, ultrafiltrare etc. Dintre cele mai cunoscute firme care utilizeaza aceste procedee pentru a realiza produsi de interes putem aminti: Millipore, Rhône-Poulenc, Sartorius, Amicon, BioRad, Bioengineering etc.
Avantaje si dezavantaje
Avantaje
Dezavantaje
Ø Conditiile de polimerizare, mai ales in cazul polimerilor vinilici, pot afecta enzima prin procese de denaturare datorate interventiei radicalilor liberi (persulfat de potasiu) sau valori de pH ridicate (sinteza nylonului).
Ø Pentru compensarea exotermicitatii unor reactii este necesar sa se lucreze la temperaturi joase.
Ø Localizarea enzimei intr-o microcapsula sau un volum limitat de o membrana semipermeabila implica obligatoriu transferuri de masa, a substratului la enzima si apoi a produsilor in solutie. Fenomenele de difuzie in interiorul si exteriorul particulelor limiteaza capacitatea de actiune a enzimelor. Rezistenta difuzionala poate fi insa redusa, mai ales in cazul gelurilor, prin macinarea acestora dupa uscare.
Ø Pe langa fenomenele de difuzie un rol important este ocupat de fenomenele de limitare sterica. Astfel porozitatea membranelor formate trebuie sa asigure mentinerea enzimelor in interior (deci porii sa fie mai mici decat talia enzimei) dar suficienti de mari pentru a permite accesul substratului la enzima. Mai ales pentru cazurile in care moleculele substratului sunt mari pentru evitarea pierderii de enzima, dupa realizarea procesului de incluziune enzima este supusa unui proces de reticulare prin intermediul unui agent polifunctional ca de exemplu glutaraldehida, adica se realizeaza si o imobilizare prin legare covalenta a enzimei.
Ø Uneori proprietatile mecanice ale gelurilor obtinute nu sunt suficient de satisfacatoare pentru ca enzima imobilizata sa poata fi utilizata la nivel pilot sau industrial. De exemplu intr-un reactor cu pat fix.
Legarea covalenta consta intr-o reactie chimica care are loc intre grupari reactive ale suportului cu unele ale enzimei, conducand la imobilizarea ireversibila a enzimei. Un interes deosebit il reprezinta metodele chimice care permit legarea enzimelor prin intermediul unor grupari functionale din structura enzimei, neimplicate in cataliza: amino (α sau ε), imido (de la triptofan), amido (de la asparagina, glutamina), hidroxil (de la serina, treonina), carboxil (α, β sau γ), tiol (de la cisteina), metiltiol (de la metionina), guanidil (de la arginina), imidazol (de la histidina) etc.
Metodele de imobilizare prin legare covalenta pot fi grupate in doua categorii principale: metode care implica un suport (insolubil sau nu) si metode care realizeaza imobilizarea prin reticularea enzimei.
3.1 Imobilizarea enzimelor prin legare covalenta de un suport.
In acest caz se urmareste stabilirea modalitatilor de legare covalenta prin intermediul unor grupari functionale ale enzimei de unele grupari functionale ale suportului astfel incat activitatea catalitica a enzimei sa fie conservata.
Gruparile functionale enzimatice sunt destul de putin reactive, fapt ce determina necesitatea existentei unor grupari functionale suficient de active pe suport astfel incat legarea sa se faca in conditii blande pentru enzima.
Exista posibilitatea de activare a gruparilor functionale ale enzimelor, dar aceste studii au avut loc mai ales la nivel de laborator ca cercetari stiintifice si nu au fost aplicate la scara deoarece in general conditiile de activare sunt putin compatibile cu conservarea activitatii enzimatice.
Astfel exista unele cercetari originale care utilizeaza activarea gruparilor functionale ale enzimelor. De exemplu Zaborsky (Zaborsky O.R., 1974, Immobilized enzymes., C.R.C. Press, new York) a efectuat experimentari de legare a glucoz-oxidazei, a carei fractie glucidica reprezinta 16 % din masa enzimei, pe diferite suporturi aminate (p-amino-stiren, amino-etil-celuloza, sticla aminata, carboximetil-celuloza activata cu hidrazida)
Se poate de asemenea sa se mareasca densitatea de grupari reactive pe molecula prin grefarea pe acestea de lanturi de politirozina sau de polilizina sau, de a se introduce grupari vinilice in molecula enzimei, prin alchilarea functiilor aminice, dupa care enzima este copolimerizata prin intermediul gruparilor vinilice cu acrilamida si bisacrilamida.
In marea majoritate a cazurilor insa, nu enzima se activeaza ci suprafata suportului.
Metode principale de activare
Pentru stabilirea metodei de activare se iau in consideratie pe de o parte gruparile functionale care participa la legatura covalenta din partea enzimei, iar pe de alta gruparile functionale implicate in legatura din partea suportului. In acest context principalele metode de activare sunt:
|
Grupa functionala |
Metoda de activare |
|
|
enzima |
suport |
|
|
―NH2 |
―NH2 |
Glutaraldehida |
|
―NH2 |
―OH |
Bromcian Triazine |
|
―NH2 |
―COOH |
Azotura Carbodiimida |
|
―COOH |
―NH2 |
Carbodiimida |
|
|
|
Sare de diazoniu |
|
|
||
|
―SH |
―SH |
Punti disulfurice |
O imagine sintetica de imobilizare a enzimelor prin legare covalenta este prezentata inb fig
Activarea cu ajutorul glutaraldehidei este una dintre cele mai utilizate metode atat pentru legarea unei enzime de un suport cat si pentru reticularea moleculelor unei enzime sau a unor celule intregi. Glutaraldehida nu reactioneaza sub forma sa de dialdehida cu functiunile aminice ale suportului sau enzimei, ci sub forma de polimer rezultat in urma condensarii aldolice a moleculelor de reactiv. Cu cat valoarea de pH este mai ridicata polimerizarea este mai mare. Astfel la pH mai mare de 10,5 are loc precipitarea polimerilor de glutaraldehida care au functiuni aldehidice α, β – nesaturate. Aceste functiuni reactioneaza cu gruparile aminice ale suportului/enzimei conducand la formarea unor legaturi iminice care se stabilizeaza prin rezonanta cu legaturile etilenice prezente (legaturi duble conjugate). Aceste structuri explica stabilitatea derivatilor obtinuti prin activare cu glutaraldehida. Astfel acesti compusi rezista, de exemplu, la atacul unei solutii de acid clorhidric 6N la temperatura de 1100C timp de 24 de ore.
La modul general imobilizarea unei enzime pe un suport activat cu glutaraldehida are loc in doua etape. In prima etapa suportul aminat este activat prin punerea in contact cu o solutie de glutaraldehida (1% - 5%) la un pH cuprins intre 7,0 si 8,6 si temparatura ambianta. Dupa spalarea cu un tampon corespunzator pentru indepartarea excesului de glutaraldehida enzima este mentinuta in contact cu suportul la temperatura de 40C. Deci conditiile de imobilizare ale enzimei sunt blande. Mecanismul de activare cu glutaraldehida este:
(n+2)
![]()
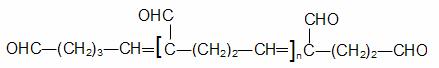
|
|
R―NH2 |
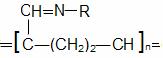
Glutaraldehida, utilizata de asemenea ca agent de fixare in histochimie sau pentru ameliorarea proprietatilor mecanice ale pieilor in tabacarii, ofera avantajul de a fi un produs disponibil la nivel industrial.
Bromcianul este utilizat pentru activarea suporturilor care au grupari de tipul α-glicolice cum sunt suporturile de natura poliozidica ( dextran, agaroza, celuloza, amidon). Tratarea acestor suporturi cu bromcian conduce la obtinerea de imidocarbonati care vor reactiona cu gruparile aminice ale proteinelor pentru a da izo-uree N- substituita.
Aceasta metoda este una dintre cele mai utilizate la nivel de laborator pentru imobilizarea enzimelor sau a moleculelor aminate (de exemplu in cromatografia de afinitate). In acest context suporturi preactivate cu bromcian sunt disponibile pe piata.
Triazinele sunt utilizate pentru activarea suporturilor care au grupari functionale hidroxil (fig..). Cele mai utilizate triazine sunt : 2,4,6 – tricloro – S – triazina (clorura de cianuril), 2-amino- 4,6-dicloro – S –triazina, colorantii Procion M etc. Triazinele fiind produse industriale este convenabil a fi utilizate pentru prepararea de cantitati importante de suporturi active in special de celuloza activa.
Azotura permite activarea eficace a suportilor ce poseda grupari de acizi carboxilici. Metoda de activare cu azotura are loc in cateva etape: esterificarea gruparilor carboxilice cu metanol in mediu acid, reactia esterilor formati cu hidrazina rezultand hidrazide, tratarea acestora cu azotit de sodiu pentru a rezulta azotura si apoi prin reactia compusului format cu gruparile aminice ale enzimei se obtine imobilizarea enzimei prin legare covalenta de tip amidic. Succesiunea reactiilor chimice implicate in acest proces este prezentata in fig
R―COOH ![]() R―COO―CH3
R―COO―CH3 ![]() R―CO―NH―NH2
R―CO―NH―NH2
R―CO―NH―E ![]() R―CO―N═
R―CO―N═![]() ═
═![]()
Fig. Metoda de imobilizare dupa activarea suportului cu azotura
Carbodiimida este de asemenea un reactiv utilizat pentru imobilizarea unor enzime prin legarea gruparilor aminice de o grupare carboxil activata de pe suport. Modul de imobilizare este similar cu cel aplicat pentru sinteza legaturilor peptidice intre aminoacizi in prezenta carbodiimidei (fig. ). Aceasta reactie decurge in mediu acid . Daca se doreste a se opera in mediu bazic se poate folosi reactivul K al lui Woodward (N – etilfenil – 5 – izoxazoliu – 3’ sulfat).
Sarurile de diazoniu se pot obtine usor la suporturile care au grupari functionale amine aromatice prin adaugarea de azotit de sodiu in mediu acid (fig..). Sarurile de diazoniu care se obtin pot reactiona cu nucleul fenolic al restului tirozinic sau cu imidazolul din restul histidinic pentru a forma legaturi de tip azoic
Punti disulfurice se pot stabili intre gruparile tiol ale suportului si gruparile tiol din resturile de cisteina ale enzimei. Pentru aceste cazuri suportul, este cel mai adesea activat, prin intermediul reactiilor cu dipiridil – 2,2’ – disulfura dupa care este pus in contact cu enzima de interes (fig..).
Aceasta metoda reprezinta una dintre putinele metode de imobilizare prin legare covalenta care ofera posibilitatea de regenerare a enzimei dupa dezactivarea sa. Astfel este suficient ca puntile disulfurice sa fie reduse, de exemplu cu ajutorul cisteinei, pentru regenerarea gruparilor tiol ale suportului si ale enzimei, dupa care se poate din nou proceda la imobilizare.
Suporturi principale
Legarea se poate realiza pe suporturi anorganice (sticla poroasa, materiale ceramice), pe suporturi organice naturale (celuloza, chitina, dextran, agaroza) sau polimeri sintetici (nailon, polistiren, poliacrilamida), prin intermediul unor grupari imidocarbonat, oxiran, azida, diazo, izotiocianat, triazinil etc. Suporturile organice prezinta fata de cele anorganice o densitate mai mare de grupari functionale in timp ce cele anorganice au mai bune proprietati mecanice.
Principalele suporturi organice sunt :
|
Compusi naturali |
Polimeri sintetici |
|||
|
Suport |
Grupare functionala |
Suport |
Grupare functionala |
|
|
Poliozide |
Poliacrilamida |
―CO―NH2 |
||
|
Dextran |
―OH |
Poliacrilati |
diversa |
|
|
Agaroza |
―OH |
Polimetacrilati |
diversa |
|
|
Celuloza |
―OH |
Copolimer etilena – anhidrida maleica |
Anhidrida acida |
|
|
Carboxi-metil-celuloza |
―COOH |
|
||
|
Amino-etil-celuloza |
―NH2 |
Polistiren |
diversa |
|
|
p-aminobenzil celuloza |
|
Poliamide |
―CO―NH― |
|
|
Proteine |
|
|
||
|
Colagen |
―COOH |
|
|
|
Dextranul si Agaroza: Dextranul este un homoplimer ramificat format din unitati de D – glucoza si este sintetizat de catre diferite bacterii (in special de Leuconostoc mesenteroides) pornind de la zaharoza. Agaroza este un polimer natural ce se extrage din alge. Aceste doua poliozide sunt utilizate in mod curent in biochimia analitica in diferite scopuri, cele mai obisnuite fiind de cernere moleculara, determinari de greutati moleculare, cromatografii de exemplu de excludere. Datorita utilizarilor multiple acesti compusi sunt disponibili pe piata in diferite forme active sau nu: Sephadex, Sepharose, Bio-Gel, Ultrogel etc.
Cea mai utilizata forma de activare a poliolilor este cea cu BrCN dar prezenta gruparilor hidroxil pe aceste suporturi permite de asemenea si activarea cu alti agenti cum sunt de exemplu triazinele.
Proprietatile mecanice ale acestor geluri pot fi imbunatatite prin asocierea cu polimeri sintetici, de exemplu agaroza cu acrilamida sau glutaraldehida.
Celuloza si derivatii sai (Carboxi-metil-celuloza, Amino-etil-celuloza, p-aminobenzil celuloza). Celuloza este un homopolimer liniar format din unitati de D-glucoza si este utilizata in mod obisnuit in domeniul analitic sub diferite forme. Acest suport natural cu o larga raspandire si disponibilitate, pe langa utilitatea sa pentru diferite industrii (hartie, vata) este si obiectul a numeroase studii chimice si structurale astfel incat se cunosc numeroase modalitati de activare a celulozei. In plus exista in prezent numerosi derivati ai celulozei disponibili in mari cantitati si care permit utilizare a variate metode de activare, asa cum sunt cei mentionati anterior.
Gruparile hidrtoxilice ale celulozei pot fi activate foarte usor prin halogenare, in particular cu ajutorul unor agenti de clorurare cum sunt clorura de tionil (SOCl2) sau clorura de sulfuril (SO2Cl2). De asemenea activari eficace se pot realiza atat a celulozei cat si a derivatilor sai cu triazine. Exista de altfel numerosi compusi activi gata preparati de catre firme recunoscute. De exemplu Grupul Lilly activeaza si vinde diferite tipuri de DEAE-celuloza activata.In plus celuloza poate fi activata atat sub forma de hartie (reactivi analitici) cat si de particlule (celuloza micro-cristalina). Este de asemenea posibil sa fie activata si celuloza prezenta in derivatii naturali sub forma de complecsi ligno-celulozici, compusi care prezinta proprietati mecanice net superioare celulozei pure. De exemplu resturile celulozice de porum constituie excelente suporturi pentru imobilizarea de enzime.
Colagenul, o proteina care joaca un rol structural foarte important in tesutul conjuntiv, este un subprodus abundent in abatoare si poate fi obtinut sub forma de fibre sau membrane. Continutul bogat in aminoacizii aminati (acidul glutamic si acidul aspartic) permite activarea colagenului prin metoda cu azotura. Membranele activate astfel sunt utilizate pentru imobilizarea de enzime care apoi sunt folosite pentru realizarea de electrozi specifici.
Polimerii acrilici (Poliacrilamida, Poliacrilati Polimetacrilati) sunt derivati care se produc adesea la scara industriala prin polimerizarea acidului acrilic, acidului metacrilic, acidului cloroacrilic si derivatii lor. Sa luam de exemplu cazul poliacrilamidei pentru a sublinia varietatea de metode de modificare chimica si activare care pot fi puse in lucru in cazul acestor tipuri de polimeri (fig) si a caror structura generala este urmatoarea:
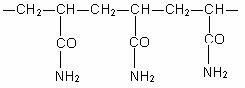
Pe baza acestor proprietati au fost dezvoltati numerosi copolimeri ai acrilamidei, ai N,N’- metilen bisacrilamidei si derivatilor acestora cu o mare varietate de functiuni reactive. Cativa din numerosii compusi Enzacryl sunt :
|
Enzacryl |
Grupa functionala |
Metoda de activare |
|
AA |
|
Diazotare |
|
AH |
|
Azotura |
|
Politiolactona |
|
Reactie directa |
|
Politiol |
|
Punte disulfurica |
|
Poliacetal |
|
Acid diluata |
Copolimerul etilena – anhidrida maleica (EMA) prezinta avantajul ca este un reactiv direct datorita functiilor sale anhidridice. Reactia cu enzima conduce la un derivat cu incarcatura negativa (fig.) care poate fi neutralizata prin reactia cu 1,6-diamino-etan sau 1,6-diamino-hexan. Condensarea acestor molecule bifunctionaleconduce printre altele si la o ameliorare a proprietatilor mecanice a suportului.
Polistiren : copolimerii stiren – divinil benzen cu structura de baza :
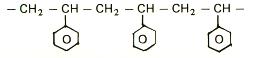
sunt baza a numeroase preparate ca rasini
schimbatoare de ioni obtinute prin modificari chimice ale acestor polimeri, in
vederea introducerii de grupe schimbatoare de ioni. De exemplu se poate
Poliamidele sunt preparate prin polimerizarea fie a acizilor dicarboxilici si diaminelor alifatice, fie a aminoacizilor sau a lactamelor lor. Una dintre cele mai cunoscute poliamide este nylonul. Acesti polimeri au grupari amidice a caror hidroliza acida partiala permit eliberarea simultana a unei grupari functionale aminice si a unei grupari carboxilice:
R1―CO―NH―R2 ![]() R1―COOH + R2―NH2
R1―COOH + R2―NH2
Gruparile astfel eliberate pot fi activate prin una dintre metodele deja prezentate.
Principalele suporturi minerale.
Silice si sticla poroasa, suporturi disponibile cu o mare varietate granulometrica si porozitate, cu suprafete de legare variind de la 10 m2/g la 400 m2/g care au porozitatile corespunzatoare de la 300 nm la 8 nm. In plus este foarte usor sa se grefeze aproape orice grupare chimica pe aceste suporturi prin condensare cu silani. Silanii sunt utilizati industrial ca promotori de adeziune.
|
(RO)3Si―R |
||
|
Silan |
R |
A |
|
γ-aminopropil trietoxi silan |
―C2H5 |
―(CH2)3―NH2 |
|
N―β―amino etil―γ―amino etil trimetoxi silan |
―CH3 |
―(CH2)3―NH―(CH2)2―NH2 |
|
β―(Clorometilfenil)etiltrimetoxi silan |
―CH3 |
|
|
γ―Cloropropiltrietoxi silan |
―C2H5 |
―(CH2)3―Cl |
|
γ―glicidoxipropil trimetoxi silan |
―CH3 |
|
|
γ―mercaptopropil trimetoxi silan |
―CH3 |
―(CH2)3―SH |
|
γ―metacriloxipropil trimetoxi silan |
―CH3 |
|
In functie de gruparea functionala enzimele pot fi imobilizate direct sau dupa activarea suportului. Metoda cea mai utilizata este de a se grefa grupari amino alifatice prin condensarea γ-aminopropil trietoxi silan pe suport apoi activarea acestor grupari prin actiunea glutaraldehidei (Fig).
In cazul sticlei poroase proprietatile
derivatilor obtinuti pot fi ameliorate folosindu-se sticla a carei
Oxizii metalici se functionalizeaza chimic prin aceleasi metode care se aplica silicei sau sticlei. Am exemplificat cazul captusirii cu oxid de zirconiu dar putem exemplifica si cu oxid de titan, de nichel, de fier, de aluminiu (alumina).
Diferite tipuri de ceramica pot fi activate prin introducerea de grupari chimice reactive sau activabile prin metoda silanarii.
In prezent tehnica de imobilizare prin legare covalenta a enzimelor este una dintre cele mai utilizate si nu prezinta dezavantajele tehnicilor anterioare.
3.2 Imobilizarea enzimelor prin reticulare.
Imobilizarea enzimei se poate realiza si fara a se utiliza suporturi prin efectuarea de punti covalente cu ajutorul unor reactivi polifunctionali. Se obtin astfel structuri cu inalta masa moleculara care devin insolubile. Pentru realizarea unei astfel de reactii se pot folosi numerosi reactivi, dintre care cei mai utilizati sunt:
|
Principalii reactivi polifunctionali |
|
|
Nume |
Structura |
|
Glutaraldehida |
|
|
Acid bis-diazobenzidin-2,2 -disulfonic |
|
|
Acid difenil-4,4’-diizotiocianat-2,2’-disulfonic |
|
|
3-metoxi-4,4’-difenil diizocianat-metan |
|
|
1,5-difluoro-2,4-dinitro-benzen |
|
De departe glutaraldehida este reactivul cel mai utilizat nu numai pentru a se reticula enzimele ci si pentru realizarea asa numitii imuno-adsorbanti.
In acest proces enzima este diluata cu o proteina inerta, cum este albumina, pentru a se limita fenomenele de denaturare si a creste eficacitatea metodei de imobilizare.
Pentru obtinerea unor derivati cu o structura foarte poroasa asemanatoare buretilor, amestecul de enzima, albumina si glutaraldehida este congelat rapid dupa care temperatura este crescuta in mod lent pana la 40C.
Derivatii rezultati pot fi si sub forma de membrane. Observatii la microscopul electronic au permis precizarea structurii fine a acestor tipuri de derivati.
Un astfel de proces de reticulare se poate aplica nu numai enzimelor ci si celulelor intregi. Acestea prezinta avantajul, mai ales in cazul in care celula contine o enzima usor accesibila (cum este cazul enzimelor periplasmatice), ca permit utilizarea activitatii catalitice fara a se efectua procesele de extractie si purificare consumatoare de energie, timp si bani. In acest caz putem spune ca celula este suportul. De asemenea se evita eliberarea sistemelor care determina autodegradarea celulara printr-o incalzire a sistemului timp scurt la o temperatura de 700- 800C. In plus acest procedeu permite scaderea importanta a costului enzimei imobilizate si este utilizat pe larg pentru imobilizarea glucoz izomerazei folosita pentru producerea de izoglucoza, una dintre cele mai importante aplicatii industriale de enzime imobilizata.
De exemplu cu glutaraldehida firma NOVO a reticulat Bacillus coagulans, iar GIST-BROCADES micelii de Actinoplanes missouriensis.
Avantaje si dezavantaje
Avantaje
BIOSENZORI
Biocatalizatorul trebuie sa fie inalt specific pentru scopul analizei;
sa fie stabil in conditii de depozitare normale si, cu exceptia benzilor enzimatice de hartie si dipsticks (a se vedea mai tarziu), sa prezinte o buna stabilitate pentru un numar larg de determinari (de exemplu mai mult de 100);
Reactia nu trebuie sa fie afectata de parametri fizici cum sunt agitarea, pH sau temperatura. Aceasta ar permite analiza probelor cu un minim de pre-tratament.
Daca reactia implica cofactori sau coenzime, acestea ar trebui, in mod preferabil, sa fie co-imobilizati cu enzima;
Raspunsul trebuie sa fie exact, précis, reproductibil si liniar pe domeniul analitic utilizat, fara dilutie sau concentrare.
Trebuie de asemenea sa fie liber de zgomot electric;
In functie de domeniul de utilizare biosenzorul trebuie sa indeplineasca cerinte specific. De exemplu pentru monitorizarea sistemelor invazive in situatii clinice, trebuie sa micut si biocompatibil, sa nu determine efecte antigenice sau toxice, iar pentru bioreactoare trebuie sa fie sterilizabil. Sterilizarea se realizeaza preferabil prin autoclavare dar nici un biosenzor cu enzime nu poate rezista unui asemenea tratament termic-umed drastic. In ambele cazuri, biosenzorul nu trebuie sa fie predispus spre viciere sau proteoliza;
Biosenzorul complet trebuie sa fie ieftin, mic, portabil si capabil de a fi utilizat chiar de operatori ce au urmat doar o scoala tehnica;
Trebuie sa existe o piata pentru biosenzor. Este clar ca exista o sansa mica sa se dezvolte un biosenzor daca alti factori (de exemplu subventii guvernamentale, angajarea continua a unor analisti dotati, sau slaba perceptie a consumatorilor) incurajeaza utilizarea metodelor traditionale si descurajeaza descentralizarea laboratoarelor de testare.
Raspunsul biologic al biosenzorului este determinat de membrane biocatalitice care realizeaza conversia reactantului in produs. Enzimele imobilizate prezinta un numar de caracteristici avantajoase care le fac, in mod particular, aplicabile in astfel de sisteme. Ele pot fi re-utilizate, ceea ce inseamna ca aceiasi activitate catalitica este disponibila pentru o serie de analize. Acesta este un factor important in asigurarea unor rezultate reproductibile si evitarea capcanelor associate cu reproducerea pipetarii enzimei libere necesara in protocoalele analitice.
Multe enzime sunt intrinsec stabilizate prin procesul de imobilizare, dar chiar acolo unde aceasta nu se intampla, exista in mod obisnuit o stabilizare aparenta considerabila. Chiar daca apare o oarecare inactivare a enzimei imobilizate dupa o anumita perioada de timp, aceasta inactivare este in mod obisnuit stationara si previzibila. Orice scadere a activitatii este usor incorporata in schema analitica prin interpolarea regulata a standardelor, intre analizele probelor necunoscute. Din aceste motive, multe dintre asemenea enzime imobilizate sunt re-utilizabile pana la 10.000 ori pe o perioada de cateva luni. In mod clar aceasta conduce la o considerabila economie in raport cu costul enzimelor fata de utilizarea analitica a enzimelor libere solubile.
Piesa cheie a biosenzorului este traductorul care face posibila o inregistrare a unei schimbari fizice care acompaniaza reactia. Acesta poate fi:
Din punct de vedere al semnalului inregistrat de traductori, exista asa numitele “generatii” de biosenzori:
Biosenzori Potentiometrici
Exista trei tipuri de electrozi ion-selectivi care sunt utilizati ca biosenzori:
(a) poate fi deasemenea utilizata in biosenzorii
potentiometrici NH![]() si CO2 (gaz).
si CO2 (gaz).
(b) poate fi deasemenea utilizata intr-un biosenzor potentiometric cu NH3 (gaz).
Raspunsul unui electrod ion-selectiv este reprezentat de relatia:
![]()
unde E este potentialul masurat (in volti), E0 este o constanta caracteristica pentru sistemul ion-selectiv/electrod extern cunoscuta si ca potentialul standard al sistemului respectiv, R este constanta gazelor, T este temperatura absoluta (K), z este sarcina ionica, F este constanta Faraday si [i] este concentratia speciilor ionice necomplexate, libere (in mod strict [i] ar trebui sa fie activitatea ionului dar la concentratiile normal intalnite in biosenzori, aceasta este efectiv egala cu concentratia). Aceasta inseamna, de exemplu, ca pentru fiecare decada de crestere in concentratia H+ la 250C exista o crestere in potentialul electric de 59 mV. Dependenta logaritmica a potentialului de concentratia ionica este responsabila atat pentru domeniu analitic larg dar si pentru exactitatea si precizia scazuta a acestor senzori. Domeniul lor normal de detectie este 10-4 – 10-2 M, desi exista cativa care sunt de 10 ori mai sensibili. Timpul necesar pentru un raspuns tipic este intre 1 si 5 minute permitand pana la 30 de analize per ora.
Biosenzorii care implica utilizarea sau eliberarea de H+ necesita utilizarea unor solutii tampon foarte diluate (de ex. < 5mM) pentru a se putea determina schimbari semnificative de potential. Relatia dintre modificarea de pH si concentratia substratului este complexa, incluzand unele efecte non-lineare ca variatia activitatii de pH si efectul de tamponare a proteinelor. Insa, adesea conditiile pentru care exista o relatie lineara intre schimbarea aparenta de pH si concentratia substratului, pot fi stabilite.
Desi s-a obtinut un important progres in realizarea de biosenzori, exista inca o serie de probleme care trebuie rezolvate. Una dintre cele mai mari probleme este faptul ca performantele biosenzorului variaza sau se degradeaza in timp relativ scurt, adesea prin forme, modalitati neasteptate. Acest fenomen impune calibrarea lor regulata sau mai bine de fiecare data inainte de utilizare pentru o noua serie de analize.
Necesitatea de a rezolva astfel de probleme a condus la realizarea unor biosenzori cu electrozi ion-selectivi care contin si tranzistori cu efect intr-un camp ion-selectiv (ISFET = Ion Selective Field). Cand contin si enzima imobilizata cuplata cu campul in care transistorul actioneaza se numesc Enzyme Field Effect Transistor (ENFET) (fig…).
Biosenzori Amperometrici
Biosenzorii amperometrici functioneaza prin producerea unui curent electric cand se aplica un potential intre 2 electrozi. Acestia au in general timpi de raspuns, domenii dinamice si senzitivitati similare biosenzorilor potentiometrici.
Cel
mai simplu biosenzor amperometric aflat pe piata implica un electrod de oxigen
Cand un potential de 0,6 V, corespunzator electrodului de Ag/AgCl, se aplica la catodul de platina, se produce un curent proportional cu concentratia de oxygen si la electrozi au loc urmatoarele reactii:
anod de Ag: 4Ag0 + 4Cl-
![]() 4AgCl + 4e-
4AgCl + 4e-
catod de Pt: O2 + 4H+
+ 4e- ![]() 2H2O
2H2O
Prin aplicarea unui potential de +0,68 V la electrodul de platina, reciproc fata de Ag/AgCl, se obtinan reactii in sens contrar:
Reducerea eficienta a oxigenului la suprafata catodului determina scaderea concentratiei la electrod chiar pana la zero. De aceea viteza reducerii electrochimice depinde de viteza de difuzie a oxigenului din masa solutiei, si care este la randul ei dependenta de gradientul de concentratie si deci de concentratia oxigenului din masa de solutie. Este clar ca o mica, dar semnificativa, proportie de oxigen prezent in solutie prin dizolvarea oxigenului din aer este consumata prin acest proces impreuna cu cel eliberat prin reactia enzimatica. Acest lucru determina ca electrodul de oxigen sa fie mult mai sensibil la schimbarile de temperatura comparative cu senzorii potentiometrici. De aceea consumul de oxigen in lipsa enzimei, in conditiile de lucru de referinta, se stabileste pentru diferite temperaturi.
O aplicatie obisnuita pentru acest tip de biosenzor este determinarea concentratiilor de glucoza prin utilizarea unei membrane cu glucoz oxidaza imobilizata. Alte oxidaze pot fi utilizate intr-o maniera similara pentru analiza substratelor lor (de exemplu alcool oxidaza, D- si L – amino acid oxidaze, cholesterol oxidaza, galactoz oxidaza si urat oxidaza).
Problema majora cu acesti biosenzori este dependenta lor de concentratia oxigenului dizolvat. Una dintre metodele de rezolvare a acestei probleme este utilizatrea unor “mediatori” care transfera electronii in mod direct la electrod ocolind procesul de reducere a co-substratului oxigen. Pentru a fi aplicabili, acesti mediatori trebuie sa posede o serie de proprietati:
Ø Trebuie sa reactioneze rapid cu forma redusa a enzimei.
Ø Trebuie sa fie suficient de solubili, atat in forma redusa cat si cea oxidata; Aceasta solubilitate, nu ar trebui sa fie, insa, prea mare incat sa favorizeze pierderi semnificative a mediatorului de la micro mediului ce inconjoara membrana biocatalitica, in masa solutiei;
Ø Mediatorul solubil nu trebuie sa fie in mod general toxic.
Ø Sa fie capabili sa difuzeze rapid intre situsul activ al enzimei si suprafata electrodului.
Ø Potentialul suplimentar pentru regenerarea mediatorului oxidat, la electrod, ar trebui sa fie scazut si independent de pH.
Ø Forma redusa a mediatorului nu ar trebui sa reactioneze rapid cu oxigenul.
O familie de compusi utilizati in mod obisnuit ca mediatori este cea a ferocenilor. Ferocenul care reprezinta originea numerosilor derivati este fier ε5-bis-ciclopentadienil:
Un exemplu al reactiilor ce implica feroceni este:
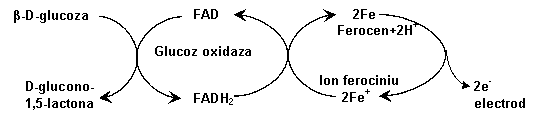
Biosenzori Optici
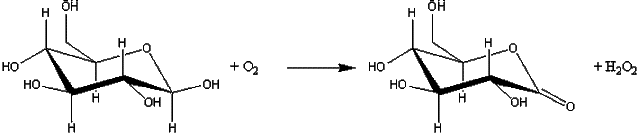
b-D-glucoza + oxigen ![]() D-glucono-1,5-lactona + peroxid de hidrogen
D-glucono-1,5-lactona + peroxid de hidrogen
peroxidaza
cromogen(2H) + H2O2 ![]() colorant + 2H2O
colorant + 2H2O
Lumina
produsa poate fi detectata fotometric prin utilizarea unor tuburi
fotoamplificatoare scumpe cu voltaj inalt dar este posibila si utilizarea unor
sisteme fotodiodice ieftine de voltaj scazut. Senzitivitatea sistemelor
continand fotoamplificatori este, cel putin pana in present, oarecum mai mare (<
104 cells ml-1, < 10-12 M ATP) fata de
fotodetectorii mai simpli care utilizeaza fotodiode. Luciferaza de la licurici
este insa o enzima foarte scumpa, obtinandu-se numai din partile din spate ale
licuricilor salbatici. Utilizarea luciferazei imobilizate reduce in mare parte
costul acestor analize.
Immunosenzori
Dezvoltarea evaluarilor a diferitilor analiti utilizand determinarea imunosorbtiei unor enzime legate, asa numitul sistem ELISA (Enzyme Linked Immunosorbent Assay) a dus si la dezvoltarea de biosenzori ce includ ELISA. Principiul general al tehnicilor ELISA se bazeaza pe imobilizarea antigenului pe un support solid, adaugarea apoi a anticorpilor conjugati cu enzima, incubarea acestora, adaugarea substratului si cromoforului si dezvoltarea culorii. Metodele ELISA sunt directe, indirecte si sandwich. Toate pot fi competitive sau de inhibitie. Cea mai simpla reprezentare a unui procedeu ELISA direct este prezentat in figura….
ELISA este utilizata pentru a detecta si amplifica o reactive antigen-antiocorp;
Cantitatea de enzima legata de anticorp se leaga de antigenul imobilizat care este apoi determinat prin comparare cu concentratia unor probe etalon si cuantificat prin viteza reactiei enzimatice. Enzimele cu un numar mare de cicluri sunt utilizate pentru obtinerea de raspunsuri rapide. Cele mai utilizate enzime in metodele ELISA sun peroxidaza si alcalin fosfataza. Senzitivitatea unor asemenea evaluari poate fi mult imbunatatita prin utilizarea reactiilor catalizate de enzime care dau in mod intrinsec un raspuns mai mare, de exemplu, acelea care conduc la cresterea culorii, fluorescentei sau bioluminiscentei produsilor.
Kit-uri de analiza folosind aceasta tehnica sunt in prezent disponibile pentru o gama larga de analize.
Pentru a le creste domeniul de analiza, viteza si sensibilitatea, recent, tehnicile ELISA au fost combinate cu cele al biosenzorilor conducand la obtinerea de immunosenzori. Cel mai simplu immunosenzor este realizat prin invelirea unui traductor cu complexul anticorp – enzima conjugata si introdus in tubul cu antigenul imobilizat. Dupa timpul necesar echilibrarii si legarii, materialul nelegat este spalat si aruncat. Cantitatea de antigen-enzima conjugata legata este determinata in mod direct din semnalul traductorului.
Dezvoltarea impetuoasa a tehnicilor la care asistam in present vor conduce curand la dezvoltarea unor imunosenzori mult mai avansati care se vor baza pe detectia directa a antigenului legat de anticorpul care inveleste suprafata biosenzorului.
In mod particular biosenzorii piezoelectrici si cei FET se considera a fi foarte potriviti pentru astfel de aplicatii.
Biosenzori Calorimetrici
Multe
reactii catalizate de enzime sunt exoterme, generand caldura (table…). Aceasta
poate fi utilizata ca baza pentru masurarea vitezei de reactie si astfel
concentratia analitului. Aceasta reprezinta tipul de biosenzor cel mai
aplicabil la modul general. Schimbarile de temperatura se determina, in mod
obisnuit, prin intermediul termistorilor
la intrarea si la iesirea dintr-o mica coloana ce contine un pat cromatografic
realizat cu enzima imobilizata si care
se afla intr-un mediu cu temperatura
In asemenea conditii, precis controlate, pana la 80% din caldura generata in reactie poate fi inregistrata ca o schimbare de temperatura in procesul de curgere a probei prin coloana. Schimbarea de temperatura poate fi usor calculata din modificarea entalpiei si cantitatea care a reactionat. Daca 1 mM reactant este complet convertit in produs, intr-o reactie care genereaza 100 kJ/mol atunci fiecare ml de solutie genereaza 0,1 J de caldura. La o eficienta de 80%, aceasta va determina o schimbare in temperatura solutiei cu aproximativ 0,020C. Aceasta este in general schimbarea de temperatura intalnita procesele enzimatice si pentru ca biosenzorul sa fie utilizabil, acesta trebuie sa aibe o rezolutie a temperaturii de 0,00010C.
Tabel…
Productia de caldura (entalpii molare) a reactiilor catalizate de enzime
|
Reactant |
Enzima |
Caldura
produsa |
|
Cholesterol |
Cholesterol oxidase |
|
|
Esteri |
Chymotrypsin |
|
|
Glucoza |
Glucose oxidase |
|
|
Hydrogen peroxid |
Catalase |
|
|
Penicillina G |
Penicillinase |
|
|
Peptide |
Trypsin |
|
|
Amidon |
Amylase |
|
|
Sucrosa |
Invertase |
|
|
Urea |
Urease |
|
|
Acid uric |
Uricase |
|
Termistorii, utilizati sa detecteze schimbul de temperatura, functioneaza prin modificarea rezistentelor lor electrice cu temperatura, si asculta de relatia:
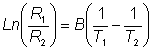 (2)
(2)
sau:
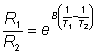 (3)
(3)
unde R1 si R2
sunt rezistentele termistorilor la temperaturile absolute T1 si T2
respectiv, iar B este o caracteristica
Cand schimbul de temperatura este foarte mic, ca in cazul prezent, valoarea B(1/T1)-(1/T2) este mult mai mica decat unu si relatia (3) poate fi substantial simplificata folosind aproximatia, cand x<<1 atunci ex 1 + x [am notat aici x = B(1/T1)-(1/T2)]. Relatia (3) devine:
 (4)
(4)
Deoarece T1 T2 acestea pot fi inlocuite la numitor prin T1
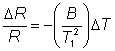 (5)
(5)
Descresterea
relativa in rezistenta electrica (ΔR/R) a termistorului este proportionala
cu cresterea temperaturii (ΔT). O
- 4%0C-1. Modificarea rezistentei este convertita intr-o schimbare proportionala de voltaj, folosindu-se o punte Wheatstone balansata, ce incorporeaza un rezistor de precizie, inainte de amplificare.
Biosenzori Piezo-electrici
Cristalele piezo-electrice (de exemplu cuartul) vibreaza sub influenta unui camp electric. Frecventa acestor oscilatii (f) depinde de grosimea si modul in care este taiat cristalul, fiecare cristal avand o frecventa rezonanta caracteristica. Aceasta frecventa de rezonanta se schimba cand se absorb sau desorb molecule pe suprafata cristalului, conform relatiei:
![]()
unde ∆f este schimbarea in frecventa
de rezonanta (Hz), ∆m este schimbarea de masa absorbita (g), K este o
Deficienta majora a acestor sisteme este interferenta cu umiditatea atmosferica si dificultatea de utilizare a lor pentru determinarea unui material aflat in solutie. Ele sunt, insa, ieftine, mici, robuste si capabile sa dea un raspuns rapid.
Reactii Enzimatice in Sisteme Lichide Bifazice
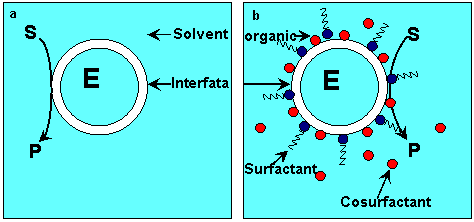
Figura 1 Diagrama schematica a unei enzime intr-un solvent organic. (a) enzima aproape anhidra este suspendata in solventul organic. Enzima (E) este inconjurata printr-un strat subtire, interfata, format din molecule de apa sau apa plus suportul de imobilizare. (b) enzima este dizolvata intr-un mediu micelar inversat. Micelele care se formeaza prin intermediul surfactantului si in unele cazuri si cosurfactantului permit o solubilizare a enzimei in solventul organic. Surfactantul se gaseste numai la interfata in timp ce cosurfactantul, nemiscibil cu apa, adera in proportii variate la interfata. El este in general mai putin polar si mult mai solubil in faza organica continua. Ambele sisteme, (a) si (b), formeaza solutii transparente din punct de vedere optic.
Solvent
LogP
Solvent
LogP
Butanona
1,1,1-tricloroetan
Etil acetat
tetraclorura de Carbon
Butanol
Dibutil eter
Dietil eter
Ciclohexan
Clorura de Metilen
Hexan
Butil acetat
eter de petrol (60-80)
Di-isopropil eter
eter de petrol (80-100)
Benzen
Dipentil eter
Cloroform
Heptan
Tetracloroetilen
eter de petrol (100-120)
Toluen
Hexadecan
Valorile logP cresc cu aproximativ 0,52 pentru fiecare grupare metilen (-CH2-) adaugata
intr-o serie omoloaga. Astfel logP a hexanolului este valoarea butanolului de 0,8 plus 2x0,52 deci aproximativ 1,8.
Alegerea fazei organice depinde de asemenea de factori suplimentari cum sunt costul, capacitatea de recuperare, riscul de incendiu sau evaporare precum si unele efecte inhibitoare specifice.
O modalitate simpla de a realiza stabilitatea enzimelor in solventi organici este de a impregna perle de polimer hidrofilic (ex. Sephadex, agaroza) cu enzima si apoi de suspendare a patului umed direct in faza organica. Aceste operatii sunt foarte importante si determina in mare parte alegerea celei mai potrivite faze organice. De asemenea astfel de paturi impregnate au si urmatoarele avantaje suplimentare:
Echilibre in Sisteme Bifazice Apa-Solvent Organic
![]() (I)
(I)
![]()
![]()
![]()
![]()
Utilizarea unor substraturi ‘nenaturale’.
Multe enzime sunt total nespecifice pentru substraturile lor naturale. S-a demonstrat ca unele enzime pot cataliza reactii complet diferite fata de cele considerate ca reactiile lor normale si reflectate in denumirea si numarul lor dat de EC (Enzymology Commission). Uneori este necesar ca enzima sa fie plasata intr-un mediu neobisnuit pentru ca ea sa-si etaleze noi activitati. Astfel, lipazele actioneaza ca transesteraze in medii ne-apoase. In unele cazuri, aceste schimbari de mediu nu sunt necesare pentru a se descoperi noi proprietati.
Cateva exemple a unor astfel de situatii:
Glucoz-oxidaza (EC 3.2.1.20) este specifica pentru substratul sau D-glucoza, dar foarte nespecific fata de oxidant, care este in mod normal oxigenul molecular. De exemplu a fost stabilit ca benzochinona este de asemenea un eficace substrat acceptor de electroni pentru aceasta enzima:
Ingineria enzimelor
Unul dintre cele mai atractive domenii de dezvoltare a enzimologiei care a luat amploare doar in ultimii ani este aplicarea tehnicilor de inginerie genetica la tehnologia enzimelor. Aceasta ramura a enzimologiei are in prezent o infloritoare dezvoltare.
In principal se utilizeaza doua cai de aplicare a ingineriei asupra enzimelor:
Figura.1 Ciclu de inginerie proteica. Procesul incepe cu izolarea si caracterizarea enzimei cerute. Aceasta informatie este analizata impreuna cu baza de date cunoscuta referitoare la efectele structurale ale substitutiei de aminoacizi pentru a se realiza o structura posibil imbunatatita. Aceasta enzima artificiala este construita prin mutageneza directa a situsului dorit, izolata si caracterizata. Rezultatele, cu success sau nu, se adauga la baza de date, si procesul se repeat pana cand se obtine rezultatul dorit.
Sisteme de Regenerare a Coenzimelor
Multe oxidoreductaze si toate ligazele utilizeaza coenzime (de exemplu NAD+, NADP+, NADH, NADPH, ATP), care trebuie regenerate cu fiecare molecula de produs ce se formeaza. Desi coenzimele sunt necesare pentru o serie de enzime utilizabile, aplicatia lor este in prezent limitata in mod sever pe de o parte de inaltul cost al coenzimelor si pe de alta de dificultatile de regenerare a acestora. Aceste doua probleme ar putea fi insa depasite daca coenzima este imobilizata impreuna cu enzima si regenerate in situ.
O metoda simpla de imobilizare/regenerare a coenzimelor ar fi de utilizare a
intregului sistem celular fapt ce va conduce binenteles la o mai larga utilitate. Insa, asa cum se cunoaste, imobilizarea coenzimelor impreuna cu enzimele conduce in general la o eficienta si flexibilitate mai scazuta decat in cazul doar a sistemelor enzimatice imobilizate.
O solutie convenabila de imobilizare si a coenzimelor impreuna cu enzimele lor ar fi reactoarele membranare. Acestea insa trebuie sa aibe dimensiunea porilor mai mica decat diametrul coenzimelor corespunzatoare, fapt ce este extrem de restrictiv.
Pentru o imobilizare si regenerare adecvata
coenzimele trebuie derivatizate. Cand acest proces se poate aplica cu succes,
coenzimele se ataseaza de suport fara ca functiile lor biologice sa fie intr-un
fel afectate. Calea sintetica cea mai larg aplicata implica alchilarea azotului
aminic exociclic N6- al adeninei prezenta in coenzimele NAD+,
NADP+, NADH, NA
In unele aplicatii, asa cum sunt cele ce utilizeaza reactoare membranare, este necesar doar ca dimensiuna coenzimei sa fie suficient de mare pentru a fi retinuta in interiorul sistemului.
Derivatii cu greutate moleculara mare si solubili in apa, sunt mult mai utilizabili deoarece ei depun o rezistenta difuzionala mult mai mica decat matricile insolubile.
Matricile insolubile larg folosite in aceste scopuri sunt dextranii, polietilenimina si polietilen glicolii. Pentru a se permite o libertate de miscare suficienta si a se evita pe cat posibil efectele inhibitoare, se considera ca trebuie atasate cantitati mici de coenzime la acesti suporti.
Proprietatile cinetice ale coenzimelor derivate variaza, depinzand de sistem, dar in general constantele Michaelis sunt mai mari si vitezele maxime mai mici decat ale coenzimelor native.
Coenzimele imobilizate pe suporti insolubili au cinetici oarecum mai putin favorabile chiar si atunci cand sunt co-imobilizate aproape de situsul activ al enzimelor ce le utilizeaza. Aceasta situatie se asteapta sa se imbunatateasca o data cu cresterea informnatiei asupra conformatiei partii proteice ce inconjoara situsurile active ale enzimelor si metodele de imobilizare vor deveni mai sofisticate. Insa costul unor asemenea derivati ramane totusi ridicat asa incat acestia vor deveni viabili din punct de vedere economic doar pentru productia unor produsi cu o valoare foarta inalta.
In present au fost totusi realizate cateva sisteme disponibile pentru regenerarea coenzimelor derivatizate prin metode chimice, electrochimice sau enzimatice.
Regenerarea enzimatica este avantajoasa datorita inaltei sale specificitati. Totusi pentru regenerarea dinucleotidelor oxidoreductazelor s-au dovedit competitive si procedurile electrochimice.
Procesele enzimatice in care regenerarea coenzimelor poate fi realizata, trebuie sa utilizeze substraturi ieftine, enzime usor disponibile si sa dea produsi usor de separat si care nu interfera cu procesul de regenerare. Exemple a unor astfel de procese sunt reprezentate de cele care utilizeaza format dehidrogenaza si acetat kinaza, desi pana acum, aceste preparate enzimatice comerciale au o activitate scazuta:
 III
III
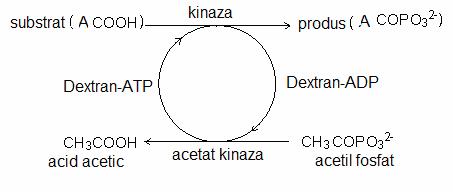 IV
IV
Tematica examen Enzimologie speciala – an III – 2008-2009
Strategia de alegere a sursei enzimatice
Schema generala a etapelor de extractie si purificare a enzimelor din diferite surse.
Separarea organitelor celulare (centrifugare diferentiata, centrifugare izopicnica).
Factori ce influenteaza extractia (Tampoane utilizate).
Factori ce influenteaza extractia (Prezenta enzimelor proteolitice).
Separarea prin membrane (Dializa).
Separarea prin membrane (Ultrafiltrarea).
Separarea prin membrane (Osmoza inversa).
Gel filtrarea.
Cromatografia de schimb ionic.
Electroforeza.
Focusarea izoelectrica. Cromatofocusarea.
Cromatografia hidrofoba
Cromatografia de afinitate. Elutia de afinitate.
Cromatografia covalenta.
Evaluarea proceselor de separare.
Imobilizarea enzimelor prin adsorbtie (tipuri de interactii, parametrii principali).
Imobilizarea prin incluziune (polimerizarea).
Imobilizarea prin incluziune (incapsulare).
Imobilizarea prin legare covalenta. Metode de activare( glutaraldehida, punti disulfurice).
Imobilizarea prin legare covalenta. Metode de activare(bromcian, triazine).
Imobilizarea prin legare covalenta (azotura, carbodiimida).
Biosenzori potentiometrici.
Biosenzori amperometrici.
Biosenzori optici.
Imunosenzori.
Reactii enzimatice in sisteme lichide bifazice - generalitati.
Echilibre in sisteme bifazice apa-solvent organic cu un substrat
Echilibre in sisteme bifazice apa-solvent organic cu doua substraturi Cazul hidrolazelor).
Echilibre in sisteme bifazice apa-solvent organic cu doua substraturi Cazul acizilor si bazelor).
Utilizarea unor substraturi ‚nenaturale’.
Ingineria enzimelor.
Enzime artificiale.
|