Membrana celulara. Structura moleculara si functiile membranelor celulare.
Membrana celulara delimiteaza continutul celular, confera individualitate celulei si mentine diferentele esentiale între citosol si mediul extracelular. Realizeaza transportul molecular si ionic, conexiunile intercelulare si ancorarea celulelor în matricea extracelulara, este sediul reactiilor enzimatice asociate structurilor membranare, are rol în semnalizarea celulara, recunoasterea, legarea si transmiterea moleculelor semnal care înmagazineaza informatie, precum si în imunitate.
3.1. Structura moleculara a membranelor biologice
Membranele biologice au o structura general identica, de ,,mozaic fluid" lipido-proteic, cu o grosime de 6-10 nm grosime. Este un fluid structural alcatuit din bistrat lipidic penetrat total sau partial de molecule proteice; între lipidele si proteinele membranare exista mai ales legaturi necovalente.
3.1.1.Dublul strat lipidic ( bistratul lipidic) al membranelor biologice
Este o componenta fundamentala de 5nm grosime, observabila în microscopie electronica. Are structura fluida, confera membranelor proprietatea de membrana impermeabila pentru moleculele hidrosolubile. Structura de bistrat este atribuabila proprietatilor speciale ale lipidelor membranare, care se asociaza spontan sub forma de bistrat si în conditii artificiale.
3.1.2.Lipidele majore ale membranelor celulare
Lipidele majore ale membranelor celulare reprezinta 50% din greutatea acestora si sunt reprezentate de trei clase 454f56e majore: fosfolipidele, colesterolul, glicolipidele. Exista 500-1000 de tipuri diferite de lipide în functie gruparile din capul polar, lungimea si gradul de desaturare al acizilor grasi componenti, în care sunt incluse si lipidele minore, de exemplu fosfatidilinozitolul. Bistratul lipidic contine 5x106 molecule lipidice/ μm2.
3.1.2.1.Fosfolipidele membranare Clasa fosfolipidelor cuprinde fosfogliceridele si sfingolipidele si reprezinta peste 50% din fosfolipidele membranare. Fosfolipidele au caracter amfipatic deoarece sunt formate dintr-o regiune hidrofila polara sau cap polar si o regiune hidrofoba nepolara sau cozi hidrofobe. Regiunea hidrofoba este formata din doua cozi hidrofobe alcatuite fiecare din câte un acid gras cu 14-24 atomi de carbon, unul fiind acid gras saturat, iar celalalt nesaturat, cu una sau mai multe legaturi duble de tip ,,cis". Diferentele în lungimea lantului de atomi de carbon ai acizilor grasi si în gradul lor de nesaturare influenteaza împachetarea moleculelor lipidice si fluiditatea bistratului. Prezenta dublelor legaturi de tip ,,cis" introduce un punct de inflexiune în catenele acidului gras nesaturat. Cele mai numeroase fosfolipide membranare sunt fosfogliceridele. Ele sunt formate dintr-un schelet de glicerina, prin esterificarea a doua grupari hidroxil din structura glicerinei cu doi acizi grasi si a celei de-a treia, cu acid fosforic. Gruparea fosfat la rândul ei, leaga diferite tipuri de molecule, formându-se regiunea cap hidrofila a diferitelor tipuri de fosfogliceride: fosfatidiletanolamine, fosfatidilserina, fosfatidilcolina, fosfatidilgicerol, difosfatidilglicerol (cardiolipina), fosfatidilinozitol. În acidul fosfatidic gruparea fosfat nu este legata la o alta molecula polara. Sfingolipidele contin sfingozina (un aminoalcool) în loc de glicerol. Sfingozina este formata dintr-un lant lung nesaturat, cu o grupare amino care leaga un acid gras prin legatura amidica, rezultând structura ceramidica si doua grupari hidroxil, dintre care gruparea hidroxil terminala a sfingozinei leaga prin legatura fosfodiesterica gruparea polara. Sfingolipidul major este sfingomielina.
3.1.2.2.Colesterolul
Raportul molecular colesterol:fosfolipide în membranele celulare este de 1:1. Molecula de colesterol se insereaza între fosfolipidele membranare, orientându-se cu gruparea hidroxil în vecinatatea capului polar al fosfolipidelor. Inelul steroidic este o structura rigida, plana, care interactioneaza cu lantul hidrocarbonat adiacent capului polar, lasând restul cozilor hidrofobe ale acizilor grasi libere, flexibile. Colesterolul moduleaza proprietatile bistratului lipidic, intensificând proprietatea de bariera impermeabila fata de moleculele mici solubile în apa, influenteaza fluiditatea membranei, previne interactiunea lanturilor hidrocarbonate ale acizilor grasi din structura lipidelor membranare.
3.1.2.3.Glicolipidele membranare
Glicolipidele membranelor celulare sunt specifice pentru specie, sunt de asemenea tisular-specifice si reprezinta 5% din moleculele lipidice ale monostratului extern. Contin un cap polar format din unul sau mai multe resturi glucidice, atasate la o structura ceramidica. De exemplu, în structura galactocerebrozidelor, sfingozina împreuna cu acizii grasi formeaza o structura ceramidica de care sunt atasate resturi de galactoza, iar gangliozidele contin unul sau mai multe resturi de acid sialic (acid N-acetilneuraminic) care imprima acestor molecule încarcatura negativa. În consecinta, gangliozidele participa la constructia moleculara a canalelor ionofore si la mecanismul de transmitere a informatiei de la suprafata celulei (semnalizarea celulara). Clasele de lipide membranare, datorita structurii si proprietatilor lor imprima membranelor anumite caracteristici: 1. Fosfolipidele formeaza spontan bistratul, deoarece au o regiune hidrofila sau polara care este capabila de interactiuni electrostatice sau prin legaturi de hidrogen cu moleculele de apa. Regiunile hidrofobe sunt insolubile în apa deoarece nu pot forma interactiuni energetic favorabile cu moleculele de apa. Ca urmare, moleculele de apa înconjoara moleculelehidrofobe formând structuri asemanatoare unor ,,custi", în care moleculele de apa se prezinta într-un aranjament mult mai ordonat decât în apa care constituie mediul înconjurator. Costul energetic este minimalizat daca moleculele hidrofobe se acumuleaza cât mai strâns, astfel încât un numar cât mai mic de molecule de apa sa fie implicate în înconjurarea lor.Introduse în mediu apos, moleculele cu caracter amfipatic ale lipidelor membranare agrega spontan în asa mod încât adapostesc regiunile (cozile) hidrofobe în interiorul structurilor sferice denumite micelii sau plane denumite bistrat lipidic, fiind expuse apei regiunile cap hidrofile. 2. Fosfolipidele se rearanjeaza spontan, refac bistratul atunci când apar brese în acesta. 3. O alta proprietate este fluiditatea care sta la baza caracterului dinamic al membranelor celulare. La o anumita valoare de temperatura denumita temperatura critica, are loc tranzitia de faza, adica trecerea bistratului din stare fluida în stare de gel, datorita scaderii mobilitatii legaturilor C-C din lanturi hidrocarbonat ale acizilor grasi din structura fosfolipidelor. Are loc trecerea de la o conformatie randomica la o conformatie cu grad superior de ordonare. Valoarea de temperatura la care are loc tranzitia de faza depinde de lungimea si caracterul nesaturat al lanturilor hidrocarbonate ale fosfolipidelor. Lanturile hidrocarbonate mai scurte si prezenta legaturilor duble favorizeaza organizarea randomica datorita scaderii numarului de legaturi van der Waals dintre regiunile hidrofobe. Fluiditatea depinde si de continutul de colesterol al membranelor, concentratiile mari de colesterol scad fluiditatea bistratului. Aceasta scadere a fluiditatii are efecte aupra functiilor membranei celuare, prin scaderea permeabilitatii pentru apa si molecule hidrofile si cresterea rezistentei mecanice a acestora. Prezenta glicolipidelor influenteaza fluiditatea: gangliozidele se caracterizeaza prin capacitatea de a participa la formarea legaturilor de hidrogen care determina cresterea gradului de ordonare moleculara si scaderea fluiditatii. 4. Bistratul lipidic este format din domenii cu compozitie diferita: fortele van der Waals (forte de atractie între lanturile hidrocarbonate ale lipidelor membranare adiacente) nu sunt suficient de selective pentru a tine împreuna grupurile de molecule fosfolipidice, în consecinta apar domenii specializate denumite ,,bacuri de lipide". Un exemplu de astfel de domenii sunt caveolele implicate în endocitoza, bogate în colesterol si sfingolipide, împreuna cu proteine specifice cu rol stabilizator al acestor domenii. Un alt exemplu este cel al unor domenii care contin o proportie ridicata de sfingolipide care, având lanturi hidrocarbonate mai lungi, determina la acest nivel o grosime crescuta a bistratului, intervenind în organizarea moleculelor proteice pentru a-si îndeplini functiile: de transport, de semnalizare celulara. 5. Organizarea sub forma de monostrat a lipidelor (în loc de bistrat) este caracteristica picaturilor lipidice cu rol în depozitarea trigliceridelor si colesterolului esterificat, fiind sursa de precursori lipidici pentru sinteza membranelor sau sursa de substrate pentru metabolismul energetic. Monostratul lipidic contine mari cantitati de proteine, unele cu functie în metabolismul lipidelor, altele cu functie necunoscuta. Lipidele neutre din aceste picaturi lipidice sunt molecule hidrofobe care în mediul apos intracelular agrega în picaturi tridimensionale înconjurate de monostratul lipidic, cu cozile hidrofobe orientate spre continutul în lipide neutre, iar cu capetele hidrofile spre mediul apos intracelular. Aceasta organizare este întâlnita în special în adipocite.
3.1.3. Proteinele membranelor celulare
Proteinele membranare sunt moleculele implicate în functiile majore ale membranelor celulare. Reprezinta 50% din greutatea membranelor celulare si 75% din greutatea membranelor mitocondriale, cu o intensa activitate metabolica. Clasificarea acestor proteine s-a facut dupa criteriul topografic, dar si dupa aspectul interactiunilor cu moleculele lipidice ale bistratului în doua clase: proteine integrale ale membranelor si proteine periferice (de suprafata).
3.1.3.1. Proteinele integrale
Pot penetra membrana în întregime datorita caracterului lor amfipatic: regiunea centrala localizata în interiorul membranei are caracter hidrofob si interactioneaza cu lanturile hidrocarbonate ale fosfolipidelor, fiind alcatuita din aminoacizi cu caracter nepolar. Legaturile dintre aminoacizi sunt legaturi peptidice care sunt legaturi polare si pentru ca apa este absenta în compartimentul hidrofob al membranelor, aceste legaturi peptidice vor forma punti de hidrogen între ele. Domeniile hidrofile ale moleculelor proteice vor fi expuse pe fata extracelulara si citosolica a membranelor, în contact cu gruparile polare ale moleculelor lipidice. Lanturile polipeptidice ale acestor proteine transmembranare pot realiza unul sau mai multe pasaje prin bistratul lipidic, prezentând conformatie de α-helix: un pasaj prin bistrat- un α-helix ( ,,singlepass"), mai multe pasaje prin bistrat- mai multe α-helixuri (,,multipass"). Conformatia de α-helix nu este unica conformatie a proteinelor transmembranare. Aceste proteine pot prezenta conformatie a lantului polipeptidic de β-foaie pliata, care poate fi împachetata sau rulata în continuare în conformatie de ,,β-barrel", multiplele segmente transmembranare putând satisface în acest caz necesitatea de legaturi de hidrogen. α-helixurile proteinelor transmembranare au functie de ancorare în bistratul lipidic prin compozitia în aminoacizi hidrofobi. Multe proteine transmembranare care realizeaza un singur pasaj prin bistrat formeaza homodimeri datorita interactiunilor dintre domeniile α-helix adiacente, cruciale pentru structura si functia proteinelor-canal si proteinelor transportor. Proteinele transmembranare care realizeaza mai multe pasaje sunt formate din mai multe α-helixuri, toate constituite din aminoacizi hidrofobi, deoarece dupa sinteza lor în citosol, acestea sunt initial integrate în bistratul lipidic de o proteina-translocaza, fiind înconjurate de molecule lipidice. Împachetarea moleculei proteice apare ulterior si apara o parte din α-helixuri de contactul cu lipidele membranare, unele interactiuni proteine-lipide fiind înlocuite cu interactiuni proteine-proteine si α-helix-α-helix, facilitând astfel aparitia unor structuri canal pentru transportul moleculelor hidrofile mici prin membrana hidrofoba . Unele proteine integrale strabat partial membrana si sunt integrate în bistrat în trei moduri diferite: 1. Proteinele prezente pe fata citoplasmatica, cum este familia de proteine Src kinaze care convertesc semnale extracelulare în semnale intracelulare, contin acid miristic adaugat la gruparea aminoterminala a proteinei în timpul sintezei în ribozomi- se stabileste o legatura amidica. Acidul miristic reprezinta o prima ancora, care se insera în monostratul citoplasmic al bistratului, însa este o ancora slaba. Aparitia unei molecule-semnal din mediul extracelular determina adaugarea acidului palmitic la un rest de cisteina al lantului polipeptidic pentru a ancora mai ferm proteinele Src. Oprirea semnalelor extracelulare conduce la desprinderea acidului palmitic si desprinderea kinazelor din membrana celulara, urmata de eliberarea lor în citosol si, fireste, de inactivarea caii de semnalizare celulara. Inserarea unor proteine cum sunt proteinele p 21ras se poate realiza prin legarea unui rest farnezil la un rest de cisteina prin legatura tioesterica , la capatul C-terminal al proteinei. 2. Proteinele situate pe fata exoplasmica a membranelor celulare se ancoreaza de monostratul lipidic prin intermediul unui fosfolipid glicozilat care contine resturi glucidice inozitol si N-acetilglucozamina.
3.1.4. Carbohidratii membranelor celulare
Reprezinta 2-10% din greutatea componentelor membranare. Oligo- si polizaharidele se leaga covalent de proteinele sau lipidele membranare formând glicoproteine si respectiv, glicolipide: majoritatea proteinelor de suprafata ale membranelor sunt glicoproteine si una din zece molecule lipidice membranare sunt glicozilate. Proteoglicanii sunt constituiti dintr-o componenta proteica în bistratul lipidic si o componenta polizaharidica. Lantul polizaharidic ramâne în exteriorul celulei, fiind o componenta a matricei extracelulare.
3.1.5. Mobilitatea proteinelor si lipidelor în membrana celulara
Mobilitatea proteinelor si lipidelor în monostratul lipidic se realizeaza prin difuzie laterala. Un alt mecanism este difuzia rotationala, care semnifica miscarea de rotatie a unei biomolecule în jurul unei axe perpendiculare pe planul membranei. Atât difuzia laterala cât si cea rotationala sunt favorizate energetic, deoarece regiunile nepolare ale moleculelor proteice si lipidice nu parasesc interiorul hidrofob. Difuzia transversala denumita si inversiune sau ,,flip-flop" se realizeaza prin deplasarea moleculelor între cele doua monostraturi ale bistratului lipidic. Mobilitatea lipidelor si proteinelor membranare împreuna cu fluiditatea bistratului determina caracterul dinamic al membranelor celulare.
3.1.6. Asimetria distributiei componentelor membranare
Este o caracteristica cu rol esential în realizarea functiilor celulare. Distributia asimetrica a moleculelor lipidice pe cele doua fete ale bistratului poate fi exemplificata prin structura membranei hematiilor care contine în monostratul lipidic extern predominant fosfatidilcolina si sfingomielina, iar în monostratul intern fosfatidiletanolamina si fosfatidilserina. Consecintele sunt multiple: diferentele gradului de nesaturare ale lanturilor hidrocarbonate ale lipidelor si natura diferita a gruparilor polare determina diferente în fluiditatea celor doua monostraturi, apare de asemenea si o distributie diferita a sarcinilor electrice, fosfatidilserina fiind singurul fosfolipid cu sarcina negativa. Importanta functionala a asimetriei de distributie a componentelor membranare poate fi exemplificata astfel:
Activitatea enzimatica a proteinelor asociate membranei este dependenta de sarcina electrica a fosfolipidelor, proteinkinazele necesitând prezenta fosfatidilserinei cu sarcina electrica negativa.
În timpul apoptozei, fosfatidilserina este translocata în monostratul exoplasmic al bistratului lipidic si expusa astfel pe suprafata celulara, semnalizeaza macrofagelor prezenta unei celule moarte, acesta fiind semnalul pentru fagocitare. Translocarea fosfatidilserinei în monostratul extern se produce prin inactivarea translocazei care realizeaza translocari din monostratul extern în cel intern si activarea scramblazei care transfera fosfolipide nespecific între monostraturile lipidice.
Localizarea glicolipidelor în monostratul extern este implicata functional în mecanisme de semnalizare celulara, ele functionând ca receptori. De exemplu, toxina holerica se leaga doar de celule care prezinta gangliozide GM1 pe suprafata celulara (celulele epiteliului intestinal). Se remarca localizarea proteinelor membranare, mai precis orientarea stricta, specifica pe fata exoplasmica sau citosolica a unor domenii ale moleculelor proteice. De exemplu, glicoproteinele au lanturile oligozaharidice orientate pe fata externa a membranelor celulare si pe fata citosolica a membranelor reticului endoplasmic si aparatului Golgi. Localizarea asimetrica a lipidelor si proteinelor determina delimitarea specifica a unor domenii structural-functionale ale membranelor celulare: un exemplu ilustrativ este domeniul apical, respectiv laterobazal al membranei celulelor epiteliului intestinal.
3.2. Functia de transport a membranelor celulare
Existenta celulelor depinde de o permanenta comunicare cu mediul înconjurator, iar un rol fundamental în aceasta comunicare o are proprietatea de permeabilitate selectiva a membranelor celulare. Consecinta este mentinerea homeostaziei celulare, adica asigurarea concentratiilor intracelulare relativ constante ale substantelor organice, ionilor, metabolitilor, mentinerea unei activitati metabolice stabile si reglarea volumului celular. Permeabilitatea selectiva este influentata de metabolismul celular, conditiile din mediul extracelular si tipul de tesut. Transportul diferitelor substante prin membrana depinde de caracteristicile substantei transportate (greutatea moleculara, forma, dimensiuni, gradul de ionizare, gradul de hidratare) si de compozitia chimica a membranelor, clasificându-se în: ◘Transport de ioni si molecule mici prin mecanisme de difuzie sau mecanisme în care sunt implicate proteine membranare. ◘Transport de macromolecule si particule prin vezicule delimitate de membrane.
Dupa consumul de energie metabolica înmagazinata în ATP, transportul prin membranele celulare se clasifica în ◘transport pasiv si ◘transport activ.
3.2.1. Transportul pasiv
Transportul moleculelor si ionilor prin membrana celulara în sensul gradientului de concentratie sau electrochimic se numeste transport pasiv. Decurge fara consum de energie inmagazinata în ATP, câteodata chiar cu pierdere de energie libera.
3.2.1.1. Difuzia simpla
Caracterizeaza moleculele mici cu caracter hidrofob si gazele: CO2, O2. Este cel mai simplu tip de transport pasiv, difuzia simpla fiind determinata de gradientul de concentratie si/sau electric al particulelor transportate, de o parte si de alta a membranei. Moleculele nu sunt modificate chimic sau asociate altor molecule în cursul trecerii prin membrana. Difuzia simpla se desfasoara în urmatoarele etape:
Trecerea moleculelor din mediul extracelular sau intracelular apos în interiorul hidrofob al membranei
Traversarea bistratului lipidic
Deplasarea moleculelor din membrana în mediul apos intracelular sau extracelular
Viteza cu care se desfasoara etapa 1 depinde de coeficientul de partitie (K) al moleculei, care masoara afinitatea relativa a moleculei pentru mediul lipidic în raport cu apa, altfel spus, ilustreaza gradul de hidrofobicitate al moleculei. Cu cât valoarea acestui coeficient este mai mare, molecula este mai hidrofoba (liposolubila) si patrunde mai repede în celula.Coeficientul de partitie este direct proportional cu constanta de permeabilitate a membranelor celulare (P). Viteza de difuzie a moleculelor prin membrana este mult mai mica în mediu apos, deci etapa 2 limiteaza viteza transportului. Difuzia simpla se desfasoara conform legii lui Fick daca avem gradient de concentratie pe cele doua fete ale membranei:
(dn/dt) = P x S (C1aq - C2aq)
adica, viteza de difuzie este direct proportionala cu diferenta de concentratie, suprafata si coeficientul de permeabilitate al membranelor.
3.2.1.2. Difuzia facilitata a moleculelor si ionilor
A.În difuzia facilitata transportul pasiv este mediat de proteine membranare denumite permeaze care au specificitate fata de molecula transportata, proces cu cinetica de tip enzimatic. Permeaza leaga reversibil la un situs activ pe o fata a membranei o singura specie moleculara sau molecule ce apartin unei singure familii: se formeaza complexul permeaza-molecula care traverseaza bistratul, disociindu-se pe cealalta fata a membranei, cu eliberarea moleculei transportate. Viteza cu care are loc difuzia facilitata în functie de concentratia moleculei transportate a evidentiat existenta unei relatii de tip Michaelis-Menten pentru reactii enzimatice cu un singur substrat. Viteza atinge o valoare maxima atunci când devine independenta de concentratia substratului: la viteza maxima apare fenomenul de saturare, toate permeazele fiind ,,ocupate", implicate în complexe de tip permeaza-molecula de transportat. O alta caracteristica comuna între difuzia facilitata si reactiile enzimatice este inhibitia specifica competitiva prin molecule similare sau necompetitiva, de exemplu prin ioni ai metalelor grele sau 2,4 dinitrofluorobenzen. Modelul propus: modelul transportorilor carausi care executa o miscare de rotatie în bistratul lipidic care are drept rezultat trecerea moleculelor de pe o fata pe alta a membranelor celulare. Un exemplu este transportul unor ioni de polipeptide antibiotic ( valinomicina transporta în acest mod ionul de potasiu). Un alt model este cel în care permeaza sufera o modificare conformationala în urma legarii moleculei de transportat, consecinta fiind o modificare conformationala, formarea unui ,,canal" prin care moleculele pot traversa membrana. Modificarea conformationala ar determina de fapt orientarea aminoacizilor hidrofili ai permeazei spre interiorul moleculei, care ar delimita ,,canalul" prin care pot trece moleculele hidrofile. B. Difuzia mediata de proteinele canal, proteine transmembranare strabatute de un canal delimitat de aminoacizi hidrofili care formeaza pori membranari: 1.proteinele canal ionice prin care ionii difuzeaza cu diferite viteze în sensul gradientului de concentratie. Sunt de mai multe tipuri în functie de modul cum are loc deschiderea lor care este un raspuns celular la stimuli mecanici, sau pot fi canale dependente de voltaj ( potentialul de membrana) sau de liganzi. Ligandul poate fi un mediator extracelular (neurotransmitator) sau intracelular (ion, nucleotid, proteina de legare a GTP). Canalele cu poarta comandata de voltaj Celulele excitabile (neuronul si celulele musculare) sufera modificari controlate ale valorilor potentialului de membrana, asigurându-se conducerea impulsului electric de-a lungul membranei plasmatice. Celulele aflate în stare de repaus se caracterizeaza prin potential de membrana denumit potential de repaus. În prezenta unui stimul, se produce o excitatie electrica rapida, autopropagabila, cu caracter tranzitoriu denumita potential de actiune care genereaza un ciclu de depolarizare a membranei, hiperpolarizare, revenire la starea de repaus, asociate cresterii tranzitorii a permeabilitatii membranei celulare pentru ionii de Na si K, datorita conformatiilor moleculare alternative ale proteinelor canal în functie de diferenta de potential. Depolarizarea este determinata de cresterea permeabilitatii pentru Na+, în consecinta ionii de Na patrund în celule datorita gradientului de concentratie ionica si potentialului de repaus. Se deschid si proteinele canal pentru K+, se produce efluxul ionilor de potasiu. Exista doua optiuni în acestmoment: anularea generarii potentialului de actiune sau dezvoltarea potentialului de actiune, în functie de permeabilitatea pentru Na/K. Daca permeabilitatea pentru ionii de sodiu este mai mare decât permeabilitatea pentru ionii de potasiu, influxul de Na este mai mare decât efluxul de K: se produce accentuarea depolarizarii locale a membranei si apare potentialul de actiune. La un prag de +35 mV canalele de Na+ sunt închise-inactive si membrana fiind refractara la noi stimuli, este posibila restabilirea potentialului de repaus. Proteinele canal pentru Na+ sunt formate din patru domenii transmembranare, fiecare alcatuit din câte sase α-helixuri. Al 4-lea α-helix din fiecare domeniu este alcatuit din aminoacizi încarcati pozitiv ( arginina, lizina), cu rol de senzor voltaic. Canalele cu poarta comandata de liganzi. Structurile jonctionale specializate în transmiterea semnalelor de la neuroni la celule-tinta: neuroni, celule musculare, poarta denumirea de sinapse, care pot fi electrice sau chimice. Sinapsele chimice implica eliberarea de catre neuroni a neurotransmitatorilor care actioneaza asupra celulelor-tinta, împachetati sub forma de vezicule sinaptice în terminatia axonala a neuronului presinaptic. Eliberarea neurotransmitatorului în placa sinaptica determina cresterea concentratiei de Ca++ în celula presinaptica, ca urmare a deschiderii canalelor pentru Ca++ cu poarta comandata de voltaj, în momentul aparitiei potentialului de actiune. Legarea neurotransmitatorilor de receptorii membranari ai celulei postsinaptice determina modificarea conformatiei acelui receptor, deschiderea canalului ionic, adica modificarea permeabilitatii locale a membranelor urmata de depolarizare si propagarea potentialului de actiune. De exemplu, legarea acetilcolinei la receptorul nicotinic creste local permeabilitatea membranei postsinaptice pentru Na+ si K+ , apare depolarizarea membranei si este generat potentialul de actiune. La rândul sau, propagarea potentialului de actiune determina deschiderea proteinelor canal pentru Na +(comandate de voltaj) din sarcolema, depolarizarea membranei reticulului sarcoplasmic si eliberarea Ca++ în citosol. Cresterea concentratiei intracelulare a calciului determina contractia musculara.
2. proteinele canal ionice de repaus, dintre care cel mai reprezentativ este canalul de K+ a carui existenta explica permeabilitatea mare a membranelor celulare pentru ionii de potasiu si rolul major al K+ în mentinerea potentialului de membrana. Exista peste 100 de tipuri de canale pentru ioni. Canalul de K+ este un tetramer dotat cu aminoacizi încarcati electronegativ care atrag cationii si cu un filtru ion-selectiv care se deschide spre mediul apos extracelular, expunând cei 4 atomi de oxigen carbonil dintr-un rest de glicina (Gly79 KcsA). Urmatorul rest al partii extracelulare a filtrului este asparagina un aminoacid încarcat negativ (Asp80 KcsA). Oxigenii carbonil sunt puternic electronegativi si atrag cationi, filtrul ion-selectiv poate astfel lega ioni de K la nivelul a 4 situsuri notate S1→S4 începând din partea extracelulara a canalului ionic. Transportul ionilor de sodiu prin aceste proteine-canal este energetic nefavorabil, interactiunile puternice dintre filtru si buclele porului nu pot permite interactiunu cu cationi de dimensiuni mai mici, cum este cationul de Na.Datorita transportului selectiv al ionilor prin membrana plasmatica si a diferentelor de compozitie ionica dintre citosol si mediul extracelular, cele doua fete ale membranei sunt diferite din punctul de vedere al încarcaturii electrice: fata citoplasmica este încarcata negativ în raport cu fata exoplasmica, deci exista o diferenta de potential electric denumita potential de membrana. Transportul unei specii ionice prin aceste proteine canal depinde de gradientul de concentratie ionica si valoarea potentialului de membrana, care împreuna formeaza gradientul electrochimic. Mentinerea stabilitatii potentialului de membrana se realizeaza prin mecanisme în care proteinele canal pentru K+ au un rol central. Pomparea ionilor de Na în spatiul extracelular prin activitatea Na+/K+ ATPazei conduce la cresterea numarului sarcinilor electrice pozitive pe fata exoplasmica a membranelor si la aparitia unui exces de sarcini electrice negative pe fata citoplasmatica datorita anionlor organici intracelulari. Restabilirea echilibrului se produce datorita influxului de K+ prin functionarea Na+/K+ ATPazei, dar si prin difuzia lor libera prin canalele de K+. Influxul de potasiu are loc împotriva gradientului de concentratie, sub actiunea fortelor de atractie electrostatica determinate de sarcinile electrice negative din celula. 3. canalele de transport pentru apa (aquaporinele) Au fost identificate 13 tipuri de aquaporine în membranele celulelor umane, membri ai unei familii de proteine majore intrinseci de membrana, care transporta apa în si din celula, prevenind trecerea ionilor si altor substante. Prima aquaporina descoperita a fost AQP1 din membrana eritrocitului, a carei existenta a fost raportata de profesor dr. Gheorghe Benga de la Universitatea de Medicina si Farmacie ,,Iuliu Hatieganu" din Cluj-Napoca, în 1986. Încercarile de izolare ale antigenului Rh, evidentiau constant o proteina asociata de 28 kDa, necunoscuta, cu functie nedeterminata, dar cu prezenta constanta în membrana hematiilor si în membranele celulelor tubilor renali. Peter Agre este cel care izoleaza si caracterizeaza aceasta proteina cu functie de transport al apei, dupa ce mult timp a fost suspectat un mecanism aditional de transport al apei care ar explica permeabilitatea mare pentru apa a membranelor unor tipuri de celule, permeabilitate care nu poate fi explicata prin simpla osmoza. Pentru activitatea sa de caracterizare si demonstarare a existentei aquaporinelor, Peter Agre primeste premiul Nobel în 2003. Aquaporinele sunt formate din 6 domenii α-helix transmembranare care determina 5 bucle interhelicale (A-E) care formeaza domeniile extracelulare si citosolice ale proteinei. Buclele B si E sunt bucle hidrofobe care contin un motiv înalt conservat Asn-Pro-Ala (NPA) care prin suprapunere în portiunea centrala hidrofoba a bistratului lipidic, formeaza una din cele doua constrictii ale aquaporinei în forma de clepsidra. Cealalta constrictie, mai îngusta, este filtrul selectiv ar/R (aromatic/Arg), care slabeste legaturile de H dintre moleculele de apa, permitând acestora sa traverseze porul îngust al aquaporinelor si sa interactioneze cu resturile de arginina încarcate pozitiv, care în acelasi timp opresc trecerea protonilor prin aceasta proteina-canal. AQP1 se gaseste în membrana bazolaterala si apicala a celulelor epiteliale din tubii contorti proximali, ansa lui Henle si vasa recta, în membranele hematiilor, endoteliilor vasculare si tractului gastrointestinal. AQP2 se gaseste în ductul colector principal al rinichilor si este controlata de vasopresina, mutatii în gena AQP2 determina diabetul insipid. AQP2 apare în membrane intracelulare. Tipurile 3 si 4 sunt raspunzatoare de reabsorbtia apei la nivelul ductelor colectoare medulare din rinichi. Tipurile 3, 7, 9 si 10 sunt aquagliceroporine, canale care transporta glicerol si apa. Daca aquaporinele au un rol crucial în mentinerea homeostaziei apei, rolul lor fiziologic si patologic ca transportori ai glicerolului nu este elucidat deplin. Adipocitele sunt sursa majora de glicerol, substrat pentru gluconeogeneza hepatica. Aquaporinele 7 si 9 (AQP7, AQP9) sunt canale pentru glicerol în adipocite si hepatocite, care mentin balanta optima între eliberarea glicerolului din adipocite si preluarea acestuia în hepatocite.
|
|
Major Sites of Expression |
Comments |
|
Aquaporin-0 |
Eye: lens fiber cells |
Fluid balance within the lens |
|
Aquaporin-1 |
Red blood cells |
Osmotic protection |
|
Kidney: proximal tubule |
Concentration of urine |
|
|
Eye: ciliary epithelium |
Production of aqueous humor |
|
|
Brain: choriod plexus |
Production of cerebrospinal fluid |
|
|
Lung: alveolar epithelial cells |
Alveolar hydration state |
|
|
Aquaporin-2 |
Kidney: collecting ducts |
Mediates antidiuretic hormone activity |
|
Aquaporin-3 * |
Kidney: collecting ducts |
Reabsorbtion of water into blood |
|
Trachea: epithelial cells |
Secretion of water into trachea |
|
|
Aquaporin-4 |
Kidney: collecting ducts |
Reabsorbtion of water |
|
Brain: ependymal cells |
CSF fluid balance |
|
|
Brain: hypothalamus |
Osmosensing function? |
|
|
Lung: bronchial epithelium |
Bronchial fluid secretion |
|
|
Aquaporin-5 |
Salivary glands |
Production of saliva |
|
Lacrimal glands |
Production of tears |
|
|
Aquaporin-6 |
Kidney |
Very low water permeability; function? |
|
Aquaporin-7 * |
Fat cells |
Transports glycerol out of adipocytes |
|
Testis and sperm |
|
|
|
Aquaporin-8 |
Testis, pancreas, liver, others |
|
|
Aquaporin-9 * |
Leukocytes |
|
|
* an aquaglyceroporin |
||
(preluat www.vivo.colostate.edu/hbooks/molecules/aquaporins.html, autor R.Bowen)
Curs 3.
3.2.2. Transportul activ
Pentru a mentine constanta concentratia ionica a mediului intracelular, celula si-a creat mecanisme de transport activ, capabile sa deplaseze moleculele si ionii în sens invers gradientelor de concentratie si electrochimice, datorita consumului de energie metabolica.
3.2.2.1. Transportul activ propriu-zis
În acest tip de transport, proteina-transportor are si functie ATPazica si utilizeaza energia eliberata prin hidroliza ATP în procesul de transport. Aceste proteine transportoare sunt clasificate în:
Clasa ATPazelor de tip P care au ca reprezentant major Na+-K+ ATPaza raspunzatoare de eliminarea activa din celula a ionilor de sodiu concomitent cu acumularea intracelulara a ionilor de potasiu. Mentinerea constanta a concentratiei intracelulare de K+ prin functia acestei pompe asigura conditii pentru desfasurarea biosintezei proteinelor, activitatii unor enzime si mentinerii potentialului de membrana. Un alt reprezentant este Ca2+ATPaza care este situata la nivelul membranei celulare si are rolul de a scoate ionii de calciu din celule, pentru mentinerea unei concentratii intracelulare potrivite desfasurarii proceselor de semnalizare celulara. Pe de alta parte, Ca2+ ATPaza localizata în membrana reticulului sarcoplasmic din celulele musculare, scade conentratia intracelulara de Ca2+ prin transportul activ al acestor ioni în lumenul reticulului în timpul relaxarii musculare.
Clasa ATPazelor de tip V cuprind pompele de protoni (H+ATPazele) care au functia de a pompa protoni prin membrana celulara a unor tipuri de celule ( renale, osteocaste, macrofage, neutrofile, spermatozoizi, celule tumorale, fiind implicate în procese ca homeostazia, resorbtia osoasa, transportul cuplat prin membrana, fecundarea ovulului de spermatozoid, metastazarea tumorala. H+ATPazele localizate la nivelul membranelor endosomale si lizosomale cu rol în scaderea pH-ului din interiorul acestor organite.
Clasa ATPazelor de tip F din membrana mitocondriilor utilizeaza gradientul protonic pentru a sintetiza ATP (cupleaza sinteza ATP cu transportul H+ de la concentratii ridicate la concentratii scazute).
Clasa ATPazelor de tip ABC se remarca printr-un numar mare de molecule ce apartin acestei clase, implicate în mecanisme cu semnificatie în domeniul clinic. Daca ABC ATPazele bacteriene realizeaza importul de ioni, aminoacizi, peptide, proteine, mono- si polizaharide necesare acestor celule, ATPazele ABC ale eucariotelor sunt specializate pentru export. O astfel de ATPaza este proteina de multirezistenta la medicamente (,,multidrug resistance protein" MDR ) care este supraexprimata în celulele tumorale umane, determinând rezistenta simultana la o varietate de medicamente citotoxice larg utilizate în chemoterapie, 40% din cancerele umane având rezistenta multimedicamentoasa. ABC ATPazele din membrana reticulului endoplasmic transporta în lumen peptide provenite din degradarea citosolica a proteinelor virale sau microbiene. Aceste peptide ajung din lumenul RE pe suprafata celulara fiind recunoscute de limfocitele T citotoxice, care în acest mod suprima celulele infectate.Un alt reprezentant al acestei clase este proteina CTFR (,,cystic fibrosis transmembrane conductance regulator"), care este un transportor al ionilor de clor prin membranele celulelor producatoare de mucus, saliva, transpiratie, lacrimi sau enzime digestive.Transportul clorului prin membranele celulare are rol în reglarea transportului de apa pentru mentinerea fluiditatii secretiilor si mucusului, dar si în reglarea transportului membranar de sodiu. Deletia unui aminoacid din pozitia 508 a proteinei CTFR determina un blocaj al transportului de apa si sare (NaCl) prin membrane, cu producerea de catre celulele care captusesc caile respiratorii sau canalele secretorii ale pancreasului a unui mucus vâscos ce obstrueaza aceste cai. Mucusul cu aceste caracteristici defavorizeaza functia ciliara si favorizeaza infectii bacteriene cronice.
3.2.2.2. Sistemele de cotransport
Proteinele transportor de tip ATPazic nu sunt singurele raspunzatoare de transportul activ prin membranele celulare. Celulele au o clasa secundara de proteine care importa sau exporta ioni si molecule mici cum sunt glucoza sau aminoacizii împotriva gradientului lor de concentratie, fara consum de energie provenita din hidroliza de ATP. Proteinele care realizeaza cotransport utilizeaza energia gradientului electrochimic al Na+ sau H+ pentru a transporta simultan o alta substanta, proces denumit cotransport. Când molecula/ionul transportat si ionul cotransportat trec prin membrana în aceeasi directie, procesul se numeste cotransport, iar când trec în directii opuse, procesul este antiport. Un exemplu de cotransport este importul glucozei sau aminoacizilor în celulele epiteliului intestinal sau al tubilor renali împotriva gradientului lor de concentratie prin cuplarea cu transportul în celula al ionilor de Na. Miscarea Na+ din mediul extracelular în celule este determinata de doua forte: gradientul de concentratie ( concentratia Na+ este scazuta în mediul intracelular fata de cel extracelular) si de potentialul de membrana (fata citoplasmica a membranelor celulare fiind încarcata negativ în raport cu fata exoplasmica). Pentru fiecare doi ioni de sodiu transportati în celula se produce cotransportul unei molecule de glucoza. În aceelasi timp, activitatea Na+-K+ATPazei asigura mentinerea gradientului de concentratie al Na+ si simportul continuu al Na+ - glucozei/AA în celulele epiteliale. Transportul transcelular al glucozei si aminoacizilor din lumenul intestinal sau tubii renali în sânge este conditionat de polaritatea celulelor epiteliale: membrana apicala contine proteina simport Na+- glucoza/aminoacizi, iar membrana latero-bazala detine pompe de tip Na+-K+ATPaza si proteine (permeaze) care mediaza difuzia facilitata a glucozei si aminoacizilor în circulatie. Celulele miocardice au o proteina membranara denumita sistem antiport Na+-Ca2+ care are un rol mai important în mentinerea unei concentratii intracelulare scazute de Ca2+ în aceste celule, importul a trei ioni de sodiu fiind însotit de exportul unui ion de calciu împotriva gardientului sau de concentratie (concentratia extracelulara de Ca2+ este de 10000 de ori mai mare decât cea intracelulara). Cresterea concentratiei intracelulare de calciu determina contractia, iar activitatea antiportului Na+-K+ care scade concentratia intracelulara de calciu reduce forta contractiilor inimii. Gradientul de Na+ necesar functionarii acestui antiport este furnizat prin activitatea Na+-K+ATPazei. Ouabaina si digoxina cresc contractiile musculaturii cardiace în insuficienta cardiaca congestiva, prin inhibarea Na+-K+ATPazei ceea ce determina cresterea concentratiei intracelulare de Na si reducerea activitatii sistemului antiport Na+-Ca2+, cu cresterea concentratiei intracelulare de ioni de calciu, consecinta fiind cresterea fortei de contractie a miocardului. Proteina antiport ClŻ/HCO3Ż denumita proteina AE1 este proteina integrala de membrana predominanta în eritrocitele mamiferelor. Schimbul unui anion de clor contra unui anion bicarbonat nu implica modificari ale încarcaturii electrice a membranei, antiportul fiind dependent doar de gradientii de concentratie ai celor doi anioni pe cele doua fete ale membranei. CO2 eliberat din celule ajunge în sângele capilar, difuzeaza prin membrana eritrocitului si este transformat în bicarbonat solubil în apa (anionul HCO3-), reactie catalizata de anhidraza carbonica:
![]()
Eliberarea O2 din oxihemoglobina induce o schimbare conformationala în polipeptidul globina, care permite unei histidine sa lege protonul produs în reactia catalizata de anhidraza carbonica cu formare de hemoglobinat acid. HCO3Ż format este transportat din eritrocit prin acivitatea antiportului ClŻ/HCO3Ż, la schimb cu ClŻ, care patrunde în eritrocit. La nivelul capilarelor pulmonare, procesul este invers. CO2 difuzeaza din eritrocite, scaderea concentratiei citosolice a CO2 determina activarea anhidrazei carbonice care catalizeaza reactia de la dreapta la stânga, în sensul formarii CO2 si OHŻ. Prin legarea oxigenului la hemoglobina, este eliberat protonul, care formeaza cu OHŻ molecula de apa. Scaderea concentratiei intracelulare a HCO3Ż datorita activitatii anhidrazei carbonice determina patrunderea HCO3Ż în celula, la schimb cu ClŻ. Daca schimbul anionic prin proteina AE1 nu ar avea loc, HCO3Ż s-ar acumula în eritrocite si ar genera mult CO2, modificând pH-ul citosolic eritrocitar, care devine alcalin. Aproximativ 80% din CO2 din sânge este transportat prin mecanismul de generare al bicarbonatului în eritrocite. Sistemul antiport ClŻ/HCO3Ż permite transportul unor mari volume de CO2 de la tesuturi spre plamâni, schimbul HCO3Ż cu ClŻ mentine pH-ul citosolic neutru.
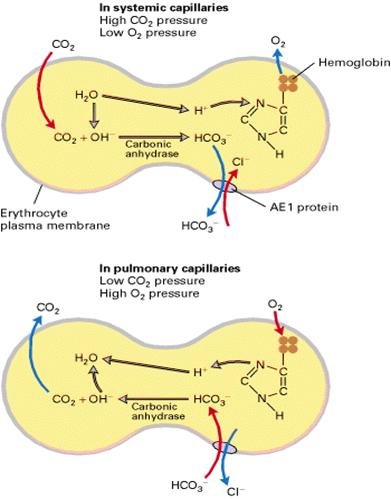
Transportul CO2 de la tesuturi la plamâni mediat de antiportul ClŻ/HCO3Ż (sursa: Lodish ,,Mollecular Cell Biology")
În reglarea pH-ului celular , un rol esential au proteinele cotransportor Na+HCO3−/Cl− si antiportul Na+/H+. Metabolismul anaerob al glucozei produce acid lactic, iar metabolismul anaerob aerob produce mari cantitati de CO2, care este hidratat de anhidraza carbonica la acid carbonic. Acest acid slab disociaza, crescând concentratia intracelulara de protoni, pH-ul celular devine acid, afectând metabolismul celulelor. Proteina antiport Na+HCO3−/Cl− importa un ion de sodiu în sensul gradientului sau de concentratie, împreuna cu ionul bicarbonat si exporta la schimb un ion de clor împotriva gradientului de concentratie. HCO3− importat se combina cu protonii, generând CO2, care difuzeaza din celule. Antiportul Na+/H+ importa un ion de sodiu în sensul gradientului de concentratie si exporta la schimb un proton. Aceste sisteme de export de protoni sunt activate de scaderea pH-ului intracelular. Cresterea pH-ului celular stimuleaza antiportul Cl−/HCO3−, care determina intensificarea exportului de HCO3− si normalizarea pH-ului citosolic la valori de 7,4. Mentinerea pH-ului fiziologic creeaza conditiile desfasurarii normale a proceselor de sinteza a ADN, a ARN, de biosinteza a proteinelor (cresterea si diviziunea celulara) si o activitatea enzimelor implicate în desfasurarea altor cai metabolice celulare.
3.2.3.Transportul macromoleculelor si particulelor prin membrana celulara
Transportul proteinelor, polinucleotidelor, polizaharidelor si particulelor prin membrana celulara se desfasoara prin mecanisme de transport mediate de vezicule. Transportul mediat de vezicule cuprinde: 1.Exocitoza prin care molecule sintetizate în celula sunt secretate în spatiul extracelular 2.Endocitoza prin care are loc transportul în celula al unor molecule sau particule din fluidul interstitial 3.Fagocitoza care reprezinta ingerarea de catre celule specializate a unor particule de ordinul micrometrilor: bacterii, debriuri celulare 4.Transcitoza este procesul prin care moleculele sau particulele patrunse în celula prin endocitoza, strabat spatiul celular fiind exportate din nou printr-o alta regiune membranara decât cea prin care au patruns.
Caracterele comune ale acestor tipuri de transport mediat de vezicule sunt: sechestrarea moleculelor sau particulelor în vezicule, transportul strict directionat, procesele de fuziune ale veziculelor cu membrane.
1.Exocitoza este procesul pe care se bazeaza secretia celulara a componentilor structurali membranari si extracelulari si a unor proteine solubile cum sunt moleculele-semnal (hormonii, neurotransmitatorii), enzimele. Proteinele de export sunt sintetizate în ribozomii atasati reticulului enpoplasmic rugos, sunt procesate si sortate în aparatul Golgi, de unde se desprind veziculele care contin proteinele de secretie si care traverseaza spatiul celular, fuzioneaza cu membrana celulara si deverseaza continutul în spatiul extracelular. Componentele lipidice si proteice ale membranelor veziculelor sunt încorporate în membrana celulara si apoi recuperate prin endocitoza si reutilizate la nivelul aparatului Golgi, de unde se desprind noi vezicule. Exocitoza este de doua tipuri: Ca2+ dependenta non-constitutiva si Ca2+ independenta constitutiva. Exocitoza la nivelul sinapselor chimice neuronale este un exemplu de exocitoza Ca2+ dependenta si are ca finalitate semnalizarea interneuronala. Exocitoza constitutiva este caracteristica tuturor celulelor si are ca finalitate eliberarea componentilor matricii extracelulare si a proteinelor de structurale de membrana care vor fi încorporate în membrana plasmatica dupa fuziunea veziculelor cu aceasta. Transportul intracelular al veziculelor de exocitoza implica activitatea proteinelor motor asociate citoscheletului actinic si tubulinic. Urmeaza captarea veziculelor de catre membrana-tinta cu care va avea loc fuziunea care implica legaturi care limiteaza mobilitatea veziculelor dar nu sunt foarte rigide si au o lungime >25 nm. Ancorarea veziculelor la membrana plasmatica se realizeaza prin interactiunea stabila a celor doua membrane, la distanta de 5-10nm, care implica rearanjari moleculare si aparitia unor structuri încolacite extinse. O alta etapa este conditionarea care însa este caracteristica doar exocitozelor Ca2+ dependente neconstitutive, este etapa care include modificarile moleculare ale proteinelor ATP-dependente si ale lipidelor, astfel încât infuzia de ioni de calciu sa declanseze secretia, de exemplu a neurotransmitatorilor. Fuziunea membranei plasmatice cu membrana veziculelor este mediata de proteinele SNARE, fiind finalizata fie prin eliberarea continutului veziculei (enzime, hormoni, neurotransmitatori, toxine) în spatiul extracelular, fie de încorporarea unor componente ale membranei veziculare (proteine, lipide) în membrana tinta (de exemplu membrana celulara). Ultimul proces e important pentru mentinerea compozitiei/dimensiunilor membranei celulare, sau dimpotriva, pentru schimbarea rapida a acestora ca raspuns la semnale exterioare. Mai mult, în acest fel se asigura cresterea suprafetei membranei în timpul cresterii. Proteinele SNARE (,,Soluble NSF Attachment Protein Receptors") mediaza fuziunea veziculelor cu membrana plasmatica sau cu membranele lizosomale. Proteinele v-SNARE , sunt localizate în membranele veziculelor, iar t-SNARE, sunt localizate în membranele-tinta. Cele mai bine studiate sunt cele implicate în fuziunea veziculelor sinaptice cu membrana presinaptica, fiind tinta neurotoxinelor bacteriene care produc tetania si botulismul. Domeniul citoplasmic al acestor proteine, motivul SNARE alcatuit din 60-70 de aminoacizi este capabil de asamblare reversibila în complexe strânse alcatuite din teancuri de câte 4 α-helixuri, denumite complexe trans- SNARE. Moleculele proteice implicate în formarea complexelor de fuziune sunt: sintaxina1 (1 α-helix) si SNAP-25 (2 α-helixuri) în membrana celulara si sinaptobrevina (1 α-helix) din membrana veziculara. Complexul trans-SNARE este format din proteine SNARE ancorate în membrane ,,trans" aflate în opozitie înainte de fuziune. Dupa unirea membranelor, proteinele SNARE formeaza un complex ,,cis" fiind localizate în membrana unica, rezultata în urma fuziunii. Influxul de calciu completeaza fuziunea, prin interactiunea senzorului pentru calciu denumit sinaptotagmin cu lipidele membranare si complexul trans-SNARE. Energia eliberata în cursul asamblarii complexului SNARE este utilizata pentru a contracara fortele de respingere dintre membrane.
2.Endocitoza este un proces de importanta vitala pentru celule, intervenind în preluarea nutrientilor din mediul extracelular, în adeziunea si migrarea celulara, semnalizarea celulara prin receptori, neurotransmisia, prezentarea antigenelor, polaritatea celulara, diviziunea, cresterea si diferentierea celulara si importul unor medicamente în celule. În functie de mecanism, se cunosc mi multe tipuri de endocitoza: a.endocitoza mediata de receptor, un mecanism de transport specific, deoarece receptorul membranar recunoaste si leaga macromolecule care intra în celula sub forma de complex receptor-ligand. Implica existenta unor regiuni specializate ale membranei celulare, care au aspectul unor depresiuni si pe a caror fata citoplasmica se afla o retea proteica. Componentul major al acestei retele proteice este clatrina, alcatuita din sase lanturi polipeptidice care formeaza o structura caracteristica de stea cu 3 brate (,,triskelion"). Prin asamblarea moleculelor de clatrina se formeaza o retea polihedrala care dau veziculelor de endocitoza aspectul de vezicule ,,îmbracate". Dupa formarea veziculelor, reteaua polihedrala se destrama, clatrina si celelalte proteine ale retelei sunt reciclate, ajungând din nou în membrana formând noi regiuni specializate pentru endocitoza. Depresiunile membranare ,,îmbracate" pot concentra si internaliza numeroase tipuri de molecule deoarece contin receptori responsabili pentru endocitoza mediata a acestor liganzi, cum sunt: LDLcolesterolul, transferina, factori de crestere, anticorpi, etc. Endocitoza mediata de receptor are loc si prin vezicule de endocitoza fara învelis de clatrina. Regiunile specializate ale membranei fara clatrina detin o proteina denumita caveolina care leaga colesterolul si au un bistrat lipidic bogat în colesterol si glicolipide. Sunt abundente în celulele musculaturii netede, pneumocite, fibroblaste, adipocite si celule endoteliale, au forma tipica de grota, de unde si denumirea lor. b. Pinocitoza sau endocitoza de faza fluida este un proces constitutiv, comun tuturor celulelor, prin care patrund în celule molecule în solutie, procesul fiind direct proportional cu concentratia moleculelor în fluidul extracelular. Veziculele de pinocitoza fuzioneaza cu alte vezicule: endosomi si lizosomi. Calea endocitozei consta din compartimente distincte care internalizeaza molecule si le recicleaza spre membrana plasmatica (endosomii timpurii si endosomii de reciclare) sau le sorteaza spre a fi degradate ( endosomii târzii si lizozomii). Endosomii timpurii sunt localizati la periferia celulei si receptioneaza veziculele internalizate din membrana celulara. Au structura tubulo-veziculara si pH acid, datorita pompelor de H+ din structura membranelor lor. Sunt organite de sortare în care receptorii disociaza de liganzi în mediu acid, receptorii fiind reciclati în membrana celulara via tubulii endosomali sau de sortare spre calea transcitozei si spre endosomii târzii. Endosomii târzii preiau particule sau molecule de la endosomii timpurii ai caii endocitozei, de la reteaua trans-Golgi în calea biosintetica sau de la fagosomi în calea fagococitozei, reprezentând ultima etapa în procesul de sortare înainte de a ceda continutul lizosomilor. Lizosomii sunt ultimul compartiment al caii de endocitoza, ffind principalul compartiment hidrolitic al celulei cu un pH acid (4,8) si continut ridicat de enzime hidrolitice.
3. Fagocitoza este un proces de aparare fata de substante straine, microorganisme, celule îmbatrînite sau tumorale, resturi celulare, etc. caracteristic unor celule specializate: monocitele care se diferentiaza în tesuturi în macrofage si neutrofilele. Procesul de fagocitoza este influentat de compozitia chimica si proprietatile suprafetei particulei ingerate si se desfasoara în urmatoarele etape:
a. legarea particulei de fagocit prin receptorii membranari ai fagocitului care recunosc si leaga specific liganzii de pe suprafata particulei-tinta. De exemplu, fagocitarea bacteriilor este precedata de opsonizarea lor (acoperirea cu anticorpi si/sau componente ale complementului). Regiunea FC a anticorpului este expusa spre exterior fiind recunoscuta si legata de receptorii FC din membrana fagocitului. Formarea complexului receptor- ligand FC declanseaza semnalul intracelular pentru internalizarea bacteriei. b. internalizarea bacteriei prin emiterea pseudopodelor care închid particula într-o vezicula care se numeste fagozom. Acesta fuzioneaza cu vezicule din compartimentul lizosomal formând fagolizosomul unde se desfasoara actiunea enzimelor hidrolitice si a enzimelor care catalizeaza reactii din care rezulta substante toxice: peroxid de hidrogen, anion superoxid, care suprima bacteriile.
4.Transcitoza se caracterizeaza prin internalizarea veziculelor de endocitoza, dupa care urmeaza sortarea la nivel endozomal, care presupune existenta unei secvente-semnal de recunoastere, complexul receptor-ligand fiind sustras actiunii enzimelor lizosomale si transportat prin vezicule spre membrana celulara, unde are loc externalizarea moleculei în spatiul extracelular.
3.3. Functia de adeziune celulara
Adeziunea celulara creeaza cai de comunicare, permite celulelor sa schimbe semnale prin care este coordonat comportamentul lor si este reglata expresia genica. Adeziunea celula- celula sau adeziunea la matricea extracelulara controleaza structura interna a fiecarei celule deoarece desfacerea si refacerea adeziunii si modelarea matricii guverneaza modul în care celulele sunt orientate în timpul cresterii, dezvoltarii si proceselor reparatorii. Jonctiunile celulare, mecanismul adeziunii celulare si matricea extracelulara sunt esentiale pentru organizarea, dinamica si functia structurilor multicelulare. Semnalele sunt transmise în structurile multicelulare prin 2 strategii: ◘ prin matricea extracelulara ◘ prin citoscheletul celular si adeziunea celula-celula care leaga citoscheletul celulelor adiacente. În tesuturi contactul dintre celule se realizeaza prin structuri specializate care poarta denumirea de jonctiuni intercelulare. Un rol important îl are matricea extracelulara, ancorarea celulelor în matrice are loc prin jonctiuni celula-matrice care sunt regiuni specializate ale membranei celulare. În tesutul epitelial matricea este subtire, alcatuieste lamina sau membrana bazala, rezistenta tesutului epitelial fiind conferita de elementele citoscheletului care interactioneaza cu membrana plasmatica la nivelul jonctiunilor specializate cu suprafata altor celule sau cu matricea extracelulara. În tesutul conjunctiv celulele sunt dispersate în matricea extracelulara, elementele matricei asigurând în acest caz stabilitatea tesutului. Aparatul de jonctiune este alcatuit din urmatoarele tipuri : 1. Jonctiunile de ancorare, realizeaza adeziunea celula- celula si celule- matrice extracelulara; 2. Jonctiunile de ocluzie, sudeaza membranele plasmatice ale celulelor epiteliale conferindu-le proprietati de bariera impermeabila sau selectiv permeabila; 3.Jonctiunile de comunicare formeaza canale, creeaza pasaje care unesc citoplasma celulelor adiacente, realizând cuplarea metabolica a celulelor care îndeplinesc aceeasi functie; 4.Jonctiuni de retransmitere a semnalelor de la celula la celula prin membranele plasmatice, la situsurile de contact celula- celula ( sinapsele interneuronale sau sinapsele imunologice în care limfocitele T interactioneaza cu celulele prezentatoare de antigen si alte exemple ilustreaza faptul ca membranele celulare trebuie sa fie în contact pentru a avea loc interactiunea ligandului cu receptorul)
3.3.1. Jonctiunile de ancorare realizeaza adeziunea celula- celula si celula-matrice extracelulara. Sunt alcatuite din proteine de atasare intracelulara care leaga elemente ale citoscheletului de structurile jonctionale si din glicoproteine transmembranare de legare care interactioneaza prin domeniul lor citoplasmic cu proteinele de atasare si prin domeniul extracelular cu glicoproteinele transmembranare ale celulelor adiacente. Jonctiunile de ancorare se clasifica în jonctiuni de adeziune si structuri dezmosomale.
3.3.1.1. Jonctiunile de adeziune intercelulara sunt structuri la nivelul carora sunt ancorate filamente de actina dispuse în manunchiuri. O jonctiune de aderenta este definita ca o jonctiune celulara a carei fata citoplasmica este atasata citoscheletului de actina. Aceste jonctiuni formeaza o banda de adeziune continua (,,zonulae adherens"), caracteristice celulelor epiteliale. Astfel de structuri jonctionale se gasesc si în celule non-epiteliale, dar ele nu formeaza benzi de adeziune continua, de exemplu în cardiomiocite. Filamentele de actina interactioneaza cu structurile jonctionale prin intermediul unor proteine de atasare: vinculina si α-actinina. Regiunea ,,cap" a vinculinei se leaga de E-caderina prin intermediul α-, β - si γ -cateninelor. Regiunea ,,coada" a vinculinei leaga lipidele membranare si filamentele de actina. Domeniul extracelular al caderinelor interactioneaza cu domeniile extracelulare ale glicoproteinelor omoloage din membranele celulelor învecinate. Jonctiunile de aderenta sunt compuse din urmatoarele proteine : Caderinele, proteine transmembranare care formeaza homodimeri în maniera Ca-dependenta cu moleculele de caderina ale celulelor adiacente. Proteinele p120 denumite delta-catenine leaga regiunea juxtamembranara a caderinei. β-catenina sau γ-catenina (plakoglobina) leaga caderina la nivelul regiunii ce contine situsul specific de legare al cateninei. α- catenina leaga caderina indirect, prin β-catenina sau plakoglobina.
E-caderina (epiteliala) este cea mai bine studiata, este alcatuita din 5 domenii repetitive (EC1 ~ EC5) în domeniul extracelular, un domeniu transmembranar si domeniul intracelular care leaga p120 catenina si beta-catenina. Domeniul intracelular contine o regiune înalt fosforilata care leaga beta-catenina, care la rândul sau leaga alfa-catenina cu rol în reglarea citoscheletului de actina . E-caderina este exprimata si fosforilata în celule în cursul diferentierii. În tesuturile adulte, E-caderina este exprimata în tesuturile epiteliale, cu un timp de înjumatatire de 5ore. Pierderea functiei E-caderinei sau lipsa exprimarii acestei glicoproteine membranare este implicata în dezvoltarea tumorii canceroase si în metastazare, deoarece în asemenea conditii descreste rigiditatea si stabilitatea tisulara si creste motilitatea celulelor, ceea ce permite celulelor tumorale sa penetreze membrana bazala si sa invadeze tesuturile din jur. Jonctiunile intercelulare prin legarea homofilica a caderinelor au un rol esential în segregarea tisulara. Aparitia si disparitia caderinelor specifice este corelata cu etapele dezvoltarii embrionare când celulele se grupeaza si îsi modifica contactele pentru a forma noi structuri tisulare. În timpul formarii tubului neural din ectoderm, celulele pierd E-caderina si sintetizeaza N-caderina, în timp ce celelalte celule din ectoderm continua sa sintetizeze E-caderina. Când celulele crestei neurale migreaza din tubul neural, caderinele mentionate sunt greu detectabile, în schimb sunt exprimate în aceste celule caderine-7 care mentin sub forma de grupari celulele migrate prin adeziune intercelulara. În final, când aceste celule agrega pentru a forma un ganglion nervos, ele exprima N-caderinele. Daca într-o cultura de celule exista celule care exprima diferite tipuri moleculare de caderine, ele vor fi sortate si vor agrega separat în functie de tipul de caderina exprimata, caderinele legându-se preferential de propriul lor tip molecular. Asamblarea celulelor în epitelii poate fi reversibila. Exprimarea E-caderinelor determina adeziunea celulelor neatasate, dispersate denumite celule mezenchimale, care pot astfel forma un epiteliu. Invers, celulele epiteliale se pot detasa, se disperseaza si îsi pot schimba caracterele migrând din epiteliul parental. Aceasta tranzitie epiteliu-mezenchim are un rol important în dezvoltarea embrionara normala, dar are un rol important în procese patologice la adult, în cancer, multe tipuri de tumori maligne având originea în epitelii.
3.3.1.2.Jonctiunile de adeziune celula- matrice extracelulara conecteaza filamentele de actina cu elementele componente ale matricei extracelulare. Adeziunea celula-matrice se realizeaza prin regiuni specializate ale membranei plasmatice, prin structuri jonctionale denumite contacte focale sau placi de adeziune. La nivelul acestor structuri se stabilesc interactiuni între manunchiurile de filamente de actina si elemente ale matricei, prin intermediul unei glicoproteine membranare ce apartine familiei integrinelor. Interactiunea filamentelor de actina cu integrina este mediata de 4 proteine diferite: o proteina de legare a capului filamentelor de actina, vinculina, α-actinina, talina.
3.3.1.3. Dezmosomii sunt structuri de adeziune celulara la nivelul carora se realizeaza contactul între filamentele intermediare ale celulelor adiacente. În celulele epiteliale structurilor dezmosomale le sunt asociate filamente de cheratina, în miocite filamente de desmina care sunt o cale de transmitere a fortei de contractie, în celulele mezenchimale filamente de vimentina. Electronomicroscopic dezmosomii apar formati din doua discuri dense de 15-20 nm grosime situate pe fata citoplasmica a membranelor a doua celule adiacente, alcatuite din molecule proteice denumite desmoplachine care interactioneaza cu filamentele intermediare, dar si cu glicoproteine transmembranara denumit desmogleina si desmocolina. Domeniile extracelulare ale desmogleinelor si desmocolinelor interactioneaza homofilic printr-un mecanism Ca-dependent, conectând desmosomii celulelor adiacente. Desmogleina si desmocolina sunt membre ale familiei de molecule de adeziune celulara denumita caderine. Domeniul extracelular a desmosomului se numeste Domeniu central extracelular (ECD) sau Desmoglea în care desmogleina interactioneaza cu desmocolina. Pe fata citoplasmica se afla Placa densa externa (ODP) si Placa densa interna (IDP), strabatute de moleculele de desmoplachina. La nivelul ODP, domeniul citoplasmic al celor 2 caderine desmosomale interactioneaza cu desmoplachina prin intermediul plakoglobinei si plakofilinei. La nivelul IDP, desmoplachina interactioneaza cu filamentele intermediare ale celulei.
3.3.1.4. Hemidesmozomii sunt structuri de ancorare a filamentelor de cheratina din celulele epiteliale de membrana plasmatica si de lamina bazala a epiteliului prin intermediul unor glicoproteine transmembranare. HD contin 2 placi asemanatoare unor nituri (placa interna si placa externa), împreuna cu fibrile de ancorare si filamente de ancorare care alcatuiesc împreuna complexul HD de adeziune stabila sau complexul filamentos HD de ancorare. Acest complex formeaza o structura continua de legatura între filamentele intermediare de keratina si membrana bazala împreuna cu componente ale dermei si este alcatuit din peste 10 molecule componente. Hemidesmosomul este alcatuit din keratina citosolica legata noncovalent de o placa citosolica de plectina care interactioneaza cu molecule de adeziune transmembranare- integrinele α6β4. Integrinele interactioneaza apoi cu una dintre numeroasele proteine multiadezive cum este laminina, din matricea extracelulara, în acest fel formându-se una dintre multele adeziuni dintre celule si matrice.
3.3.2. Jonctiunile de ocluzie sau ,,zonulae occludens" , mai sunt denumite jonctiuni strânse sau impermeabile (,,tight junctions") sunt prezente la nivelul polului apical al celulelor epiteliale ce delimiteaza lumenul unor cavitati. Sunt evidentiate în M.E. ca puncte de contact sau de sudura ale membranelor celulelor adiacente. Sunt formate dintr-o retea ramificata de catene strânse, fiecare catena fiind independenta. Eficienta acestor jonctiuni în a preveni difuzia ionilor creste exponential cu numarul de catene componente. Fiecare catena este formata dintr-un sir de proteine transmembranare, care interactioneaza direct la nivelul domeniilor extracelulare. Speciile proteice majore sunt claudina si ocludina, asociate cu proteine membranare periferice localizate pe fata citoplasmica a membaranei plasmatice, care ancoreaza aceste catene proteice de citoscheletul de actina, unind în acest fel citoscheletul de actina al celulelor adiacente. Functiile jonctiunilor de ocluzie sunt: mentinerea adeziunii intercelulare, mentinerea polaritatii celulelor prin prevenirea difuziei laterale a proteinelor integrale de membrana între zona apicala si cea bazala sau zonele laterale, permitând mentinerea functiilor specifice ale fiecarei suprafete celulare: de exemplu endocitoza mediata de receptor pe suprafata apicala si exocitoza pe suprafata bazolaterala (transportul transcelular) sau antiportul Na/ glucoza la nivelul celulelor epiteliului intestinal. O alta functie este de prevenire a trecerii moleculelor sau ionilor prin spatiile intercelulare. Ionii sau moleculele trebuie sa patrunda doar în celule prin difuzie sau transport activ. Aceasta functie exercita control asupra transportului selectiv al particulelor, fiind nepermisiv pentru unele, ca în cazul barierei hemato-encefalice, însa mecanismul de control nu este cunoscut, poate sa se datoreze unor brese aparute prin mici discontinuitati structurale sau prin pori multipli. În functie de permisivitatea fata de moleculele de apa si solutii, epiteliile care contin astfel de jonctiuni se clasifica în epitelii impermeabile sau permeabile.
3.3.3. Jonctiunile de comunicare se numesc si jonctiuni permeabile (,,gap jonctions"). Conecteaza direct citoplasma a doua celule si permit trecerea ionilor si moleculelor între celule. O astfel de jonctiune este formata din 2 conexoni sau hemicanale care strabat spatiul intercelular. Conexonii sunt formati din homo sau heterodimeri de conexina-proteina constitutiva. La nivelul jonctiunilor de comunicare, spatiul intercelular este de 4 nm si unitatile conexonilor apartinând celor 2 celule adiacente sunt aliniate. Jonctiunile formate din doua hemicanale identice sunt denumite homotipice, iar cele formate din hemicanale diferite sunt heterotipice. Hemicanalele formate din conexine identice sunt homodimerice, cele formate din cenexine diferite sunt heterodimerice. Compozitia chimica influenteaza functiile acestor canale, care sunt: ▫ de comunicare electrica între celule, diferitele subunitati de conexina pot împartasi diferite conductante electrice ▫ de comunicare chimica între celule, prin transportul meleculelor mici, cum sunt mesagerii secundari (IP3, Ca2+), diferitele subunitati de conexina pot rezenta selectivitate diferita pentru anumite molecule mici. Desi diferitele conexine determina dimensiuni diferite ale porilor, cu selectivitate electrica diferita, toate aceste canale permit în general trecerea moleculelor mai mici sau egale cu 1000 Da. Nu este permisa trecerea macromoleculelor: proteine, acizi nucleici. ▫ asigura controlul transportului moleculelor prin spatiul intercelular, confera caracter ordonat, înlatura posibilitatea ,,scurgerii" de molecule în acest apatiu. Functiile mentionate asigura cuplarea electrica si metabolica a celulelor prin schimburi electrice si chimice prin hemicanale si are implicatii în homeostazie. Potentialul de actiune este raspândit în miocard de la celula la celula determinând contractia ritmica a cordului. La nivelul anumitor sinapse din creier, jonctiunile de comunicare permit transmiterea potentialului de actiune, într-un interval mai scurt de timp decât cel necesar neurotransmitatorilor. Defecte ale conexinelor ce compun jonctiunile la nivelul tesutului nervos duc la degenerari ale substantei albe în maniera caracteristica unor afectiuni cum este boala Pelizaeus-Merzbacher si scleroza multipla. Neuronii din retina sunt cuplati prin jonctiuni permeabile care apar între aceleasi tipuri de celule dar si între celule diferite. În timpul travaliului, jonctiunile permeabile dintre celulele musculaturii netede a uterului permit contractii coordonate, puternice necesare expulziei fetale. ▫ functia de transport este dublata de o functie de adeziune a celulelor adiacente în timpul dezvoltarii embrionare, cu implicatii în diferentiere, ex.: migrarea neuronala în neocortex. Defectele genetice ale proteinelor structurale ale jonctiunilor permeabile sunt implicate în boli ale pielii, deoarece acest tip de jonctiuni sunt puternic implicate în procesele de diferentiere si proliferare ale acestor tesuturi. ▫ sunt supresori ai oncogenelor, s-a constatat exprimarea scazuta sau lipsa totala a acestor proteine în celule tumorale cu pierderea controlului proliferarii. Defecte ale conexinelor sunt implicate în cancerul mamar, renal, esofagian, etc. Conexinele sunt exprimate în toate tipurile tisulare cu exceptia unor celule mobile cum sunt hematiile si spermatozoizii
3.3.4. O alta categorie este adeziunea mediata de selectine ,,selected lectins", proteine de adeziune celulara care leaga carbohidrati. În timpul raspunsului inflamator, stimuli ca histamina si trombina determina mobilizarea P-selectinelor din interiorul celulelor, pe suprafata lor. În plus, citokinele ca TNF-alpha stimuleaza exprimarea E-selectinelor si P-selectinelor aditionale, câteva ore mai târziu. Domeniul distal ,,lectin-like" al selectinelor leaga grupuri carbohidrat prezente în molecula glicoproteinelor cum este glicoproteina PSGL-1 din membrana leucocitelor, care favorizeaza patrunderea acestor celule la situsul infectiei. Neutrofilele si eozinofilele se leaga de E-selectine.
|
|
1.IgSF(superfamilia imunoglobulinelor) - Ca2+independente |
N-CAM ,,Neural Cell Adhesion Molecule" sau proteina zero a mielinei · ICAM1,5 ,,Intercellular adhesion molecules" · VCAM-1 ,,Vascular cell adhesion molecules" · PE-CAM molecule de adeziune plachetare/ endoteliale· L1-CAM molecule de adeziune din neuroni, intervin în diferentierea si dezv. SN CD2 de pe suprafata LT sau NK intervin în interactiunea cu alte molecule de adeziune (LFA3/CD58) de pe suprafata Mf SIGLEC ,,sialic acid binding Ig-like lectins" de pe suprafata Mf., LB Familia CTX ex.: JAM ,,junctional adhesion molecule B" în jonctiunile impermeabile ale cel. endoteliale ESAM ,,endothelial cell selective adhesion molecules" |
|
2. Integrinele sunt receptori care mediaza adeziunea dintre o celula si alte celule sau matricea extracelulara apartinând tesuturilor din jurul ei. Au rol important în semnalizarea celulara si definesc forma celulelor, mobilitatea, regleaza ciclul celular -Ca2+independente |
Integrina β-2( CD18) este subunitatea β a 3 structuri: 1.LFA-1 ,,Lymphocyte function-associated antigen"-molecule de adeziune ale LT , LB , Mf, neutrofilelor la cel. prezentatoare de Ag, are loc recrutarea lor la situsul infectiei. 2.Integrina alphaXbeta2- receptor de complement. 3.Antigenul 1 al macrofagelor- receptor de pe suprafata Mf care recunosc componenta C3b a complementului legata de suprafata cel. straine, declanseaza fagocitarea acestor cel. VLA1-6 molecule de adeziune celula-celula si de integrare a EMC cu citoscheletul Glicoproteina IIb/IIIa sunt receptori pentru fibrinogen ai plachetelor, intervin în activarea plachetara |
|
|
|
3. Caderinele sunt o clasa majora de proteine de membrana cu rol proeminent în adeziunea celulara, reglarea organizarii tisulare si morfogeneza. Mediaza adeziunea monotipica celula-celula dar si adeziunea heterotipica între diferite tipuri de caderine este posibila. Actioneaza atât ca receptor cât si ca ligand. Sunt responsabile pentru adeziunea selectiva celula-celula care este necesara pentru a repartiza diferitele tipuri celulare în pozitia corecta în timpul dezvoltarii. Caderinele tind sa se concentreze pe suprafata celulara la nivelul jonctiunilor celula-celula, fiind structural asociate filamentelor de actina. Domeniul citoplasmic este asociat cu proteine citoplasmice denumite catenine. Deletia domeniului citoplasmic distruge aceste interactiuni si functia caderinelor.Functia caderinelor ca receptori membranari este de a receptiona semnale externe si de a le traduce în semnale interne prin activarea GTPazelor si caii beta-catenin/Wnt rezultând o reorganizare dinamica a citoscheletului si schimbari fenotipice. - Ca2+dependente |
Desmogleina (DSG1, DSG2, DSG3, DSG4) au rol în formarea desmosomilor Desmocolina (DSC1, DSC2, DSC3) · T-caderina · Protocaderina · CDH1 E-caderina (epiteliala) CDH2 N-caderina (neurala) CDH3 P-caderina (din placenta) CDH4 R-caderina (din retina) CDH5 VE-caderina (vasculara endoteliala) CDH6 K-caderina (renala) CDH8 CDH9(T1) CDH10(T2) CDH11 OB-Caderina (osteoblastica) CDH12 CDH13 T-caderin - H-caderinA (inima) CDH15 - M-caderina (miotubuli) CDH16 - KSP-caderina CDH17 - LI caderina (ficat-intestin) CDH18 - caderina 18, tip 2 CDH19 - caderina 19, tip 2 CDH20 - caderina 20, tip 2 CDH23 - caderina 23, (epitelii neurosenzoriale |
|
4.Selectinele sunt o familie de molecule de adeziune heterofile care leaga carbohidrati fucozilati, de exemplu mucine. Cel mai bine reprezentat ligand pentru cele trei selectine este P-selectin glicoprotein ligand-1 (PSGL-1), care este o glicoproteina tip mucina exprimata în toate celulele albe ale sângelui. - Ca2+dependente |
E-selectina (endoteliala) L-selectina (leucocitara) P-selectina (plachetara) |
|