CATALIZA SI CHIMIE VERDE
CATALIZA HETEROGENA
Daca in cataliza omogena reactia catalitica are loc la nivel molecular intre speciile dispersate in mediul de reactie, in cataliza heterogena reactia se produce intre reactantii adsorbiti si activati pe suprafata catalizatorului. Complexitatea proceselor catalitice consta in 535h73f faptul ca ele presupun o succesiune de etape intermediare, fiecare dintre acestea putand fi etapa determinanta de viteza.
Intr-un proces atalitic heterogen reactantii
trebuie sa difuzeze din faza fluida spre suprafata externa a granulei
catalitice, iar de aici spre suprafata interna majoritara, prin
Etapele elementare ale unui proces catalitic heterogen pot fi vizualizate de maniera urmatoare:
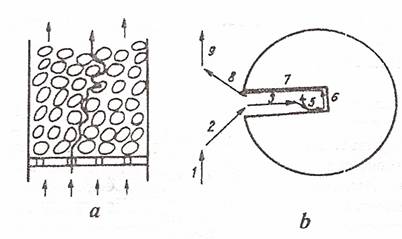
a. parcurgerea stratului catalitic granular de
catre fluxul de reactant gazos; b. etapele procesului catalitic la nivelul unei
granule de catalizator poros: 1 - transportul fortat al moleculelor reactante
in stratul poros, prin curgerea fazei fluide, la traversarea reactorului; 2 -
difuzia externa a reactantului, din curentul principal de fluid, spre suprafata
externa a granulei, prin filmul stationar de fluid (strat Nernst) ce inconjoara
granula de catalizator; 3 - difuzia interna (in pori), constand in patrunderea
moleculelor reactante, de la suprafata externa a granulei, in porii acesteia; 4
- adsorbtia reactantilor pe centri activi ai suprafetei externe si interne a
solidului; 5 - reactia superficiala (transformarea chimica) intre componentii
activati prin adsorbtie; 6 - desorbtia produsilor de reactie; 7 - difuzia
interna (din pori) a produsilor de reactie spre suprafata externa a granulei; 8
- difuzia externa a produsilor prin filmul de fluid de la suprafata externa a
granulei catalitice, in curentul principal de fluid; 9 - evacuarea produsilor
de reactie din strat prin transport fortat.
In cadrul evolutie moleculelor reactante pe parcursul unei reactii catalitice, etapele principale numerate pot fi insotite sau nu, de urmatoarele fenomene secundare:
Transformarile chimice
secundare ale moleculelor reactante sau ale produsilor, fie in faza gazoasa
omogena in cursul inaintarii lor in strat sau
Transportul de calcuda din strat spre exterior (reactii exoterme) sau interior (reactii endoterme) de catre gazul efluent
Transportul de caldura de la regiunea interfaciala la faza fluida (sau invers) pentru reactii exoterme (sau endoterme)
Transportul cantitatii de miscare de la moleculele de fluid la granulele de solid ale stratului. Datorita curgerii fluidului la traversarea stratului catalitic
La nivelul unei singure granule poroase se pot explica clar etapele 2 - 8:
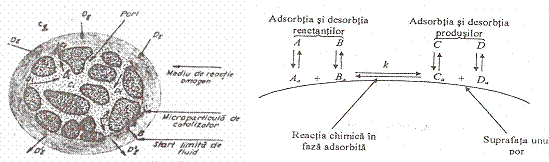
Unde: DI - difuzia interna a reactantilor; DI'
- difuzia externa a reactantilor; DE - difuzia externa a
reactantilor; DE' - difuzia externa a produsilor; cE -
concentratia reactantilor in faza omogena; cS - concentratia
reactantilor la nivelul suprafetei externe; cI - concentratia
reactantilor in
A si B - reactanti; Aa si Bb - reactanti adsorbiti; Ca si Dd - produsi adsorbiti; C si D - produsi de reactie.
Zeoliti si industria chimicalelor
 |
|||
 |
|||
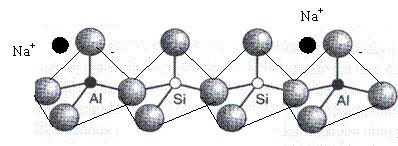
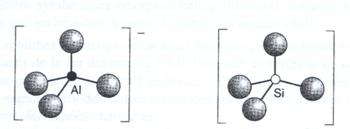
Datorita numarului de coordinare 4 si valentei 3 a aluminiului, tetraedrele [AlO4]- sunt purtatoare de sarcina negativa, neutralizata de un cation metalic (cation compensator de sarcina), in general un cation alcalin M1, introdus in timpul sintezei (deoarece ionii aluminat sunt stabili doar la valori ridicate de pH, sinteza zeolitilor se face intotdeauna din solutii bazice). De aici, formula generala a zeolitilor: M1, AlO2, nSiO2, xH2O sau M+[AlO2,nSiO2]-,xH2O. Partea dintre paranteze reprezinta structura alumosilicatului iar numarul "x" - moleculele de apa care variaza functie de porozitatea structurii si de continutul de aluminiu. In cazul zeolitilor, valoarea n (sau raportul Si/Al) nu poate fi mai mica de 1: o regula empirica data de Lowenstein spune ca toate tetraedrele de aluminiu [AlO4]- sunt separate unele de altele de cel putin un tetraedru de siliciu [SiO4] (deoarece speciile AlO4- devin instabile).
Moleculele de apa prezente in structura dupa sinteza pot fi eliminate printr-o simpla incalzire, eliberand in acest mod un volum foarte important de micropori, volum care poate fi utilizat in operatii importante precum uscare, purificare, separare sau transformare catalitica a diverselor molecule. Volumul de micropori al zeolitilor rezulta din existenta unei retele de canale mono-, bi- sau tridimensionale in structura. In cazul sistemelor poroase bi- si tridimensionale, canalele sunt interconectate intre ele.
Formula generala si ideala arata ca dupa sinteza, un cation monovalent, in general alcalin, neutralizeaza teoretic fiecare tetraedru de aluminiu. Astfel de cationi de compensare sunt in interactie electrostatica cu structura zeolitica si nu sunt fixati puternic in porozitatea structurala. O operatie relativ simpla de schimb ionic permite inlocuirea acestora cu alti cationi. Astfel, cationul alcalin poate fi inlocuit cu un proton (H+) pe diverse cai: fie direct prin schimb cu o solutie apoasa acida daca stabilitatea structurii zeolitice permite acest schimb (zeolitii bogati in aluminiu nu sunt stabili in contact cu o solutie acida), fie intr-o maniera indirecta prin schimb cu o solutie apoasa a unei sari de amoniu, urmata de descompunere termica (intre 400 si 6000C) a ionului de amoniu la proton si amoniac. Protonul format constituie aciditatea Bronsted a solidului. Ca urmare, teoretic, fiecarui tetraedru de aluminiu (adica fiecarui atom de aluminiu din structura retelara) ii corespunde un centru acid Bronsted. Asadar, cantitatea maxima de centri acizi Bronsted recuperabila este data de continutul de aluminiu din structura.
Interesul pentru zeoliti in cataliza acida se datoreaza faptului ca acestia poseda centri acizi- majoritatea situati in interiorul micropororilot- conferindu-le acestora proprietati particulare. Centri acizi pot fi de tip Bronsted si de tip Lewis. Multe aplicatii catalitice pe scara larga a zeolitilor alumosilicat se bazeaza pe aciditatea lor Bronsted, furnizata prin unul din urmatoarele procese:
(ZO-)zMz+ + zH+ zZ(OH) + Mz+
Unde: ZO- - retea zeolitica anionica; M - cation compensator de sarcina
ZO-NH4+ Z(OH) + NH3
c. La
temperaturi ridicate ionii de aluminiu pot fi usor dislocati din reteaua
zeolitica trecand in
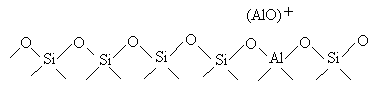
Astfel, centrii acizi Lewis pot fi asociati cationilor de aluminiu formati prin dislocarea aluminiului din retea. Atomii de aluminiu extraretelar poate fi prezent intr-o varietate mare de specii chimice, functie de conditiile de dealuminizare utilizate: a. specii de aluminiu cationic, partial hidrolizat (Al3+, Al(OH)2+, Al(OH)2+) total dislocate din retea, actionand ca centrii puternici Lewis; b. specii de aluminiu monomerice, coordinate cu mai putin de patru oxigeni retelari; c. oxihidroxizi de aluminiu oligomeric; d. oxihidroxizi sau oxizi de aluminiu polimeric; e. faza amorfa SiO2-Al2O3
ZO-N+ Z(OH) + produsi de oxidare
(ZO-)3[M(H2O)n]3+ Z(OH) + (ZO-)2[M(OH)(H2O)n-1]2+
Exemplu: [Ca(H2O)]2+ [Ca(OH)]+ + H+
Astfel, moleculele de apa coordinate la cationii polivalenti sunt disociate prin tratament la cald conducand la urmatoarea structura locala:
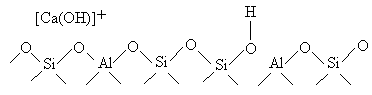
Zeolitii cu raport Si/Al mare contin un numar mai mare de astfel de centri. Intrucat distantele mai mari dintre centrii [AlO4-] favorizeaza hidroliza cationilor. Dupa hidroliza, in zeolit se formeaza doua grupe OH distincte, una atasata cationului, cealalta retelei zeolitice.
f. Reducerea cationilor metalici tranzitionali la o stare de valenta inferiora:
(ZO-)xMx+ + x/2 H2 x Z(OH) + M
Exemple: Cu2+ + H2 Cu0 + 2H+
Ag+ + 1/2H2 Ag0 + H+
Toate reactiile conduc la generarea gruparilor OH in punte (reprezentate prin Z(OH)) care reprezinta aciditatea Bronsted (reprezentand activitatea catalitica a zeolitilor alumosilicati protonici). Datorita provenientei diferite a gruparilor OH, taria acida a acestora este diferita.
Pentru producerea eficienta a benzinei este necesara cracarea fractiilor grele de petrol; la ora actuala in lume exista peste 350 unitati de cracare fiecare dintre acestea procesand peste 150.000 tone de materie prima pe zi. Cracarea catalitica este probabil unul dintre cele mai importante procese catalitice din punct de vedere economic. Cantitatea de benzina (fractia C5 - C10, punct de fierbere 70 - 220oC) din titei variaza considerabil functie de originea titeiului. Initial, acest proces s-a realizat la temperatura ridicata (cracare termica) dupa care a fost inlocuit cu cracarea catalitica, in prezenta clorurii de aluminiu dar, desi eficienta energetica si de materiale a fost inbunatatita, procesul producea cantitati mari de deseuri cu aluminiu, atata timp cat catalizatorul nu putea fi recuperat eficient. A urmat apoi utilizarea catalizatorilor pe baza de argile si mai apoi zeolitii. La ora actuala procesul este cunoscut ca "cracare catalitica in pat fluidizat" (FCC) datorita metodologiei aplicate. Cracarea catalitica in pat fluidizat este aplicata fractiilor grele de petrol (C20 - C40, 350 - 550oC) si fractiei de reziduuri de vacuum (>C40, >550oC).
Reactiile care au loc intr-un proces de cracare sunt destul de complexe si variate:
formarea de alcani si alchene mici prin cracarea alcanilor cu numar mare de atomi de carbon
C14H30 C7H16 + C7H14
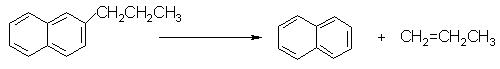
dealchilarea aromatelor policiclice ramificate la aromate simple
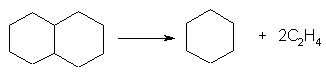
cracarea naftenelor policiclice in naftene monociclice si alchene
reactii cu transfer de hidrogen in care alchenele sunt transformate in alcani in prezenta naftenelor care, la randul lor sunt transformate in aromate
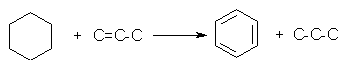
reactii de izomerizare ale alchenelor lineare la alchene ramificate
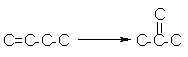
reactii de deshidratare si ciclizare la centri puternic acizi care duc la formarea hidrocarburilor polinucleare. Aceastea fie (1) se adsorb puternic pe centri acizi ducand la pierderea activitatii catalitice, fie (2) formeaza cocs in strat multiplu care otraveste catalizatorul. Acest cocs se poate forma si pe cale termica datorita conditiilor severe utilizate (a temperaturii foarte ridicate la care opereaza procesul de cracare).
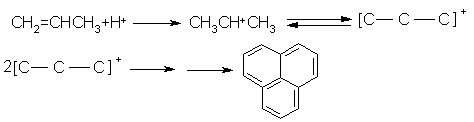
Efectul general al acestor reactii este cracarea primara a hidrocarburilor grele cu formarea hidrocarburilor mici, in domeniul benzinelor urmata de cracarea secundara care produce produsi cu masa moleculara foarte mica (in domeniul gazelor). Pe catalizator se depoziteaza circa 0.8 - 1% cocs.
Marele avantaj al FCC fata de cracarea termica este dat de faptul ca ruperea legaturilor prin intermediari carbocationici (carbocationii tertiari fiind cei mai stabili) este mult mai selectiva decat cea intalnita in procesul termic prin radicali liberi. De asemenea, din fericire, hidrocarburile cu mai putin de 7 atomi de carbon nu sunt cracate in timpul FCC, ceea ce limiteaza volumul de fractie usoara formata si determina cresterea randamentului in benzina (tipic, in jur de 50% din materia prima).
![]()
In FCC cel mai frecvent se
utilizeaza zeolitul Y (faujasita sintetica); acest zeolit poseda
![]()
![]()
Ca in multe procese care decurg in prezenta zeolitilor, nici in acest caz zeolitul nu se utilizeaza ca atare datoita faptului ca acesta se dezactveaza rapid prin cocsare si este otravit de vanadiul si nichelul prezent in materia prima. Zeolitul este suportat intr-o matrice precum alumina, care prezinta si ea o activitate oarecare in procesul de cracare. Matricea va pre-craca molecule prea largi pentru a putea difuza in porii zeolitului si va retine parte din metalele reziduale.
Zeolitul Y se obtine initial in forma sodiu. Indepartarea completa a sodiului prin schimb ionic se poate realiza in conditii destul de dure obtinandu-se un produs destul de scump si cu o stabilitate redusa. In conditii normale doar 85% din ionii de sodiu sunt inlocuiti cu protoni, adesea prin schimb cu ioni amoniu urmat de tratament termic. Inbunatatirea activitatii cataitice se poate face daca ionii reziduali de sodiu sunt inlocuiti cu ioni de metale rare precum La3+. De asemenea, florurarea partiala conduce la cresterea aciditatii si activitatii.
Cataliza heterogena in industria de chimicale fine si industria farmaceutica
In contrast cu industria petrochimica si cea a chimicalelor uzuale, catalizatorii heterogeni sunt utilizati destul de rar in fabricarea chimicalelor fine si a farmaceuticelor. Acest lucru se datoreaza in mare parte cercetarii poate prea accentuate din perioada 1950 - 1980 pentru dezvoltarea zeolitilor pentru procesele de mare tonaj. Acesti catalizatori au o deschidere a porilor prea mica si o aciditate prea mare pentru cele mai multe molecule utilizate in aceste sectoare ale industriei chimice. Odata cu cresterea interesului asupra produsilor secundari (deseuri) generati de aceste industrii, precum si odata cu cresterea costului de tratare si eliminare a deseurilor, a inceput si interesul pentru dezvoltarea unor catalizatori capabili sa mareasca eficienta procesului si sa reduca impactul proceselor asupra mediului.
Cataliza heterogena bazica
Reactiile catalizate de baze nu sunt utilizate prea frecvent in producerea de chimicale de baza dar sunt extrem de frecvente in sintezele de chimicale fine deoarece gruparile functionale care contin N- sau O- sunt stabile in mediu bazic. Pentru astfel de procese este diponibila o gama larga de catalizatori solide bazice de la metale simple, oxizi metalici si hidroxizi impregnati pe suporturi precum g-alumina, silicea si zeoliti schimbati cu ioni (Cs+) pana la catalizatori cu functiunea bazica grefata pe o grupare inerta.
Unul dintre putinele procese industriale care utilizeaza catalizator heterogen bazic - si anume producerea etiliden-norbornenei va fi discutat in cursurile ulterioare. Acum se va specifica doar ca acest proces reprezinta o ilustrare excelenta a importantei heterogeneizarii: inlocuirea amalgamului Na/K in amoniac lichid, extrem de periculos, cu hidroxid de Na / K impregnat pe alumina - relativ nepericulos. O sinteza extrem de neuzuala dezvoltata de Merck (pentru moment nu este total comercializata) implica reactia iminei (formate din acetona cu metil-amina) cu dioxidul de sulf pe ZSM-5 dopat cu Cs:
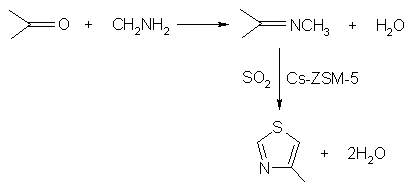
Produsul, obtinut cu un randament de 70% la 4700C, este 4-metiltiazolul, un intermediar cheie pentru fabricarea fungicidului - tiabenzazol. Chiar daca randamentul este mai degraba modest, temperatura ridicata si materiile prime nu tocmai ideale fac ca acest proces sa nu fie unul tocmai "verde" -este oricum mult mai nepoluant pentru mediul inconjurator decat cel utilizat la ora actuala. Acesta implica o secventa de 5 reactii care utilizeaza clor, disulfura de carbon si amoniac ca materii prime si produce cantitati stoichiometrice de acid clorhidric, bisulfura de sodiu si clorura de amoniu ca deseuri.
Multe transformari bazice precum esterificarile, aditiile Michael si reactia Knoevenagel au loc in conditii bazice, unele dintre acestea utilizand baze apoase, altele necesitand baze omogene organice puternice precum guanidinele. De obicei baza nu este recuperata, producand fie saruri fie deseuri organice. In cazul bazelor organice scumpe, dificltatea de recuperare impiedica adesea comercializarea procesului. Ca atare s-au dezvoltat diverse metode de heterogeneizare a bazelor organice pe suporturi precum silicea sau polistirenul. In acelasi timp dezvoltarea silicelor mezoporoase a deschis multe oportunitati pentru prepararea catalizatorilor bazici (si acizi) heterogeni. Pentru o activitate catalitica acceptabila este important sa se maximizeze cantitatea de centri bazici pe catalizator in acelasi timp cu mentinerea unei structuri deschise pentru accesul reactivilor voluminosi.
Silicea amorfa, cu deschiderea porilor de 1 -10 nm
este un suport comun pentru catalizatorii bazici, in timp ce
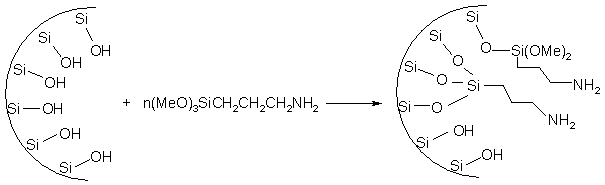
Numarul de legaturi formate intre molecula grefata si suport (1, 2 sau 3) va varia functie de natura suportului si a gruparii grefate. De obicei se obtin catalizatori cu grupari functionale grefate in canttate de circa 1 mmol / g. Alternativ, in metoda sol-gel silanul cu gruparea functionala poate fi incorporat direct in procesul de polimerizare in cantitati mari.
Astfel de sisteme catalitice s-au dovedit a fi eficiente pentru reactia Knoevenagel desi numarul de cicluri (TON) si otravirea catalizatorului fac ca acestia sa nu poata fi aplicati comercial. In general, materialele HMS substituite s-au dovedit a fi mult mai active decat catalizatorii pe baza de silice amorfa pentr aceasta reactie, dar procesul este foarte complex, unele substraturi prezentand o reactivitate mult mai mare pe silice amorfa. Un exemplu de reactie Knoevenagel este cel de reactie ntre benzaldehida si etilcianoacetat:
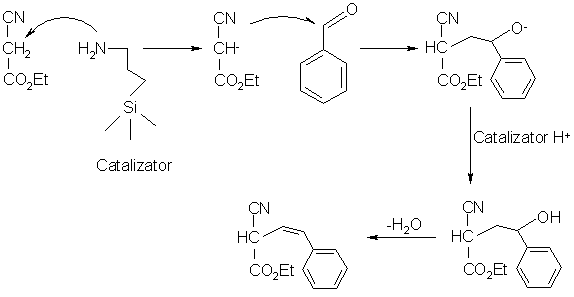
Reactia Knoevengel are multe similaritati cu aditia Michael, in care este necesara o baza pentru a forma carbanionul dintr-un precursor metilenic activat, care mai apoi realizeaza o aditie nucleofilica la o alchena care contine o grupare precum cea esterica capabila sa stabilizeze anionul rezultat prin delocalizare. Aceste reactii sunt frecvent utlizate pentru producerea de compusi farmaceutici, intermediari in industria parfumeriei sau agrochimici. Un exemplu elocvent este cel de utilizarea a aditiei Michael in sinteza ierbicidului pe baza de metilpiridina:
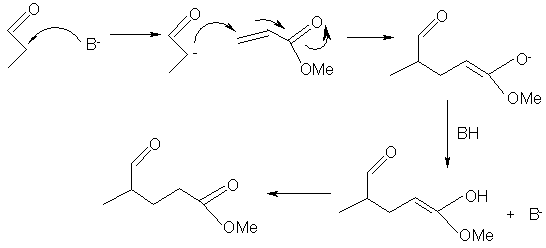
Un alt suport important folosit pentru obtinerea catalizatorilor solizi bazici este polistirenul care, chiar daca nu poseda o structura poroasa bine definita, acesta gonfleaza in solventi asigurand o suprafata specifica accesibila mare pe care poate avea loc reactia. O metoda uzuala de legare chimica a gruparilor functionale la polistiren implica incorporarea unei cantitati specifice de stiren cu grupari functionale in procesul de polimerizare. Acestea pot apoi reactiona pentru a forma o varietate larga de catalizatori (atat acizi cat si bazici).
|