ALTE DOCUMENTE
|
|||||||||
Echilibrul chimic
1. Se aplica principiul lui Le Chatelier pentru a examina influenta concentratiei unei substante participante la reactie asupra echilibrului chimic.
2. Se calculeaza constanta de echilibru a reactiei reversibile dintre clorura de fier si sulfocianura de potasiu care decurge în solutie.
Într-o reactie chimica reversibila la un moment dat, în conditii determinate de temperatura si presiune se stabil 16216r177q este starea de echilibru dinamic, caracterizata printr-o compozitie invariabila în timp.
Starea de echilibru se stabileste când vitezele cu care se desfasoara cele doua reactii opuse si simultane sunt egale.
Pentru reactia chimica reversibila de forma:
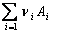
![]()
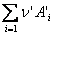 (3.37)
(3.37)
Viteza reactiei directe este:
![]() (3.38)
(3.38)
Viteza reactiei inverse este:
![]()
![]() (3.39)
(3.39)
la echilibru v1
= v2, deci ![]() (3.40)
(3.40)
rezulta:  (3.41)
(3.41)
unde: k1 si k2 reprezinta constanta de viteza pentru reactia molara a reactantului (Ai) si produsului de reactie (A'i); Kc, constanta de echilibru a reactiei exprimata în unitati de concentratii molare.
Pentru reactiile chimice care decurg în solutii lichide exista urmatoarele relatii de legatura între valorile constantei de echilibru exprimate prin activitati termodinamice, K, prin numar de moli Kn, prin fractii molare Kx si prin concentratii molare Kc:
K = Kx
= Kn∙n-Dn = ![]() (3.42)
(3.42)
S-a notat cu n, numarul total de moli la echilibru, V, volumul total al solutiei, Dn S n'i - ni
Relatia (4) defineste legea actiunii maselor (Guldenbeg si Waage), care stabileste interdependenta dintre concentratiile la echilibru ale substantelor participante la reactie, la temperatura si la presiune data (pentru sistemele chimice care contin substante gazoase).
Constanta de echilibru depinde de temperatura, presiune si de concentratia la echilibru a reactantilor si produsilor de reactie.
Conform principiului lui Le Chatelier, principiul deplasarii echilibrului chimic, daca se modifica unul din factorii care influenteaza echilibrul chimic, sistemul se deplaseaza spre o noua pozitie de echilibru, în sensul care se opune modificarii produse.
Aceasta înseamna ca la cresterea concentratiei unui reactant, prin adaugarea lui în sistemul chimic, echilibrul se deplaseaza, în sensul consumarii lui, deci a reactiei directe.
Scaderea concentratiei unui produs de reactie, prin îndepartarea lui din sistem deplaseaza echilibrul în sensul formarii lui, deci al reactiei directe.
În aceasta lucrare se studiaza influenta concentratiei asupra echilibrului chimic efectuând urmatoarea reactie, care decurge în solutie:
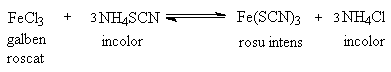
Pahar Berzelius, eprubete, cilindru gradat, pipete, termometru.
Solutii de clorura ferica, FeCl3, sulfocianura de amoniu, NH4SCN, clorura de amoniu, NH4Cl solid.
Într-un pahar Berzelius se introduc 39 ml apa distilata masurati cu un cilindru gradat, la care se adauga câte 0,5 ml solutie de FeCl3 si NH4SCN masurate cu o pipeta gradata.
Se noteaza temperatura T a solutiei.
Solutia obtinuta se toarna în volume egale (10 ml) în patru eprubete.
Eprubeta 1 se pastreaza ca etalon de comparatie.
În eprubeta 2 se introduc 4-5 picaturi solutie de FeCl3. Se agita continutul eprubetei si se noteaza observatia referitoare la modificarea intensitatii culorii în comparatie cu eprubeta etalon.
În eprubeta 3 introduc câte 4-5 picaturi solutie NH4SCN si un vârf de spatula NH4Cl. Se procedeaza la fel ca în primul caz, notându-se variatia de culoare observata.
În eprubeta 4 se introduc câteva picaturi de solutie de NH4Cl si se procedeaza la fel.
Se completeaza tabelul urmator:
|
Nr. eprubeta |
Culoare initiala |
Se adauga în exces |
Culoare finala |
Sensul de deplasare al echilibrului chimic |
||
|
(FeCl3)aq |
NH4SCN(aq) |
NH4Cl(s) |
||||
|
| ||||||
Ţinând seama de modificarile de culoare se discuta deplasarea echilibrului chimic pentru cele 3 cazuri studiate, pe baza principiului lui Le Chatelier.
Se calculeaza compozitia
de echilibru, pe baza bilantului material, cunoscând: concentratiile
initiale ale reactantilor ![]() si stiind ca la echilibru în cei 40 ml
solutie (rezultata prin amestecarea reactantilor cu apa) se
formeaza 0,0005 mol Fe(SCN)3.
si stiind ca la echilibru în cei 40 ml
solutie (rezultata prin amestecarea reactantilor cu apa) se
formeaza 0,0005 mol Fe(SCN)3.
Se completeaza schema de bilant material.
|
Concentratie |
FeCl3 |
NH4SCN |
FeSCN |
NH4Cl |
|
Moli initiali, no | ||||
|
Moli la echilibru, nech | ||||
|
Concentratii molare la echilibru, cech |
Se calculeaza constanta de echilibru Kc cu relatia 3.41.
Se calculeaza entalpia libera de reactie DG cu relatia:
DG = - R T ln K. (3.43)
|