Electrosinteza apei oxigenate
prin reducera catodica a oxigenului
1. Introducere
În conditiile în care normele ecologice sunt tot mai drastice se pune si problema înlocuirii agentilor de înalbire pe baza de compusi ai clorului cu altii mai putin sau deloc poluanti. Apa oxigenata este, din acest punct de vedere, deosebit de atractiva însa prepararea ei pune înca unele probleme tehnologice.
Generarea "in-situ" a H2O2 prin reducerea catodica a oxigenului reprezinta una din metodele electrochimice folosite în depoluare. Aplicatiile industriale permit, de a 535w2222f semenea, utilizarea apei oxigenate produsa "in-situ" ca reactiv în reactiile din chimia organica, în procese de electrosinteza indirecta.
Cea dintâi metoda de obtinere a apei oxigenate a fost hidroliza peroxiziilor, a peracizilor sau a persulfatilor:
![]() (1)
(1)
![]() . (2)
. (2)
Peroxidul de bariu se obtine industrial prin reactia de oxidare a bariului, la cca. 700 0C si pO2 = 0,2 atm:
![]() (3)
(3)
Peracizii si persulfatii se obtin prin oxidarea anodica a acidului sulfuric, respectiv a sulfatilor.
În ultima perioada H2O2 se obtine în urma unui proces de autooxidare a unor compusi organici cum ar fi de exemplu 2-etil, 5, 10-dihidroxiantracen. Produsul antrachinonic (în acest caz: 2-etil antrachinona) ce rezulta în paralel cu apa oxigenata poate fi reciclat fie prin reducere catalitica pe Ni-Raney, fie prin reducere electrochimica.
Electrosinteza directa a apei oxigenate se realizeaza prin reducerea catodica a oxigenului:
O2 + 2H2O + 2e- ![]()
![]() HO2- + OH- =
-0,065 V. (4)
HO2- + OH- =
-0,065 V. (4)
Sinteza H2O2 prin electroreducerea partiala a O2 în solutii alcaline ofera posibilitatea unei scaderi semnificative a consumului de energie comparativ cu metodele de hidroliza a percombinatiilor si o simplificare a tehnologiei fata de alternativa autooxidarii unor compusi organici.
Problemele dificile care apar constau în instabilitatea peroxidului produs fata de electroreducerea ulterioara la ioni hidroxil:
HO2- + H2O + 2e- ![]() 3OH- =
0,867 V, (5)
3OH- =
0,867 V, (5)
respectiv, descompunerea lenta a peroxidului:
2 H2O2 2 H2O + O2 (6)
Acest din urma proces este catalizat de o varietate mare de materiale (ex. praf, Pt, Fe, Cu, unii carbuni, unele specii ionice precum Fe2+), din aceste motive dezvoltarea unui proces comercial reprezinta o provocare tehnologica semnificativa.
Pentru a evita reactia (5), polarizarea catodica trebuie limitata la valori reduse, conditii în care viteza reactiei (4) scade semnificativ. Din aceasta cauza este necesar sa se foloseasca electrozi cu suprafete active mari si cu proprietati electrocatalitice pentru reducerea moleculei de oxigen doar cu 2e-. În acest context, atentia cercetatorilor s-a îndreptat, pe de o parte, spre electrozii volumici, care asigura o suprafata activa foarte mare raportata la unitatea de volum de electrod (m2/m3) si, implicit, la unitatea de volum de reactor,iar pe de alta parte, spre gasirea de electrocatalizori adecvati. Din gama electrozilor volumici pot fi citati carbonul vitros reticulat, electrozii porosi sau în pat fix pe baza de carbune activ iar dintre materialele cu proprietati electrocatalitice pentru electrosinteza H2O2 se remarca oxizii de Pd, RuO2 pur sau dopat cu alti oxizi, oxizi micsti de tipul Cu1+xMn2-xO4.
Reactia anodica cea mai des folosita este reprezentata de descarcarea oxigenului, ea oferind mai multe avantaje, printre care mentionam posibilitatea alimentarii la catod a oxigenului produs (asigurând jumatate din necesarul stoechiometric de O2) si cea a utilizarii unor anozi relativ ieftini în conditiile unui anolit alcalin.
2. Scopul lucrarii
Scopul lucrarii este studierea electrosintezei apei oxigenate prin reducerea catodica a oxigenului si stabilirea influentei unor parametri experimentali (densitatea de curent, debitul de aer, concentratia electrolitului, etc.) asupra procesului.
3. Principiul lucrarii
Lucrarea consta în realizarea electrosintezei în regim galvanostatic. Influenta diferitilor factori este pusa în evidenta prin efectuarea de teste în care acesti parametri sunt modificati (pe rând) si se evalueaza efectul modificarilor.
4. Aparatura si materialele necesare
celula de electrosinteza compartimentata cu o membrana schimbatoare de ioni;
catod de carbon vitros reticulat;
anod de grafit;
electrod de referinta;
ampermetru si voltmetru digital;
sursa de curent constant;
pompa de aer;
barbotor de aer din sticla;
debitmetru de aer;
reactivi: NaOH (1, 2 si 4 M), H2SO4 97 % si KMnO4. 10-3 N
5. Mod de lucru
Se umplu compartimentele celulei de electrosinteza cu câte 100 mL solutie de NaOH 1 M, dupa care se introduc electrozii si barbotorul de aer în celula. Se realizeaza montajul prezentat în Figura 1 si se conecteaza aparatura la reteaua de alimentare de 220V.
|
|
Figura 1. Montajul experimental pentru electrosinteza apei oxigenate: catod din carbune vitros reticulat; anod din grafit; electrod de referinta de calomel saturat (ESC); reactor electrochimic comparti-mentat din plexiglass; membrana schimbatoare de ioni (Nafion®); sursa de curent constant; voltmetru digital; milivoltmetru digital; pompa de aer; ventil de reglare a debitului de aer; debitmetru pentru aer; barbotor din sticla; miliampermetru digital; solutie de electrolit (NaOH) |
Milivoltmetrul 8 se fixeaza pe scala de 2000 mV (DC), voltmetrul 7 pe scala de 20 V (DC) iar ampermetrul 13 pe scala de 200 mA (DC). Se efectueaza electrosinteza la parametrii indicati de coordonatorul de lucrari (curentul între 50 si 200 mA si debit de aer între 25 si 60 l/h). La sfârsitul electrolizei se face analiza cantitativa a H2O2 prin dozare cu KMnO4 în mediu de H2SO4. Practic, se iau 2 probe de 25 mL de solutie din compartimentul catodic, se introduc în doua pahare Erlenmeyer, se adauga circa 5 - 6 mL H2SO4 concentrat (98 %, d = 1,83 g/l) pâna la pH acid, apoi se titreaza cu solutie de KMnO4 0,1 N pâna la remanenta culorii violet.
Operatiile se repeta si cu celelalte solutii de electrolit, variind, eventual, si ceilalti parametri experimentali. Durata unui test va fi cuprins între 30 si 60 minute, crescând pentru curentii de valori reduse. Pe durata experimentului se verifica constanta curentului prin circuit si se citeste din 5 în 5 minute potentialul catodic, ec, si tensiunea la bornele celulei de electrosinteza, EB.
Numarul de teste si al parametrilor studiati va fi ales în functie de durata sedintei de laborator.
6. Prelucrarea datelor
Se reprezinta grafic ec = f(t), EB = f(t) si ec = f(log i). Se analizeaza evolutia parametrilor electrosintezei în timp si interdependentele dintre acestia.
Pentru a determina randamentul faradaic, rF,
si consumul specific de energie, WS, se tine cont de
cantitatea experimentala de H2O2, ![]() , sintetizata în cadrul
fiecarui experiment:
, sintetizata în cadrul
fiecarui experiment:
![]() (g) (7)
(g) (7)
unde ![]() reprezinta concentratia normala
a solutiei de KMnO4,
reprezinta concentratia normala
a solutiei de KMnO4, ![]() este volumul solutiei
de KMnO4 utilizata pentru titrare (ml); Vsample este volumul probei
prelevate din compartimentul catodic (ml), VNaOH
reprezinta volumul solutiei de NaOH introdus în compartimentul
catodic (ml), iar
este volumul solutiei
de KMnO4 utilizata pentru titrare (ml); Vsample este volumul probei
prelevate din compartimentul catodic (ml), VNaOH
reprezinta volumul solutiei de NaOH introdus în compartimentul
catodic (ml), iar ![]() corespunde
echivalentului H2O2 (E.g. = 17
g).
corespunde
echivalentului H2O2 (E.g. = 17
g).
Cantitatea
teoretica de H2O2, ![]() , se calculeaza pe baza legii lui Faraday:
, se calculeaza pe baza legii lui Faraday:
![]() (g) (8)
(g) (8)
unde I reprezinta intensitatea curentului (A), t este timpul de electroliza (s) iar F reprezinta constanta lui Faraday (96500 C/E.g.).
Randamentul faradaic al procesului de electroliza se calculeaza ca raportul dintre cantitatea experimentala de H2O2 si cea teoretica:
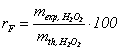 (%) (9)
(%) (9)
Consumul specific de energie, WS rezulta din relatia:
![]() (kWh/kg
H2O2)
(kWh/kg
H2O2)
unde EB reprezinta tensiunea la bornele reactorului electrochimic (V).
Pe baza analizei cantitative a H2O2, formate în timpul electrosintezei, se evalueaza influenta factorului studiat asupra randamentului de curent si a consumului specific de energie, kWh/kg H2O2.
Bibliografie
1. L. Oniciu, P. Ilea si I.C. Popescu, " Electrochimie tehnologica", Casa cartii de ötiinta, Cluj- Napoca, 1995, p. 172.
2. J. A. Mc Intyre, The Electrochemical Society Interface, 1995, p. 29-33.
3. M. R. Tarasevich, A. Sadkovski, E. Yeager, "Comprehensive Treatise of Electrochemistry", Plenum Press, New York, vol. 7, 1983, p. 162.
4. K. Kinoshita, " Elrctrochemical Oxygen Technology", Wiley-Interscience, John Wiley& Sons, Inc. , New York, 1991.
5. J. P. Hoare, " The Electrochemistry of Oxigen", John Wiley& Sons, Inc. , New York, 1968.
|