Orice covalenta se caracterizeaza prin:
tarie (energie de legatura); - lungime (raza covalenta); unghi de valenta (determinat de orientarea în spatiu a orbitalilor atomici puri sau hibrizi); - multiplicitate (ordin de legatura) ; - polaritate.
Energia de legatura (kj/mol) este energia degajata la formarea covalentei între doi atomi, egala si de semn contrar cu energia necesara ruperii unei legaturi si raportata la un mol de substanta. Cunoasterea energiilor de legatura dintre atomii unei molecule permite sa se faca aprecieri cantitative asupra stab 626c24g ilitatii partilor mai reactive ale acesteia. Energiile de legatura se pot determina experimental prin metode termochimice si spectroscopice. În moleculele diatomice, valorile energiilor de legatura sunt aceleasi cu ale energiei de desfacere a moleculei în atomii constituenti. În moleculele poliatomice, energia de legatura reprezinta valoarea medie
-pag.5-
a energiilor de rupere a tuturor legaturilor din molecula, însumând valorile pentru diferitele legaturi: ex. în BF3, energia de legatura trebuie sa fie 1/3 din desfacerea moleculei în atomi:
![]()
![]() BF3(g) B(g) + 3F(g) DHd=3ElegB-F sau BF3(g) BF2(g)+F(g) DH1
BF3(g) B(g) + 3F(g) DHd=3ElegB-F sau BF3(g) BF2(g)+F(g) DH1
![]() BF2(g) BF(g)+F(g) DH2
BF2(g) BF(g)+F(g) DH2
![]() BF(g) B + F(g) DH3
BF(g) B + F(g) DH3
DH = DH1+DH2+DH3
Deoarece energiile de rupere succesive sunt diferite, în mod curent se folosesc energiile medii de legatura cu care se calculeaza caldura de formare a combinatiei respective.
Energia legaturii covalente se poate calcula cu relatia empirica propusa de L. Pauling, folosind coeficientii de electronegativitate (X) ai elementelor implicate. Pentru o molecula AB avem:
![]()
unde: EA-A si EB-B sunt energiile legaturilor în conditii standard (kj/mol);
XA si XB - coeficientii de electronegativitate.
Forma spatiala a unei molecule se poate preciza daca se cunosc dimensiunile moleculei si distantele dintre atomi.
Lungimea covalentei nu este perfect definita deoarece norul electronic nu are o delimitare exacta.
În molecula diatomica A-A, cu distanta interatomica dA-A, raza covalenta este dA-A/2. În molecula heteronucleara A-B, raza covalenta rA-B se poate calcula cu aproximatie pe baza regulei aditivitatii:
dA-B =(dA-B +dB-B)/2
Factorii urmatori influenteaza distantele interatomice si introduc abateri fata de valorile calculate cu relatia de mai sus:
polaritatea legaturii covalente;
diferenta de electronegativitate a atomilor;
multiplicitatea legaturii;
prezenta electronilor neparticipanti.
Legatura covalenta se realizeaza prin punerea în comun a electronilor necuplati din stratul de valenta al atomilor implicati, care dobândesc configuratie de dublet sau octet. Legatura covalenta conduce la formarea moleculelor si retelelor cristaline atomice. Numarul maxim de covalente pe care le poate forma un atom este în functie de numarul lui atomic, de configuratia electronica a stratului exterior si de raportul razelor atomilor implicati. Într-un agregat de atomi uniti prin covalente, atomii sunt mentinuti în pozitii fixe fata de care nu sunt posibile decât oscilatii ale acestora. Pozitiile fixe determina distante între atomi si unghiuri de valenta caracteristice.
Teoria electronica introduce urmatoarele tipuri de covalente:
-pag.6-
legatura covalenta nepolara, care se stabileste între atomi de aceeasi natura chimica, cu acelasi Z, cu o repartizare uniforma a perechii de electroni din legatura; ex: H:H; :Cl.. :Cl....:
![]() legatura
covalenta polara, care se stabileste între
atomi de natura chimica diferita, cu numere atomice diferite, în
care perechea de electroni de legatura este mai apropiata de
nucleul atomului mai electronegativ; apar astfel sarcini partial negative
(-d) si pozitive (+d) la cei doi atomi. Ex:
:Cl.. . + . H Cl(-d H(+d
legatura
covalenta polara, care se stabileste între
atomi de natura chimica diferita, cu numere atomice diferite, în
care perechea de electroni de legatura este mai apropiata de
nucleul atomului mai electronegativ; apar astfel sarcini partial negative
(-d) si pozitive (+d) la cei doi atomi. Ex:
:Cl.. . + . H Cl(-d H(+d
Teoria electronica introduce notiunea de electroni participanti (perechi de electroni neparticipanti la covalente) si un nou tip de covalenta: coordonativa sau dativa.
Legatura chimica ce se realizeaza prin punerea în comun de electroni între un atom care poseda o pereche de electroni neparticipanti (atom donor) si un atom deficitar în electroni (atom acceptor) se numeste covalent coordinativa sau de tip donor-acceptor care odata formata nu se mai depsebeste de covalenta propiu-zisa.
Moleculele cu legaturi covalente sunt predominant în stare gazoasa (au volatilitate mare), sunt solubile în solventi si au constante fizice (Tt, Tf) joase deoarece fortele de atractie dintre molecule sunt slabe, comparativ cu cele ionice care sunt mult mai puternice.
metoda legaturii de valenta -MLV - covalenta se formeaza prin suprapunerea orbitalilor atomici (OA) periferici, nedeformati, pe o portiune în spatiul dintre cele doua nuclee, în scopul cuplarii spinului electronilor. Electronii cuplati din OA periferici nu participa la formarea legaturilor, fiind perechi de electroni neparticipanti.
metoda orbitalilor moleculari -MOM- legatura covalenta se formeaza prin deformarea orbitalilor atomici (OA) periferici si contopirea lor în orbitali moleculari (OM).
Astfel, electronii implicati în covalenta se misca simultan în câmpul mai multor nuclee si nu este obligatorie cuplarea de spin. Orbitalii interiori ocupati complet cu electroni nu participa la legaturi, ramân fie orbitali atomici, fie ca orbitali moleculari de nelegatura (OMN).
Daca se contopesc orbitali s cu p,d,f, numai prin câte un singur lob se realizeaza legaturi simple de tip s cu o simetrie cilindrica ce determina configuratia spatiala a moleculei.
Când atomii care se leaga au un surplus de electroni sau orbitali se pot forma legaturi multiple p d, etc. a doi, patru, etc. lobi.
Moleculele biatomice în stare gazoasa ca si moleculele mono sau poliatomice, din punct de vedere al covalentei din retelele moleculare se leaga prin forte slabe (13-20kj/mol) de natura electrostatica, numite forte van der Waals. Ele sunt de trei tipuri:
interactiuni prin forte de dispersie;
interactiuni prin forte de inductie;
interactiuni prin forte de orientare.
-pag.7-
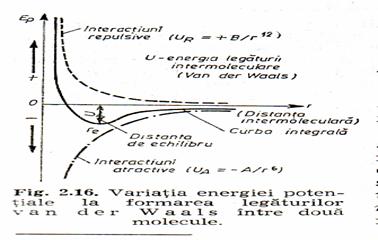
Indiferent de natura lor, interactiunile dipol-dipol sunt atractive si repulsive, iar stabilitatea retelei moleculare se datoreaza echilibrului dintre ele. Particulele se apropie pâna la o distanta intermoleculara minima (distanta de echilibru) la care taria legaturii prin forte van der Waals este maxima (si energia legaturii, U=UA+UR este minima).
Aceasta energie este rezultanta interactiunilor atractive, UA=-A/r6, a caror raza de actiune, r, este foarte mica (2-3 diametre moleculare) si scade rapid cu cresterea distantei si a interactiunilor repulsive: UR B/rn.
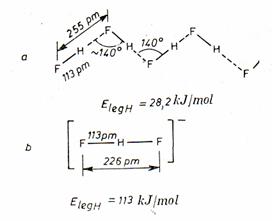
Legaturi de hidrogen - interactiune ce se realizeaza între protonii unei molecule si un atom puternic electronegativ (F, O, N, Cl etc.) dintr-o molecula vecina. Exista legaturi de hidrogen tari si lehaturi de hidrogen slabe. Legaturile tari (ex. [FHF]-, [HOHOH]-, etc.) au protonul legat tricentric la aceeasi distanta fata de atomii pe care îi leaga, distanta fiin mai mica de 0,25nm si energia legaturii de 40-80 kj/mol.
Legaturile de hidrogen slabe (ex: HF, H2O, ROH, R-COOH, etc.) au protonul asezat asimetric fata de atomii pe care îi leaga, asigurând o distanta între acestia mai mare de 0,25nm si o energie a legaturii de 17-30kj/mol.
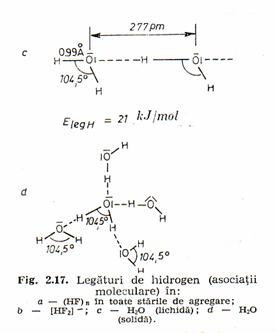
Lichidele asociate prin legaturi de hidrogen (H2O, HF) sunt solventi buni pentru alcooli, fenoli, acizi carboxilici, au o densitate scazuta ce variaza neliniar cu temperatura.
LEGĂTURA METALICĂ
Metalele - cca. 80 din cele 108 elemente descoperite - au proprietati comune ce se justifica prin structura lor electronica si caracterul deosebit al legaturii dintre atomi. Natura legaturii dintre atomii metalelor nu poate fi ionica, deoarece nu este posibila între atomi de acelasi fel, dar nu poate fi nici covalenta, localizata între câte doi atomi, deoarece într-un cristal fiecare atom de metal este înconjurat de 8 sau 12 atomi de acelasi fel. Deasemeni, nu poate fi nici legatura prin forte van der Waals, deoarece fortele de coeziune dintre atomii metalelor sunt mult mai puternice.
- Teoria gazului electronic
Legatura metalica este ca o legatura covalenta realizata prin OM extinsi, ce formeaza benzi largi de energie (de câtiva eV) ce apartin tuturor nucleelor.
Partea din banda de energie populata cu electroni, poarta numele de banda ocupata. Gradul de ocupare explica taria legaturii din reteaua metalica si implicit o serie de proprietati: - Tt, Tf, densitatea, duritatea, tenacitatea etc. Partea din banda de energie neocupata cu electroni numita banda de conductie este folosita la circulatia electronilor supusi unei diferente de potential electric sau termic si explica astfel conductibilitatea termica si electrica a metalelor.
|