TERMOECONOMIE
1.1. Notiuni teoretice
Sistemul este definit ca totalitatea de constituenti dintr-un spatiu inchis si delimitat de o frontiera aleasa arbitrar. Constituentul este determinat de urmatoarele specificatii:
a) tipul constituentului si intervalul de valori ale cantitatii acestuia;
b) tipul si intervalul de valori ale
parametrilor care caracterizeaza in mod complet fortele exterioare exercitate
asupra constuituentului de alte corpuri, altele decat insasi constituentul, cum
ar fi volumul unui vas. Fortele exterioare nu depind de coordonatele altor
corpuri, decat de cele ale constituentului considerat. Un astfel de parametru
poate fi considerat volumul, ![]() .
Volumul este un parametru intern de stare (extensiv, adica
aditiv care depinde de masa sistemului), care determina spatiul ocupat
de de corpul sau sistemul considerat,
.
Volumul este un parametru intern de stare (extensiv, adica
aditiv care depinde de masa sistemului), care determina spatiul ocupat
de de corpul sau sistemul considerat, ![]() .
In mod frecvent, in termodinamica se opereaza cu volumul specific,
.
In mod frecvent, in termodinamica se opereaza cu volumul specific, ![]() ,
care este raportul dintre volumul,
,
care este raportul dintre volumul, ![]() ,
si masa,
,
si masa, ![]() ,
a corpului si care este legat cu densitatea,
,
a corpului si care este legat cu densitatea, ![]() ,
a substantei din care este constituit corpul prin relatia:
,
a substantei din care este constituit corpul prin relatia:
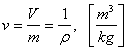 (1.1)
(1.1)
c) fortele interioare dintre particulele constituentului, cum ar fi fortele intermoleculare, depind de coordonatele tuturor particulelor care 555f57f interactioneaza.
Vom nota cantitatea de constituent cu n si valoarea volumului cu V. Pentru orice moment de timp, cantitatea de constituent si volumul au valori determinate. Vom nota aceste valori cu n si V cu sau fara subscriptii aditonale.
Frontiera sistemului este o suprafata careia i se atribuie anumite calitati.
Daca frontiera este impermeabila atat pentru schimbul de masa cu alte sisteme, cat si pentru transferul de energie sub forma de caldura si lucru mecanic, atunci sistemul se numeste izolat. Un exemplu particular de sistem izolat este sistemul adiabatic, al carui frontiera este impermeabila pentru transferul de caldura.
Daca frontiera este impermeabila pentru schimbul de masa cu alte sisteme, insa permeabila pentru transferul de energie, atunci sistemul se numeste inchis.
Daca frontiera este permeabila atat pentru schimbul de masa cu alte sisteme, cat si pentru transferul de energie sub forma de caldura si lucru mecanic, atunci sistemul se numeste deschis.
Orice altceva care nu este inclus in sistem se numeste mediu ambiant.
Valorile cantitatii de constituent si a volumului pentru orice moment de timp nu sunt suficiente pentru a caracteriza in mod deplin conditiile sistemului in acest moment. De aceea vom considera de asemenea si valorile proprietatilor in momentul dat de timp.
Proprietatea este un atribut care poate fi evaluat in orice moment de timp cu ajutorul unui set de masuratori si operatii care sunt efectuate in sistem si rezulta ca valori numerice - valoarea proprietatii. Aceasta valoare este independenta de aparatele de masura, de alte sisteme si de mediul ambiant sau de alte momente de timp. Doua proprietati sunt independente, daca valoarea uneia din ele poate fi variata fara a afecta valoarea celeilalte.
Pentru sistemul dat, valorile cantitatii de constituent, valoarea volumului si valorile setului complet de proprietati independente inglobeaza tot ce poate fi spus despre sistem la un moment dat de timp si despre rezultatele unor masurari care pot fi efectuate in acest moment de timp. Vom numi aceasta caracterizare completa a sistemului in momentul dat de timp ca starea sistemului. Fara nici o modificare, aceasta definitie a starii este aplicabila in orice ramura a fizicii.
Starea sistemului poate varia in timp
tot atat de spontan, cum constituentul reuseste sa se conformeze la fortele
exterioare si interioare sau la rezultatul interactiunilor cu alte sisteme sau
la ambele. Sistemul izolat suporta doar variatii spontane de stare. Sistemul
care nu este izolat interactioneaza cu mediul ambiant printr-un numar de
diferite cai, unele din care pot rezulta in fluxuri nete de proprietati intre
sistem si mediul ambiant. Relatia care descrie evolutia starii unui sistem
izolat - variatiile spontane ale starii - in functie de timp se numeste ecuatia
miscarii. O perioada determinata de timp a guvernat ecuatia lui Newton care
relateaza ca forta sumara a fiecarei particule din sistem depinde de masele lor
inertiale m si de acceleratiile a, astfel ca ![]() .
O alta evolutie a constituit-o ecuatia dependenta de timp a lui Schröedinger,
care este
.
O alta evolutie a constituit-o ecuatia dependenta de timp a lui Schröedinger,
care este
echivalenta ecuatiei lui Newton in mecanica cuantica. Alte relatii stabilite experimental, desigur, nu pot ingloba ambele din aceste ecuatii. Rezulta ca ecuatia miscarii pe care o avem este incompleta. Cautarea ecuatiei complete a miscarii care ar descrie toate fenomenele fizice ramane a fi un subiect de cercetare la frontiera stiintei contemporane - cea mai intriganta si mai provocatoare problema in termodinamica. Doua din cele mai generale si mai studiate distinctii ale ecuatiei miscarii sunt conturate de consecintele primelor doua principii ale termodinamicii.
Mai eficient decat prin dependenta explicita in timp la care recurge ecuatia completa a miscarii, variatia starii - procesul, poate fi descris in termeni de:
a) interactiuni care sunt active in perioada variatiei starii;
b) starile extreme ale sistemului (starea initiala si cea finala);
c) conditiile asupra valorilor proprietatiilor starilor extreme, care sunt consecinte ale legilor termodinamicii si, daca nu exprima totul, sa exprime cele mai generale si mai studiate parti distinctive ale ecuatiei complete ale miscarii .Fiecare interactiune este caracterizata cu ajutorul fluxurilor nete respective de proprietati prin frontiera sistemului.
Spre exemplu, dupa definirea proprietatilor energiei si entropiei putem observa ca unele interactiuni declanseaza fluxuri de energie prin frontiera sistemului fara a declansa si un flux de entropie, in timp ce alta interactiune declanseaza ambele fluxuri. Printre conditiile impuse valorilor proprietatilor vom observa ca variatia energiei sistemului trebuie sa fie egala cu variatia energiei dintre sistem si ambianta sa, in timp ce variatia entropiei nu poate fi mai mica, decat variatia entropiei dintre sistem si mediul ambiant.
Una din consecintele primului principiu
al termodinamicii este, ca fiecare sistem A in orice stare ![]() are o proprietate numita energie,
cu valoarea notata cu simbolul
are o proprietate numita energie,
cu valoarea notata cu simbolul ![]() .
Energia este o proprietate aditiva, ceea ce inseamna ca energia unui
sistem compus din mai multe subsisteme este egala cu suma energiilor acestor
subsisteme. Mai mult decat atat, energia fiecarui din ele are aceeasi valoare
in momentul final ca si in momentul initial, daca procesul este un proces de ridicare
a unei greutati cu efect net nul, sau ramane invarianta in timp, daca procesul
este spontan.
.
Energia este o proprietate aditiva, ceea ce inseamna ca energia unui
sistem compus din mai multe subsisteme este egala cu suma energiilor acestor
subsisteme. Mai mult decat atat, energia fiecarui din ele are aceeasi valoare
in momentul final ca si in momentul initial, daca procesul este un proces de ridicare
a unei greutati cu efect net nul, sau ramane invarianta in timp, daca procesul
este spontan.
In ambele din aceste doua procese, ![]() pentru timpii
pentru timpii ![]() ,
ceea ce inseamna ca energia se conserva. Conservarea energiei este un
rezultat dependent de timp. Ea este obtinuta fara utilizarea ecuatiei generale
a miscarii. De remarcat, ca energia easte definita pentru orice sistem (atat
pentru cel macroscopic, cat si pentru cel microscopic) si pentru fiecare stare,
si nu este o marime statistica.
,
ceea ce inseamna ca energia se conserva. Conservarea energiei este un
rezultat dependent de timp. Ea este obtinuta fara utilizarea ecuatiei generale
a miscarii. De remarcat, ca energia easte definita pentru orice sistem (atat
pentru cel macroscopic, cat si pentru cel microscopic) si pentru fiecare stare,
si nu este o marime statistica.
Printre alte distinctii, fiecare proces poate fi reversibil sau ireversibil. Un proces este reversibil, daca el poate fi realizat pe calea cea mai scurta astfel, ca sistemul si mediul ambiant sa poata fi returnate la starile lor initiale respective . Un proces este ireversibil , daca este imposibil de a fi realizat pe o astfel de cale, ca sistemul si mediul ambiant sa poata fi returnate la starile lor initiale respective.
Entropia este notiunea care distinge termodinamica de orice alta ramura a stiintei si ingineriei. Este o dimensiune aditionala a spatiului definita de proprietatile sistemului, si are caracteristici importante, stranii si neobisnuite care atrag atentia miilor de savanti si ingineri si care stimuleaza discutii aprinse.
Entropia nu are inca o definitie completa. Sunt definite doar unele particularitati ale entropiei, spre exemplu:
1. Entropia ![]() este functia de stare a sistemului formata
prin integrarea pe conturul unui proces inchis (ciclu) a raportului variatiei infinit
de mici a caldurii
este functia de stare a sistemului formata
prin integrarea pe conturul unui proces inchis (ciclu) a raportului variatiei infinit
de mici a caldurii ![]() ca
functie de proces la temperatura absoluta
ca
functie de proces la temperatura absoluta ![]() ca factor de integrare, astfel ca
ca factor de integrare, astfel ca
![]() sau
sau ![]() , (1.2)
, (1.2)
unde semnul "=" se refera la procesele reversibile iar semnul "<" sau ">" se refera la procesele ireversibile.
2. Intr-un
sistem macroscopic izolat procesele se desfasoara de la sine de la potentiale
ridicate la potentiale scazute, cu crestere de entropie, corespunzand sensului
de maxima probabilitate termodinamica ![]() (directia desfasurarii proceselor
naturale), cu alte cuvinte, entropia este direct proportionala cu
probabilitatea termodinamica a starii respective, conform formulei lui
Boltzmann:
(directia desfasurarii proceselor
naturale), cu alte cuvinte, entropia este direct proportionala cu
probabilitatea termodinamica a starii respective, conform formulei lui
Boltzmann:
![]() (1.3)
(1.3)
unde ![]() este constanta lui Boltzmann.
este constanta lui Boltzmann.
3. Entropia este masura haosului din sistem in starea data
S-a stabilit, ca entropia poate avea si valori absolute si ca este o marime nenegativa. Deoarece energia este o marime aditiva, entropia este si ea o proprietate aditiva. Tinand cont, ca energia ramane constanta in timp atunci, cand sistemul suporta procese spontane sau interactiuni cu efect net nul la ridicarea greutatii, entropia ramane constanta si atunci, cand fiecare din aceste procese este reversibil, sau creste, cand fiecare din aceste procese este ireversibil. Aceste doua aspecte sunt cunoscute ca principiul nediminuarii entropiei. Generarea spontana de entropie sau cresterea acesteia pe parcursul unui proces ireversibil este numita generarea entropiei cauzata de ireversibililtate. Ea este pozitiva. Ca si consevarea energiei nediminuarea entropiei este un rezultat dependent de timp, care aici este obtinut fara utilizarea ecuatiei generale a miscarii, care inca nu este cunoscuta.
Sistemul, in general, are o infinitate
de proprietati independente. Daca ne concentram la familia speciala de stari
care sunt in echilibru stabil, principiul de stare mai enunta, ca valoarea
fiecarei din aceste stari este determinata in mod univoc de valorile ![]() sau de valorile unui set echivalent din alte
trei proprietati independente, spre exemplu, temperatura
sau de valorile unui set echivalent din alte
trei proprietati independente, spre exemplu, temperatura ![]() ,
presiunea
,
presiunea ![]() si volumul
si volumul ![]() .
Din contra, pentru starile care nu se afla in echilibru stabil, valorile E,
n si V nu sunt suficiente pentru a specifica valorile tuturor
proprietati independente. In general, una din proprietatile de mare inters este
entropia starilor de echilibru stabil, care in corespundere cu principiul de
stare, trebuie sa satisfaca relatia:
.
Din contra, pentru starile care nu se afla in echilibru stabil, valorile E,
n si V nu sunt suficiente pentru a specifica valorile tuturor
proprietati independente. In general, una din proprietatile de mare inters este
entropia starilor de echilibru stabil, care in corespundere cu principiul de
stare, trebuie sa satisfaca relatia:
![]() (1.4)
(1.4)
adica S trebuie sa fie ea insasi
functie de E, n si V . Functia ![]() este numita relatie fundamentala si
este concava - are o derivata partiala de gradul doi negativa - in raport cu
fiecare din variabilele independente E, n si V. Entropia
unicei stari de echilibru stabil este mai mare, decat in orice alta stare cu
aceleasi valori E, n si V. Acest rezultat este cunoscut ca
marele principiu entropic.
este numita relatie fundamentala si
este concava - are o derivata partiala de gradul doi negativa - in raport cu
fiecare din variabilele independente E, n si V. Entropia
unicei stari de echilibru stabil este mai mare, decat in orice alta stare cu
aceleasi valori E, n si V. Acest rezultat este cunoscut ca
marele principiu entropic.
Solutionand relatia fundamentala (1.4) in raport cu E , obtinem relatia energiei, care prezinta energia exprimata in functie de S, n, V:
![]() (1.5)
(1.5)
Traditional, daca energia sistemului in
starea de echilibru stabil depinde numai de ![]() si
si ![]() ,
ea este numita energie interioara si se noteaza cu U. Aceasta
terminologie nu trebuie tratata gresit in sensul, ca unele sisteme au si
energie interioara, si energie exterioara.
,
ea este numita energie interioara si se noteaza cu U. Aceasta
terminologie nu trebuie tratata gresit in sensul, ca unele sisteme au si
energie interioara, si energie exterioara.
Diferentialele totale scrise in baza relatiei fundamentale (1.4) si a relatiei energiei (1.5) au forma:
![]() (1.6)
(1.6)
![]() (1.7)
(1.7)
Vom defini:
![]() (1.8)
(1.8)
Temperatura este un parametru intern de stare care la parametrii externi constanti este functie numai de energie, constituind in acest fel o masura a acesteia. Temperatura termodinamica (absoluta) este definita prin principiul al doilea al termodinamicii.
A doua definitie este:
![]() (1.9)
(1.9)
Presiunea
este un parametru intern de stare (parametru intensiv care nu depinde de
masa sistemului) determinata de forta ![]() care
actioneaza perpendicular pe unitatea de arie
care
actioneaza perpendicular pe unitatea de arie ![]() a suprafetei (spre exemplu, a suprafetei
frontierii sistemului). Se disting: presiunea statica
a suprafetei (spre exemplu, a suprafetei
frontierii sistemului). Se disting: presiunea statica ![]() ,
presiunea dinamica
,
presiunea dinamica ![]() si presiunea termica (de pozitie,
numita impropriu tiraj)
si presiunea termica (de pozitie,
numita impropriu tiraj) ![]() ,
unde
,
unde ![]() este densitatea fluidului,
este densitatea fluidului, ![]() ;
;
![]() - viteza fluidului,
- viteza fluidului, ![]() ;
;
![]() - inaltimea dintre cotele 1 si 2,
- inaltimea dintre cotele 1 si 2, ![]() ;
;
![]() - acceleratia caderii libere.
- acceleratia caderii libere.
A treia definitie este
![]() (1.10)
(1.10)
Solutionand ecuatia (1.5) in raport cu dE si comparand rezultatul cu ecuatia (1.6), stabilim:
![]() (1.11)
(1.11)
Notiunile de temperatura, potential chimic si presiune sunt valabile doar pentru starile de echilibru stabil, cand temperatura, potentialul chimic si presiunea unui sistem este respectiv egala cu temperatura, potentialul chimic si presiunea altui sistem. Cu alte cuvinte, au loc egalitatile temperaturilor, potentialelor chimice si a presiunilor.
Este remarcabil faptul, ca fiecare din diferentialele,
![]() (1.12)
(1.12)
![]() (1.13)
(1.13)
este relatia matematica dintre proprietatile starilor de echilibru stabile vecine si nu rezultatul unor interactiuni. Temperatura se masoara in unitati diferite. Aceasta este just si pentru potentialul chimic si presiune.
1.2. Schema instalatiei experimentale
Schema instalatiei experimentale de demonstrare a proprietatilor si parametrilor de stare ai unui sistem termodinamic de molecule este prezentata in fig.1.1.
Instalatia este compusa din bobina 1 care infasoara vasul din sticla 2, in care se afla particulele feromagnetice 3 din hexafierit de bariu, avand moment magnetic propriu. Peretii vasului de sticla 2 si pistonul 6 modeleaza frontiera sistemului termodinamic, iar particulele 3 - moleculele constituentului acestuia. Bobina este conectata la autotransformatorul 5. In circuitul de alimentare a bobinei 1 este conectat paralel cu ea condensatorul 4 ales din conditia ca intensitatea curentului ce trece prin bobina sa fie minima. Bobina 1 creaza un camp magnetic alternativ, fortele caruia sunt fortele exterioare care interactioneaza cu moleculele constituentului sistemului termodinamic.
Principalele caracteristici tehnice ale elementelor constructive ale standului sunt urmatoarele:
bobina (inductia campului magnetic - 40 mT ; tensiunea de alimentare - reglabila intre 0 si 220 V; intensitatea maxima a curentului de alimentare - 3 A; numarul de spire - 1053; diametrul interior - 150 mm; lungimea - 100 mm
vasul din sticla (diametrul - 130 mm, inaltimea - 190 mm
bilele din hexafierit de bariu (diametrul - 2.5 mm
condensatorul (capacitatea - 40 ![]() ,
tensiunea - 400 V
,
tensiunea - 400 V
(tensiunea 0 - 220 V, intensitatea maxima - 8 A
Aceste marimi au fost obtinute prin calcule de dimensionare. La calculul bobinei s-au impus doua conditii: marimea inductiei campului magnetic pe ax si functionarea in regim de rezonanta pe frecventa retelei. La determinarea capacitatii condensatorului s-a impus conditia ca intensitatea curentului sa fie minima.
Calculele s-au verificat cu ajutorul programelor specializate Calculer si Bobtech.
1.3. Metodologia realizarii masuratorilor
La alimentarea bobinei 1 cu curent alternativ, aceasta induce un camp magnetic care interactioneaza cu pariculele fieromagnetice, datorita faptului ca acestea poseda moment magnetic propriu. Ca urmare, particulele sunt antrenate intr-o miscare complexa, in care acestea se rotesc concomitent cu miscarile de translatie in diverse directii. Miscarea este influentata si de ciocnirile reciproce dintre particule si dintre particule si peretii vasului in care acestea sunt amplasate. Astfel, comportamentul particulelor feromagnetice in camp magnetic alternativ este similar comportamentului unui sistem de molecule care interactioneaza cu exteriorul prin schimb de energie cu acesta. Ciocnirile conduc la disiparea energiei transmise de catre campul magnetic exterior. Intensitatea miscarii este direct proportionala cu inductia campului magnetic creat de bobina, adica cu tensiunea de alimentare a acesteia.
Inductia campului magnetic ![]() este analogul fluxului de caldura
este analogul fluxului de caldura ![]() ,
introdus in sistem, si poate fi variata prin variatia tensiunii de alimentare a
bobinei 1 cu ajutorul autotransformatorului 5.
,
introdus in sistem, si poate fi variata prin variatia tensiunii de alimentare a
bobinei 1 cu ajutorul autotransformatorului 5.
Presiunea ![]() se determina cu formula:
se determina cu formula:
![]() (1.14)
(1.14)
in care ![]() este masa pistonului 6;
este masa pistonului 6; ![]() ;
;
![]() - aria sectiunii transversale a vasului din
sticla 2,
- aria sectiunii transversale a vasului din
sticla 2, ![]() .
.
Volumul ![]() ,
pe care-l ocupa sistemul de molecule in vasul de sticla 2, se determina cu
relatia:
,
pe care-l ocupa sistemul de molecule in vasul de sticla 2, se determina cu
relatia:
![]() (1.15)
(1.15)
in care ![]() este cota la care se ridica pistonul 6 in
vasul de sticla 2,
este cota la care se ridica pistonul 6 in
vasul de sticla 2, ![]() .
.
Analogul temperaturii ![]() a sistemului de molecule este intensitatea
miscarii acestora
a sistemului de molecule este intensitatea
miscarii acestora ![]() .
Temperatura se determina cu formula:
.
Temperatura se determina cu formula:
![]() (1.16)
(1.16)
in care ![]() este numarul de kilomoli de constituent
molecular din sistem (
este numarul de kilomoli de constituent
molecular din sistem (![]() );
);
![]() - constanta universala a gazului perfect.
- constanta universala a gazului perfect.
Masuratorii se vor realiza in urmatoarea ordine:
1. Se alimenteaza cu tensiune
autotransformatorul 5 (pozitia initiala a rotii de variatie a tensiunii se
pozitioneaza la ![]() ).
).
2. La tensiunile de alimentare ale
autotransformatorului 5, ![]() si 220 V, cu ajutorul unei rigle milimetrice,
se masoara valorile cotei
si 220 V, cu ajutorul unei rigle milimetrice,
se masoara valorile cotei ![]() de ridicare a pistonului in raport cu fundul
vasului de sticla 2.
de ridicare a pistonului in raport cu fundul
vasului de sticla 2.
3. Cu rigla milimetrica se masoara
diametrul interior ![]() al
vasului de sticla 2 si se determina aria sectiunii transversale
al
vasului de sticla 2 si se determina aria sectiunii transversale ![]() a acestuia.
a acestuia.
4. Cu formulele (1.14)-(1.16),
pentru valorile tensiunii ![]() ,
indicate in p.2, se calculeaza valorile presiunii
,
indicate in p.2, se calculeaza valorile presiunii ![]() ,
volumului
,
volumului ![]() si temperaturii
si temperaturii ![]() a constituentului molecular din vasul de
sticla 2.
a constituentului molecular din vasul de
sticla 2.
5. Rezultatele masuratorilor si valorile calculate se prezinta sub forma tabelului 1.1.
6. Utilizand notiunile teoretice din p.1.1 sa se caracterizeze sistemul termodinamic studiat si parametrii de stare masurati ai constituentului molecular din care este alcatuit sistemul.
|
Nr.crt. |
U [V] |
h, [m] |
A, [m2] |
p, [Pa] |
V, [m3] |
T, [K] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[1] Sajin T. Termoeconomie, Ed. Alma
Mater,
[2] Sajin T., Craciun A. Memorator tehnic, Ed. TEHNICA-INFO, Chisinau, p.239-245.
|