Studiul comportamentului Mioglobinei prin intermediul spectroscopiei UV-Vis
Mioglobina este o hemoproteina monomera, cu structura asemanatoare unei subunitati de hemoglobina , fiind alcatuita dintr-un lant proteic elicoidal care contine in interiorul sau o grupare prosteica ,hemul (fig.1) . In mioglobina ionul de fier (II) are numarul de coordinare cinci deoarece se leaga coordinativ de patru atomi de azot ai inelelor pirolice din hem si de un azot de histidina din proteina. Mioglobina are rolul de depozitare a oxigenului si este prezenta in tesutul muscular. Aceasta este prezenta in tesutul muscular, cu o greutate moleculara de 17000 alcatuita dintr-un nucleu heminic si un lant polipeptidic format din 153 resturi de aminoacizi, numit si lant m; lantul polipeptidic are un grad de ordonare mare.
Fig. 1 HEMUL
Mioglobina (fig.2) are suprafata peptidei neconductiva la auto-asociere, spre deosebire de hemoglobina. In consecinta mioglobina este monomer, in timp ce hemoglobina este o unitate tetramera constand din patru unitati hem si cate doua lanturi peptida α si β dispuse tetraedric (Fig. 6). Lanturile α contin resturile a 141 aminoaciz 737c22h i si cele β, 146 aminoacizi.
In procesele respiratorii, oxigenul este legat de catre hemoglobina in plamani, trasportat prin sange pana la muschi, unde este cedat mioglobinei, pentru a fi depozitat si utilizat.
Atat hemoglobina cat si mioglobina exista in trei forme commune: deoxi-, in care fierul este complet redus la forma Fe+2, oxi-, formate prin reactia oxigenului cu deoxi - (HbO2 , MbO2) si met- in care fierul este oxidat la Fe+3 si nu reactioniaza cu oxigenul. Cand oxigenul reactioniaza cu forma redusa (deoxi-) este favorizata si oxidarea Fe+2 la Fe+3 (forma met), care se suprapune peste aditia reversibila a oxigenului la forma deoxi. Oxidarea ireversibila a fierului este redusa de asezarea sa in "buzunarul" hidrofob si de existenta la locul activ de legaturi de hidrogen intre proteine.
Fig 2. MIOGLOBINA
Asadar prezenta lucrare are scopul de a ilustra rezultatele obtinute in urma studiului comportamentului mioglobinei in diverse domenii ( pH , redox ). In urma acestor studii am tras concluzii referitoare la structura si reactivitatea mioglobinei.
S-a ales ca metoda de investigare spectometria UV-Vis. Metoda este aplicabila deoarece mioglobina absoarbe in acet domeniu, datorita posibilitatii trazitiilor electronice π-π*, din invelisul proteic, respectiv din hem (datorita legaturilor duble conjugate), si tranzitiilor electronice metal-ligand. Domeniul util de colectare a spectrelor este 260-800 nm, obsevandu-se un maxim in jur de 280 nm, datorat matricii proteice. Mioglobina fiind o metaloproteina, va prezenta un maxim de absorbitie, la aproximativ 409 nm, banda numita banda Soret.
Colectarea spectrelor se face in solutii diluate, pentru a se incadra in conditiile de liniaritate a legii Lambert-Beer, insa concentratia trebuie sa fie suficient de mare pentru a obtine un spectru clar, cu absorbante pe cat posibil cuprinse in intervalul 0.1-1.
2. METODE SI MATERIALE
Spectroscopia UV-
Astfel am preparat solutii tampon pentru valorile de pH 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13. Concentratia solutiei tampon va fi 200 mM, iar solutiile tampon se prepara in apa de cea mai inalta puritate posibila. Pentru prepararea solutiei tampon la pH 2 am folosit o solutie de fosfat disodic (Na2HPO4. 12 H2O ), la pH 3,4,5 acetat de sodiu ( CH3COONa ), la pH 6,7 carbonat de sodiu ( Na2CO3 ) , pH 8,9,10 fosfat monosodic (NaH2PO4. H2O ), iar la pH 11,12,13 tetraborat de sodiu ( Na2B4O7.10 H2O). Punem in baloane cotate cantitatiile de 35.814 g de fosfat disodic, 8.16 g acetat de sodiu , 12.7 g carbonat de sodium, 24.8 g fosfat monosodic si 22.92 g tetraborat de sodium, dupa care aducem fiecare balon la cota prin adaugarea de apa distilata, agitand pana la dizolvare.
Pentru a putea ajunge la pH-ul dorit am adaugat fie baza
tare( ex: NaOH ), fie acid tare( HCl) in functie de situatie, acesta fiind
monitorizat cu ajutorul pH-metrului. De exemplu pentru a ajunge la pH 2,la solutia
de fosfat disodic am adaugat acid, deoarce solutia avea un pH mai mare de 2.
Inainte de a folosi pH-metrul acesta trebuie calibrat prin apasarea butonului "
Apoi pentru a putea inregistra spectrele UV-Vis am preparat o solutie stoc de mioglobina. Pentru manipularea proteinelor din clasa mioglobinei se recomanda pastrarea in stocuri de 1-5mM,daca sunt in solutie.Solutia se mioglobina fiind obtinuta astfel: mioglobina pura (din inima de cal) impreuna cu apa ,care trebuie sa fie la fel de multa ca si cantitate cat am adaugat si mioglobina. Concentratia solutiei stoc o calculam din legea lui Lmabert Beer :
A=ε×l×c
Conform legii echivalentei:
C1V1=C2V2, unde C1, C2, V1, V2 sunt concetratiile respectiv volumele solutiei din cuva ,respectiv din tubul Ependorf, asftfel a fost calculata concentratia solutiei stoc.
Inainte de a inregistra orice spectru, trebuie sa facem linia de zero a aparatului cu o solutie tampon sau apa,aceasta fiind solutia blanck. Astfel injectam in cuva solutia tampon pentru pH 6, pe care o asezam in spectrometru si inregistram spectrul. Extragerea probelor din solutiile stoc se va face daca este posibil,cu un varf de pipeta nou de fiecare data, sau cel putin cu un varf necontaminat cu alti reactivi. Se utilizeaza de preferinta pipete tip Eppendorf.
Se inregistreaza asadar spectrele UV-Vis ale mioglobinei in domeniile de pH rescpective. Din primul spectru ne dam seama in ce cantitati trebuie sa punem mioglobina datorita absorbantei care trebuie sa fie intre 0,1 -1 unitati. Daca este peste 1 atunci volumul de mioglobina e mare. Domeniul util de colectare a spectrului UV-vis pentru o proteina este de obicei 260-800 nm;de multe ori pentru Mb si alte hemoproteine se inregistreaza spectrul doar in domeniul 400-750 nm.
Pentru determinarea pKa-ului, folosim un program de tip excel reprezentandu-se grafic absorbanta in functie de pH, valoarea acesteia fiind determinata din grafic.
Se prepara o solutie stoc de guanidina(Gu) in concentratie de 5-6M,in solutie tampon de pH 7 pt a putea urmari comportamentul mioglobinei in prezenta unui agent denaturant . Proteina se incubeaza pentru 15-30 min in concentratia dorita de guanidina inainte de inregistrarea spectrului.
Deoximioglobina se prepara usor prin adaugarea catorva cristale de ditionit de sodiu Na2S2O4 la o solutie aerobica de met Fe(III) mioglobina.Ditionitul este un agent reducator puternic care elimina oxigenul molecular din solutie si reduce Fe(III) la Fe(II). Pentru inregistrarea spectrului UV-Vis al deoximioglobinei, Fe(II), la pH=7 se amesteca mioglobina Fe(III) cu solutie tampon (pH=7) si realizam spectrul. Astfel prin repetarea aceleasi opreatiuni la pH 10 respectiv 12 se evidenteaza influenata tariei ligandului asupra starii de spin. Adaugand Na2S2O4 cu spatula si inregistrand din nou spectrul, se observa ca ramane acelasi.
Peste proba de pH 12, s-a adaugat o cantitate mica dioxid de tiouree in scopul obtinerii FeII-CO. Acest reactiv reduce metalul, dar in acelasi timp elibereaza CO in cuva. Spectrul se inregistreaza dupa aproximativ 15 minute de la adaugarea dioxidului de tiouree.
3. DISCUTII
Influenta ph-ului
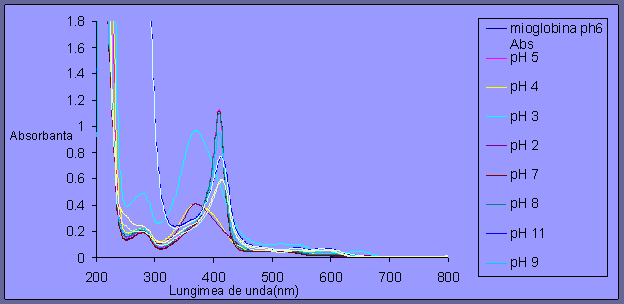
Fig 3.1 Spectrul UV-vis al mioglobinei la diverse valori de pH
Din spectrul UV-Vis al mioglobinei la diverse valori de pH se observa ca mioglobina da nastere spectrelor (formata din aminoacizi si Fe in mijlocul porfirinei). Putem observa de asemenea ca pH-ul influenteaza schimbarea concentratiei protonilor iar aminoacizii sunt in contact cu protonii care dau pH-ul. In proteina aminoacizii se orienteaza in jurul hemului, fortele fiind legaturi de hidrogen, Van Der Waals si puntii ionice care implica protoni, atfel aceste legaturi sunt influentate de schimbul de pH. Daca concentratia de protoni este foarte mare ,proteina se v-a denatura (nu mai este impachetata in jurul hemului). Semnul denaturarii proteinei este evidentiata prin banda Soret care este largita, pe cand, in mod normal banda Soret este foarte definita.
Histidina proximala are o grupare care poarta un proton ce este responsabil de schimbari.La pH acid - este vorba de protonul unei molecule de apa legate la Fe iar la pH bazic e vorba de legarea fierului de OH-.Asadar daca la Fe legam OH- acesta devine de spin jos iar cand legam apa la Fe acesta devine de spin inalt asadar daca schimbam ligandul se schimba si starea de oxidare a metalului.
Din spectre rezulta ca la un pH acid ,pH<5 proteina este denaturata ceea ce inseamna ca hemul isi pierde ligandul (posibil Fe) si se schimba polaritatea din jurul hemului (se schimba reactivitatea substantei) care vine de la orbitali.Pe masura ce creste pH-ul de la 5-12 proteina este intacta, iar orice schimbare a spectrelor nu se datoreaza denaturarii matricii proteice. De asemenea intre pH 6 si 13 se observa o tranzitie treptata de electroni.
La 750- 800 nm proteina nu absoarbe in principiu (dar exista schimbari continue).
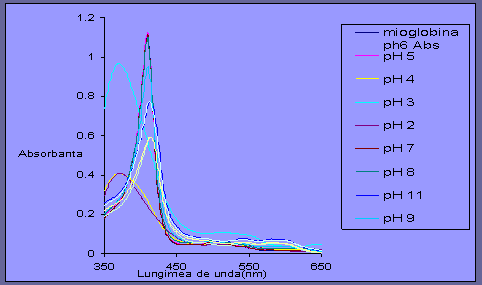
Fig 3.2 Spectrul UV-Vis al mioglobinei la diverse valori de pH,
la un interval de lungime de unda cuprins intre 350 si 650.
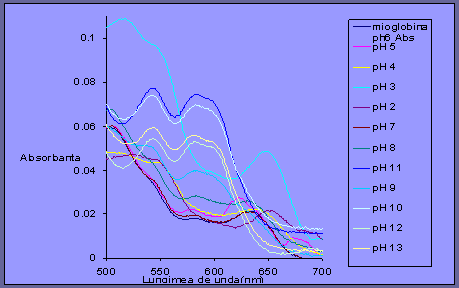
Fig 3.3 Spectrul UV-Vis al mioglobinei la diferite valori de pH
pt absorbanta cuprinsa intre 0 si 0.11 si lungimea de unda 500-700
In domeniul 550-650 nm spectrele se intersecteaza intr-un punct, numit punct isosbestic, care indica prezenta in probe a doua specii aflate in echilibru.
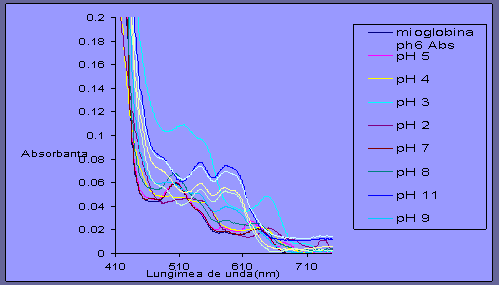
Fig 3.4 Spectrul UV-Vis al mioglobine la diverite valori de pH
pt absorbanta cuprinsa intre 0 si 0.2 si lungimea de unda intre 410-710
La lungimea de unda 450 bazicitatea este reprezentata sus si aciditatea jos. Se mai poate spune ca in intervalul 480 - 520 nm unde pentru pH 10, pH 11, pH 12, pH 13 curba U este aceeasi iar de la pH 2 pana la pH 9 curba este invers.
 UV-Vis ofera informatii despre starea metalului desi el nu
influenteaza spectrul direct.
UV-Vis ofera informatii despre starea metalului desi el nu
influenteaza spectrul direct.
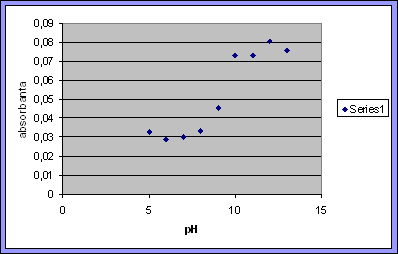
Reprezentarea din figura alaturata seamana cu o curba de titrare, si avem un fenomen foarte simplu adica transferul unui proton induce schimbarii dramatice.
Fig 3.5
Pe domeniul de pH in care proteina este in stare nativa, pH>4, se poate defini o constanta pka similara constantei de aciditate din chimia analitica, care insa indica punctul de echivalenta dintre Fe in stare de spin inalt sau jos.
Apa in stare libera are pka = 14,iar cand e legat de Fe are pka= 9. Faptul ca pka este mai mic cand legam Fe fata de pka a apei care este in stare libera, se datoreaza sarcinii pozitive. Aceasta sarcina arata ca este un deficit de electroni, astfel Fe trage electronii de la oxigen si atunci protonii sunt mai liberi.
Influenta agentului denaturant
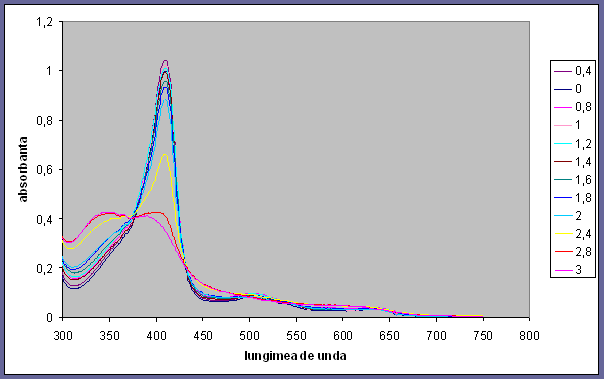
Fig 4.1 Spectrul mioglobinei ferice in prezenta de guanidina
Adaugare unui agent denaturant solutiilor de proteina determina distrugerea structurii tridimensionala a proteinei ;
Guanidina prezinta 2 stari: o stare normala de la concetratii 0M pana la 2M si o stare denaturata de la 2.4M pana la 3M.
Pentru un pH>5 proteina se denatureaza si pornind de la pH=13 are loc fenomenul de protonare (datorat porfirinei) ,protonul se ataseaza pe hem. Proteina se denatureaza mai mult cu cat concentratia de guanidina este mai mare.
Fig 4.2
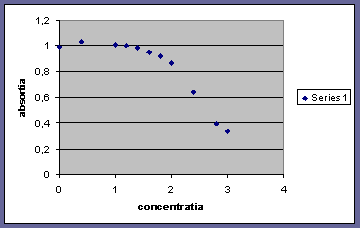 Figura alaturata reprezinta gradul de distrugere al proteinei in functie
de concentratia de agent denaturant.
Figura alaturata reprezinta gradul de distrugere al proteinei in functie
de concentratia de agent denaturant.
Compararea formei deoxiMb cu metMb la pH 7 si pH 10
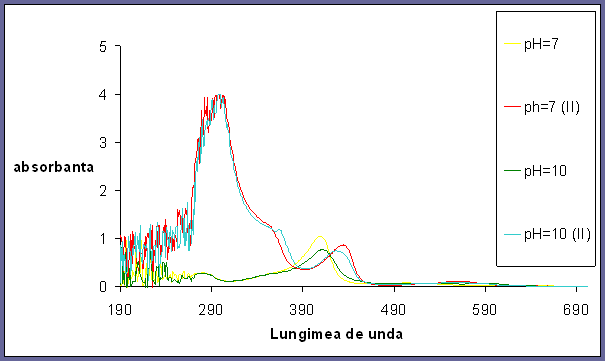
Fig 5. Spectrul UV-Vis al deoxiMb si al metMb la pH 7 si pH 10
In cazul probelor la pH=7, odata cu reducerea metalului am observat o depalsarea a benzii Soret spre vizibil pentru Fe in forma ferica la lungimea de unda de 409 nm, respectiv in cazul formei feroase la 435 nm, precum si o scadere in intensitate a acesteia;
Intre formele feroase diferenta este foarte mica din cauza ca Fe nu mai are legata o molec de apa care sa se poata deprotona in functie de pH cum este in cazul mioglobinei ferice;
La spectrul feros apare o banda foarte mare in stanga datorita excesului mare de Na2S2O4 .
4.Concluzii
In urma studiului realizat asupra coportamentului mioglobinei in diferite medii, prin metoda spectroscopiei UV-Vis am tras urmatoarele concluzii:
Mioglobina ramane intacta intre pH-urile 5 - 12 iar la pH <4 proteina se denatureaza;
Prezenta excesiva sau absenta protonilor, in solutiile apoase, poate influenta taria ligandului;
Agentii denaturanti prezenti in concentratii mici (> 1,6M) va afecta intr-o mica masura proteina, insa in concentratii mai mari pot fi periculosi.;
Starea de spin a metalui este influentata de starea de oxidare a metalului si de natura ligandului, astfel ca schimbarea de spin da schimbarea spectrelor.
5.BIBLIOGRAFIE
a. "Chimie Bioanorganica generala"-autori: Mircea Nicolae Palamaru, Alexandra Raluca Iordan, Alexandru Cecal.
b."Chimie bioanorganica"-autor :Letitia Ghizdavu.
C.Sursa online: www.winkipedia.com
|