CAIET DE PROBLEME
LA
CHIMIE
Al studentului
Grupa
AN sCOLAR 2005-2006
1. CALCULE CU MĂRIMI sI UNITĂŢI IMPORTANTE ÎN CHIMIE
Executarea corecta a calculelor în cadrul diverselor operatii de laborator si aplicatii de chimie, presupune cunoasterea principalelor notiuni care stau la baza evaluarii cantitative a transformarilor fizico-chimice. Aceste notiuni vor fi prezentate mai jos:
substanta chimica, element chimic, compus chimic;
masa atomica; atom-gram; kiloatom-gram;
masa moleculara; molecula-gram; milimol, kilomol;
masa echivalenta sau echivalent-gram;
calcul de numar de moli sau atom-gram cunoscând masa substantei;
raportul de masa;
compozitia procentuala.
substanta chimica, element chimic, compus chimic
Substanta chimica este definita ca fiind un tip omogen de materie, cu o compozitie chimica bine definita.
Substantele chimice pot fi subîmpartite în doua categorii: substante elementare (elemente chimice) si substante compuse (compusi chimici).
Elementul chimic poate fi definit ca fiind tipul de materie care consta din atomi de acelasi fel (adica din atomi ale caror nuclee au toate aceeasi sarcina electrica).
Elementele sunt reprezentate printr-un simbol, compus dintr-o litera sau doua, de exemplu, simbolul hidrogenului este H, al oxigenului O, al clorului Cl etc. Simbolurile tuturor elementelor chimice sunt trecute în sistemul periodic al lui Mendeleev.
Elementele chimice pot fi formate din unul sau mai multi atomi. Astfel gazele rare (argonul, neonul etc.) sunt elemente monoatomice, notându-se cu Ar, Ne etc. În timp ce majoritatea gazelor obisnuite (oxigenul, clorul, azotul etc.) sunt biatomice, notându-se cu O2, H2, Cl2, N2 etc. Exista si elemente poliatomice, ca de exemplu fosforul, P4, sulful, S8 etc.
Gradul de asociere al atomilor într-un element poate sa varieze în
functie de conditiile în care se afla elementul respectiv. De
exemplu, în intervalul de temperatura 20 -
Compusul chimic poate fi definit ca fiind substanta rezultata prin combinarea, în anumite proportii, a doua sau mai multe elemente chimice. Compusul chimic rezultat are proprietati diferite de ale elementelor care îl compun.
Orice compus chimic se reprezinta printr-o formula chimica, care indica numarul de atomi ai diferitelor elemente care intra în compozitia sa. De exemplu, formula acidului azotic HNO3, a oxidului de magneziu MgO, a clorurii de zinc ZnCl2 etc.
Moleculele chimice rezulta prin unirea (în anumite conditii si dupa anumite reguli) a doi sau mai multi atomi. Atomii pot fi de acelasi fel sau diferiti. În primul caz se obtin molecule de substante elementare, ca de exemplu Cl2, O2, P4 etc, în timp ce în al doilea caz se obtin molecule de substante compuse cum sunt MgO, ZnCl2, SO2, H2O etc.
masa atomica, atom-gram, kiloatom-gram
Masa atomica este o marime
relativa care arata de câte ori atomul unui element este mai mare
decât unitatea atomica de masa (u.a.m). Drept unitate atomica de
masa s-a ales daltonul, care
reprezinta a douasprezecea parte din masa atomului de carbon.
Rezulta ca masa atomica este un numar fara
dimensiuni. De exemplu, masa atomica a hidrogenului este 1,008, a
oxigenului
Exemple:
AH = 1, AC = 12, AFe = 56
Atomul-gram (atom-g) este o marime dimensionala ce reprezinta cantitatea în grame dintr-un element, numeric egala cu masa lui atomica. Se calculeaza exprimând masa atomica în g.
Exemple:
1 atom-g O = 16g, 1 atom-g Al = 27g
Kiloatom-gram (katom-g) este o marime derivata: 1 Katom-g = 103 atom-g, si se defineste ca marime dimensionala ce reprezinta cantitatea în kg dintr-un element, numeric egala cu masa lui atomica. Se calculeaza exprimând masa atomica în kg.
Exemple:
1 katom-g
Cu =
masa moleculara, molecula-gram, milimol, kilomol
Masa moleculara, M, este o marime relativa ce arata de câte ori molecula unui e 555j92f lement poliatomic sau molecula unei combinatii este mai mare decât u.m.a.
Masa moleculara reprezinta suma maselor atomice ale elementelor componente (tinând cont de coeficientii stoechiometrici). În calcule masele moleculare se rotunjesc.
Exemple:
MHCl = 1 + 35,5 = 36,5 MNaOH = 23 + 16 + 1 = 40
Molecula-gram, mol, este cantitatea în grame dintr-o substanta numeric egala cu masa moleculara a substantei.
Molul reprezinta cantitatea în grame dintr-o substanta egala cu suma maselor absolute a N particule, reprezentate printr-o formula chimica.
Se calculeaza exprimând masa moleculara în g.
Termenul de mol se aplica la:
substante cu formule moleculare cunoscute: H2O, HCl etc.;
substante ce nu formeaza molecule: NaCl, CaCl2 etc.;
la atomii liberi: H, Cl etc.;
la ioni: Na+, Cl- etc.;
la particule subatomice: e-.
Exemple:
1 mol O2 =
Milimol, mmol, este o marime derivata:
1 mmol = 10-3 mol
si reprezinta cantitatea în mg dintr-o substanta, numeric egala cu masa ei moleculara. Se calculeaza exprimând masa moleculara în mg.
Exemple:
1 mmol F2 = 38 mg, 1 mmol H3PO4 = 98 mg
Kilomol, kmol, este o marime derivata:
1 kmol = 103 mol
si reprezinta cantitatea în kg dintr-o substanta, numeric egala cu masa ei moleculara. Se calculeaza exprimând masa moleculara în kg.
Exemple:
1 kmol Cl2 =
masa echivalenta sau echivalent-gram
Echivalent chimic (gram) al unui element,
este acea cantitate, exprimata în grame, din acest element care se
combina cu
În sensul teoriei atomice, echivalentii chimici reprezinta mase relative ale atomilor care se combina, raportate la masa atomului de hidrogen (cel mai usor atom).
Echivalentul gram:
la elemente se calculeaza prin împartirea masei atomice la valenta.
la saruri se calculeaza împartind masa moleculara la produsul dintre valenta metalului si numarul atomilor de metal;
la oxizi se obtine împartind masa moleculara a oxidului la produsul dintre numarul atomilor de metal sau nemetal si valenta acestuia;
la acizi si baze, se calculeaza împartind masa moleculara la numarul atomilor de hidrogen care se pot înlocui prin metale, respectiv numarul gruparilor oxidril, (OH).
Exemple:
![]() =
= ![]() g echivalent
g echivalent
![]() =
= ![]() g echivalent
g echivalent
![]() g echivalent
g echivalent
![]() g echivalent
g echivalent
![]() g echivalent
g echivalent
Calcul de numar de moli sau de atom-gram cunoscând masa substantei
Numar de moli se calculeaza împartind masa substantei, exprimata în grame, la masa ei molara.
Numar de atomi-gram, se calculeaza împartind masa substantei elementare exprimata în grame la masa atomica a elementului.
Raportul de masa
- reprezinta raportul cantitativ al elementelor care compun unitatea de structura a substantei chimice compuse.
Compozitia procentuala
A calcula compozitia procentuala a unei substante compuse înseamna a calcula % în care sunt continute elementele respective în unitatea de structura.
PROBLEME REZOLVATE:
Problema nr.1
Câti atom-g reprezinta:
0,4 katom-g N = 0,4 × 103 = 400 atom-g N
Problema nr.2
Câte grame reprezinta: 8 mol H2; 500 mmol CaO; 0,02 kmol H2SO4?
8 mol H2 = 8 × 2 =
500 mmol CaO = 500 × 55 × 10-3
=
0,02 kmol H2SO4
= 0,02 × 103 × 98 =
Problema nr.3
Câti moli reprezinta:
300 mmol KOH = 300 × 10-3 = 0,3 mol KOH
0,4 kmol HNO3 = 0,4 × 103 = 400 mol HNO3
Problema nr.4
Sa se calculeze masa molara pentru: H2O, CaCO3?
![]() = (1 × 2) + 16 =
= (1 × 2) + 16 =
![]() = 40 + 12 + (3 × 16) =100 g CaCO3
= 40 + 12 + (3 × 16) =100 g CaCO3
Problema nr. 5
Sa se calculeze raportul de masa al apei.
![]() = (2 × 1) + 16 = 18
= (2 × 1) + 16 = 18
H : O = 2 : 16 = 1 : 8
Problema nr. 6
Sa se calculeze raportul de masa pentru CaCO3.
![]() = 40 + 12 + (3 × 16) = 100
= 40 + 12 + (3 × 16) = 100
Ca : C : O = 40 : 12 : 48 = 10 : 3 : 12
Problema nr. 7
Sa se calculeze compozitia procentuala a apei.
![]() = (2 × 1) + 16 = 18
= (2 × 1) + 16 = 18
x = 11,11% H
y = 100 - x = 100 - 11,11 = 88,89 % O
Problema nr.8
Sa se calculeze masa de sulf
existenta în
![]() = 40 + 32 + (16 × 4) = 136
= 40 + 32 + (16 × 4) = 136
x =
Problema nr.9
Determinati formula unei substante care contine : 43,39% Na, 11,32% C si 45,28% O.
NaxCyOz
x = 43,39 : 23 = 1,89 atom-g Na 1,89 : 0,94 = 2,01
y = 11,32 : 12 = 0,94 atom-g C 0,94 : 0,94 = 1
z = 45,28 : 16 = 2,83 atom-g O 2,83 : 0,94 = 3,01
x : y : z = 2 : 1 : 3
NaxCyOz = Na2CO3
PROBLEME PROPUSE:
1. Câte grame reprezinta:
10 atom-g Ca; 5 atom-g Al; 2 atom-g S; 0,5 katom-g O; 0,2 katom-g C; 0,1 katom-g Fe?
2. Câti atom-g reprezinta:
3. Câti katom-g reprezinta:
4. Câti mol reprezinta:
5. Câte kg reprezinta:
0,4 kmol Ca(OH)2; 5 kmol CaCO3; 0,06 kmol HNO3?
6. Câti kmol reprezinta:
Calculati masa molara pentru:
Ca3(PO4)2; Na2S; CaCl2; AlCl3; Na3PO4; NH4H2PO4; Al2(SO4)3?
Calculati echivalentul-gram pentru:
Na; Al; SO2; Al2O3; HCl; H3PO4; Ca(OH)2; Al(OH)3; CuSO4; Al2(SO4)3; HNO3; KOH; Ba(OH)2; Fe(OH)3; MgO; Fe2O3.
Sa se calculeze raportul de masa al elementelor care compun CaCO3.
Sa se calculeze raportul de masa al elementelor care compun CaO.
11. Sa se calculeze raportul de masa al elementelor care compun Al2(SO4)3.
Sa se calculeze compozitia procentuala a Ca3(PO4)2.
13. Sa se calculeze compozitia procentuala a Na2SO4.
14.Sa se calculeze compozitia procentuala a Al2(SO4)3.
Sa se afle compozitia
procentuala a unui aliaj format din
16. La analiza a
17. Determinati masa fierului existent în
18. Determinati masa fosfatului monoacid de amoniu în care se
gasesc
19. Aflati formula substantei care contine: 28,67 % K; 1,47 % H si 22,8 % P.
Sa se afle formula substantei al carui raport de masa este: H : S : O = 1 : 16 : 24.
Determinati formula chimica a substantei al carui raport de masa este:
Ca : H : P : O = 20 : 2 : 31 : 64
Determinati formulele combinatiilor cu compozitia procentuala:
a). 43,09% K; 39,21 % Cl; 17,7 % O
b). 36,67 % K; 33,33%; 30 % O
c). 31,8 % K; 28,9 % Cl; 39,3 % O
d). 28 % K; 25,7 % Cl; 46,3 % O
23. Determinati formulele substantelor în care raportul de masa al elementelor componente este:
a). Ca : S : O = 5 : 4 : 6
b). Ca : S : O = 5 : 4 : 8
c). Ca : P : O = 60 : 31 : 48
d). Ca : P : O = 60 : 31 : 64
e). Ca : H : P : O = 40 : 1 : 31 : 64
2. CONFIGURAŢIA ELECTRONICĂ A ATOMILOR
Marimile caracteristice nucleului sunt:
Z: numar de ordine, numar atomic, numar de protoni ( = numarul de electroni);
A: numar de masa, masa atomica, suma de nucleoni;
N = A - Z : numar de neutroni:
N - Z : numar izotopic.
izotopi = acelasi Z
izobari = acelasi A
izotoni = acelasi N
Reguli de ocupare cu electroni a orbitalilor atomici
a). Ocuparea cu electroni se face în ordinea cresterii energiei;
b). Principiul excluziunii lui Pauli
Conform acestui principiu, într-un atom nu pot exista doi sau mai multi electroni care sa aiba toate cele patru numere cuantice (n, l, m, ms) identice. Toti electronii unui atom trebuie sa difere între ei cel putin prin unul din cele patru numere cuantice.
c). Regula lui Hund - electronii se repartizeaza în numarul maxim de orbitali de acelasi fel care le sta la dispozitie. Cu alte cuvinte, mai întâi se ocupa pe rând fiecare orbital cu câte un electron si numai dupa aceea cu cel de-al doilea.
Succesiunea de ocupare a nivelelor si subnivelelor energetice cu electroni
a). Regula sumei n + l
Conform acestei reguli valoarea crescatoare a paturilor si nivelelor energetice este data de valoarea crescatoare a sumei n + l. Daca doua sau mai multe nivele au aceeasi valoare a sumei n + l, nivelele corespunzatoare numarului cuantic n cel mai mic are energia mai mica.
b). Tabla de sah Goldanski
|
1s | |||||||
|
2s | |||||||
|
2p |
3s | ||||||
|
3p |
4s | ||||||
|
3d |
4p |
5s | |||||
|
4d |
5p |
6s | |||||
|
|
5d |
6p |
7s | ||||
|
|
6d |
7p |
8s |
c). Cu ajutorul sistemului periodic.
Orbitalii de tip:
s = 2 e-; p = 6 e-; d = 10e-; f = 14 e-;
|
I-A |
II-A |
III-A |
IV-A |
V-A |
VI-A |
VII-A |
VIII-A |
||||||||||
|
s1 |
s2 |
III-B |
IV-B |
V-B |
VI-B |
VII-B |
VIII-B |
I-B |
II-B |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
||
|
d1 |
d2 |
d3 |
d4 |
d5 |
d6 |
d7 |
d8 |
d9 |
d10 | ||||||||
Exemple:
Pentru Z = 11 sa se scrie configuratia electronica.
Z = 11 1s2 2s2 2p6 3s1
Numarul din fata ultimului orbital de tip s ne da numarul perioadei, iar ultimul orbital ne da numarul grupei.
În cazul Z = 11 avem perioada a 3-a, grupa I-A.
Particule emise din nuclee radioactive
Partea centrala a atomului în care este acumulata aproape
toata masa atomului are dimensiuni de ordinul a 10-
În nucleu exista protoni - particule cu sarcina electrica pozitiva si neutroni - particule neutre.
Un nucleu (sau denumit mai general nuclid) oarecare este exprimat simbolic sub forma
![]() , în care s-a notat cu X simbolul atomului din care face
parte nucleul respectiv; cu Z s-a notat numarul de protoni sau
numarul de sarcini electrice elementare a nucleului, iar cu A s-a notat
numarul de nucleoni sau masa aproximativa a nucleului exprimata
în unitati atomice de masa. Numarul de neutroni se obtine
scazând din numarul de nucleoni, numarul de protoni. Deci
numarul de neutroni este A - Z.
, în care s-a notat cu X simbolul atomului din care face
parte nucleul respectiv; cu Z s-a notat numarul de protoni sau
numarul de sarcini electrice elementare a nucleului, iar cu A s-a notat
numarul de nucleoni sau masa aproximativa a nucleului exprimata
în unitati atomice de masa. Numarul de neutroni se obtine
scazând din numarul de nucleoni, numarul de protoni. Deci
numarul de neutroni este A - Z.
Doi nuclizi X si Y sunt izotopi
daca au acelasi numar de protoni sau altfel spus daca atomii corespunzatori ocupa
acelasi loc în sistemul periodic al elementelor. Acesti nuclizi
izotopi se exprima simbolic: ![]() ;
; ![]() .
.
Doi nuclizi X si Y sunt izobari
daca au acelasi numar de nucleoni sau daca atomii au aceeasi masa. Acesti nuclizi
izobari se exprima simbolic sub forma: ![]() ;
; ![]() .
.
Doi nuclizi X si Y sunt izotoni daca au acelasi
numar de neutroni. Acesti
nuclizi izotoni se exprima simbolic sub forma: ![]() ;
; ![]() , cu conditia: A - Z =
, cu conditia: A - Z = ![]() -
- ![]() .
.
Configuratia unui nuclid instabil se modifica prin dezintegrare, conducând la o alta configuratie care poate fi stabila, sau de asemenea instabila.
În functie de particula emisa din nucleu, exista diferite tipuri de dezintegrari:
a). Dezintegrarea α
Procesul în care un nucleu de masa A si sarcina Z emite
în mod spontan particule α (![]() sau
sau ![]() ) cu eliberarea unei cantitati de energie sub forma
energiei cinetice a particulelor α, se numeste dezintegrare α.
) cu eliberarea unei cantitati de energie sub forma
energiei cinetice a particulelor α, se numeste dezintegrare α.
Schematic procesul de dezintegrare α se reprezinta astfel:
![]()
![]()
![]() +
+ ![]()
În urma dezintegrarii se obtine un nou nucleu al unui atom situat în sistemul periodic cu doua casute mai la stânga.
b). Dezintegrarea β
Nucleele radioactive β sunt cele mai numeroase. Acest tip de dezintegrare apare natural la nucleele cu Z ≥ 81.
Dezintegrarea radioactiva β:
![]()
![]()
![]() +
+ ![]()
PROBLEME REZOLVATE
Problema nr.1
Se da nuclidul ![]() . Sa se scrie marimile caracteristice nucleului,
valori, semnificatii. Sa se scrie câte 2 izotopi, 2 izobari si 2
izotoni.
. Sa se scrie marimile caracteristice nucleului,
valori, semnificatii. Sa se scrie câte 2 izotopi, 2 izobari si 2
izotoni.
Z = 56 - numar de ordine, numar de protoni, numar atomic;
A = 137 - numar de masa, masa atomica, ![]() ;
;
A - Z = 81 - numar de n0;
N - Z = 25 - numar izotopic.
izotopi Z = 56 ![]()
izobari A = 137 ![]()
izotoni N = 81 ![]()
Problema nr.2
Grupati urmatorii nuclizi pe specii caracteristice:
![]()
Izotopi: ![]()
![]()
Izobari: ![]()
![]()
Izotoni: ![]()
![]()
Problema nr.3
Sa se scrie configuratia
învelisului electronic a nucleului obtinut din ![]() prin emiterea a 6 particule α si 4 particule
β. Precizati grupa, perioada si principalele
proprietati ale noului element format.
prin emiterea a 6 particule α si 4 particule
β. Precizati grupa, perioada si principalele
proprietati ale noului element format.
![]()
![]() 6
6![]() + 4
+ 4![]() +
+ ![]()
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 5p6 6s2 4f14 5d10 6p4
perioada a 6-a grupa VI-A, metal
PROBLEME PROPUSE
1. Sa se stabileasca pozitia în sistemul periodic si caracterul chimic al elementelor cu Z: 12, 16, 24, 26, 29, 32, 36, 47, 64, 83.
2. Sa se scrie configuratia elementului E1 din perioada a 5-a, grupa V-A si a elementului E2 din perioada a 4-a, grupa V-A.
Sa se stabileasca caracterul chimic al elementelor respective.
Care este valoarea Z1 si Z2 pentru cele doua elemente?
stiind ca A1 = 122 si A2 = 75 sa se calculeze marimile caracteristice nucleelor respective si sa se scrie un izotop pentru E1 si un izobar pentru E2.
3. O specie atomica are Z = 16 si A = 32.
Câti e-, p+, n0 are specia si cum poate fi redata simbolic?
Scrieti câte un izotop, izoton si izobar al speciei. Precizati pozitia în sistemul periodic si caracterul chimic al elementului.
4. Se da urmatoarea serie de nuclizi:
![]()
Sa se grupeze nuclizii pe baza relatiei dintre A, Z, N.
5. Se da izotopul cu urmatoarea compozitie a nucleului: 15 p+ si 16 n0. Scrieti configuratia electronica a elementului, marimile caracteristice nuclidului, pozitia în sistemul periodic, un izotop, un izobar si un izoton posibil. Elementul formeaza un acid cu compozitia procentuala: H - 3,06%, X - 31,63%. Care este formula acidului si ce stare de oxidare are X?
Mase atomice: H - 1, O - 16.
6. Elementul X din perioada a 3-a, grupa VI-A are în nucleu si 16 n0. Scrieti configuratia electronica a elementului, marimile caracteristice nuclidului, un izotop, un izobar si un izoton posibil. Elementul formeaza un acid în care starea lui de oxidare este 4+. Care este formula acidului si compozitia lui procentuala?
Mase atomice: H - 1, O - 16.
7.
Sa se scrie configuratia învelisului electronic a nucleului
obtinut din ![]() prin emiterea a 7
particule α si 5 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
prin emiterea a 7
particule α si 5 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
8.
Sa se scrie configuratia învelisului electronic a nucleului
obtinut din ![]() prin emiterea a 7
particule α si 6 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
prin emiterea a 7
particule α si 6 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
Sa se scrie configuratia
învelisului electronic a nucleului obtinut din ![]() prin emiterea a 5
particule α si 4 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
prin emiterea a 5
particule α si 4 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
10.
Sa se scrie configuratia învelisului electronic a nucleului
obtinut din ![]() prin emiterea a 6
particule α si 5 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
prin emiterea a 6
particule α si 5 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
11.
Sa se scrie configuratia învelisului electronic a nucleului
obtinut din ![]() prin emiterea a 7
particule α si 4 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
prin emiterea a 7
particule α si 4 particule β. Precizati grupa, perioada
si principalele proprietati ale noului element format.
3. PROPRIETĂŢI FIZICE sI CHIMICE ALE ELEMENTELOR
Proprietati fizice si modul de variatie corelat cu pozitia elementelor în sistemul
periodic.
Volumul atomic
Volumul atomic este definit prin relatia:
![]()
este o functie periodica de numarul atomic. Volumele atomice cele mai mari le au metalele alcaline, iar cele mai mici, metalele tranzitionale.
creste VI B creste VIII A
![]()
scad
Razele atomice
O periodicitate analoga prezinta si razele atomice. Cele mai mari raze atomice prezinta metalele alcaline, iar cele mai mici, metalele tranzitionale.
Raza atomica (ra):
creste VI B creste VIII A
![]()

creste
Razele ionice
Razele ionice variaza la fel ca si razele atomice. Cu cât sarcina pozitiva a ionilor pozitivi este mai mare cu atât raza este mai mica.
Razele ionilor negativi sunt mai mari decât razele atomilor. Cu cât sarcina negativa a ionilor negativi este mai mare, raza ionilor este mai mare.
creste VI B creste VIII A
![]()

creste
Energia de ionizare
Una dintre cele mai importante marimi fizice ale atomilor este energia de ionizare. Prin energie de ionizare se întelege energia cheltuita pentru smulgerea unui electron dintr-un atom. Ea se exprima de obicei în electroni volti (eV). Cele mai mici energii de ionizare le au metalele alcaline, deoarece ele pot pierde cel mai usor electronul de pe ultimul strat. Energia de ionizare creste paralel si cu cresterea numarului atomic Z pentru elementele din aceeasi perioada. Aceasta se explica prin cresterea puterii de atractie a electronilor de catre nucleu.
![]()
![]() Ei creste
Ei creste
creste
Afinitatea pentru electroni
Prin afinitate pentru electroni se întelege energia eliberata la alipirea unui electron la un atom, cu formarea unui ion negativ.
Faptul ca atomul neutru poate sa accepte electroni, arata ca nucleul nu are câmpul electric complet saturat si tinde spre o saturare formând ioni negativi prin acceptare de electroni. Stabilitatea ionului negativ astfel format este mult mai mare decât a atomului neutru. Asa se explica de ce ionul de fluor F- este mai stabil ca atomul de fluor, iar anionul OH- este mai stabil decât radicalul OH.
Afinitatea variaza invers cu energia de ionizare:

Proprietati chimice si modul de variatie corelat cu pozitia elementelor în sistemul periodic.
Starea de oxidare
O proprietate periodica este si starea de oxidare (numar de oxidare, treapta de oxidare).
Se întelege prin stare de oxidare o sarcina electrica formala, pozitiva sau negativa ce se atribuie unui element în combinatiile sale. Se atribuie sarcina pozitiva sau negativa în functie de caracterul electropozitiv sau electronegativ al partenerului.
Ca regula, putem spune ca în combinatiile cu elemente mai electronegative decât ele, starile de oxidare maxime ale elementelor din grupele principale, sunt pozitive egale cu numarul grupei din sistemul periodic. În combinatiile lor cu elemente mai electropozitive decât ele, starile de oxidare sunt negative si egale cu 8 - numarul grupei în care se gaseste elementul.
Starea de oxidare reprezinta numai întâmplator sarcina ionului real (de exemplu în Na2S, Na2O, NaCl etc.). Metalele de regula au numar de oxidare pozitiv, iar nemetalele au numar de oxidare si pozitiv si negativ.
Valenta elementelor într-o perioada creste de la stânga spre dreapta.
Electronegativitatea. Electropozitivitate.
Fiecare perioada se termina cu un gaz rar, formând împreuna grupa a VIII-a A. Aceste elemente se caracterizeaza printr-o mare inertie chimica, explicata printr-o structura electronica stabila. Dupa gazele rare urmeaza metalele alcaline care formeaza grupa IA si se caracterizeaza toate prin usurinta de a pierde electronul s, transformându-se într-un ion pozitiv.
Elementele care prezinta o tendinta accentuata de a primi electroni se numesc electronegative, iar cele care pierd usor electronii periferici, se numesc electropozitive.
Caracterul electronegativ creste de la stânga spre dreapta în rândurile orizontale ale sistemului periodic, iar caracterul electropozitiv se atenueaza. De asemenea se constata o scadere a caracterului electronegativ în grupe, de sus în jos. Aceasta înseamna ca cele mai electropozitive elemente se gasesc în stânga jos a sistemului periodic, iar cele mai electronegative în dreapta sus. În grupele din mijlocul sistemului periodic se gasesc elementele care nu au un caracter electropozitiv sau electronegativ pronuntat, ele sunt practic neutre.
Caracterul acido-bazic
Exista un paralelism între electronegativitate si caracterul acid sau bazic. Elementele electropozitive (sau cu electronegativitate mica) formeaza oxizi cu caracter bazic, iar elementele electronegative (sau cu electronegativitate mare) formeaza oxizi cu caracter acid.
Caracterul acid creste în grupa de jos în sus, iar în perioada creste de la stânga la dreapta. Cel mai puternic caracter acid se întâlneste la elementele situate în coltul din dreapta, sus a sistemului periodic.
Caracterul bazic creste în grupa de sus în jos, iar în perioada creste de la dreapta spre stânga. Elementele aflate în coltul din stânga, jos al sistemului periodic au caracterul bazic cel mai pronuntat.
Elementele din grupele secundare nu se supun regulilor de mai sus. Majoritatea elementelor din grupele secundare (tranzitionale) apar în mai multe stari de oxidare.
Punctele de topire si de fierbere
Desfacerea retelei cristaline prin topire depinde de fortele de legatura dintre particulele constituente. Aceste forte depind de caracteristicile particulelor (volum, sarcina electrica, învelis electronic, etc.).
Elementele cu volum atomic mic si valenta mare formeaza cristale în care fortele de legatura sunt foarte mari.
Punctele de topire sunt functie de numarul atomic, Z. În grupele principale, I - IV, temperaturile de topire scad cu cresterea numarului atomic, pe când în grupele IV - VIII principale si în grupele secundare cresc cu numarul atomic. În perioada, temperatura de topire a elementelor creste pâna la grupa a IV-a, apoi, scade. În acelasi mod se comporta si temperatura de fierbere.
PROBLEME REZOLVATE
Problema nr.1
Ordonati urmatoarele elemente în sensul cresterii electronegativitatii lor:
![]()
Se scrie configuratia electronica a elemenetelor si se pozitioneaza în sistemul periodic.
O : 1s2 2s2 2p4 perioada a 2-a, gr. VIA
F : 1s2 2s2 2p5 perioada a 2-a, gr. VIIA
S : 1s2 2s2 2p6 3s2 3p4 perioada a 3-a, gr. VIA
P : 1s2 2s2 2p6 3s2 3p3 perioada a 3-a, gr. VA
Cl : 1s2 2s2 2p6 3s2 3p5 perioada a 3-a, gr. VIIA
Ţinând cont de variatia electronegativitatii elementelor în grupe si perioade, se ordoneaza elementele în sensul cresterii electronegativitatii:
|
|
VA |
VIA |
VIIA |
|
|
F |
||
|
|
|
Cl |
|
P < S < Cl < O < F
Problema nr. 2
Care din elementele urmatoare are energia de ionizare mai mare?
![]()
![]()
Se scrie configuratia electronica a elemenetelor si se pozitioneaza în sistemul periodic.
Na : 1s2 2s2 2p6 3s1 perioada a 3-a, gr.IA
Al : 1s2 2s2 2p6 3s2 3p1 perioada a 3-a, gr. IIIA
K : 1s2 2s2 2p6 3s2 3p6 4s1 perioada a 4-a, gr.IA
Ca: 1s2 2s2 2p6 3s2 3p6 4s2 perioada a 4-a, gr. IIA
Ţinând cont de variatia energiei de ionizare elementelor în grupe si perioade, se ordoneaza elementele în sensul cresterii energiei de ionizare:
gr
|
per. |
IA |
IIA |
IIIA |
||
|
|
Al |
||||
|
K |
Ca | ||||
Al < Ca < Na < K
![]() Problema 3.
Problema 3.
Care dintre metalele Zr (Z=40), V (Z=23) si Ir (Z=77) va avea duritatea mai mare? (Toate metalele cristalizeaza în retea compacta.)
Se scrie configuratia electronica a metalelor si se stabileste numarul de electroni de pe ultimul strat cu care metalul participa la formarea legaturii metalice:
Zr Z=40 1s22s22p63s23p64s23d104p65s24d2 4e-
V Z=23 1s22s22p63s23p64s23d3 5e-
Ir Z=77 1s22s22p63s23p64s23d104p65s24d105p66s24f145d7 9e-
Se ocupa cu electroni banda de valenta pentru a stabili care este gradul de ocupare cu electroni a acesteia.

Duritatea cea mai mare o are V, deoarece el are cel mai mare grad de ocupare cu electroni a benzii de valenta. Urmeaza apoi Zr si Ir.
PROBLEME PROPUSE
1. Sa se discute comparativ proprietatile metalelor: Ti Z = 22; Cr Z = 24; Mo = 42; Mn Z = 25; W Z = 74; Rb Z = 37; Nb Z = 41.
Cu exceptia Rb care cristalizeaza în retea afânata, restul metalelor cristalizeaza în retea compacta.
2. Care din elementele urmatoare are caracterul cel mai metalic?
![]()
![]()
3. Care dintre urmatoarele elemente are raza cea mai mica?
![]()
![]()
![]()
![]()
Aranjati elementele de mai jos în ordinea cresterii energiei de ionizare:
![]()
Se dau elementele chimice A cu numarul atomic Z = 11 si B cu Z = 17. Se cere:
a) valenta metalelor date;
b) pozitia în sistemul periodic.
Ordonati în sensul cresterii temperaturilor de topire urmatoarele metale: Ti Z= 22; Mo Z = 42; Ag Z = 47. Scrieti configuratiile electronice si pozitiile în sistemul periodic al elementelor.
4. CONCENTRAŢIA SOLUŢIILOR
Concentratia unei solutii exprima raportul dintre substanta dizolvata si solutie sau solvent. Exista numeroase moduri de exprimare a concentratiei solutiilor, în functie de unitatile de masura în care se exprima cele doua componente (dizolvatul si solutia sau solventul).
1. Concentratia procentuala
1.1.
Concentratia procentuala de masa: reprezinta cantitatea
de substanta dizolvata, exprimata în grame din
![]() ,
,
ms = md + msolv.
unde: c%m - concentratia procentuala de masa[%] ;
md - masa solutie [g];
ms - masa solutiei [g];
msolv. - masa solventului [g].
1.2.
Concentratia procentuala de volum: exprima numarul de litri de dizolvat
din
 , Vs = Vd
+ Vsolv.
, Vs = Vd
+ Vsolv.
unde: c%v - concentratia procentuala de masa[%] ;
Vd - volumul solutiei [l];
Vs - volumul solutiei [l];
Vsolv. - volumul solventului [l].
Acest mod de exprimare a concentratiei se aplica atunci când componentele solutiei sunt gaze.
1.3. Concentratia procentuala volumetrica: reprezinta grame de solut la 100 ml solutie.
2. Concentratia molara (molaritatea)
- reprezinta numarul de moli de substanta dizolvata într-un litru de solutie.
![]()
unde: m - concentratia molara [mol/l];
Md - masa molara a solvatului [g].
3. Concentratia normala (normalitatea)
- reprezinta numarul de echivalenti-gram de solut dintr-un litru de solutie.
![]()
unde: n - concentratia normala, [val/l];
Ed - echivalentul gram al solutului, [g];
VS - volumul solutiei [l].
4. Concentratia molala (molalitatea)
- este
definita ca fiind moli de solut la
![]()
unde: a - concentratia molala, [moli/1000 g solvent];
Md - masa molara a solutului, [g];
m2 - masa solutului, [g].
5.Fractia molara
Considerând o solutie binara ce contine n1 mol solvent si n2 mol substanta dizolvata, atunci fractiile molare x1 (a solventului) si x2 ( a substantei dizolvate) sunt:
![]()
![]()
unde: x1 + x2 = 1.
6.Titrul solutiei
- reprezinta cantitatea de substanta dizolvata, exprimata în grame, într-un mililitru de solutie.
![]()
unde: T - titrul solutie, [g/ml];
md - masa de substanta , [g];
VS - volumul solutiei, [ml].
Alte relatii utilizate în calcule de concentratii:
|
c |
m |
n |
T |
|
|
c |
|
|
|
|
|
m |
|
- |
|
|
|
n |
|
|
|
|
|
T |
|
|
|
PROBLEME REZOLVATE:
Problema nr.1:
Reactioneaza
NaOH + HCl = NaCl + H2O
MNaOH = 23 + 16 + 1 = 40
MHCl = 1 + 35,5 = 36,5
Pentru NaOH: ![]() g NaOH
g NaOH
Pentru HCl: ![]() g HCl
g HCl
36,5 - 36,5 = 0
Rezulta ca reactia este totala.
Problema nr.2
Se da
![]()
![]() H2SO4
+ Zn ZnSO4 + H2
H2SO4
+ Zn ZnSO4 + H2
AZn = 64
y g H2SO4 ..........13 g Zn
![]() g H2SO4
g H2SO4
![]()
Problema nr.3
Se amesteca doua solutii ale unei substante cu raportul molar: H : S : O = 1 : 16 : 32, astfel:
- 800 cm3 solutie 4% cu ρ = 1025 kg/m3
- 500 cm3 solutie 54% cu ρ = 1435 kg/m3
Despre ce substanta este vorba? Sa se determine concentratia procentuala, molara, normala, molala si titrul solutiei finale.
HxSyOz
![]() H :
H : ![]() H
= 1
H
= 1
![]()
![]() S:
S: ![]() x 2 S = 1 H2SO4 acidul sulfuric
x 2 S = 1 H2SO4 acidul sulfuric
O: ![]() O
= 4
O
= 4
![]()
![]()
Din relatia ![]()
![]() g
g
![]() g
g
![]() g
g
![]() Din relatia
Din relatia ![]()
![]()
![]()
![]() g
g
![]() g
g
![]() g
g

Problema nr.4
Se amesteca:
-
-
-
- 0,25 kmol apa.
Considerând denstitatea solutiei ca fiind aproximativ egala cu 1 g/cm3, sa se exprime concentratia solutiei finale în toate modurile posibile.
![]()
![]()

PROBLEME PROPUSE:
1. Reactioneaza
2. Reactioneaza 500 cm3 solutie H2SO4 51% cu ρ = 1,4 g/cm3 cu 500 cm3 solutie KOH 50% cu ρ = 1500 kg/m3. Sa se arate daca reactia este totala.
3. Se da
4. La neutralizarea a
5.Ce cantitate de substanta este necesara pentru a obtine:
a)
b)
c)
d)
6.S-au
dizolvat
7. Se amesteca doua solutii ale unei substante cu urmatoarea compozitie procentuala: H = 3,06%, P = 31,63%, astfel:
-
-
Despre ce substanta este vorba? Sa se determine concentratia procentuala, molara, normala, molala si titrul solutiei finale.
8. Se amesteca doua solutii ale unei substante cu urmatoarea compozitie procentuala: H = 2.06%, S = 32.65%, astfel:
-
-
Despre ce substanta este vorba? Sa se determine concentratia procentuala, molara, normala, molala si titrul solutiei finale.
9. Se amesteca:
a) 400 cm3 solutie
de HCl
b) 600 cm3 solutie H2SO4
0,5 n cu
Se cere m si n a solutiei finale.
10. Se amesteca:
a)
b)
Se cere c% a solutiei finale.
11. Se amesteca:
a)
b) 500 cm3 solutie H2SO4
11.
12.
14.Se amesteca:
-
-
-
- 0,25 kmol apa.
Sa se exprime concentratia solutiei finale în toate modurile posibile.
5. TERMODINAMICA CHIMICĂ
1. CONSIDERAŢII TEORETICE
O reactie chimica este însotita de un schimb energetic, de cele mai multe ori de caldura. Transferul de caldura se ia în considerare fie la volum constant, fie la presiune constanta. Daca are loc un transfer de caldura la volum constant atunci transferul de caldura este egal cu variatia energiei interne (ΔU). Daca se lucreaza la presiune constanta, atunci schimbul de caldura este egal cu variatia de entalpie (ΔH). În conditii obisnuite, se lucreaza la presiune constanta si ca urmare, se ia în considerare variatia entalpiei, ΔH. Reactiile în care ΔH>0 se numesc endoterme, cele în care ΔH<0, exoterme.
Exista tabele care contin
variatiile entalpiilor în conditii standard. Pentru conditiile
standard, aceste variatii de entalpii se noteaza în mod diferit în
functie de procesul care a avut loc, conform unei conventii.
Daca variatia de entalpie produsa la cantitatile
exprimate de catre ecuatia chimica, se numeste entalpia
standard de reactie si se noteaza cu ![]() . Cu
. Cu ![]() se noteaza
entalpia standard de formare, care reprezinta variatia de entalpie
care însoteste formarea unui mol de substanta în stare
standard din elementele sale componente, tot în stare standard. Entalpiile
standard de formare ale elementelor se considera prin conventie egale
cu zero. Daca însa un element se cunoaste sub mai multe forme,
atunci se considera egala cu zero numai entalpia standard de formare
a structurii stabile în conditii standard (de exemplu în cazul carbonului pentru grafit sau în
cazul sulfului pentru sulful ortorombic).
se noteaza
entalpia standard de formare, care reprezinta variatia de entalpie
care însoteste formarea unui mol de substanta în stare
standard din elementele sale componente, tot în stare standard. Entalpiile
standard de formare ale elementelor se considera prin conventie egale
cu zero. Daca însa un element se cunoaste sub mai multe forme,
atunci se considera egala cu zero numai entalpia standard de formare
a structurii stabile în conditii standard (de exemplu în cazul carbonului pentru grafit sau în
cazul sulfului pentru sulful ortorombic).
Cunoscând entalpiile standard de formare se pot calcula entalpiile standard de reactie.
Legile termochimiei se bazeaza pe conservarea energiei, deci pe primul principiu al termodinamicii.
a) Legea Lavoisir-Laplace (1781)
"Efectul termic al reactiei de descompunere a unei substante în elemente este egal si de semn contrar cu caldura de formare din elemente a substantei".
Exemplu:
![]() ΔH=-6,2
kcal/mol
ΔH=-6,2
kcal/mol
![]() ΔH=+6,2
kcal/mol
ΔH=+6,2
kcal/mol
b) Legea lui Hess (1840) - legea aditivitatii caldurilor de reactie:
"Efectul termic al unei reactii depinde numai de starea initiala si finala a sistemului, adica efectul termic este acelasi, fie ca reactia se desfasoara direct, într-o singura etapa, fie ca are loc în mai multe etape intermediare".
Ecuatiile termochice se pot deci aduna sau scadea ca si ecuatiile algebrice.
Consecintele legii lui Hess
1. "Efectul termic al unei reactii este egal cu diferenta dintre suma caldurilor de formare din elemente ale produsilor de reactie si suma caldurilor de formare ale reactantilor initiali" (se tine seama de coeficientii stoechiometrici ai reactiilor):
![]()
2. "Efectul termic al unei reactii este egal cu diferenta dintre suma caldurilor de combustie a reactantilor si suma caldurilor de combustie a produsilor de reactie" (se tine seama de coeficientii stoechiometrici ai reactiilor):
![]()
Cu ajutorul legii lui Hess se pot calcula caldurile de reactie ale proceselor greu de realizat sau de masurat direct (de exemplu: procese care decurg prea lent pentru a le fi determinat efectul termic).
Mai uzual, consecinta a doua a legii lui Hess se enunta astfel: "caldura de formare din elemente a unei substante se afla scazând caldura ei de ardere din suma caldurilor de ardere ale elementelor componente".
c) Legea lui Kirchhoff
Caldura de reactie este dependenta de temperatura. Legea lui Kirchhoff exprima cantitativ aceasta dependenta.
Coeficientul de temperatura al caldurii de reactie este egal cu diferenta capacitatilor calorice ale sistemului dupa reactie (Cpf) si înainte de reactie (Cpi):
![]()

Aceasta ecuatie permite calcularea caldurii de reactie la orice temperatura.
Daca ΔCp este constant, atunci integrarea între T1=0 si T2=T duce la ecuatia:
![]()
unde ΔH0 este valoarea extrapolata la 0 K a caldurii de reactie.
![]()
![]()
![]()
ΔHT=f(T) este o curba crescatoare sau descrescatoare, care poate avea minim sau maxim, în functie de modul cum se schimba ΔCp cu temperatura.
La proiectarea instalatiilor industriale trebuie sa se aibe în vedere acest lucru pentru dimensionarea corecta a încalzitoarelor sau racitoarelor.
2. PROPBLEME REZOLVATE
2.1. Legea lui Hess
Problema 1
Sa se determine caldura de formare din elemente a ZnSO4 cunoscând efectele termice ale reactiilor de mai jos (în kcal/mol):
ZnS = Zn + Sortorombic ΔH1 = +44,00
![]() ΔH2
= -110,94
ΔH2
= -110,94
![]() ΔH3
= -23,44
ΔH3
= -23,44
![]() ΔH4
=+55,10
ΔH4
=+55,10
Rezolvare
Se rescriu ecuatiile ca mai jos si se aduna:
![]() -ΔH1
-ΔH1
![]() ΔH2
ΔH2
![]() ΔH3
ΔH3
![]() -ΔH4
-ΔH4
![]() ΔHf
ΔHf
ΔHf = -ΔH1 + ΔH2+ ΔH3 + ΔH4 = -233,48 kcal/mol
Problema 2.
Determinati caldura de reactie a procesului:
![]()
daca sunt cunoscute caldurile de formare din elemente ale substantelor:
![]() J/mol
J/mol
![]() J/mol
J/mol
![]() J/mol
J/mol
Rezolvare
Se cunosc deci efectele termice ale reactiilor urmatoare:
![]() ΔH1=
-1,2·106 J/mol
ΔH1=
-1,2·106 J/mol
![]() ΔH2
= -0,394·106 J/mol
ΔH2
= -0,394·106 J/mol
![]() ΔH3
=-0,286·106 J/mol
ΔH3
=-0,286·106 J/mol
care se pot scrie astfel:
![]() ΔH1
ΔH1
![]() - 6ΔH 2
- 6ΔH 2
![]() - 6 ΔH3
- 6 ΔH3
![]()
![]() J/mol
J/mol
Se
ajungea la acelasi rezultat aplicând direct consecinta
![]() J/mol
J/mol
Problema 3.
Sa se calculeze caldura de formare a metanului (care nu poate fi masurata direct):
![]() ΔH= ?
ΔH= ?
Se cunosc efectele termice ale reactiilor urmatoare:
![]() ΔH1 = -94,05 kcal/mol
ΔH1 = -94,05 kcal/mol
![]() ΔH2 = - 68,32 kcal/mol
ΔH2 = - 68,32 kcal/mol
![]() ΔH3
= -212,80 kcal/mol.
ΔH3
= -212,80 kcal/mol.
Rezolvare
Conform consecintei a doua a legii lui Hess, rezulta:
![]() kcal/mol
kcal/mol
Sau, se cunosc efectele termice ale urmatoarelor reactii:
![]() ΔH1
ΔH1
![]() 2 ΔH2
2 ΔH2
![]() -
ΔH3
-
ΔH3
![]() kcal/mol
kcal/mol
Problema 4.
Sa se calculeze caldura de esterificare standard a alcoolului etilic si a acidului acetic:
a) din calduri de ardere;
b) din entalpii de formare.
Se cunosc:
|
Substanta |
ΔHc [kcal/mol] |
ΔHf [kcal/mol] |
|
C2H5OH | ||
|
CH3COOH | ||
|
CH3COOC2H5 | ||
|
H2O |
Rezolvare
Reactia de esterificare este:
![]()
a) ![]()
![]() kcal
kcal
![]() kcal
kcal
![]() kcal
kcal
b) ![]()
![]() kcal
kcal
![]() kcal
kcal
![]() kcal
kcal
Problema 5.
În conditii standard, în reactia:
![]()
Se degaja cantitatea de caldura de 135,28 kcal. Sa se calculeze caldura molara de formare standard a CO2(g), cunoscând caldura de formare standard a CO(g): ΔHf(CO)=-26,41 kcal/mol.
Rezolvare
Caldura de reactie este:
![]()
![]()
![]()
![]() kcal/mol
kcal/mol
2.2. Legea lui Kirchhoff
Problema 1.
Sinteza alcoolului
metilic din gazul de sinteza este însotita de degajarea a 22,1
kcal/mol în conditii normale. Care este entalpia de reactie la
|
Substanta |
Cp [cal/mol] |
|
CO | |
|
H2 | |
|
CH3OH |
2+0,03·T |
Rezolvare
Reactia de sinteza a alcoolului metilic este:
![]()
![]() kcal
kcal
Se cunoaste relatia:

![]()
![]()
![]()
![]()
Δa = 2 - (7 + 2·7) = -19 cal/K
Δb = 0,03 - (0 + 2·0) = 0,03 cal/K2
ΔCp = -19 + 0,03·T
T = 273 + 500 = 773 K
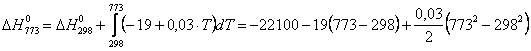 = 23494 cal =
23,494 kcal
= 23494 cal =
23,494 kcal
3. PROBLEME PROPUSE
3.1. Legea lui Hess
1. Sa se calculeze caldura de formare din elemente a Fe2(SO4)3. se cunosc:
![]() ΔH1 = -198,5
kcal/mol
ΔH1 = -198,5
kcal/mol
![]() ΔH2
= -106,0 kcal/mol
ΔH2
= -106,0 kcal/mol
![]() ΔH3 = -136,7 kcal/mol
ΔH3 = -136,7 kcal/mol
2.
În reactia carbidului (CaC2) cu apa în exces rezulta
acetilena si hidroxid de calciu. Calculati caldura de
reactie care apare la obtinerea a
![]() ΔH1 = -14,100 kcal/mol
ΔH1 = -14,100 kcal/mol
![]() ΔH2
= -68,52 kcal/mol
ΔH2
= -68,52 kcal/mol
![]() ΔH3
= +54,8 kcal/mol
ΔH3
= +54,8 kcal/mol
![]() ΔH4 = -238,8 kcal/mol
ΔH4 = -238,8 kcal/mol
3.
Un alcan cu catena normala, a carui caldura de formare
din elemente în conditii standard este ![]() = -1505,3 kcal/mol are caldura de combustie
= -1505,3 kcal/mol are caldura de combustie ![]() = -845,3 kcal/mol. Sa se determine formula alcanului.
= -845,3 kcal/mol. Sa se determine formula alcanului.
Se cunosc:
![]() kcal/mol;
kcal/mol;
![]() kcal/mol.
kcal/mol.
4. În conditii standard în reactia:
![]()
Se degaja cantitatea de caldura de 249,88 kcal. Sa se calculeze caldura molara de formare standard a H2S, cunoscând:
![]() kcal/mol:
kcal/mol:
![]() kcal/mol.
kcal/mol.
5.
Sa se calculeze caldura de reactie standard ![]() (în J si cal) pentru reactia:
(în J si cal) pentru reactia:
![]()
Se dau:
|
Substanta |
|
|
NH3 | |
|
NO | |
|
H2O(g) |
6. Sa se calculeze cantitatea de caldura necesara pentru descompunerea unui kilogram de CaCO3 în CaO si CO2 în conditii standard, stiind ca:
|
Substanta |
|
|
CaCO3 | |
|
CaO | |
|
CO2 |
7.
Sa se calculeze cantitatea de caldura degajata sau
absorbita la neutralizarea completa a
Se dau:
|
Substanta |
|
|
HCl | |
|
NaOH | |
|
NaCl | |
|
H2O |
3.2. Legea lui Kirchhoff
1. Sa se calculeze efectul termic al reactiei:
![]()
la
temperatura de
|
Substanta |
|
|
|
SO3(g) |
8,2 + 10,236·10-3·T |
|
|
SO2(g) |
8,12 + 6,825·10-3·T -2,103·10-6·T2 |
|
|
O2(g) |
6,0954 + 3,2533·10-3·T -10,171·10-7·T2 |
2.
Sa se calculeze cantitatea de caldura necesara la
descompunerea a 1 t de CaCO3 de puritate 60% la temperatura de
|
Substanta |
|
|
|
CaCO3 | ||
|
CaO | ||
|
CO2 |
3. Sa se calculeze variatia de entalpie la încalzirea unui mol de MgO de la 298 K la 1298 K. Se cunoaste:
![]() cal/mol K
cal/mol K
|