CLASA SILICAŢI
14.1 Caractere generale
Si este al doilea element ca abundenta in scoarta terestra dupa O, iar legatura Si-O este mai puternica decât legatura dintre O si oricare alt element. De aceea silicatii sunt constituentii majoritatilor rocilor, participând în proportie de 95% la alcatuirea scoartei terestre.
Legatura Si-O poate fi abordata cu ajutorul modelelor ionic si covalent.
a) Modelul ionic presupune existenta ionilor Si4+ si O2- apropiati prin forte electrostatice nedirectionate. Ionii de O2- au tendinta de a se împacheta compact si de a-si satisface sarcinile negative prin cationi Si4+ si alti cationi pozitionati în interstitiile împachetarii compacte. Acest model ofera o buna aproximare a legaturii Si-O:
- unii silicati prezinta o densitate apropiata de cea a împachetarii compacte, respectând coordinarea cationilor calculata din raportul rcat/ran;
- raportul razelor ionice ale Si4+ si O2- anticipeaza coordinarea tetraedrica a Si de catre O:
![]() (cuprins între 0,225 si 0,414)
(cuprins între 0,225 si 0,414)
Acest model nu poate explica d(Si-O)=1,62Ć (suma razelor ionice este 1,81Ć).
b) Modelul covalent presupune întrepatrunderea orbitalilor atomilor de Si si O. Atomul de Si, cu configuratia stratului de valenta 3s23p2 se hibridizeaza sp3, prezentând 4 orbitali sp3 în configuratie tetraedrica. Un astfel de atom se leaga de patru atomi de O, formând tetraedrul SiO4. Acest model explica:
- configuratia tetraedrica a grupului SiO4;
- unghiul de legatura O-Si-O care este deviat foarte putin de la valoarea ideala a unghiului tetraedric 109ș30'.
Nu poate explica d(Si-O)=1,62Ć (suma razelor covalente 1,81Ć).
Nici unul dintre modele prezentate nu poate explica total legatura Si-O; se accepta în general o legatura intermediara cu 50% ionicitate. Descrierea structurilor silicatilor din acest curs va urmari în general aspecte pur geometrice, neluând în consideratie un model sau altul dintre cele prezentate, astfel încât denumirile de ion/atom se vor folosi arbitrar, fara a lua în considerare particularitati ale legaturii Si-O. Se vor utiliza totusi razele ionice ale cationilor pentru a putea explica substitutiile elementelor în structura.
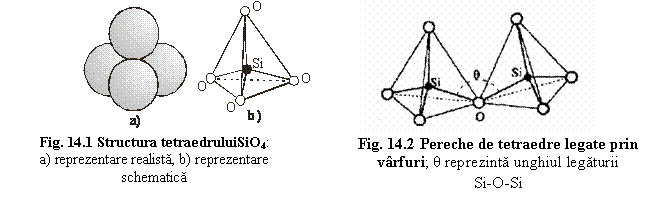
Tetraedrul SiO4. S-a observat faptul ca în toate structurile silicatilor sunt prezente grupuri SiO4, fapt ce a determinat sa fie individualizata o unitate structurala comuna tuturor silicatilor: tetraedrul [SiO4]. Acesta este constituit dintr-un atom central de Si coordinat tetraedric de 4 atomi de O. (fig. 14.1)
Luând în consideratie tetraedrul [SiO4] individual, forma sa este definita de legatura Si-O si de unghiul de legatura O-Si-O. Pentru întelegea structurilor silicatilor este necesar sa vedem cât de rigid este acest tetraedru, adica în ce masura l-ar putea deforma atomii aflati în vecinatatea lui structurala. Dimensiunile tetraedrului SiO4 au fost determinate pentru multe structuri ale silicatilor prin difractie neutronica si de raze X, ajungându-se la urmatoarele concluzii:
1. Cel mai frecvent d(Si-O)= 1,62Ć. Cationii din jurul tetraedrelor atrag si ei atomii de O din vârfurile tetraedrelor, astfel încât pot slabi legaturile Si-O. Rezulta ca va exista o modificare a d(Si-O) care va reflecta taria legaturilor Si-O. Distantele masurate în diferite structu 353e47d ri au aratat ca d(Si-O) = 1,60-1,64Ć, fapt ce demonstreza ca dimensiunea tetraedrului [SiO4] variaza functie de conjunctura sa structurala, dar foarte putin; putem considera astfel tetraedrul [SiO4] comportându-se relativ rigid în cadrul modificarilor structurale.
2. Atunci când doua tetraedre se leaga între ele printr-un atom de O (notat simbolic Oleg), unghiurile si distantele interatomice sunt putin diferite:
- d(Si-Oleg) = d(Si-O) + 0,025Ć,
- unghiul Oleg-Si-O < unghiul O-Si-O.
Aceasta demonstreaza deplasarea atomului de Si din centrul tetraedrului dinspre Oleg datorita repulsiei reciproce a atomilor de Si.
3. Când tetraedrele se leaga prin colturi, unghiul Si-Oleg-Si (notat θ) defineste orientarea relativa a tetraedrelor legate (fig. 14.2). θ = 120-180ș si depinde de vecinatatea tetraedrului, de presiune si temperatura.
Din aceste observatii rezulta faptul ca tetraedrul [SiO4] este relativ rigid, adica sufera modificari neglijabile la variatiile presiunii, temperaturii si a vecinatatii structurale. Tetraedrele [SiO4] legate între ele îsi pot modifica pozitia relativa (θ) pentru a se adapta variatiilor structurale.
Substitutia Si-Al este un proces frecvent la silicati, determinând existenta în structura a tetraedrelor [AlO4] care joaca un rol structural similar tetraedrelor [SiO4]. Dimensiunea tetraedrului [AlO4] este mai mare decât dimensiunea tetraedrului [SiO4] deoarece d(Al-O) = 1,75Ć (>1,62). În cazul în care într-o structura se leaga tetraedre [SiO4] cu tetraedre [AlO4], diferenta lor dimensionala este însotita de o modificare a unghiului θ (unghiul T-Oleg-T, T = Si, Al).
 Masurarea energiei potentiale a legaturilor T-O-T au
aratat faptul ca energia de legatura Al-O-Al > energia
legaturilor Al-O-Si. Rezulta de aici ca perechea de tetraedre
[SiO4]-[AlO4] este mai favorabila energetic decât
perechea [AlO4]- [AlO4]. Concluzia acestor
determinari este aceea ca, într-o succesiune de tetraedre de Al
si Si legate între ele, un tetraedru [AlO4] tinde sa se
lege de un tetraedru [SiO4] si nu de un tetraedru [AlO4].
Acest principiu al "evitarii aluminiului" joaca un rol important în
ordonarea Al si Si în pozitiile tetraedrice la alumosilicati
(ex: feldspati).
Masurarea energiei potentiale a legaturilor T-O-T au
aratat faptul ca energia de legatura Al-O-Al > energia
legaturilor Al-O-Si. Rezulta de aici ca perechea de tetraedre
[SiO4]-[AlO4] este mai favorabila energetic decât
perechea [AlO4]- [AlO4]. Concluzia acestor
determinari este aceea ca, într-o succesiune de tetraedre de Al
si Si legate între ele, un tetraedru [AlO4] tinde sa se
lege de un tetraedru [SiO4] si nu de un tetraedru [AlO4].
Acest principiu al "evitarii aluminiului" joaca un rol important în
ordonarea Al si Si în pozitiile tetraedrice la alumosilicati
(ex: feldspati).
14.2 Clasificarea silicatilor
Tetraedrul [SiO4] reprezinta unitatea structurala de baza a silicatilor. În structurile silicatilor, aceste tetraedre pot fi izolate sau legate între ele, formând scheletul silicatic. Pentru descrierea acestuia vom tine seama de câteva reguli:
- tetraedrele se leaga doar prin colturi;
un atom de O poate fi legat de maximum doi atomi de Si → doua tetraedre îsi pun în comun doar un vârf;
sarcina [SiO4] este 4+.
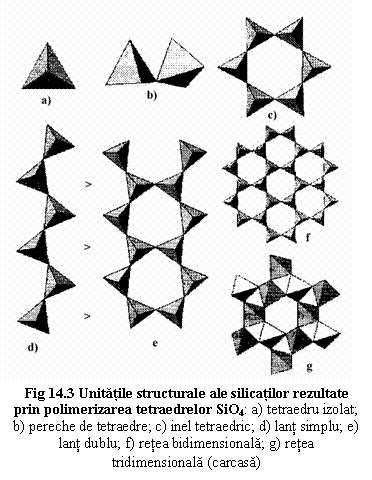
Desi compozitia chimica a silicatilor este foarte complexa, s-au observat doar câteva moduri de combinare (polimerizare) a tetraedrelor [SiO4] pentru a forma scheletul silicatic. Aceste moduri posibile de polimerizare stau la baza clasificarii silicatilor (tab. 14.1, fig. 14.3).
Principalele subclase ale silicatilor vor fi caracterizate prin anumite unitati structurale rezultate din polimerizarea tetraedrelor [SiO4]. Tetraedrul [SiO4] poate fi considerat astfel drept unitatea structurala de baza care încadreaza un mineral în clasa silicati, în timp ce unitatea structurala rezultata prin polimerizarea tetraedrelor încadreaza mineralul în una dintre subclase. Aceasta unitate structurala se reflecta în forma gruparii anionice (raportul Si:O).
Tabel 14.1 Clasificarea silicatilor
|
Subclasa |
Unitati structurale caracteristice (Polimerizarea tetraedrelor) |
Raportul Si:O Gruparea anionica |
Exemple |
|
Nezosilicati (Orthosilicates) |
tetraedre izolate, legate indirect prin intermediul cationilor |
[SiO4]n4n- |
Forsterit Mg2[SiO4] |
|
Sorosilicati (Sorosilicates) |
perechi de tetraedre legate printr -uhn colt |
[Si2O7]n6n- |
Rankinit Ca3[Si2O7] |
|
Nezo-sosrosilicati (Ortho-sorosilicates) |
tetraedre izolate si perechi de tetraedre |
([SiO4][Si2O7])n10n- |
Zoizit Ca2Al2[SiO4][Si2O7] |
|
Ciclosilicati (Ring Silicates) |
inele de tetraedre cel putin trei tetraedre legate prin colturi |
[SiO3]n2n- |
Beril Be3Al2[Si6O18] |
|
Inosilicati (Chain Silicates) a) Piroxeni Piroxenoizi b) Amfiboli |
lanturi tetraedrice infinite: a) simple - tetraedre legate prin câte un vârf b) duble - œ din tetraedre legate prin câte un vârf si œ prin doua vârfuri |
[SiO3]n2n- [Si4O11]n6n- |
Enstatit Mg2Si2O6 Antofilit Mg7[Si4O11]2(OH)4 |
|
Filosilicati (Sheet Silicates) |
retele tetraedrice bidimensionale ← tetraedre legate între ele prin vârfuri |
[Si2O5]n2n- |
Talc Mg6[Si8O20](OH)4 |
|
Tectosilicati (Framework Silicates) |
carcase tetraedrice tridinensionale ← tetraedre legate prin toate colturile |
[SiO2]0 |
Cuart SiO2 |
În tabelul 14.1, gruparile anionice sunt descrise pentru cazul în care toate tetraedrele sunt ocupate de Si. Daca în structura unui silicat exista alaturi de tetraedrele [SiO4] si tetraedre [AlO4], raportul Si:O va fi înlocuit de raportul (Al+Si):O, iar gruparea anionica va contine atât Si cât si Al.
Exemplu: albitul Na[AlSi3O8] se poate scrie Na[Z4O8], unde Z = Al, Si. Rezulta raportul (Al+Si):O=1:2, ceea ce arata apartenenta albitului la subclasa tectosilicati.
La unele minerale, exista Al atât în pozitii tetraedrice, cât si în afara tetraedrelor. Al din afara tetraedrelor se va scrie deci în exteriorul gruparii anionice. Exemplu: muscovit K2Al4[AlSi3O10]2(OH)4.
14.3 Subclasa Nezosilicati
Caractere generale:
- unitatea structurala caracteristica: tetraedrul [SiO4];
- gruparea anionica: [SiO4];
- Al nu substituie Si în pozitiile tetraedrice.
Clasificare Grupa olivinei Forsterit Mg2[SiO4]
Fayalit Fe2[SiO4]
Tefroit Mn2[SiO4]
Grupa zirconului Zircon Zr[SiO4]
Thorit Th[SiO4]
Grupa granatilor Seria piralspitelor Pirop Mg3Al2[SiO4]3
Almandin Fe3Al2[SiO4]3
Spessartin Mn3Al2[SiO4]3
Seria ugranditelor Uvarovit Ca3Cr2[SiO4]3
Grossular Ca3Al2[SiO4]3
Andradit Ca3Fe2[SiO4]3
Grupa topazului Topaz Al2[SiO4](OH, F)2
Grupa silicatilor de Al Sillimanit Al2[SiO4]O
Andaluzit Al2[SiO4]O
Disten Al2[SiO4]O
Grupa staurolitului Staurolit FeAl4[SiO4]2O2(OH)2
Grupa sfenului Sfen CaTi[SiO4](O, OH, F)
14.3.1 Grupa olivinei
Contine minerale cu formula generala: M22+[SiO4] cu Z=4, unde M = Mg, Fe2+, Mn2+, Ca.
Cationii divalenti se pot substitui reciproc în retea, determinând existenta unor solutii solide. Cea mai importanta este solutia solida continua izotipa Forsterit-Fayalit (seria olivinei) (Mg, Fe)2[SiO4] în care Mg si Fe se pot substitui reciproc în orice proportie. Grupul spatial: Pbnm.
Structura mineralelor din seria olivinei este descrisa de arhetipul "forsterit" Mg2[SiO4]. În reprezentarea cu atomi si tetraedre SiO4 (fig. 14.4a) se observa ca tetraedrele [SiO4] formeaza siruri paralele cu axul z si axul x, toate tetraedele unui sir având orientare comuna. Exista doua tipuri de pozitii cationice: M1 - între tetraedele unui sir paralel cu axele z sau x (volum mai mic) si M2 - între sirurile tetraedrice (volum mai mare).
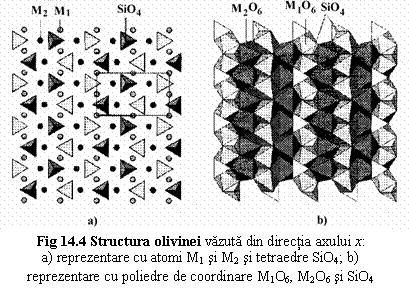 În reprezentarea cu poliedre de coordinare din fig 14.4b:
În reprezentarea cu poliedre de coordinare din fig 14.4b:
- M1 si M2 - coordinate octaedric de 6 atomi de O → octaedre M1O6 si M2O6;
- lanturi de octaedre M1O6 si lanturi de octaedre M2O6 dispuse în directia axului c → legatura octaedrelor prin muchii;
- cele doua tipuri de lanturi se leaga între ele prin muchiile octaedrelor componente;
- tetraedrele SiO4 sunt pozitionate între lanturile octaedrice, fiind legate de acestea prin muchii si vârfuri;
- octaedrele M2O6 au dimensiuni mai mari si sunt deformate.
Celula elementara: a0 = 4,756Ć, bo = 10,195Ć, c0 = 5,881Ć
Influenta variatiei temperaturii, presiunii si compozitiei asupra structurii forsteritului
Cresterea temperaturii determina cresterea volumelor octaedrelor de coordinare (tetraedrele SiO4 sunt relativ rigide).
Cresterea presiunii determina scaderea volumelor octaedrelor de coordinare.
Natura cationului. Daca în structura forsteritului se substituie o parte din Mg cu
Fe2+, diferenta lor dimensionala minima (![]() Ć;
Ć; ![]() Ć) va determina distributia statistica în
pozitiile cationice M1 si M2, rezultând astfel
o structura dezordonata. Astfel exista posibilitatea
substitutiei nelimitate Mg-Fe si în consecinta formarea
unei solutii solide continue între forsterit si fayalit (seria
olivinei). Toti termenii acestei serii vor prezenta structura de tip
forsterit; parametrii celulei elementare si distantele interatomice
vor varia cu compozitia.
Ć) va determina distributia statistica în
pozitiile cationice M1 si M2, rezultând astfel
o structura dezordonata. Astfel exista posibilitatea
substitutiei nelimitate Mg-Fe si în consecinta formarea
unei solutii solide continue între forsterit si fayalit (seria
olivinei). Toti termenii acestei serii vor prezenta structura de tip
forsterit; parametrii celulei elementare si distantele interatomice
vor varia cu compozitia.
Daca
în acest tip de structura se substituie o parte din Mg cu Ca (![]() Ć, mult mai mare), cei doi cationi vor tinde sa ocupe
pozitii specifice: Mg pozitiile M1 (volum mai mic), iar Ca
pozitiile M2 (volum mai mare). Aceasta distributie va
determina ordonarea structurii si implicit scaderea simetriei. Mineralul
rezultat: monticellit CaMg[SiO4]
Ć, mult mai mare), cei doi cationi vor tinde sa ocupe
pozitii specifice: Mg pozitiile M1 (volum mai mic), iar Ca
pozitiile M2 (volum mai mare). Aceasta distributie va
determina ordonarea structurii si implicit scaderea simetriei. Mineralul
rezultat: monticellit CaMg[SiO4]
 Chimism si geneza
Chimism si geneza
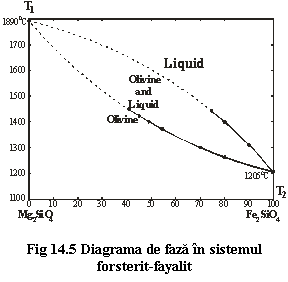
Formarea olivinei prin procesul de cristalizare magmatica poate fi examinata în cadrul sistemelor forsterit-fayalit si forsterit-silice.
1. Sistemul binar forsterit (Fo) - fayalit (Fa) (fig. 14.5). Termenul de temperatura ridicata este forsteritul (1890șC) si cel de temperatura joasa este fayalitul (1205șC).
Cristalizarea pentru un termen cu compozitie intermediara se produce într-un interval de temperatura T1-T2. Când, la scaderea temperaturii, este atinsa curba liquidus, primele cristale care se formeaza dintr-o topitura A au compozitie mai bogata în Mg decât compozitia de la care s-a plecat, si anume o compozitie A'. Daca temperatura scade lent de la T1 la T2, procesul de cristalizare are loc la echilibru si, cristalele mai bogate în Fo care se formeaza au timp sa reactioneze prin schimb de ioni cu topitura mai saraca în Mg (sistemul nu are schimb de substanta cu exteriorul). În finalul cristalizarii compozitia cristalelor ca si cea a topiturii se apropie de cea a topiturii initiale A. Daca însa racirea se produce rapid, schimbul de ioni cristal-topitura nu mai este posibil si cristalele formate vor prezenta zonalitati, cu nucleul mai bogat în Fo si periferia mai bogata în Fa.
2. Sistemul forsterit-silice (fig. 14.6) este un exemplu de sistem eutectic cu compus incongruent. Daca initial compozitia topiturii este saturata în silice, la începutul procesului de cristalizare primele cristale vor fi cele de forsterit. La o anumita temperatura acestea vor reactiona cu topitura conform reactiei:
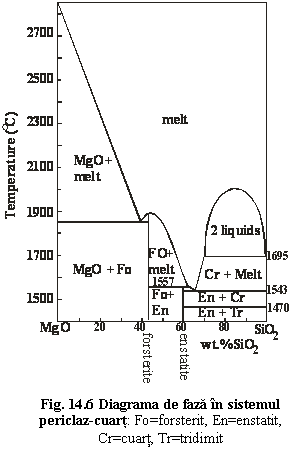 Mg2[SiO4] + SiO2 = 2Mg[SiO3]
Mg2[SiO4] + SiO2 = 2Mg[SiO3]
forsterit silice enstatit
fig 14.5+14.6
În functie de cantitatea totala de silice aflata în sistem, forsteritul se poate consuma în reactie partial sau total, astfel încât în final asociatia minerala va fi alcatuita din: forsterit+enstatit, enstatit sau enstatit+silice. Ca rezultat direct al acestui proces de cristalizare este incompatibilitatea chimica dintre olivina si cuart. Olivinele pot fi deci întâlnite exclusiv în roci subsaturate în silice (lipsite de cuart).
Proprietati fizice. Habitusul este prismatic
tabular. Structura compacta determina duritatea ridicata (6 œ), si clivajul slab dupa ![]() si
si ![]() . Chimismul variabil determina variatia greutatii specifice si a indicilor de refractie care cresc
cu continutul de Fe.
. Chimismul variabil determina variatia greutatii specifice si a indicilor de refractie care cresc
cu continutul de Fe.
Transformari
Un prim tip de transformari suferite de olivine au loc chiar la începutul cristalizarii magmatice. Asa cum s-a aratat, olivina reactioneaza cu topitura, formând piroxenul feromagnezian, enstatitul. Sunt cunoscute structurile de reactie "înghetate"-cristale de olivina cu coroana de piroxen sau relicte de olivina în piroxen, cristale izolate de olivina, cu aspect tipic de "sâmbure de maslina", corodate de magma.
Un al doilea tip de transformari se desfasoara ca efect al influentei fluidelor hidrotermale. De exemplu, forsteritul poate reactiona cu apa cu formare de serpentine:
Mg2[SiO4] + 3H2O = Mg3[Si2O5](OH)4 + Mg(OH)2
forsterit apa serpentina brucit
Fierul aflat în compozitia olivinei este eliberat în urma unei astfel de reactii si fixat sub forma de oxizi de fier. Sunt cunoscute structurile celulare ale serpentinitelor, roci formate pe seama unor roci initial bogate în olivina, în care serpentina pseudomorfozeaza cristalele granulare de olivina, iar piroxenii de fier se plaseaza la limita dintre cristale sau pe fisurile acestora.
14.3.2 Grupa granatilor
Formula generala: A32+B23+[SiO4]3, cu Z=8 A2+: Ca, Mg, Fe, Mn;
B3+: Al, Fe, Cr
Contine minerale izotipe Ia3d
Clasificare: seria piralspitelor pirop Mg3Al2[SiO4]3
(B=Al) almandin Fe3Al2[SiO4]3
spassartin Mn3Al2[SiO4]3
seria ugranditelor uvarovit Ca3Cr2[SiO4]3
(A=Ca) grossular Ca3Al2[SiO4]3
andradit Ca3Fe2[SiO4]3
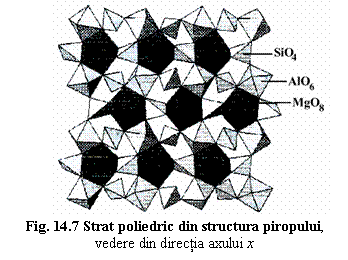 Structura este descrisa de arhetipul "pirop" Mg3Al2[SiO4]3.
Într-o reprezentare cu poliedre de coordinare (fig.14.7) se poate observa ca Mg este
coordinat de 8 atomi de O, rezultând un poliedru numit dodecaedru trigonal MgO8,
iar Al este coordinat octaedric de 6 atoni de O.
Structura este descrisa de arhetipul "pirop" Mg3Al2[SiO4]3.
Într-o reprezentare cu poliedre de coordinare (fig.14.7) se poate observa ca Mg este
coordinat de 8 atomi de O, rezultând un poliedru numit dodecaedru trigonal MgO8,
iar Al este coordinat octaedric de 6 atoni de O.
Structura vazuta din directia axului 4: lanturi formate din octaedre SiO4 si octaedre AlO6 legate prin vârfuri, orientate în directia axelor 4 → un edificiu poliedric tridimensional în spatiile caruia sunt pozitionate dodecaedrele trigonale MgO8 legate prin muchii de tetraedre si octaedre.
Celula elementara: a0 =
Influenta variatiei temperaturii, presiunii si compozitiei asupra structurii piropului
Cresterea volumelor octaedrice si dodecaedrice ca urmare a cresterii temperaturii sau a razelor cationice care determina rotatia relativa a tetraedrelor [SiO4]. Cu cât cresterea acestor volume este mai mare, cu atât rotatia tetraedrelor va fi mai mare.
 Daca într-un granat cu structura piropului coexista Ca cu
cationi de raze mai mici (Mg, Fe, Mn), se manifesta tendinta de
ordonare structurala: Ca va ocupa pozitii dodecaedrice cu volum mai
mare. La anumite procente de substitutie scade simetria
(tetragonala), aceasta putând explica unele dintre anomaliile optice
(anizotropie) observate la granati.
Daca într-un granat cu structura piropului coexista Ca cu
cationi de raze mai mici (Mg, Fe, Mn), se manifesta tendinta de
ordonare structurala: Ca va ocupa pozitii dodecaedrice cu volum mai
mare. La anumite procente de substitutie scade simetria
(tetragonala), aceasta putând explica unele dintre anomaliile optice
(anizotropie) observate la granati.
Chimism
Proprietati fizice.
Habitusul este izometric, iar trachtul
este dominat de dodecaedrul romboidal ![]() si/sau trapezoedru
si/sau trapezoedru
![]() . Duritatea este
ridicata, clivajul
lipseste, iar greutatea
specifica este ridicata. Culoarea
la granatii piralspitici este pe diferite tonuri de rosu, iar la cei
granditici pe tonuri galben-brun-verzui. Uvarovitul are culoarea specifica
verde stralucitor. Când sunt transparenti, nefisurati si
nealterati, granatii pot fi întrebuintati ca pietre
pretioase.
. Duritatea este
ridicata, clivajul
lipseste, iar greutatea
specifica este ridicata. Culoarea
la granatii piralspitici este pe diferite tonuri de rosu, iar la cei
granditici pe tonuri galben-brun-verzui. Uvarovitul are culoarea specifica
verde stralucitor. Când sunt transparenti, nefisurati si
nealterati, granatii pot fi întrebuintati ca pietre
pretioase.
14.3.3 Grupa silicatilor de Al
Cuprinde trei minerale cu formula chimico-structurala Al2O[SiO4] cu Z=4
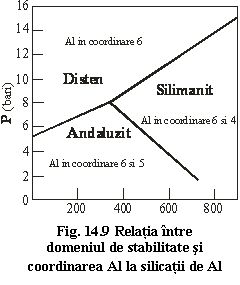 Sillimanit Pbnm
Sillimanit Pbnm
Andaluzit Pnnm
Disten (kyanit) P![]()
Structura si stabilitate (vezi polimorfism)
Proprietati fizice. Habitusul este lung
prismatic, pâna la acicular (sillimanit), cu un tracht dominat de fete de prisma si pinacoid. Clivajul este bun dupa ![]() la sillimanit, bun
dupa
la sillimanit, bun
dupa ![]() si slab dupa
si slab dupa
![]() la andaluzit si
perfect dupa
la andaluzit si
perfect dupa ![]() , bun dupa
, bun dupa ![]() si distinct
dupa
si distinct
dupa ![]() la disten. Duritatea este cuprinsa între 6œ
si 7œ la andaluzit si silimanit. La disten se distinge o
variatie destul de mare a duritatii pe fata (100): 4-5
paralel cu axul z si 6-7 paralel
cu axul y. Culoarea este cenusiu deschisa la silimanit,
variabila la andaluzit (incolor, cenusiu, galben, roz, rosu,
verde) si albastru la disten.
la disten. Duritatea este cuprinsa între 6œ
si 7œ la andaluzit si silimanit. La disten se distinge o
variatie destul de mare a duritatii pe fata (100): 4-5
paralel cu axul z si 6-7 paralel
cu axul y. Culoarea este cenusiu deschisa la silimanit,
variabila la andaluzit (incolor, cenusiu, galben, roz, rosu,
verde) si albastru la disten.
14.4 Subclasa Sorosolicati
Soros (gr.) = adunare, pereche (sorosilicates, disilicates)
Si:O = 2:7 → [Si2O7]6- grupari suplimentare (OH), molecule H2O
Hemimorfit Zn4[Si2O7](OH)2·H2O Imm2
Lawsonit CaAl2[Si2O7](OH)2·H2O C2221
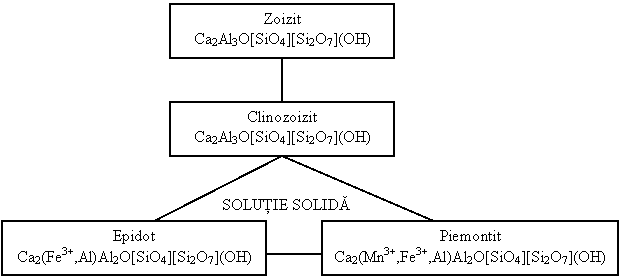
14.5 Subclasa Nezo-sorosilicati
([SiO4] [Si2O7])10-
Zoizit Ca2Al3O[SiO4][Si2O7](OH) Pnma
Grupa epidotului
Clinozoizit Ca2Al3O[SiO4][Si2O7](OH) P21/m
Epidot Ca2(Fe3+,Al)Al2O[SiO4][Si2O7](OH) P21/m
Piemontit Ca2(Mn3+,Fe3+,Al)Al2O[SiO4][Si2O7](OH) P21/m
14.6 Subclasa Ciclosilicati
Kyklos (gr.) = cerc;
Ringsilicates, ring = cerc
Polimerizarea tetraedrelor → inele cu numar diferit de tetraedre.
Si:O = 1:3 → [SiO3]n2n-, combinatii posibile n=3 Benitoit BaTi[Si3O9]
n=4 Papagoit Ca2Cu2Al2Si2O12(OH)6 - rar
n=6 - mai frecvent
Beril Be3Al2[Si6O18] P6/mcc
Indialit (Mg, Fe)2Al3[AlSi5O18]·nH2O P6/mcc
(distributie dezordonata a Al si Si în pozitiile tetraedrice)
Cordierit (Mg, Fe)2Al4Si5O18·nH2O Cccm
(distributie ordonata a Al si Si în pozitiile tetraedrice)
Sunt considerati tectosilicati cu formula chimico-structurala (Mg, Fe)2[Al4Si5O18] deoarece Al apare doar în coordinare tetraedrica (pozitia T).
Raportul T:O=(4+5):18=1:2 → [TO2]9
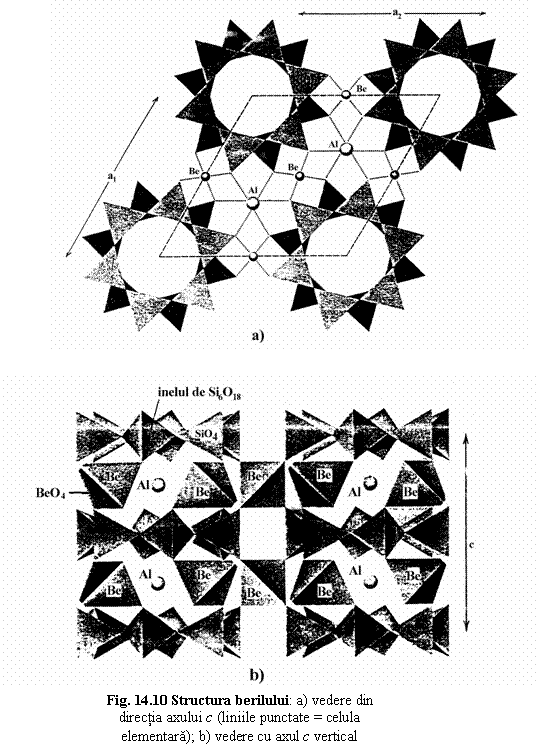
Beril Be3Al2[Si6O18]
[SiO3]6
coordinarea BeO4- octaedre
AlO6- tetraedre
Inelele
[Si6O18] → strate paralele cu![]()
Între aceste strate se intercaleaza strate de atomi de Be si Al, în directia axului c alternanta de inele SiO6 si poliedre cationice BeO4 si AlO6.
Vazute din directia axului c, inelele din strate diferite au centrele dispuse pe un ax de ordinul 6 → sistem hexagonal P6/mcc.
Aceasta dispozitie arata existenta unor canale paralele cu axul c care pot fi ocupate cu ioni, atomi sau molecule neutre: (OH)-, H2O, F, He, Rb, Cs, Na, rezultând substitutii interstitiale (vezi solutii solide).
Proprietati fizice: tracht ![]() ,
, ![]() ; clivaj slab
; clivaj slab ![]() →
alternanta stratelor de atomi, legaturi mai slabe; culoarea
variabila: aquamarin-verde; margarit-roz deschis-închis; smarald-verde
închis, transparent; beril auriu-galben auriu; (pietre pretioase, duritate
ridicata 71/2 - 8).
→
alternanta stratelor de atomi, legaturi mai slabe; culoarea
variabila: aquamarin-verde; margarit-roz deschis-închis; smarald-verde
închis, transparent; beril auriu-galben auriu; (pietre pretioase, duritate
ridicata 71/2 - 8).
Geneza: pegmatite si granite de obicei → aluviuni
Ocurenta în România: pegmatite (Razoare, Mas. Gilau).
Cordierit (Mg, Fe)2Al4Si5O18·nH2O
Mg, Fe - pozitia Al de la beril → coordinare 6 (octaedrica)
Al - pozitia Be de la beril → coordinare 4 (tetraedrica)
- substituie Si din inel → coordinare 4 (tetraedrica)
Inelele tetraedrice sunt ocupate de Al si Si → [AlSi5O18]·nH2O → (Mg, Fe)2Al3[AlSi5O18]·nH2O
[AlSi5O18] → Al:Si = 1:5
Distributia dezordonata a Al si Si în inele arata o simetrie asemanatoare berilului, P6/mcc, modificari de temperatura ridicata: indialit.
Ordonarea Al si Si duce la scaderea simetriei: Cccm (cordierit de temperatura scazuta).
H2O ocupa canale paralele cu axul c.
Deoarece Al are coordinare 4, (Mg, Fe)2Al4Si5O18·nH2O, 9:18 = 1:2 → tectosilicati (tetraedre legate prin toate colturile)
Geneza: roci metamorfice de contact (corneene), metamorfism regional orogenic (Mg, Fe, Al, Si).
Turmalina (Na, Ca)(Li, Mg, Al)3 (Al, Fe3+, Mn)6 (BO3)3[AlSi5O18](OH, F)4
- inele hexagonale
- interventia celor 3 grupari (BO3) → scaderea simetriei R3m.
Proprietati
fizice: tracht ![]() ; culoarea depinde de chimism: schörl-neagra (Fe)- cea
mai comuna; dravit-bruna (Mg); rare- cu Li elbait (Na) si
liddicoatit (Ca), colorate deschis; foarte rara, incolora-adroit,
pietre pretioase: roz-rubinit, albastru- indicolit (duritatea 7-7 œ).
; culoarea depinde de chimism: schörl-neagra (Fe)- cea
mai comuna; dravit-bruna (Mg); rare- cu Li elbait (Na) si
liddicoatit (Ca), colorate deschis; foarte rara, incolora-adroit,
pietre pretioase: roz-rubinit, albastru- indicolit (duritatea 7-7 œ).
Geneza: pegmatite granitice (neagra), roci magmatice si metamorfice (mineral accesoriu), aluviuni.
Ocurenta în România: pegmatite: Razoare, M-tii Lotrului, Retezat, Mehedinti, Semenic, M-tele Mare; roci metamorfice: M-tii Fagaras, Cibin, Parâng, Semenic, Macin; roci magmatice: Turcoaia, Ditrau.
14.7 Subclasa Inosilicati
Polimerizarea tetraedrelor [TO4] determina formarea unor lanturi tetraedrice infinite simple sau duble.
14.7.1 Inosilicati cu lanturi simple
Polimerizarea tetraedrelor [TO4] (T=Si, Al): orice tetraedru are doi atomi de O legati la alte doua tetraedre si doi atomi de O neimplicati în legaturile tetraedrice. Lanturile tetraedrice simple se leaga lateral prin cationi în coordinare 6 sau 8. Flexibilitatea lanturilor simple asigura o configuratie geometrica stabila pentru o gama larga de cationi si pentru un domeniu larg de presiune si temperatura.
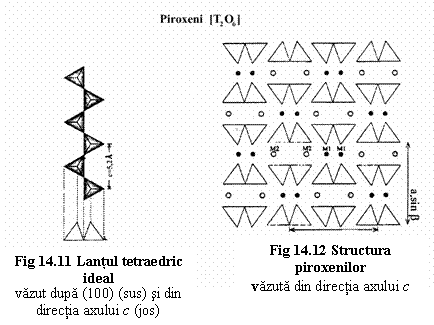
Lantul simplu este definit de unitatea de periodicitate (numarul minim de tetraedre din unitatea asimetrica care genereaza lantul prin translatie) (fig.14.18) care poate fi:
2 → grupul piroxenilor;
>2 → grupul piroxenoizilor.
14.7.1.1 Piroxenii
Formula generala M2M1[(Si, Al)2O6] (M2 si M1 - pozitiile cationice din structura)
Caractere structurale
Lantul tetraedric este orientat paralel cu axul c ; unitatea de periodicitate a lantului este 2 → raportul T:O=2:6 → gruparea anionica [T2O6] cu cazul particular [Si2O6]4- pentru T=Si. Parametrul c0 al celulei elementare este dat de lungimea a doua tetraedre: ~5,2Ć pentru toti piroxenii. În structura idealizata a piroxenilor (fig. 14.11) se poate observa ca tetraedrele au vârfirile orientate în acelasi sens.
Structura ideala a piroxenilor vazuta din directia axului c : lanturile alaturate au vârfurile tetraedrelor orientate în sens opus în directiile axelor a si b; cationii ocupa doua pozitii specifice:
 -M1 - între vârfurile tetraedrelor din doua laturi alaturate în
directia axului a;
-M1 - între vârfurile tetraedrelor din doua laturi alaturate în
directia axului a;
- volume mai mici;
- coordinare octaedrica (6);
-M2 - între bazele tetraedrelor din doua laturi alaturate în directia axului a;
- volume mai mari;
- coordinare octaedrica (6) sau dodecaedric trigonala (8).
Octaedrele cationice se leaga între ele prin muchii formând lanturi orientate în directia axului c acestea fac legatura dintre lanturile tetraedrice.
Exemplu: structura jadeitului NaAl[Si2O6]: Na (pozitia M2) si Al (pozitia M1) în coordinare 6, octaedrica → lanturi octaedrice M1O6 paralele cu axul c în care se pozitioneaza octaedrele M2O6. (fig. 14.13)
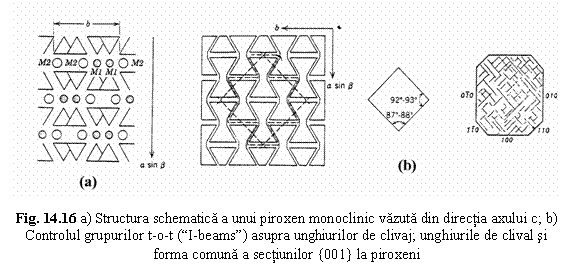
Adaptarea structurii piroxenilor la modificarile de T, P si compozitie. Configuratia lantului tetraedric depinde de volumele poliedrelor cationice M1. Acestea cresc cu cresterea razei cationilor care le ocupa, cu cresterea temperaturii si scaderea presiunii. La crestea volumelor octaedrelor, pentru mentinerea legaturilor dintre tetraedre si octaedre, lantul tetraedric se întinde. La scaderea volumelor octaedrelor, lantul tetraedric se "muleaza" dupa lantul octaedric, micsorându-si lungimea. Aceasta adaptare se realizeaza prin rotirea relativa a tetraedrelor vecine, mentinându-se periodicitatea 2; rezulta astfel lanturi rotite tip O (prin rotirea convergenta a tetraedrelor vecine) sau lanturi rotite tip S (prin rotirea divergenta a tetraedrelor vecine) ( fig.14.14). Aceasta calitate a lantului tetraedric de a se adapta modificarilor de volum ale poliedrelor cationice face posibila stabilitatea structurii piroxenilor într-un domeniu larg de presiune, temperatura si compozitie.

Modelul structural descris cu grupuri t-o-t (module I). Legaturile cele mai puternice dintre lanturile tetraedrice se realizeaza prin intermediul cationilor M1. Se poate defini astfel un grup structural t-o-t format din doua lanturi tetraedrice legate prin cationi M1 (fig. 14.15) ce se mai numeste modulul I datorita asemanarii cu litera I. Reprezentarea structurilor piroxenilor folosind aceste module structurale (fig. 14.16) permite comparatii structurale între diferiti piroxeni si între piroxeni si alte grupe de minerale (amfiboli, filosilicati).
Clasificare dupa simetrie
piroxeni monoclinici (clinopiroxeni) C2/c sau P21c
- piroxeni rombici (ortopiroxeni) Pbca
Chimism
Ocuparea pozitiilor M1 si M2:
- cationi cu raze mari: Li, Na, Ca; coordinare 6 sau 8; M2
- cationi cu raze medii si mici: Mg, Fe2+, Mn2+ (M2 + M1), Fe3+, Al3+, Ti4+ (M1); coordinare 6; M1 si M2
Termeni importanti din grupa piroxenilor
 M2=Li; M1=Al → Spodumen LiAl[Si2O6] C2/c
M2=Li; M1=Al → Spodumen LiAl[Si2O6] C2/c
M2=Na; M1=Al → Jadeit NaAl[Si2O6] C2/c
M1=Fe3+ → Egirin NaAl[Si2O6] C2/c
M2=Ca; M1=Mg → Diopsid CaMg[Si2O6] C2/c
M1=Fe2+ → Hedenbergit CaFe[Si2O6] C2/c
M1=Mn → Johannnsenit CaMn[Si2O6] C2/c
M2=M1=Mg → Enstatit Mg2[Si2O6] Pbca Piroxeni de Mg si Fe

Solutii solide:
Augit (Ca, Na)(Mg, Fe2+, Fe3+, Ti4+, Al)[(Si, Al)2O6] C2/c
Pigeonit (Mg, Fe2+, Ca,)(Mg, Fe2+)[Si2O6] P21/c
14.7.1.2 Piroxenoizii
Formula generala: M2+[SiO3]; M=Ca, Fe, Mn; sistemul de cristalizare triclinic (diferite grupuri spatiale).
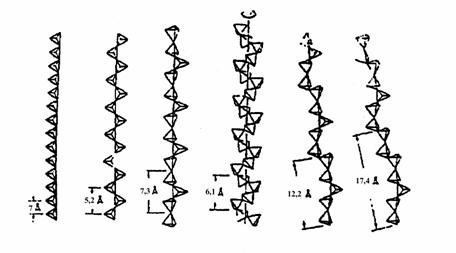
Structura. Lantul tetraedric are periodicitate >2: 3, 4, 5, 7 (fig. 14.18). Raportul Si:O=1:3 → gruparea anionica [SiO3]2-. Cationii se afla în coordinare 6 (octaedrica). Octaedrele formeaza lanturi (legatura prin muchii) orientate în aceeasi directie cu lanturile tetraedrice.

Chimism (fig. 14.19)

Minerale mai importante:
Wollastonit Ca[SiO3]
Ferosilit III Fe[SiO3]
Rodonit, Piroxmangit (Mn, Fe, Ca)[SiO3]
Piroxferroit (Fe, Mn, Ca)SiO3
Ferrobustamit (Fe, Ca, Mn)SiO3
Bustamit Fe)SiO3
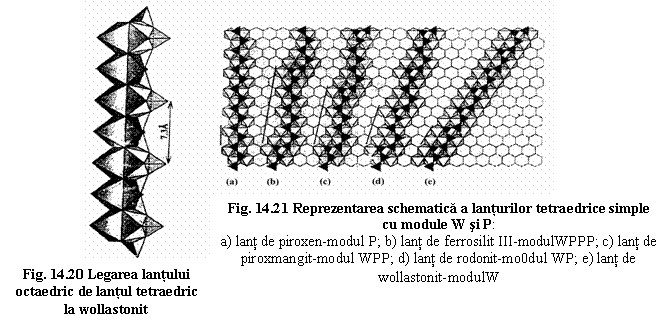
Polisomatismul lantului tetraedric. Lanturile tetraedrice ale piroxenoizilor se pot descrie pornind de la doua tipuri de module structurale:
- modulul W dat de cele 3 tetraedre din unitatea de periodicitate a lantului de tip wollastonit;
- modulul P dat de cele doua tetraedre din unitatea de periodicitate a lantului de tip piroxen.
Combinarea diferita a acestor module W si P, numita polisomatism genereaza lanturile piroxenoizilor caracterizate prin urmatoarele succesiuni de module:
- succesiunea WWW. periodicitate 3 wollastonit
- succesiunea WPWP. periodicitate 5 (3+2) rodonit
- succesiunea WPPWPP. periodicitate 5 (3+2+2) piroxmangit
- succesiunea WPPPWPPP. periodicitate 5 (3+2+2+2) ferosilit III
Influenta structurii asupra stabilitatii P-T a piroxenoizilor. Descrierea lanturilor tetradrice prin module W si P ajuta la explicarea influentei cresterii volumelor octaedrice asupra configuratiei lantului tetraedric, aplicând urmatoarele reguli:
modulele W se acomodeaza mai bine unor volume octaedrice mari (cationi mari, temperaturi ridicate si presiuni scazute);
- modulele P se acomodeaza mai bine unor volume octaedrice mici (cationi mici, temperaturi scazute si presiuni ridicate).
Rezulta astfel ca piroxenoizii la care predomina modulele W vor fi stabili la temperaturi ridicate si presiuni scazute si vor prefera cationi cu dimensiuni mari, iar piroxenoizii la care predomina modulele P vor fi stabili la presiuni ridicate si temperaturi scazute si vor prefera cationi cu dimensiuni mai scazute.
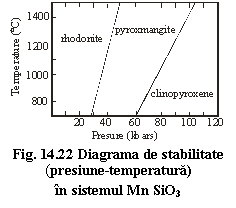 Diagrama de stabilitate P-T (fig. 14.22) confirma aceasta relatie:
frecventa modulelor P creste de la rodonit la clinopiroxen, astfel
încât presiunea de stabilitate creste.
Diagrama de stabilitate P-T (fig. 14.22) confirma aceasta relatie:
frecventa modulelor P creste de la rodonit la clinopiroxen, astfel
încât presiunea de stabilitate creste.
De asemenea, ocurenta piroxenoizilor poate fi explicata prin structura: wollastonitul se formeaza în roci de temperaturi ridicate si presiuni scazute (skarne), în timp ce rodonitul si piroxmangitul sunt caracteristice unor roci de presiuni mai ridicate, formate prin procese de metamorfism regional.
Proprietati fizice. Orientarea lanturilor în directia axului z → habitus prismatic. Legaturile slabe dintre modulele I
determina un clivaj bun
dupa fetele de prisma (![]() la cei mai multi piroxeni) cu unghiul dintre plane de
aproximativ 90ș. Culoarea si greutatea
specifica variaza cu chimismul
la cei mai multi piroxeni) cu unghiul dintre plane de
aproximativ 90ș. Culoarea si greutatea
specifica variaza cu chimismul
14.7.2 Inosilicati cu lanturi duble
Amfibolii
Caractere structurale (fig. 14.23)
Lantul dublu tetraedric poate fi vazut ca fiind format din doua lanturi simple de tip piroxen unite prin vârfurile tetraedrelor dupa un plan de reflexie care se mentine si daca lanturile simple sunt torsionate; tetraedrele care formeaza lantul dublu au vârfurile orientate în acelasi sens. Aceste lanturi sunt dezvoltate în directia axului z, astfel încât parametrul c0 al celulei elementare este dat de unitatea de periodicitate 2 a lanturilor simple si valoarea acestuia este similara cu cea de la piroxeni (~ 5,2Ć).
Raportul T:O=4:11 → gruparea anionica [T4O11], T=Al, Si; [Si4O11]6- pentru T=Si.
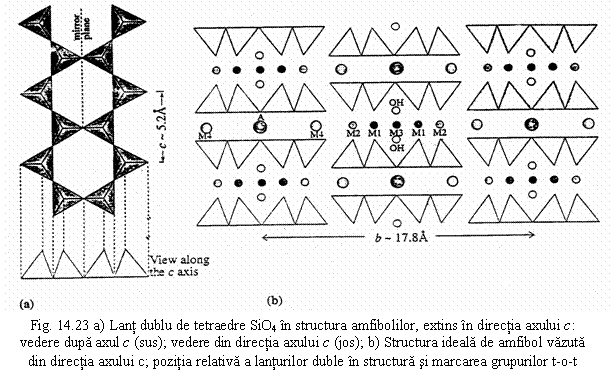
Configuratia lantului este determinata ca si la piroxeni de volumele poliedrelor cationice, iar adaptarea dimensionala se face în acest caz prin rotirea individuala a tetraedrelor care implica modificarea lungimii lantului.
Într-o reprezentare idealizata a structurii se observa ca lanturile alaturate au vârfurile orientate în sensuri opuse în directia axelor a si b si exista anumite pozitii structurale pe care le vom prezenta comparativ cu piroxenii:
- M4 - între bazele tetraedrelor din lanturi adiacente;
- echivalenta cu pozitia M2 de la piroxeni;
- M1, M2, M3 - între vârfurile tetraedrelor din lanturi adiacente;
- echivalente cu pozitia M1 de la piroxeni; spatiul suplimentar creat de lantul dublu determina triplarea acestei pozitii;
- A ← spatiul suplimentar creat de lantul dublu;
- între bazele tetraedrelor din lanturi adiacente, pe directia axului de simetrie al inelului hexagonal al lanturilor;
- poate fi vacanta, partial sau total ocupata;
- suplimentar fata de piroxeni apare gruparea (OH)- pozitionata în centrul inelelor hexagonale ale lanturilor tetraedrice la nivelul vârfurilor tetraedrelor; aceasta pozitie poate fi ocupata si de F-.

Exemplu structura unui amfibol monoclinic C2/m: pozitiile M1, M2, M3 în coordinare 6 (octaedrica), pozitiile M4 în coordinare 8 (dodecaedre trigonale), pozitia A în coordinare 10 (poliedre complexe, nereprezentate în figura).
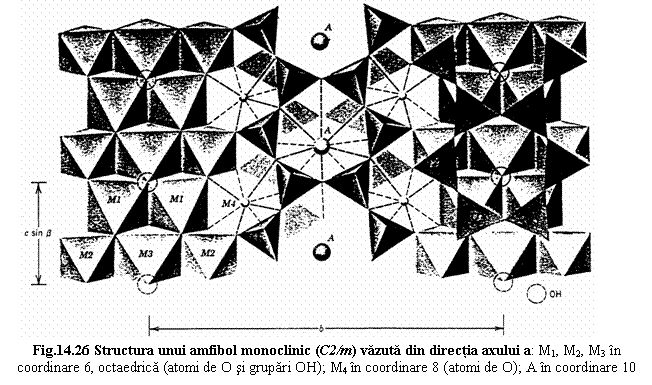
Modelul structural descris cu grupuri t-o-t (module I). Ca si la piroxeni, legaturile cele mai puternice dintre lanturile tetraedrice se realizeaza prin intermediul cationilor M1, M2, M3, astfel încât se poate defini un modul I dublu fata de piroxeni.
Clasificare dupa simetrie:
- amfiboli monoclinici (clinoamfiboli) C2/m sau P21/m
- amfiboli rombici (ortoamfiboli) Pnma
Chimism
Ocuparea pozitiilor cationice:
Pozitia A ocupata sau vacanta: cationi cu raze mari Na (K); coordinare 10 sau 12
Pozitia M4: cationi cu raze mari si medii Na, Ca, Li, Mg, Fe2+, Mn2+; coordinare 6 sau 8
Pozitiile M1, M2, M3: cationi cu raze medii si mici Mg, Fe2+, Mn2+, Fe3+, Al3+, Ti4+; coordinare 6
Pozitia T: cationi cu raze mici Si, Al; coordinare 4
Tabel 14.2: Ocuparea pozitiilor atomice la piroxenii si amfibolii comuni
|
Pyroxenes |
Amphiboles |
|||||
|
Atomic sites |
Name |
Atomic sites |
Name |
|||
|
M1 |
M2 |
A |
M4 |
M1+M2+M3 | ||
|
Mg Fe |
Fe Mg |
Enstatite other members of orthopyroxene series |
Mg Fe Fe |
Mg Mg Fe |
Anthophyllite Cummingtonite Grunerite |
|
|
Ca Ca Ca |
Mg Fe Mn |
Diopside Hedenbergite Johannsenite |
Ca Ca |
Mg Fe |
Tremolite Ferroactinolite |
|
|
Ca, Na |
Mg, Fe2+, Mn, Al, Fe3+, Ti |
Augite |
Ca, Na |
Mg, Fe2+, Mn, Al, Fe3+, Ti |
Hornblende |
|
|
Na Na |
Al Fe3+ |
Jadeite Aegirine |
Na |
Na Na Na |
Mg, Al Fe2+, Fe3+ Fe2+, Fe3+ |
Glaucophane Riebeckite Afrvedsonite |
|
Li |
Al |
Spodumene |
Li |
Mg, Fe3+, Al, Fe2+ |
Holmquistite |
|
represents a vacant atomic sites
|
Tabel 14.3: Relatia dintre pozitiile cationice la piroxeni si amfiboli |
||
|
Piroxeni |
Amfiboli |
Coordinare |
|
A | ||
|
M2 |
M4 | |
|
M1 |
M1, M2, M3 | |
|
T |
T | |
TERMENI IMPORTANŢI DIN GRUPA AMFIBOLILOR
Amfiboli alcalini
M4 = Na M1-M3 = Mg, Al Glaucofan Na2Mg3Al2[Si8O22](OH)2 C2/m
M1-M3 = Fe3+, Fe2+ Riebeckit Na2Fe2+3Fe3+2[Si8O22](OH)2 C2/m
A+M4 = Na M1-M3 = Fe3+, Fe2+ Arfvedsonit Na2Fe2+4Fe3+[Si8O22](OH)2 C2/m
Amfiboli de Ca
M4 = Ca M1-M3 = Mg Tremolit Ca2Mg5[Si8O22](OH)2 C2/m
M1-M3 = Fe2+ Feroactinot Ca2Fe32+[Si8O22](OH)2 C2/m
Amfiboli de Mg, Fe
M4 = Mg M1-M3 = Mg Antofilit Mg7[Si8O22](OH)2 C2/m
M4 = Fe2+ M1-M3 = Mg Cummingtonit Fe2Mg5[Si8O22](OH)2 P21/m
M1-M3 = Fe2+ Grunerit Fe7[Si8O22](OH)2 C2/m
SOLUŢII SOLIDE:
Antofilit (Mg, Fe2+)2Mg5[Si8O22](OH)2 Pnma
Gedrit Na0,5(Mg, Fe2+)3,5(Al,Fe3+)1,5[Si6Al2O22](OH)2 Pnma
pozitia A
Holmquistit Li2(Mg, Fe2+)3(Al, Fe3+)2[Si8O22](OH)2 Pnma
Cummingtonit Fe2+2(Mg, Fe2+)5[Si8O22](OH)2 P21/m→C2/m
Actinot (Ca, Mg, Fe2+)2(Mg, Fe2+)5[Si8O22](OH)2 C2/m
Hornblenda (Ca, Na)2-3(Mg, Fe, Al, Ti)5[Si6(Si, Al)2O22](OH)2 C2/m
pozitiile A si M4
Proprietati fizice. Orientarea lanturilor în directia axului z → habitus prismatic. Rezistenta mai ridicata a lanturilor
duble comparativ cu lanturile simple face ca în general amfibolii sa
aiba un habitus lung prismatic pâna la fibros. Legaturile slabe
dintre modulele I determina în clivaj
foarte bun dupa fetele de prisma (![]() la cei mai multi amfiboli) cu unghiul dintre plane de
aproximativ 125ș. Culoarea si
greutatea specifica variaza cu chimismul.
la cei mai multi amfiboli) cu unghiul dintre plane de
aproximativ 125ș. Culoarea si
greutatea specifica variaza cu chimismul.
14.8 Subclasa Filosilicati
14.8.1 Clasificare
I. Filosilicati cu pachete formate din doua straturi T/O (1:1)1
a) cu retele dioctaedrice2 Grupa kanditelor Caolinit Al4[Si4O10](OH)8
Dickit Al4[Si4O10](OH)8
Nacrit Al4[Si4O10](OH)8
Anauxit Al4[Si4O10](OH)
Grupa halloysitului Halloysit Al4[Si4O10](OH)8·2-4H2O
Grupa allofanului m Al2O3 nSiO2 pH2O
b) cu retele trioctaedrice Grupa serpentinelor Antigorit Mg6[Si4O10](OH)8
Crisotil Mg6[Si4O10](OH)8
Lizardit Mg6[Si4O10](OH)8
Garnierit (Mg, Ni)6[Si4O10](OH)8·4H2O
Palygorskit si Sepiolit (Mg, Al)6[Si4O10](OH)8·2H2O
II. Filosilicati cu pachete formate din trei straturi T/O/T (2:1)
A. fara cationi între straturi:
a) cu retele dioctaedrice Pirofilit Al2[Si4O10](OH)2
b) cu retele trioctaedrice Talc Mg3[Si4O10](OH)2
B. cu cationi între straturi: Grupa Micelor
a) cu retele dioctaedrice Muscovit K2Al4[Al2Si6O20](OH, F)4
Paragonit Na2Al4[Al2Si6O20](OH)4
Lepidolit K2(Li, Al)5-6[Al2Si6O20](OH, F)4
Fuchsit K2(Li, Cr)4[Al2Si6O20](OH, F)4
Zinwaldit K2(Fe2-12+,Li2-3, Al2)5-6[Al2Si6O20](OH1-2, F3-2)4
b) cu retele trioctaedrice Biotit K2(Mg,Fe2+)6-4(Fe3+, Al, Ti)0-2[Al2-3Si6-5O20]O0-2(OH, F)4-2
Flogopit K2(Fe2+,Mg)6[Al2Si6O20](OH, F)4
Eastonit K2(Fe2+)5Al[Al3Si5O20](OH, F)4
Annit K2Fe62+[Al2Si6O20]O0-2(OH, F)4
c) Grupa micelor casante Margarit Ca2Al4[Al4Si4O20](OH)4
Clintonit Ca2(Mg, Fe, Al)4,6Al1,4[Al5,5Si2,5O20](OH)4
Xantofilit Ca2(Mg, Fe, Al)4,6Al1,4[Al5,5Si2,5O20](OH)4
C. cu cationi si molecule H2O între straturi:
a) cu retele dioctaedrie Grupa smectitelor
Montmorillonit (1/2Ca, Na)0,66(Al, Mg, Fe)4[(Al, Si)8O20](OH)4·nH2O
Beidelit (1/2Ca, Na)0,66Al4[(Al, Si)8O20](OH)4·nH2O
Nontronit (1/2Ca, Na)0,66Fe43+[(Al, Si)8O20](OH)4·nH2O
b) cu retele trioctaedrice Grupa vermiculitului
Vermiculit Mg3[Si4O10](OH)2·nH2O
Saponit Na0,33Mg6[(Al, Si)8O20](OH)4·nH2O
Hectorit Na0,33(Mg, Li)6[(Al, Si)8O20](OH)4·nH2O
Sauconit Na0,33(Mg, Zn)6[(Al, Si)8O20](OH)4·nH2O
c) Grupa illitului
Illit K1-1,5Al4[(Al1-1,5, Si7-6,5)O20](OH)4
Fengit K2(Al, Fe2+,Mg)4[Al2Si6O20](OH, F)4
Hidromuscovit K2Al4[(Al,Si)8O20](OH)4·nH2O
Glauconit (K, Na, Ca)2(Fe2+, Fe3+,Al, Mg)4[(Al,Si)8O20](OH)
III. Filosilicati cu pachete formate din doua straturi: T/O/T/O (2:1:1)
Grupa cloritelor Clorite neoxidate Pennin Mg10Al2[(Al,Si)8O20](OH)16
Clinoclor (Mg, Fe)10Al2[(Al,Si)8O20](OH)16
Proclorit (Mg, Fe)10Al2[(Al,Si)8O20](OH)16
Carundofilit (Mg, Fe)10Al2[(Al,Si)8O20](OH)16
Amesit Fe10Al2[(Al,Si)8O20](OH)16
Clorite oxidate Thuringit Fe3,5(Al, Fe)1,5[Al1,5Si2,5O10](OH)6·4H2O
Chamosit Fe4Al2[(Al,Si)8O10](OH)6·nH2O
IV. Alti filosilicati: Apofilit K, Ca4[Si8O20]F·8H2O
Prehnit Ca2Al[AlSi3O10](OH)2
Attapulgit MgAl2[Si4O10]·4H2O
Palygorskit Mg2[Si4O10](OH)·4H2O
Sepiolit Mg4 [Si6O15](OH)2.6H2O
![]() 1:1 semnifica raportul dintre
numarul retelelor tetraedrice (T) si numarul retelelor
octaedrice (O) din pachetul structural; rezulta astfel succesiunea T/O
1:1 semnifica raportul dintre
numarul retelelor tetraedrice (T) si numarul retelelor
octaedrice (O) din pachetul structural; rezulta astfel succesiunea T/O
retelele în care predomina cationii trivalenti, în principal Al; sinonime: straturi hidrargilitice, straturi gibbsitice
retelele în care predomina cationii divalenti, în principal Mg; sinonime: straturi brucitice

Caractere structurale
Filosilicatii au o structura stratificata, formata din doua unitati costitutive de baza:
- retea tetraedrica, retea plana formata prin polimerizarea tetraedrilor [TO4]
- retea octaedrica, retea plana formata prin polimerizarea octaedrelor cationice.
Ambele retele sunt dispuse dupa (001).
Reteaua teraedrica (T) Fiecare tetraedru TO4 se leaga prin 3 vârfuri de alte 3 tetraedre, formând o retea plana cu ochiuri hexagonale rezultând gruparea anionica [T2O5]n, [Si2O5]2n-. Vârfurile tetraedrelor din aceasta retea sunt legate de cationii din reteaua octaedrica.
Reteaua octaedrica (O) Cationii se afla în coordonare 6, octaedrica. În centrele octaedrelor se afla cationi 2+ sau 3+, iar în vârfurile octaedrelor se afla O si/sau grupari OH. Aceste octaedre se leaga între ele prin muchii rezultând o retea octaedrica. Configuratia retelei octaedrice depinde de sarcina cationului din centru:
- cation 2+ (Mg, Fe) → toate octaedrele sunt ocupate, rezultând o retea octaedrica continua (retea trioctaedrica)
- cation 3+ → sunt ocupate doar 2/3 din octaedru, rezultând o retea discontinua (retea dioctaedrica); octaedrele ocupate sunt deformate, astfel încât volumele vacante sunt mai mari.
Structurile filosilicatilor pot fi descrise urmarind modul de împachetare a acestor retele. Prin împachetarea retelelor rezulta un pachet (strat) care se repeta în directia axului c, caracterizat printr-o anumita succesiune de retele T si O. Exista trei tipuri de straturi rezultate din trei moduri de împachetare a retelelor T si O. Acestea stau la baza clasificarii filosilicatilor.
Clasificarea filosilicatilor
Filosilicatii se împart în trei grupe, caracterizate printr-un anumit strat, corespunzator unei împachetari caracteristice a retelelor T si O, Astfel, fiecare din cele trei grupe de filosilicati va fi definita de o anumita succesiune a retelelor T si O din stratul caracteristic.
Fiecare grupa de filosilicati se mai clasifica în doua subgrupe, în functie de tipul de retea octaedrica: dioctaedrica, trioctaedrica.
FILOSILICAŢI 1:1 (strat T-O)
- stratul format dintr-o retea T si o retea O, legate între ele prin vârfuri;
- straturile sunt neutre electic; sunt legate între ele prin legaturi Van der Waals;
- cu retele dioctaedrice (ex: caolinit) si trioctaedrice (ex: mineralele serpentinice - antigorit, crisotil, lizardit).
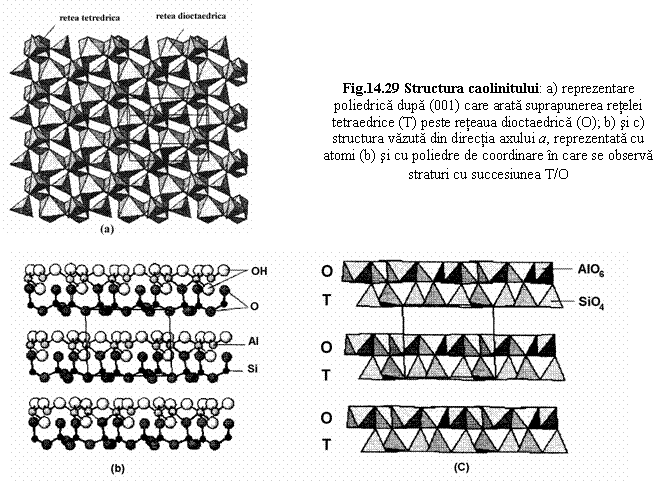
Caolinitul - triclinic Al4[Si4O10](OH)8 P![]() →
→![]()
* din directia axului a
- reprezentare cu atomi - Si - coordinat de O
- Al - coordinat de O si OH
- succesiunea planelor de atomi dintr-un strat: O, Si, O+OH, Al, O
- reprezentare cu poliedre - un strat format dintr-o retea T si o retea O
- stratul se repeta în directia axului c
* vazuta paralel cu (001), cu poliedre: retea dioctaedrica
Lizardit Mg6[Si2O5]2(OH)8 - hexagonal a0 = 5,3 Ć, c0 = 7,3 Ć, γ = 120ș.
* din directia axului a
- cu atomi - Si - coordinat de O
- Mg - coordinat de O si OH
- succesiunea perechilor de atomi dintr-un strat: O, Si,O+OH, Mg, OH
- cu poliedre - un strat: T si O
- repetarea stratului în directia axului c
* din directia axului c
- retea trioctaedrica
- trei octaedre într-un ochi hexagonal al retelei tetraedrice

FILOSILICAŢI 2:1 (strat T-O-T)
2 retele T: 1 retea O
- stratul format dintr-o retea O prinsa între vârfurile opuse a doua retele T
- starturile pot fi legate prin: legaturi Van der Waals; cationi aflati între straturi
A) filosilicati 2:1 fara cationi între straturi
- dioctaedrice: pirofilit
- trioctaedrice: talc
B) filosilicati 2:1 cu cationi între straturi
- dioctaedrice: muscovit
- trioctaedrice: flogopit
C) filosilicati 2:1 cu cationi si molecule H2O între straturi
- dioctaedrice: montmorillonit
- trioctaedrice: vermiculit
Pirofilit Al2[Si2O5]2(OH)2 - monoclinic C2/C → 2/m
a0 = 5,16 Ć, b0 = 8,90 Ć, c0 = 19,64 Ć, β = 99ș55′.
* din directia axului a
- cu atomi - Si - coordinat de O
- Al - coordinat de O si OH
- un strat -succes. de plane de atomi: O, Si, O+OH, Al, O+OH, Si, O
- cu poliedre - un strat: TOT
- succesiunea stratelor din directia axului c
- straturile nu sunt legate între ele prin cationi
Flogopit K2(Fe2+,Mg)6[Al2Si6O20](OH, F)4 - monoclinic Cm → m
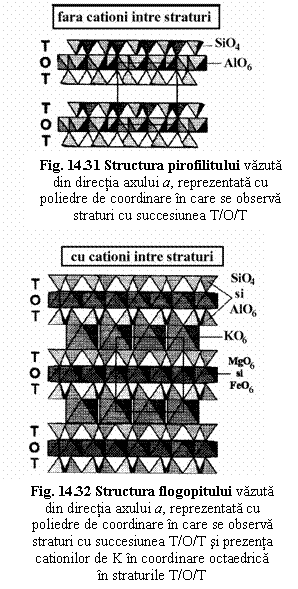 a0 = 5,3 Ć, b0 = 9,2
Ć, c0 = 10,1 Ć, β =
100ș.
a0 = 5,3 Ć, b0 = 9,2
Ć, c0 = 10,1 Ć, β =
100ș.
* din directia axului a
- cu atomi - Si - coordinat de O
- Mg, Fe, Al - coordinat de O+OH
- K - coordinat de O
- un strat -succes. de plane de atomi: O, Si+Al, O+OH, Mg+Fe+Al, O+OH, Si+Al, O
- cu poliedre - un strat: TOT
- succesiunea stratelor din directia axului c
- straturile nu sunt legate ele prin octaedre KO6
FILOSILICAŢI 2:1 (strat T-O-T)
- stratul este format dintr-o retea O prinsa între doua pachete T-O-T
Cloritele (Mg, Fe)12[Si2O5]4(OH)16 - monoclinic C2 → 2
a0 = 5,3 Ć, b0 = 9,2 Ć, c0 = 14,2 Ć, β = 100ș
* din directia axului a
- cu atomi - Si - coordinat de O
- Mg, Fe- coordinat de O+OH
- succesiunea de plane de atomi: O, Si, O+OH, Mg+Fe, O+OH, Si, O, OH, Mg+Fe, OH
- cu poliedre - un strat: TOT+O
Modificari ale structurii impuse de variatiile volumelor octaedrice
Legarea prin vârfuri a retelei O de cea T impune restrictii privind dimensiunile lor relative. Daca avem o retea T formata doar din tetraedre [SiO4], aceasta se potriveste dimensional si deci, se leaga perfect de o retea O plana, în care cationul are dimensiunea de ~ 0,70 Ć (sensibil mai mare raza Mg2+ = 0,65 Ć, Fe2+ = 0,64 Ć).
La filosilicati exista substitutii considerabile: în pozitiile tetraedrice Al substituie Si (cresterea razei cationice); în pozitiile octaedrice pot aparea diferiti cationi cu raze mai mari (Ca, Na) sau mai mici (Al).
Aceste substitutii produc variatii dimensionale ale retelelor T si O, ducând la nepotrivirea lor dimensionala. Acest fapt determina modificari ale retelelor sau chiar ruperea lor.
O consecinta importanta o reprezinta faptul ca, la anumite compozitii chimice, se pot forma doar cristale de dimensiuni mici, deoarece tensiunea rupturala determinata de nepotrivirea dimensionala a cationilor. Acest fenomen caracterizeaza mineralele argiloase.
Ca si în cazul inosilicatilor, modificarile scheletului silicatic au loc ca reactie la modificarea volumelor octaedrice.
Vom urmari în continuare modul de adaptare dimensionala a retelelor O si T pentru câteva minerale din grupa filosilicatilor.
Filosilicati 1:1
Caolinitul: fibros, cu structura cea mai simpla. Prezenta Al în pozitiile octaedrice determina scaderea volumelor octaedrice, comparativ cu volumele octaedrice din reteaua T ideala amintita mai sus, rezultând scaderea dimensiunilor elementare a retelei O. Pentru legarea optima a retelei O de cea T, este necesara adaptarea retelei T. Aceasta adaptare dimensionala a retelei T are loc prin rotirea tetraedrului SiO4 cu ~9ș. Rotatia are loc ca si la piroxeni: doua tetraedre alaturate se rotesc în sens opus.
La ceilalti filosilicati 1:1 diferenta dimensionala a retelelor T si O, variaza astfel:
- scade prin înlocuirea Al de catre Mg (diferenta scade cu cresterea razei cationice)
- creste prin înlocuirea Si de catre Al (diferenta creste cu cresterea razei cationului T).
Mineralele serpentinice
Diferenta dimensionala a retelei T si O este mai mica în conditii normale: reteaua T este apropiata de reteaua T ideala amintita mai sus.
La modificarea temperaturii si presiunii, are loc variatia volumului octaedric. Aceasta variatie se reflecta în trei moduri de adaptare a retelei T, corespunzatoare a tei minerale:
*Lizardit: cele doua retele se potrivesc dimensional. Reteaua tetraedrica ramâne plana, având loc doar o rotire a tetraedrelor SiO4 (~3ș30'). Straturile T-O ramân plane.
*Crisotil: cresterea dimensiunilor elementare a retelei O → cresterea distantelor dintre vârfurile tetraedrelor din reteaua T. Aceasta se realizeaza prin curbarea stratului T-O, rezultând habitus fibros.
*Antigorit: cresterea în continuare a volumelor octaedrice → curbarea stratului T-O este însotita de schimbare periodica a orientarii tetraedrelor din reteaua T (cu aspect de tabla ondulata).
De la lizardit la antigorit are loc o crestere a volumelor octaedrice cu cresterea temperaturii si scaderea presiunii.
Filosilicatii 2:1
Nu este posibila curbarea retelei T deoarece reteaua O este cuprinsa între doua retele T.
Talcul Mg3[Si2O5]2(OH)2. Starturile TOT sunt plane. Adaptarea dimensionala a retelei T are loc prin rotire usoara a tetraedrelor (~3ș30'). Daca Mg se înlocuieste cu Al rezulta scaderea volumelor octaedrice ducând la cresterea diferentelor dimensionale si rotirea tetraedrelor cu 10ș (ex: pirofilit).
Cresterea volumelor octaedrice duce la modificarea orientarii tetraedrelor din reteaua T si separarea în benzi a retelei octaedrice (ex: sepiolit).
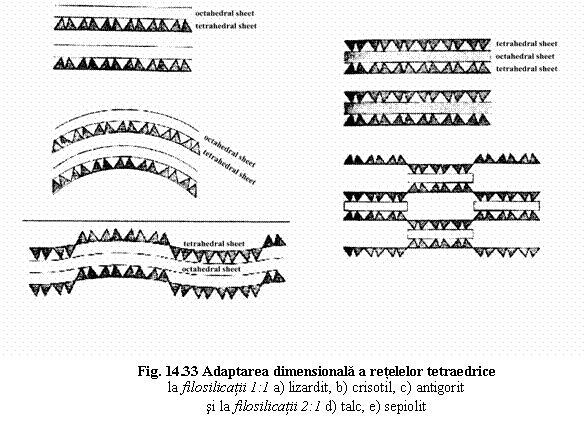
Proprietati fizice comune filosilicatilor (det. de structura stratificata)
- habitus fibros dezvoltat dupa (001)
- clivaj perfect paralel cu (001)
- densitate scazuta, mai ales la speciile hidratate
- plasticitate (leg. 50% covalenta din ret. T; leg. slabe dintre straturi)
→ posibilitatea deplasarii relative a straturilor.
Observatii asupra mineralelor argiloase
Un filosilicat poate fi considerat mineral argilos daca indeplineste urmatoarele conditii: dimensiunea cristalelor < 2 mm; contine molecule de H2O între straturi, acestea oferindu-le anumite proprietati specifice.
* capacitatea de schimb ionic: proprietatea de a schimba cationii din retea (Ca, Na) fara modificarea retelei teraedrice;
* gonflarea ~ expandarea: smectitele au capacitatea de a retine molecule de H2O între straturi; cresterea continutului de apa determina excpandarea retelei în directia axului c; moleculele de H2O se pierd prin încalzire la 100-150°C;
* plasticitatea foarte ridicata: aditionarea unei anumite cantitati de apa între straturi determina deplasarea relativa a acestora pâna la pierderea coeziunii;
* tixotropia: smectitele saturate în apa, solicitate prin vibratii, pierd coeziunea dintre straturi; fenomenul este reversibil la încetarea solicitarii.
Cele mai importante minerale argiloase:
Montmorillonit - mineral asemanator pirofilitului, dar mai hidratat;
Illit - muscovit cristalizat fin, cu o parte din K+ înclocuit de ioni H3O+;
Vermiculit - biotit cu apa între straturi.
14.9 Subclasa Tectosilicati
14.9.1 Grupul feldspatilor
Feldspatii au formula generala M[T4O8] cu Z = 4. Complexitatea chimica, structurala si proprietatile acestor minerale impun separarea în cadrul acestei grupe a unor subgrupe de minerale cu însusiri fizice si chimice distincte.
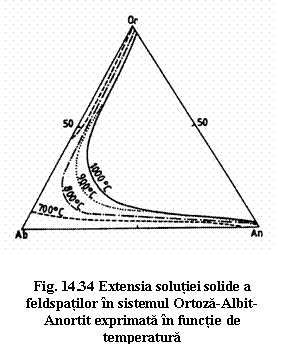
Majoritatea feldspatilor pot fi clasificati din punct de vedere chimic în cadrul sistemului ternar ortoza-albit-anortit . Termenii seriei ortoza-albit sunt numiti feldspati alcalini, iar cei din seria albit-anortit sunt numiti feldspati plagioclazi. Feldspatii alcalini pot contine pâna la 5-10 % molecule de anortit în solutie solida, iar feldspatii plagioclazi pot contine pâna la 5-10 % molecule de ortoza în solutia solida.
Tabel 14.4: Clasificarea feldspatilor
|
Seria |
Numele termenilor |
Formula chimica |
Sistem de cristalizare |
|
Feldspati alcalini (K, Na)[AlSi3O8] |
Sanidina Ortoza Microclin |
K[AlSi3O8] |
monoclinic |
|
Anortoza |
(K, Na)[AlSi3O8] |
triclinic |
|
|
Albit |
Na[AlSi3O8] |
||
|
Feldspati plagioclazi Na[AlSi3O8]-Ca[Al2Si2O8] |
Albit 0-10 % An Oligoclaz 10-30 % An Andezin 30-50 % An Labradorit 50-70 % An Bytownit 70-90 % An Anortit 90-100 % An |
Na[AlSi3O8] Ca[Al2Si2O8] |
triclinic |
|
Feldspati cu bariu |
Celsian Hyalofan |
Ba[Al2Si2O8] BaK2[Al4Si4O16] |
monoclinic |
Chimism si structura (vezi polimorfism - transformari ordine/dezordine si solutii solide)
Feldspatii alcalini
Feldspatul potasic K[AlSi3O8] poate exista în mai multe stari structurale în functie de conditiile de geneza. Cheia întelegerii tranzitiilor dintre diferitele faze polimorfe se afla în studiul distributiei ionilor de Al si Si. Astfel, în functie de gradul de ordonare a al si si în pozitiile T exista:
Sanidina - cristalizeaza la temperaturi înalte, în sistemul monoclinic, cu distributia Al/Si dezordonata;
Ortoza - cristalizeaza la temperaturi mai joase, un amestec intim de faze monoclinice si triclinice, cu distributia Al/Si partial ordonata;
Microclinul - cristalizeaza la tempertura cea mai joasa, în sistemul triclinic, cu distributia Al/Si partial ordonata.
Marimea care caracterizeaza variatiile gradate ale gradului de ordonare poarta numele de triclinicitate. În functie de valorile triclinicitatii exista si alte varietati structurale (ex: microclin intermediar).
Adularul este un feldspat potasic care se distinge mai mult prin particularitatile morfologice decât prin cele structurale; este caracteristic filoanelor alpine.
Albitul este termenul predominant sodic si prezinta varietati structurale în functie de temperatura de formare, separându-se termenii: albit de temperatura înalta, albit de temperatura intermediara si albit de temperatura joasa.Toate acestea cristalizeaza în sistemul triclinic, dar pentru temperaturile cele mai înalte de formare exista tendinta de a se realiza o simetrie monoclinica - la temenul monalbit.
Pentru a putea stabili legaturile între feldspatii potasici, cei sodici si cei calco-sodici (plagioclazi), este nevoie sa precizam elemente legate de seriile izomorfe albit - feldspat potasic si de cristalele mixte de feldspati. Seriile izomorfe albit - feldspat potasic sunt diferite în functie de conditiile de temperatura la care iau nastere:
1. Seria albit de temperatura înalta - sanidina de temperatura înalta reprezinta o solutie solida continua. În cadrul ei se face trecerea de la o simetrie triclinica (Ab100-Ab65) la o simetrie monoclinica (Ab65-Ab0). Termenii triclinici ai acestei serii se numesc anortoze si reprezinta o serie de la sanidina bogata în sodiu la sanidina bogata în potasiu.
2. În seria albit de temperatura ridicata - sanidina de temperatura joasa solutia solida este limitata la extreme, iar termenii compozitiei intermediare constau în doua faze separate la scara submicroscopica (sanidina criptopertitica). Aceasta serie cuprinde: albit (Ab100-Ab63), anortoza criptopertitica si sanidina.
3. Seria albit de temperatura joasa - ortoza si 4. seria albit de temperatura joasa - microclin la care solutia solida este si mai limitata iar separatia de faze se poate observa la microscop. Exsolutia celor doua faze (sodica si potasica) poarta numele de pertite.
Cristalele cu compozitie intermediara între feldspat potasic si albit se formeaza numai la temperaturi ridicate. Exsolutiile se produc la scaderea temperaturii sub 500-700°C, în functie de presiunea de vapori a apei. La temperatura normala cristalele intermediare persista în stare metastabila.
Feldspatii plagioclazi sunt grupati în cadrul unei serii cu miscibilitate continua albit-anortit. Toti termenii acestei serii sunt triclinici. Denumirile utilizate în petrologie, dar discreditate mineralogic, pentru termenii intermediari sunt: albit 0-10 % An; oligoclaz 10-30 % An; andezin 30-50 % An; labrador 50-70 % An; bytownit 70-90 % An; anortit 90-100 % An.
Proprietati fizice
Habitusul este prismatic sau tabular, iar trachtul este dominat de fete de prisma si pinacoid.
Macle:
- feldspatii alcalini: macla Carlsbad - cu planul (010) si axul [010], macla Baveno - cu planul (021), macla Manebach - cu planul (001). Albitul prezinta macle polisintetice de tip albit - cu planul (010) si axul perpendicular pe (010), iar microclinul prezinta "macla în gratar" (macla albit-periclin).
- feldspatii plagioclazi: macla polisintetica de tip albit.
Clivajul este perfect dupa si bun dupa , formând un unghi de ~90° la feldspatii alcalini.
Duritatea este ridicata (6-61/2).
Culoarea: în general incolori sau albi, coloratii allocromatice (roz, galben, verde, rosu).
14.9.2 Grupul feldspatoizilor
Termeni importanti:
Nefelin Na3K[Al4Si4O16]
Leucit K[AlSi2O6]
Sodalit Na8[Al6Si6O24]Cl2
Nosean Na8[Al6Si6O24](SO4)
Haüyn (Na, Ca)4-8[Al6Si6O24](SO4, S2, Cl)1-2
Cancrinit (Na, Ca)7-8[Al6Si6O24](CO3, SO4, S2, Cl)1,5-2.1-5 H2O
Structura si chimism
Daca feldspatii reprezinta minerale saturate în silice (pot forma împreuna cu cuartul o parageneza), feldspatoizii sunt minerale subsaturate în silice. Formulele lor pot fi întelese plecând de la cele ale feldspatilor corespunzatori; exemplu:
Na[AlSi3O8] - 2 SiO2 = Na[AlSiO4]
albit nefelin
K[AlSi3O8] - SiO2 = K[AlSi2O4]
ortoza leucit
Structura feldspatoizilor este afânata, ceea ce face posibila introducerea unor anioni suplimentari care explica numarul relativ mare de termeni. Complicatii în cadrul acestei grupe apar si datorita seriilor de substitutii izomorfe cu miscibilitate completa sau partiala (exemplu: Na prin K în seria nefelin-kalsilit, Na prin Ca concomitent cu substitutia SO4/Cl în grupa sodalitului). De asemenea, polimorfismul are o larga raspândire printre feldspatoizi (exemplu: kalsilit-tetrakalsilit)
Proprietati fizice
Habitusul este izometric la feldspatoizii cubici si scurt prismatic la cei hexagonali. Trachtul este prismatic la varietatile hexagonale si trapezoedric sau dodecaedric romboidal la varietatile cubice.
Din punct de vedere al maclelor, un aspect interesant îl prezinta maclele mimetice ale leucitului.
Culoarea: nefelin - cenusiu; leucit - alb; sodalit - albastru; cancrinit - galbui.
Geneza
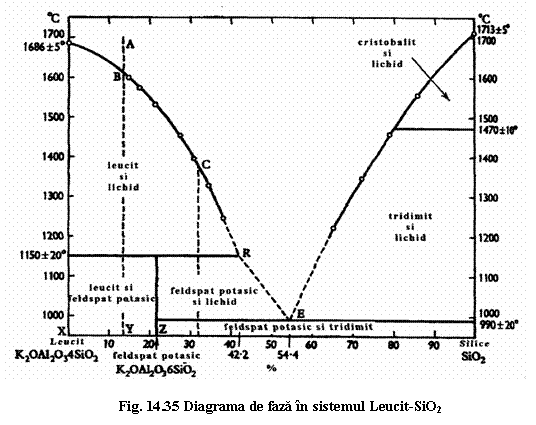
Cristalizarea feldspatoizilor din topituri se poate urmari în diagrame de faze, construite prin studierea sistemelor nefelin-silice sau leucit-silice.
Sistemul leucit-silice reprezinta un sistem binar cu un compus de topite incongruenta. Acesta este feldspatul potasic, care la presiuni normale se topeste incongruent, cu formare de cristale de leucit si o topitura mai bogata în silice. În procesul de cristalizare, fenomenele se produc analog celor din sistemul forsterit-silice. Se demonstreaza astfel incompatibilitatea leucitului si a silicei.
14.9.3 Grupul zeolitilor
Formula generala (Li, Na, K)a(Mg, Ca, Sr, Ba)d[Ala+2dSin-(a+2d)O2n].m H2O
Clasificare
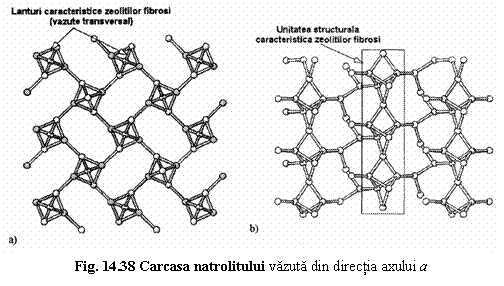
1. Zeoliti fibrosi Natrolit Na16[Al16Si24O80].16 H2O
Thomsonit Na4Ca8[Al20Si20O80].24 H2O
Gonnardit Na5Ca2[Al9Si11O40].12 H2O
2. Zeoliti cu lanturi formate din inele tetragonale simplu conectare
Analcim Na16[Al16Si32O96].16 H2O
Wairakit Ca8[Al16Si32O96].16 H2O
Laumontit Ca2[Al4Si12O32].8 H2O
3. Zeoliti cu lanturi formate din inele tetragonale dublu conectate
Phillipsit K4(Ca0,5, Na)4[Al6Si10O32] .12 H2O
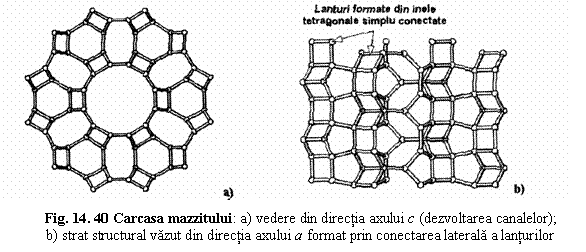
Mazzit K3Ca1,5Mg2[Al10Si26O72] .28 H2O
4. Zeoliti cu inele hexagonale simple sau duble
Gmelit Na8[Al8Si16O48].22 H2O
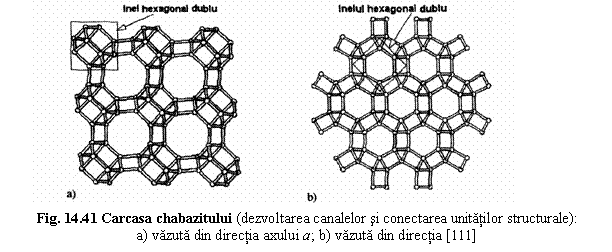
Chabazit Ca2[Al4Si8O24].12 H2O
Erionit NaK2MgCa1,5[Al8Si28O72].28 H2O
5. Zeoliti din grupul mordenitului
Mordenit Na3KCa2[Al8Si40O96].28 H2O
Epistilbit Ca3[Al6Si18O48].16 H2O
6. Zeoliti din grupul heulanditului
Heulandit (Na, K)Ca4[Al9Si27O72].24 H2O
Clinoptilolit (Na, K)6[Al6Si30O72].20 H2O
Stilbit NaCa14[Al9Si27O72].30 H2O
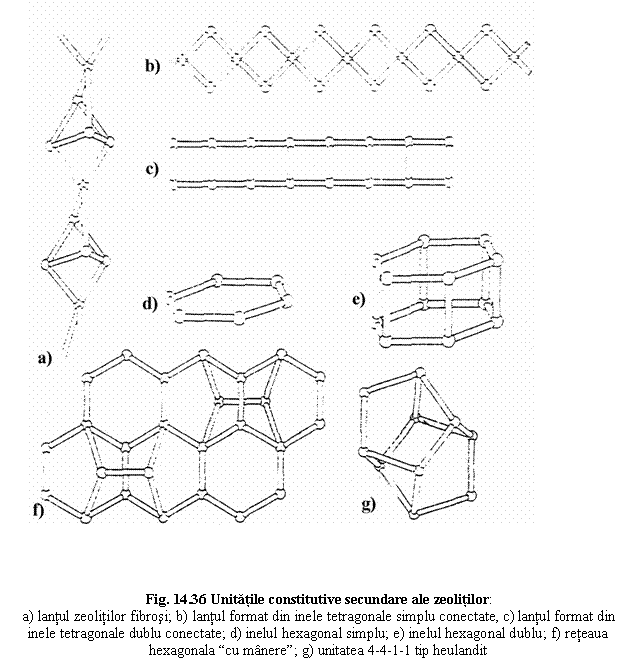
Moduri de reprezentare a structurii consacrate pentru zeoliti
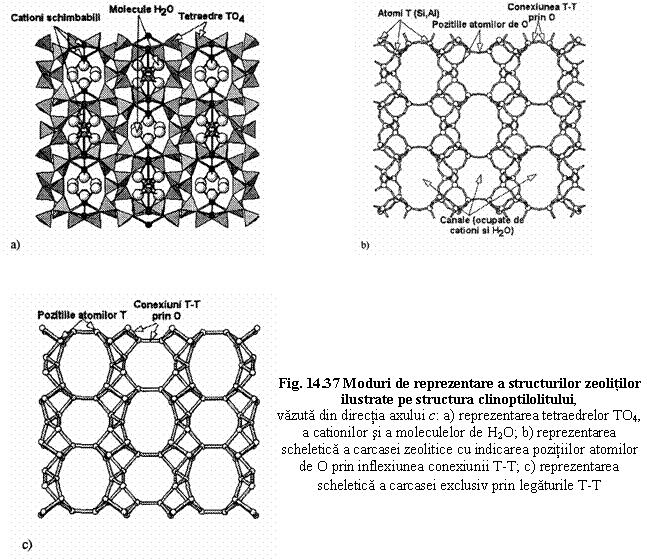
Exemple de structuri pentru ilustrarea grupelor de zeoliti
1. Zeoliti fibrosi
2. Zeoliti cu lanturi tetraedrice simplu conectate

3. Zeoliti cu lanturi formate din inele tetragonale dublu conectate
4. Zeoliti cu inele hexagonale
5. Zeoliti cdin grupul mordenitului
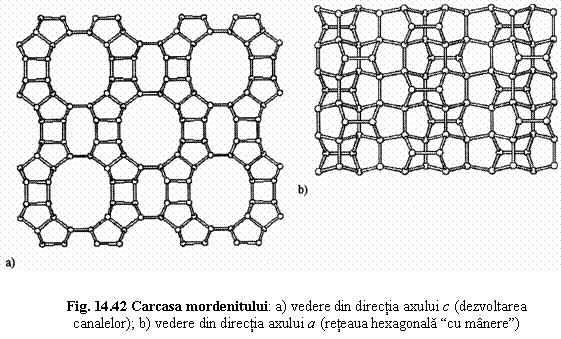
6. Zeoliti din grupul heulanditului

14.9.4 Grupul mineralelor SiO2 (vezi si polimorfism)
Bioxidul de siliciu se întâlneste în natura sub forma mai multor minerale: cuart, trdimit, cristobalit, coesit, stishovit. Amintim modificatia amorfa, opalul SiO2.n H2O care nu costituie un mineral.
Forma cea mai frecventa este cuartul; tridimitul si cristobalitul, prezenti în roci vulcanice, sunt mai rari; opalul mai putin comun; coesitul si stishovitul sunt caracteristici meteoritilor.
Stabilitate (vezi polimorfism)
La presiuni înalte, cuartul este stabil pâna la temperatura de 870°C; urmeaza domeniul de stabilitate al tridimitului care se întinde pâna la temperatura de 1470°C. La aceasta temperatuta începe domeniul de stabilitate al cristobalitului pâna la temperatura de 1713°C la care apare topitura.
Fiecare dintre aceste forme ale SiO2 se poate prezenta în doua modificatii care se transforma una în alta (transformari deplasative). Modificatia de temperatura scazuta se noteaza cu α, iar cea de temperatura ridicata cu β. Modificatiile β ale tridimitului si cristobalitului sunt instabile la temperatura normala. Pentru celelalte modificatii s-au precizat urmatoarele domenii de stabilitate:
![]()
![]()
![]()
![]() cuart α 573°C ccuart β 870°C tridimit α 1470°C cristobalit α 1713°C silice lichida
cuart α 573°C ccuart β 870°C tridimit α 1470°C cristobalit α 1713°C silice lichida
 Proprietatile
fizice ale cuartului (α: grup punctual 32;
β: grup punctual 622)
Proprietatile
fizice ale cuartului (α: grup punctual 32;
β: grup punctual 622)
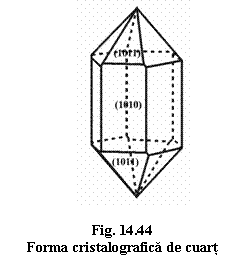
Habitus: prismatic, columnar, tracht: prisma cu fete striate orizontal, terminata cu combinatia de octaedru pozitiv , si negativ , uneori aproape egal dezvoltate, dând impresia unei dipiramide hexagonale; formele cristalografice prezinta fenomenul de enantiotropism.
Macle: Dauphiné - de penetratie cu c ax cde macla, cu o rotatie de 180° în jurul axei c [0001]; Braziliana - de pentratie cu plan de macla; Japoneza - de contact cu plan de macla.
Clivaj: absent.
Culoare: incolor sau colorat allocromatic în diverse nuante.
Duritate: 7; greutate specifica: 2,65.
În afara de mineralele mentionate mai exista si alte varietati de silice cunoscute sub diferite nume:
* varietati macrocristaline: ochi de tigru - pseudomorfoza de cuart fibros galben dupa crocidolit (amfibol); ametist - violet si transparent; citrin - galben si transparent; morion - fumuriu si semitransparent; aventurin - incluziuni fine de hematit (rosu) sau mice cromifere (verde).
* varietati microcristaline:
- fibroase = CALCEDONIE (cuart fibros)
- crhysoprase - calcedonie galbena colorata de oxidul de Ni;
- agat - format prin alternanta unor strate de calcedonie cu culori si porozitati diferite depuse in cavitati, paralele cu peretii cavitatilor
- onix - calcedonie dispusa în strate paralele;
- agat de muschi - calcedonie alba care contine agregate asemanatoare muschiului de pamânt formate din oxizi de Mn bruni sau negri;
- lemn silicifiat sau agatizat - consta în general din calcedonie rosie sau bruna care a înlocuit materia lemnoasa;
- granulare
- jasp - cuart microcristalin granular, în general de culoare rosie, galbena sau bruna, culori datorate particulelor coloidale de oxizi de Fe;
chert-ul si cremenea - calcedonie opaca masiva, de obicei alba, galben pal, cenusie sau neagra, care apare ca noduli sau strate în rocile sedimentare.
|