
![]() Simbolul chimic: C
Simbolul chimic: C
![]() Numarul atomic "Z": 6
Numarul atomic "Z": 6
![]() Numarul de masa "A": 12
Numarul de masa "A": 12
![]() Nemetal
Nemetal
![]() Carbonul se gaseste in grupa a IV-A si
perioada a 2-a
Carbonul se gaseste in grupa a IV-A si
perioada a 2-a
![]() Nu formeaza ioni
Nu formeaza ioni
STARE NATURALA:
Carbonul formeaza numai 0 % din masa scoartei terestre. El se gaseste raspandit in natura sub forma de compusi :
![]() In
substantele anorganice :
In
substantele anorganice :
ex.: carbonati - calcar ( CaCo3 )
dioxid de carbon (CO2)
![]() Carbonul
se gaseste in toate substantele organice:
Carbonul
se gaseste in toate substantele organice:
ex.:Se gaseste in corpul uman : corpul unui om de 70 de kg contine 14 kg de carbon.
Carbonul prezinta aliotropie si se gaseste in stare libera sub 4 forme:
![]() -diamant
-diamant
![]() -grafit
-grafit
![]() -fulerene
-fulerene
![]() -carbune
de pamant
-carbune
de pamant
PROPRIETATI FIZICE:
Proprietatile fizice ale carbonului difera in functie de forma in care se gaseste:
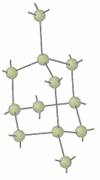

Diamantul
Structura diamantului
Diamantul, incolor si straveziu , cānd este pur, cristalizeaza in sistemul cubic. Densitatea este 3,51 g/cm3. Indicele de refractie, neobisnuit de mare, da nastere jocului de lumina specific al acestei pietre pretioase. Diamantul este rau conductor de lumina si electricitate.
Diamantul este una dintre cele mai dure substante cunoscute si din aceasta cauza de neinlocuit pentru fabricarea de scule destinate a taia, gauri sau lustrui materiale foarte dure. El īnsusi nu poate fi lustruit decat cu propria sa pulbere. Pe de alta parte diamantul este casant. El poate fi pulverizat intr-un mojar de otel.
Din pacate exista foarte putine depozite de diamante pe Pamānt, cele bogate fiind si mai putine. Unul dintre ele se afla in Africa de Sud si īnca oferea pana la 90 % din productia mondiala de diamante.
In Rusia s-a descoperit in Iakutia o regiune īntinsa continand diamante si acum acestea se obtin la scara industriala.
Formarea diamantelor naturale necesita conditii extraordinare, si anume temperaturi si presiuni uriase. Diamantele s-au nascut in straturile mai adānci ale scoartei terestre. In anumite locuri straturile cu diamante se topesc si apoi ies la suprafata si īngheata, dar aceasta se īntāmpla foarte rar.
Proprietati
 Structura cristalina a diamantului da
socoteala de toate proprietatile acestei substante. Temperatura
īnalta de vaporizare, aproape 4000° si lipsa unei faze lichide se explica
prin faptul ca, la trecerea din starea cristalina in starea de vapori trebuie
rupte covalente. La temperatura īnalta la care are loc vaporizarea,
vaporii de carbon sunt compusi din atomi liberi.
Structura cristalina a diamantului da
socoteala de toate proprietatile acestei substante. Temperatura
īnalta de vaporizare, aproape 4000° si lipsa unei faze lichide se explica
prin faptul ca, la trecerea din starea cristalina in starea de vapori trebuie
rupte covalente. La temperatura īnalta la care are loc vaporizarea,
vaporii de carbon sunt compusi din atomi liberi.
In cristalul de diamant, atomii sunt mentinuti in pozitiile lor de echilibru prin forte mult mai puternice decat in metale sau in cristalele ionice.
Proprietatile optice ale diamantului sunt de asemenea in concordanta cu structura sa cristalina. Transparenta totala fata de lumina vizibila si ultravioleta dovedeste ca electronii legaturilor C-C din diamant nu pot fi excitati de frecventele acestor radiatii electromagnetice.
Diamantul este mult mai putin reactiv decat carbunele negru si chiar decat grafitul. El se aprinde, in oxigen molecular, doar la 800° C. Prin īncalzire īndelungata la 1500° , in absenta oxigenului, diamantul se transforma in grafit.

Celebrul diamant Hope, de 45 carate
este cel mai mare diamant albastru cunoscut. Poarta numele unui bancher american si
a fost donat muzeului Smithsonian.
Diamante artificiale
Īncercari numeroase de a fabrica diamante sintetice, efectuate timp de aproape un secol, au dat gres. Īncepānd din 1955 se fabrica industrial diamante sintetice, prin īncalzirea grafitului la 3000° si 125000 atm. Viteza transformarii este marita prin mici adaosuri de Cr, Fe sau Pt.
Se obtin diamante negre, de 0,02-0,05 g, care se utilizeaza pentru scopuri industriale.
Structura grafitului
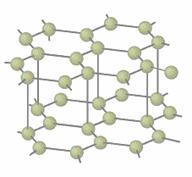
Grafit
Grafitul este un solid nergu cu duritate mica (1-2 pe scara duritatii). Prezinta fenomenul de clivaj si lasa urme pe hartie.
 Grafitul este singura forma a carbonului care este bun conducator de
caldura si elctricitate. Este opac si insolubil
Grafitul este singura forma a carbonului care este bun conducator de
caldura si elctricitate. Este opac si insolubil
in orice dizolvant, cu densitatea de aprozimativ 2,2 g/cm3.
Este distribuit la scara mare peste tot pe glob, depozite importante gasindu-se in Marea Britanie, Madagascar, Sri Lanka si Canada.
Structura fulerenelor
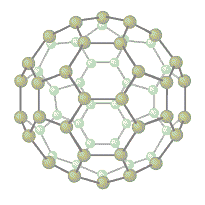
Fulerene
Fulerenele reprezinta solide opace de culoare neagra cu duritate mica. Sunt proaste conducatoare de caldura si elctricitae si solibile in benzina. Densitatea variaza intre 1,75 si 2,19 g/cm3.
In 1996 a fost oferit Premiul Nobel in domeniul chimiei pentru descoperirea fulerenelor.
PROPRIETATI CHIMICE:
Reactia carbonului cu hidrogenul:
-rezulta hidrocarburi (metanul )
C + 2H2 CH4
- reactia are loc la peste 2000C sau in prezenta unui catalizator ( Ni )
Arderea carbonului
arderea poate fi completa sau incompleta
2C + O2 2CO ( ardere incompleta )
C + O2 CO2
( ardere completa )
2CO + O2 2CO2
prin arderea carbonului cu oxigenul rezulta caldura
Reactia carbonului cu apa
daca peste carbunii adusi la incandescenta se trece un curent de vapori de apa, se obtine un amestec de gaze ( CO si H2 ) numit "gaz de apa" :
C + H2O CO + H2
"gazul de apa" se utilizeaza drept combustibil
Reactia carbonului cu oxizii unor metale
C + 2CuO 2Cu + CO2
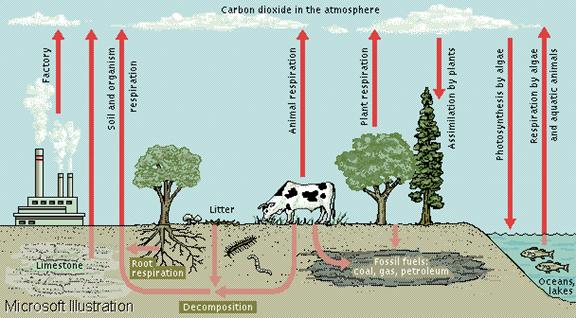 CIRCUITUL CARBONULUI IN NATURA
CIRCUITUL CARBONULUI IN NATURA
|