Fenomene de suprafata
Natura fenomenelor de suprafata, datorate in principal adsorbtiei si structurii stratului dublu electric, nu este pe deplin inteleasa. Astfel, aceste fenomene sunt interpretare intr-un mod semiempiric si sunt greu de manipulat in directii predictibile. Acest lucru nu insemna ca ele pot fi ignorate, cu toate acestea, transferurile de electroni sunt procese heterogene care au loc la interfata electrod-solutie. Deoarece compusii organici sunt adsorbiti pe suprafata electrozilor intr-o masura mai mare sau mai mica, 323j99d in electrochimia organica sunt intalnite o serie de fenomene de suprafata.
Efecte de camp
Diferenta de potential intre suprafata electrodului si solutie poate fi de 1V sau mai mare pe o distanta foarte mica, de aproximativ 50 – 5000 Å (grosimea stratului dublu electric). Intalnim astfel, un gradient mare al campului electric de aproximativ 106 – 107 V/cm sau mai mare. Intr-un asemenea camp electric, moleculele care poseda momente de dipol permanente sunt puternic orientate la suprafata electrodului. Mai mult decat atat, daca o molecula este polara sau polarizabila, in aceste conditii momentul de dipol este inmultit cu un factor egal cu 2 sau mai mare.
De exemplu, reducerea hidrocarburilor aromatice are loc in trepte; intr-o prima etapa se formeaza un radical anion, iar in cea de-a doua etapa se formeaza un dianion. Folosind modelele de calculare a energiilor orbitalilor moleculari, Hoijtink a prevazut o dependenta puternica a densitatii electronice din anion de taria campului electric superficial pentru mai multe hidrocarburi aromatice. Calculele sale au aratat pentru dianionul antracenului o densitate de electroni maxima in pozitiile 9 si 10 pentru campuri electrice < 6.107 V/cm si in pozitiile 1,4,5 si 8 pentru campuri electrice ≥ 7.107 V/cm.
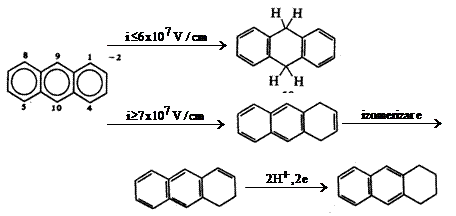 Stiind ca
protonarea are loc la pozitiile cu densitate electronica maxima,
Hoijtink a sugerat urmatoarea schema de reducere a antracenului:
Stiind ca
protonarea are loc la pozitiile cu densitate electronica maxima,
Hoijtink a sugerat urmatoarea schema de reducere a antracenului:
Fig. 7.2 Reducerea electrochimica a antracenului.
Grupa carbonil este polara si polarizabila, iar procesele de electrod ale compusilor carbonilici sunt influentate de campul electric superficial. In timpul proceselor de reducere, la intrarea in campul electric superficial, grupa carbonil se gaseste in forma dipolara (R2C+-O-). Astfel, compusii carbonilici au un caracter bazic mai pronuntat la suprafata electrodului comparativ cu interiorul solutiei. Elvin si Leone au observat ca potentialele de semiunda pentru anumite alchil- si aril-cetone se modifica cu 59 mV pentru fiecare unitate de pH indicand faptul ca reducerea compusilor cetonici se face prin acceptarea simultana a unui electron si a unui proton.
2 Orientarea substratului la suprafata electrodului
Ca o consecinta a efectelor incluzand adsorbtia chimica, adsorbtia fizica si/sau repulsia si atractia electrostatica, moleculele organice sunt orientate in geometrii specifice la suprafata electrodului.
Majoritatea moleculelor neutre sunt puternic adsorbite superficial, la potentialul in circuit deschis si se desorb progresiv la potentiale anodice si catodice crescatoare. Compusii aromatici sunt mai puternic adsorbiti decat compusii alifatici datorita scaderii tensiunii superficiale electrod / solutie. Aceste fenomene au fost observate, de exemplu, pentru piridina, anumite chinoline, benzen, derivati ai naftalinei si cumarinei si se datoreaza tendintei sistemului al speciei aromatice de a se fixa plat pe suprafata electrodului.
Bockris si coautorii au studiat adsorbtia unor molecule cu formula generala RX, unde X reprezinta grupele functionale (amino, carboxil, sulfhidril etc.) iar R poate fi n-butil, fenil sau naftil si au aratat ca speciile fenil si naftil se fixeaza plat (paralel) pe suprafata electrodului, in timp ce derivatii n-butil se adsorb perpendicular pe suprafata. Semnificatia acestor observatii experimentale consta in faptul ca derivatii aromatici, prin acest mod de adsorbtie, nu inhiba transferul de electroni, spre deosebire de substantele alifatice care frecvent inhiba transferul de electroni atunci cand se adsorb pe suprafata electrodului.
Inhibarea reactiilor de electrod
Din acest punct de vedere exista doua situatii distincte: toate procesele de transfer de electroni sunt inhibate datorita adsorbtiei speciilor organice sau cazul in care speciile adsorbite nu interfera deloc. Exemple ale celor doua cazuri sunt respectiv: adsorbtia pe suprafata electrodului a hidrocarburilor cu catena lunga, capabile sa formeze un film adsorbit inaintea transferului de electroni si adsorbtia compusilor aromatici paralel pe suprafata electrodului cand transferul de electroni se realizeaza chiar si in cazul formarii de filme adsorbite, datorita sistemului
Inhibarea nu este datorata unei interferente directe cu etapa electrochimica ci unor reactii chimice anterioare transferului de electroni. De exemplu, dimerizarea, disproportionarea sau protonarea intermediarilor poate fi inhibata de o viteza de difuziune mica a acestora, datorita formarii filmului adsorbit.
Meites si coautorii au descris un exemplu de inhibare care are loc la reducerea eterului metilic al acidului p-clorofenilpropiolic:
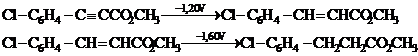
![]()
Autorii au demonstrat ca folosind ca solvent alcool etilic 25% si saruri de tatraalchilamoniu (R4N+X-) ca electrolit suport, procesul de reducere depinde de natura lui R. atunci cand R = Me polarograma inregistreaza doua unde bielectronice, iar pe masura ce R creste (≥ C4) se inregistreaza o singura unda polarografica tetraelectronica. Cele doua unde polarografice corespund reducerii lui 1 la 2 si respectiv 2 la 3. Ionii tetraalchilamoniu sunt puternic adsorbiti pe suprafata electrodului, iar atunci cand R ≥ C1 fenomene de adsorbtie sunt cu atat mai pronuntate.
4 Accelerarea proceselor de electrod
Spre deosebire de cazurile anterioare in care adsorbtia inhiba procesele de electrod, adsorbtia poate facilita anumite reactii care in alte conditii nu sunt posibile. Acest caz reprezinta situatia general intalnita in care special electroactiva este chiar adsorbatul, iar anumite proprietati electrochimice si chimice pot fi imbunatatite printr-o orientare geometrica favorabila sau datorita unei concentratii mai mari la suprafata electrodului comparativ cu interiorul solutiei (prin contrast, inhibarea este frecvent intalnita la electroliza compusilor in prezenta substantelor tensioactive).
Un exemplu il constituie electroliza Kolbe care implica oxidarea anionilor carboxilati in apa sau metanol. Atunci cand se folosesc anozi din platina se obtin produsi dimerici, RR prin intermediari radicalici, iar cand se folosesc anozi din carbon, in aceleasi conditii, se obtin alcooli, eteri (reactie Hofer-Moest) avand ca intermediari ioni carboniu:
![]() (VII.17)
(VII.17)
Diferenta de comportament electrochimic a fost explicata de Ross prin prezenta pe suprafata electrodului de carbon a numeroase centre paramagnetice care retin puternic orice radical format intermediar, impiedica desorbtia lor si favorizeaza oxidarea ulterioara la ioni carboniu.
|