METODE DE PROTECTIE ANTICOROZIVA A MATERIALELOR METALICE
Consideratii teoretice
Protectia impotriva coroziunii reprezinta totalitatea masurilor care se iau pentru a proteja materialele tehnice de actiunea agresiva a mediilor corosive.
Desi exista metale si aliaje care prezinta o buna rezistenta la coroziune, acestea sunt de obicei scumpe. De aceea s-au stabilit diferite metode pentru a proteja impotriva coroziunii metalelor uzuale, usor accesibile.
Cauzele coroziunii fiind variate si metodele de protectie sunt variate; ele se pot clasifica in cateva categorii mari :
Straturi protectoare
Inhibitori si pasivizatori
Conditionarea mediului coroziv
Protectia catodica
Straturile protectoare. Acestea sunt cele mai vechi si mai aplicate metode de protectie. Dupa natura lor, ele pot fi: metalice, anorganice si organice.
a) Straturile metalice pot fi obtinute prin diferite procedee: galvanizare, metalizare, difuziune, cufu 525c21f ndare in metal topit, placare etc.
Galvanizarea consta in depunerea unui strat prin electroliza. In general, pentru acoperirea fierului se folosesc zincul, cromul si plumbul.
Metalizarea consta in aplicarea unui metal protector, in stare topita si pulverizata pe suprafata de protejat. Ea se face cu flacara oxiacetilenica in care se topeste o sarma din metalul ce trebuie depus, pulverizarea fiind facuta cu aer comprimat.
Difuziunea – consta in tratarea suprafetei unui metal cu un metal de protectie; la temperatura inalta la care are loc operatia, la suprafata metalului se formeaza un strat protector alcatuit dintr-o solutie solida a celor doua metale.
Cufundarea in metal topit – se face de obicei pentru acoperirea fierului cu un metal care are punctul de topire mai mic, metale ca plumbul, staniul sau zincul.
Placarea - consta in presarea sau laminarea, la cald, a doua metale diferite. Metalul care trebuie placat se toarna intr-o forma captusita cu metalul protector, dupa care se lamineaza. Aderenta stratului protector la metalul de baza se face datorita fortelor mecanice si datorita difuziunii.
b) Straturile anorganice sunt si ele de diferite tipuri. Astfel, suprafata obiectului metalic se poate supune unor tratamente chimice pentru obtinerea unei pelicule ce prezinta o buna rezistenta la coroziune.
Oxidarea - consta in formarea pe suprafata metalica a unei pelicule din oxidul metalului, sub actiunea aerului. Adeseori stratul natural de oxid creste cand metalul este supus unor tratamente speciale cu oxidanti puternici sau pe cale electrochimica.
Fosfatarea – consta in formarea pe suprafetele obiectelor metalice a unei pelicule protectoare formata din fosfatul metalului respectiv. Acesta se realizeaza prin introducerea metalului in solutii acide de fosfati de fier, de zinc sau de mangan.
c) Straturile organice formeaza un izolant intre metal si mediul coroziv. Ele trebuie sa fie adezive, continue si impermeabile.
Inhibitori si pasivizatori. Inhibitorii sunt substante care, adaugate mediului corosiv, micsoreaza sau chiar anuleaza viteza de coroziune. Nu exista reguli generale asupra naturii inhibitorului. Pasivizatorii actioneaza asupra metalului modificandu-i potentialul fata de solutia in care este introdus.
Conditionarea mediului coroziv. Uneori coroziunea metalelor poate fi atenuata daca se indeparteaza componentele corozive din mediul cu care vine in contact metalul.
Protectia catodica. O noua metoda de protectie contra coroziunii o reprezinta indrumarea fluxului de electroni in directia opusa aceleia in care are loc coroziunea metalului, prin crearea in mod artificial a unui cuplu galvanic special.
Prin aplicarea metodelor moderne de protectie impotriva coroziunii se economisesc anual mii de tone de materiale metalice, care altfel ar fi distruse. De aceea, dezvoltarea tehnicii moderne pune in fata tehnicienilor si a oamenilor de stiinta nu numai sarcina de imbunatatire a calitatiilor materialelor existente, ci si aceea de descoperire a celor mai eficiente mijloace de protectie a acestora.
1.1 Protectia catodica cu anozi de sacrificiu
Scopul lucrarii
In lucrarea experimentala se vor masura cu un instrument universal tensiunile electromotoare ale fierului neprotejat si ale Zn, Al, Cu suprapuse pe rand pe fier fata de electrodul de referinta Cu/CuSO4. Comparand semnele si valorile potentialului de electrod al fierului singular si al fierului legat cu Zn, Al si Cu fata de electrodul de referinta, se vor pune in evidenta ce metale pot fi utilizate ca anozi de sacrificiu.
Introducere
Protectia catodica cu anozi de sacrificiu este o metoda electro-chimica de protectie impotriva coroziunii ce se aplica la constructiile metalice in contact cu solul, apa marilor sau atmosfera (conducte de otel pentru transportul fluidelor, stalpi metalici de sustinere, rezervoarele, cazanele, coloanele de extractie, cablurile etc).
Principiul metodei de protectie catodica consta in modificarea potentialului de coroziune al sistemului metalic de protejat spre valori atat de negative incat coroziunea sa nu mai poate avea loc.
Protectia catodica cu anozi de sacrificiu se realizeaza practic prin fixarea pe suprafata metalica de protejat a unor bare, placi, benzi metalice speciale denumite anozi de sacrificiu, anozi solubili sau anozi activi. Anozii de sacrificiu sunt alcatuiti dintr-un metal sau aliaj cu potential de coroziune in mediul dat mai negativ decat al metalului de protejat. De exemplu: pentru protectia sistemelor pe baza de Fe se folosesc Zn, Al, Mg si aliajele lor.
Reactiile chimice in coroziunea cu depolarizare de hidrogen sunt:
In medii acide
Reactie de ionizare a metalului (oxidare), M M+z +ze-
(Fe Fe+2 + 2e-)
si Reactie de depolarizare (reducere), zH++ze- z/2 H2
(2H+ + 2e- H2)
Reactie globala: M+ zH+ M+z + z/2 H2,
(Fe + 2H+ Fe+2 + H2)
In medii neutre si alcaline
Reactie de oxidare, M M+z +ze-
(Fe Fe+2 + 2e- )
Reactie de depolarizare (reducere), zH2O+ze- zOH- + z/2 H2
(2H2O+2e- 2OH- + H2)
Reactie globala: M + zH2O M+z + zOH- + z/2 H2,
(Fe + 2H2O Fe+2 + 2OH- + H2)
Coroziune cu depolarizare de oxigen:
In medii acide
Reactie de oxidare, M M+z +ze-
Fe Fe+2 + 2e-
Reactie de depolarizare, zH++z/4 O2 +ze- z/2H2O
2H++1/2 O2 +2e- H2O
Reactie globala: M+ zH++z/4 O2 M+z +z/2H2O,
Fe+ 2H++1/2 O2 Fe+2 +2H2O
In medii neutre si alcaline
Reactie de oxidare, M M+z +ze-
Fe Fe+2 + 2e-
Reactie de depolarizare (reducere), z/2 H2O +z/4O2+ze zOH-
H2O +1/2O2+2e- 2OH-
Reactie globala: M+z/2 H2O +z/4O2 M(OH)z,
Fe+ H2O +1/2O2 Fe(OH)2
Eficienta protectiei catodice cu anozi de sacrificiu este asigurata de mentinerea constanta a potentialului de protectie impus. Controlul protectiei catodice se realizeaza prin masurarea potentialului de coroziune al sistemului metalic de protejat fata de un electrod de referinta prin intermediul unui voltmetru electronic.
Aparatura si substante: electrozi de Fe, Cu, Zn, Al si electrodul de referinta Cu/CuSO4, medii corozive: acid, neutru si alcalin, instrument universal de masura.
Mod de lucru
Placutele (electrozii) de Zn, Fe, Al, Cu se curata cu hartie de smirghel inaintea fiecarei masuratori. Se alcatuiesc urmatoarele pile galvanice de coroziune:
(-) Fe/mediu coroziv//electrod de referinta (+)
(-) Fe+M /mediu coroziv//electrod de referinta (+),
unde: M este Zn, Fe, Al, Cu, iar mediul coroziv va fi: NaCl 1N, NaOH 0.1N, H2SO4 0,1N succesiv.
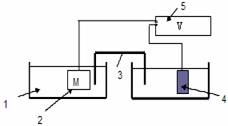 Pilele electrochimice de mai sus se
realizeaza introducand electrodul de Fe si electrodul de referinta (Cu/CuSO4) in vasul continand solutia coroziva. Electrozii
pilei electrice se leaga la bornele aparatului de masura astfel incat t.e.m. sa
fie pozitiva (Fig. 4.6.3.1)
Pilele electrochimice de mai sus se
realizeaza introducand electrodul de Fe si electrodul de referinta (Cu/CuSO4) in vasul continand solutia coroziva. Electrozii
pilei electrice se leaga la bornele aparatului de masura astfel incat t.e.m. sa
fie pozitiva (Fig. 4.6.3.1)
celula electrolitica;
M - Zn, Al sau Cu;
punte electrolitica;
electrod de Cu/CuSO4;
multimetru.
Fig. 4.6.3.1. Celulǎ electrochimic
Rezultate si calcule:
Se noteaza pentru fiecare pila electrica indicata in tabelul de mai jos marimea tensiunii electromotoare, (Eexp), dupa doua minute cand se atinge o valoare relativ constanta;
Se calculeaza potentialul de electrod al fierului si al sistemului Fe+Zn, Fe+Al, Fe+Cu pe baza relatiei:
![]()
in care![]() =0.34 [V],
iar sistemul metalic este Fe, Fe+Zn, Fe+Al, Fe+Cu.
=0.34 [V],
iar sistemul metalic este Fe, Fe+Zn, Fe+Al, Fe+Cu.
Deci ![]() = 0.34 – Eexp
= 0.34 – Eexp
Rezultatele obtinute din masuratorile experimentale si din calcule se inscriu intr-un tabel conform modelului:
|
Nr. det. |
Pila galvanica de coroziune |
Eexp. [V] |
jsistem [V] |
Zn, Al, Cu poate (nu poate) fi anod de sacrificiu |
|
(-)Fe/NaCl//CuSO4/Cu (+) | ||||
|
(-)Fe+Cu/NaCl//CuSO4/Cu (+) | ||||
|
(-)Fe+Zn/NaCl//CuSO4/Cu (+) | ||||
|
|
(-)Fe+Al/NaCl//CuSO4/Cu (+) | |||
|
(-)Fe/H2SO4//CuSO4/Cu (+) | ||||
|
(-)Fe+Cu/H2SO4//CuSO4/Cu (+) | ||||
|
(-)Fe+Zn/H2SO4//CuSO4/ Cu (+) | ||||
|
(-)Fe+Al/H2SO4//CuSO4/Cu (+) | ||||
|
(-)Fe/NaOH//CuSO4/Cu (+) | ||||
|
(-)Fe+Cu/NaOH//CuSO4/Cu (+) | ||||
|
(-)Fe+Zn/NaOH//CuSO4/Cu (+) | ||||
|
(-)Fe+Al/NaOH//CuSO4/Cu (+) |
Interpretarea rezultatelor:
Daca potentialul sistemului metalic Fe + alt metal (Zn, Cu, Al) este mai negativ decat potentialul Fe, intr-un mediu coroziv dat, atunci metalul cu care s-a asociat Fe este anod de sacrificiu. In caz contrar, metalul de asociere nu este anod de sacrificiu. De asemenea, in functie de valoarea potentialului sistemului metalic (Fe + alt metal) se apreciaza care metal este cel mai bun protector pentru Fe, intr-un mediu coroziv dat.
|