PRINCIPII DE FORMARE A STRUCTURII MINERALE
2.1 Stabilitatea structurii minerale
Așa cum s-a arătat în capitolul introductiv, mineralele reprezintă cristale cu o compoziție chimică definită. Cu alte cuvinte, ele reprezintă un sistem de particule (atomi, ioni, molecule) care interacționează, această interacțiune având drept consecință apariția unei configurații spațiale caracteristice, numită structură minerală. Cunoscând natura particulelor constitutive și a tipului de interacțiune dintre acestea putem explica și, până la un punct chiar anticipa, structura cristalină a unui mineral.
O primă întrebare ridicată de analiza structurilor mineralelor ar putea fi: "De ce se leagă aceste particule între ele pentru a forma un edificiu cristalin? ". Răspunsul la această întrebare este dat de condiția de echilibru a sistemului mineral, adică de tendința sistemelor minerale de a atinge faze cât mai stabile în condiții date. Există două moduri de abordare a stabilității sistemelor minerale:
a) Stabilitatea termodinamică folosește drept criteriu de studiu al echilibrului energia liberă de reacție ∆G. Se consideră transformarea minerală A→B. Dacă energia liberă de reacție are valoare pozitivă (∆G>0), compusul A este mai stabil decât compusul B. În consecință, sistemul evoluează în sensul scăderii energiei libere (∆G<0). Valoarea energiei libere de reacție depinde în primul rând de presiunea și temperatura sistemului mineral, deci o anumită structură va fi stabilă termodinamic într-un anumit domeniu de temperatură și presiune. Evoluția unui sistem spre starea de echilibru termodinamic urmărește două reguli fundamentale:
1. Creșterea temperaturii favorizează structuri cu grad scăzut de ordonare a elementelor la nivelul structurii.
2. Creșterea presiunii favorizează structuri dense care ocupă volume specifice mai mici.
b) Stabilitatea cinetică. O structură minerală instabilă termodinamic în anumite condiții de temperatură și presiune se poate menține un timp îndelungat atunci când conversia spre o altă structură mai stabilă se produce cu o viteză (rată) neglijabilă. Această structură se numește metastabilă termodinamic, dar stabilă cinetic. De exemplu, structura diamantului rezistă în condiții normale de temperatură și presiune, deși, în acest domeniu este instabilă termodinamic. Potrivit analizei termodinamice, ea ar trebui să evolueze spre structura grafitului, stabilă în aceste condiții. Deoarece rata de transformare a diamantului în grafit este neglijabilă, diamantul se consideră stabil cinetic în condiții normale de temperatură și presiune. Existența mineralelor metastabile termodinamic, dar stabile cinetic poate fi explicată prin faptul că adaptarea acestora nu se poate face totdeauna spontan, fiind necesară o energie de activare a transformării.
2.2. Legături chimice. Dimensiunile efective ale atomilor
în structura mineralelor (Raze cristalochimice)
O structură minerală presupune existența unei interacțiuni între elementele chimice existente, a cărei explicație trebuie căutată în tendința de evoluție spre starea de echilibru. Privit la scară atomică, echilibrul se referă la stabilitatea învelișurilor electronice ale atomilor componenți.
O scurtă analiză a elementelor chimice arată faptul că doar în cazul gazelor nobile este stabilă termodinamic configurația electronică a unui atom liber în condiții normale de temperatură și presiune. Pentru toate celelalte elemente chimice această configurație nu este stabilă termodinamic în condiții normale. Astfel, pentru atingerea stării de echilibru, atomii acestor elemente chimice interacționează cu alți atomi, fie ai aceluiași element, fie ai unor elemente diferite. Aceste interacțiuni sunt reprezentate prin legăturile chimice.
Legăturile chimice și valențele elementelor chimice sunt foarte importante pentru înțelegerea structurii cristaline a mineralelor, dar ele au fost elaborate în special pentru a explica structurile moleculelor, astfel încât este necesară o abordare particulară a lor pentru a explica interacțiunea din spațiul cristalin. Într-un cristal, fiecare atom este înconjurat de alți atomi aflați în imediata lui vecinătate, la distanțe definite, interacționând cu aceștia. Interacțiunea nu se restrânge la acest nivel, atomul respectiv interacționând direct sau indirect și cu atomii din a doua, a treia, etc. vecinătate. Așadar, formarea cristalului rezultă din interacțiunea colectivă a atomilor constituenți, putând fi privită ca un rezultat al forțelor atractive și repulsive dintre atomi.
Să luăm de exemplu halitul, NaCl. Dacă scriem formula acestuia Na+Cl- în acord cu valențele atomilor, am putea deduce faptul că mineralul este format din molecule izolate de Na+Cl-. În realitate, în structura halitului fiecare ion de Na este înconjurat de 6 ioni de Cl și apoi de alți 12 ioni de Na (sau invers), situație ce nu poate fi explicată prin formula Na+Cl-. Vom vedea mai târziu că și implicarea unui atom într-o astfel de legătură depinde numărul atomilor care îl înconjoară (vezi conceptele de coordinare și electrovalență). Această configurație a atomilor de Na și Cl este impusă de condiția de echilibru a acestor elemente chimice în condiții termodinamice date (presiune, temperatură).
Clasificarea convențională a legăturilor chimice cuprinde: legătura covalentă, legătura ionică, legătura metalică, legătura Van der Waals, legătura de hidrogen. Aceste tipuri de legături reprezintă de fapt niște modele care nu pot explica total situațiile reale din structurile minerale din două motive principale:
- nu se poate vorbi despre legături pur covalente, pur ionice, etc., ci de legături care se apropie în mai mică sau mai mare măsură de unul dintre aceste modele, cel mai adesea putând fi interpretate ca niște legături intermediare între acestea;
- legătura dintre doi atomi nu poate fi izolată perfect din contextul interacțiunii colective.
Consecința interacțiunilor din spațiul cristalin este reprezentată de dispoziția atomilor într-un aranjament ordonat, caracterizat prin existența unor poziții și a unor distanțe interatomice definite care reflectă tipul de forțe dintre ei. Dimensiunea atomilor implicați în această interacțiune depinde și ea de tipul de legătură, fiind cunoscut faptul că atomii nu au dimensiuni (raze) definite. Dimensiunea (raza) atomului implicat într-o interacțiune se numește raza cristalochimică și ea este definită de tipul predominant de legătură chimică (covalentă, ionică, etc.). Putem discuta deci despre raze ionice, covalente, etc., ale atomilor. Datorită faptului că modelele legăturilor chimice amintite nu pot explica perfect tipul de legătură dintre atomi, razele cristalochimice calculate pe baza tipului predominant de legătură nu pot nici ele să coincidă cu dimensiunile reale ale atomilor din structură, dar calculul lor poate fi util pe de o parte în explicarea parțială a tipului de legătură și pe de altă parte în înțelegerea comportamentului chimic al mineralelor.
2.2.1. Modelul legăturii ionice. Raza ionică.
 Atunci când prin interacțiunea învelișurilor
electronice ale atomilor vecini se produce un transfer de electroni de la un
atom la celălalt apar ioni care se resping electrostatic. Această legătură se
numește legătura ionică și apare în
structuri minerale relativ simple, formate din atomi ai metalelor tipice si ai
nemetalelor. Legătura din aceste structuri nu este pur ionică; chiar și la
compușii considerați ionici tipici apare o anumită fracție de legătură
covalentă ca urmare a întrepătrunderii învelișurilor exterioare ale atomilor.
Cristalochimiștii au căutat o modalitate de a descrie tendința atomilor de a
forma o legătură ionică și de a estima fracția ionică/covalentă a legăturii.
Atunci când prin interacțiunea învelișurilor
electronice ale atomilor vecini se produce un transfer de electroni de la un
atom la celălalt apar ioni care se resping electrostatic. Această legătură se
numește legătura ionică și apare în
structuri minerale relativ simple, formate din atomi ai metalelor tipice si ai
nemetalelor. Legătura din aceste structuri nu este pur ionică; chiar și la
compușii considerați ionici tipici apare o anumită fracție de legătură
covalentă ca urmare a întrepătrunderii învelișurilor exterioare ale atomilor.
Cristalochimiștii au căutat o modalitate de a descrie tendința atomilor de a
forma o legătură ionică și de a estima fracția ionică/covalentă a legăturii.
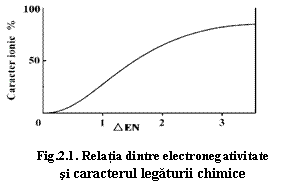
Prima încercare a fost făcută de Pauling prin introducerea conceptului de electronegativitate (EN) care măsoară tendința de a câștiga/pierde electroni. El a oferit o astfel de scală empirică a electronegativității, folosind următorul criteriu: când se combină doi atomi, electronii exteriori se deplasează spre atomul cu electronegativitate mai ridicată (anion). Pentru aprecierea fracției ionice/covalente, el a utilizat diferența electronegativităților atomilor care se combină (∆EN), elaborând o diagramă de apreciere empirică a fracției ionice a legăturii (fig. 2.1).
Electronegativitatea poate fi determinată mai riguros pe baza potențialului de ionizare I+ și a energiei de atracție a electronilor (afinitatea pentru electroni) I- determinate pentru stările de valență respective. Astfel, electronegativitatea χ se calculează:
![]()
Ionicitatea legăturii ε: ![]()
Sarcina efectivă a ionului
implicat în legătura ionică z': ![]()
unde n = valența ionului, e- = sarcina electronului
Exemplu NaCl: ε = 0,82; z, = 0,82e-,n = 1. Rezultă din aceste valori faptul că atât Na, cât și Cl, care au valența 1, participă cu o fracție de 0,82 în legătura ionică, restul până la 1 (0,18) reprezentând fracția covalentă a legăturii dintre Na și Cl.
Raza ionică. La ionizarea unui atom metalic prin cedare de electroni (cation), penultimul înveliș electronic al atomului, complet ocupat, devine înveliș exterior, astfel încât raza cationului este mai mică decât raza atomică inițială; ex.: rNa = 1,713 Å; rNa+ = 0,278 Å. La ionizarea unui atom nemetalic prin acceptare de electroni (anion), învelișul exterior al atomului se completează, devenind "mai dens", astfel încât raza anionică rămâne aproximativ egală cu raza atomului inițial; ex.: rCl = 0,725 Å; rCl- = 0,742 Å.
 La NaCl, distanța dintre atomul de Na și atomul de Cl măsurată (prin
difracție RX) este aproximativ egală cu suma razelor atomice ale Na și Cl și
mai mare decât suma razelor lor ionice. Să vedem cum se explică această
situație.
La NaCl, distanța dintre atomul de Na și atomul de Cl măsurată (prin
difracție RX) este aproximativ egală cu suma razelor atomice ale Na și Cl și
mai mare decât suma razelor lor ionice. Să vedem cum se explică această
situație.
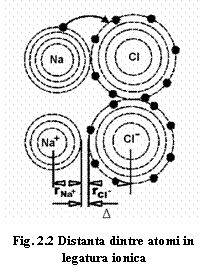
Considerăm un compus ionic A+B-. Distanța dintre ionii A și B(de exemplu Na și Cl) se poate scrie:
d(A+B-) = r(A+) + r(B-) + ∆
Semnificația fizică a valorii ∆ (fig.2.2): ∆ indică distanța minimă de la penultimul înveliș al cationului la care pot fi poziționați următorii electroni, indiferent dacă ei formează învelișul extern al atomului metalului neutru sau dacă sunt electroni ai învelișului extern al unui atom vecin. Așadar, deși atomii s-au ionizat prin încorporarea electronului în învelișul extern al anionului, distanța dintre aceștia nu s-a modificat.
Valoarea razei ionice a unui atom depinde de numărul atomilor din imediata vecinătate (numărul de coordinare).
2.2.2 Modelul legăturii covalente. Raza covalentă
 Legătura covalentă este definită de obicei ca
o legătură chimică direcționată, realizată prin perechi de electroni. O astfel
de legătură biatomică este stabilă deoarece atomii își realizează configurația
de octet a stratului de valență prin intermediul zonei de suprapunere
(întrepătrundere), presupunând că electronii de valență ai acestei zone sunt
comuni ambilor atomi. Această regulă este interpretată calitativ prin tendința
de formare a orbitalilor electronici stabili cu perechi de electroni cu spini
antiparaleli și poate fi explicată prin mai multe modele dintre care vom
aminti:
Legătura covalentă este definită de obicei ca
o legătură chimică direcționată, realizată prin perechi de electroni. O astfel
de legătură biatomică este stabilă deoarece atomii își realizează configurația
de octet a stratului de valență prin intermediul zonei de suprapunere
(întrepătrundere), presupunând că electronii de valență ai acestei zone sunt
comuni ambilor atomi. Această regulă este interpretată calitativ prin tendința
de formare a orbitalilor electronici stabili cu perechi de electroni cu spini
antiparaleli și poate fi explicată prin mai multe modele dintre care vom
aminti:
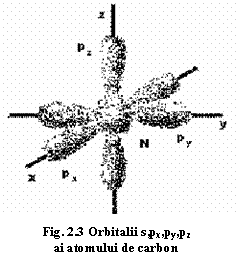
a) Hibridizarea orbitalilor. Sa luăm de exemplu legătura dintre C și H. Configurația electronică a stratului exterior al atomului de C este: 2s22p2, cu o distribuție a electronilor arătată schematic în figura 2.3. Apropierea atomilor de C și H determină rearanjarea electronilor în atomul de C. Într-o primă etapă are loc excitarea acestuia, deci trecerea stratului de valență într-o configurație 2s12p3. Următoarea etapă presupune hibridizarea atomului de C: dintr-un orbital s și trei orbitali p rezultă patru orbitali hibrizi sp3 (fig. 2.3 Această nouă configurație îi este necesară atomului de C pentru a asigura o suprapunere mai bună a învelișului său electronic peste învelișul atomilor de H. Va rezulta astfel o moleculă CH4 cu configurație tetraedrică în anumite condiții date.
Configurația spațială a moleculelor care se formează prin legarea a două tipuri de ioni depinde de numărul perechilor de electroni care participă la legătură: 2-liniară, 3-trunghiulară, 4-tetraedrică, 5-dipiramidal trigonală, 6-octaedrică, etc.

b) Orbitalul molecular. Acest model de explicare a legăturii covalente pornește de la generalizarea modelului hibridizării orbitalilor, presupunând că orbitalii ocupați de un singur electron aparțin câmpului tuturor nucleelor atomice care formează cristalul (molecula) și ia în considerație interacțiunea acestor orbitali. Rezultă astfel mai multe tipuri de legături:
- legătura σ rezultă din următoarele tipuri de orbitali: s+s, s+p și p+p (legătură liniară);
- legătura π rezultă din următoarele tipuri de orbitali: p+p (legătură paralelă),p+d și d+d;
- legătura δ rezultă prin combinarea a doi orbitali d.
O structură minerală care poate fi explicată prin acest model este structura grafitului. La grafit, legătura dintre atomii de C implică hibridizarea sp2 a acestora: dintr-un orbital s și doi orbitali p rezultă trei orbitali hibrizi sp2 și un orbital p (pz) (fig.2.6 fiecare dintre aceștia fiind ocupat de câte un electron. Acest tip de hibridizare permite legarea atomului de C de atomii vecini astfel:
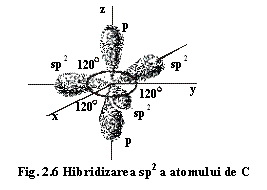

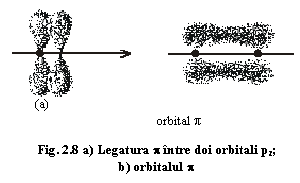
- orbitalii sp2 cu o dispoziție planară și cu unghiul de legătură= 120° între ei asigură legarea atomului de alți trei atomi de carbon în acest plan printr-o legătură σ, cu unghiul de legătură 120° (fig. 2.6., 2.7.);
- orbitalul p, cu o dispoziție verticală, ocupat cu un electron se leagă "lateral" (paralel) de orbitalii p ai atomilor vecini printr-o legătură π (fig. 2.7.), electronii din acești orbitali devenind "delocalizați", aparținând în aceeași măsură tuturor atomilor implicați în legătură, constituind astfel așa-numitul orbital π.
Pentru a înțelege legăturile din cadrul compușilor covalenți este necesar să cunoaștem structura atomică a elementului chimic și tipul de orbital molecular/hibrid pe care îl poate forma în interacțiune cu un alt element chimic.
Ca și în cazul legăturii ionice, și în cazul legăturii covalente există un anumit procent de legătură ionică, cu excepția unor structuri covalente tipice (de exemplu legătura C-C din diamant). Aprecierea fracției ionice a legăturii este mai complexă și se poate deduce folosind ecuația lui Schrödinger.
Raza covalentă se deduce din distanțele interatomice măsurate între atomii aceluiași element implicați într-o legătură covalentă. Calculul acestei raze trebuie să ia în considerație faptul că raza covalentă depinde de tipul de legătură (simplă, dublă etc.) și de numărul de coordinare al atomului respectiv în structura considerată. De exemplu raza covalentă a carbonului s-a calculat pornind de la legătura covalentă simplă C-C din diamant, unde distanța dintre atomi d(C-C)=1,54Å. Rezultă raza covalentă a carbonului 0,77Å. În cazul legăturilor covalente în care intervine un anumit grad de ionicitate, distanța dintre atomi diferă de suma razelor lor covalente printr-un termen care depinde de valoarea electronegativității elementelor chimice respective.
2.2.3. Modelul legăturii metalice. Raza atomică în metale
Natura legăturii metalice este asemănătoare cu cea a legăturii covalente deoarece implică unirea electronilor din învelișurile externe ale atomilor. Particularitatea acestei legături constă în aceea că localizarea (distribuția) acestor electroni este diferită. În atomii metalici, orbitalii externi sunt ocupați de un număr mic de electroni, iar potențialul de ionizare I+ este foarte scăzut. În cele mai multe cazuri, acești orbitali sunt de tip s. Când atomii metalici se apropie pentru a forma cristale, acești orbitali se suprapun cu un număr mare de orbitali identici (la Au de exemplu cu 12). Distribuția electronilor în acest caz corespunde conceptului de "gaz" de electroni liberi în metale.
La Au, Ag și Cu de exemplu, în orbitalul s există doar câte un singur electron. În cazul în care atomii se apropie, electroni de valență nu mai aparțin unui atom sau unei perechi de atomi, ci aparțin întregului cristal, formând benzi de valență. La atomii izolați, orbitalii s au aceeași energie; la atomii legați, aceștia vor avea energii puțin diferite, determinând despicarea nivelului energetic în n nivele energetice (n=număr de atomi). Ansamblul acestor nivele energetice formează o bandă de energie. Electronii din banda de valență tind să ocupe orbitalii din nivelele energetice minime în perechi cu spin opus. De exemplu, n atomi de Cu au n electroni și 2n poziții electronice disponibile. Electronii vor ocupa jumătatea inferioară a benzii de energie, cea superioară rămânând vacantă, formând banda de conducție. Absorbind o cantitatea minimă de energie, o parte din electronii din banda de valență pot trece ușor în banda de conducție, formând așa-numitul "gaz electronic" responsabil pentru proprietățile fizice specifice metalelor.
Raza atomică a metalelor se calculează ca fiind jumătate din distanța interatomică din structura metalului respectiv și este influențată de numărul de coordinare.
2.2.4. Modelul legăturii Van der Waals. Raza Van der Waals
 În structurile formate din molecule cu sarcini
electrice compensate (neutre) se poate întâmpla ca centrele de greutate ale
sarcinilor pozitive și negative ale moleculei să nu coincidă. În aceste cazuri
moleculele se comportă ca dipoli
electrici permanenți care interacționează, conferind coeziune cristalului.
În structurile formate din molecule cu sarcini
electrice compensate (neutre) se poate întâmpla ca centrele de greutate ale
sarcinilor pozitive și negative ale moleculei să nu coincidă. În aceste cazuri
moleculele se comportă ca dipoli
electrici permanenți care interacționează, conferind coeziune cristalului.
Astfel de forțe de natură electrostatică se observă și în absența unui dipol permanent, având drept cauză mișcarea electronilor prin care se realizează o oarecare densitate electronică în spațiul intermolecular. Acest fenomen apare mai ales la substanțele cu molecule de dimensiuni reduse la care modificarea rapidă a pozițiilor electronilor induce efecte tranzitorii de dipol capabile să mențină coeziunea cristalului.
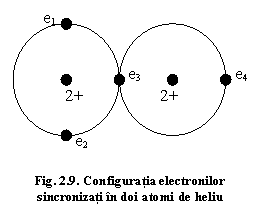
O astfel de situație oferă spre exemplu heliul, o substanță care cristalizează la o temperatură foarte scăzută (-272°C). Configurația electronică a atomului de heliu este 1s2.Învelișul electronic al atomului de heliu are o simetrie sferică, dar dacă am putea face observații asupra unui atom pentru un timp foarte scurt raportat la viteza electronilor, simetria acestuia nu ar fi sferică. În consecință, într-o observație punctuală de timp atomul poate fi polar sau dipolar. Dacă doi atomi de heliu se apropie, se va manifesta o tendință de corelare sau sincronizare a electronilor lor datorită corelării sarcinilor (fig. 2.9). Putem considera că fiecare dintre atomi induce un dipol în atomul vecin, iar orientarea acestor dipoli este sincronizată.
Trebuie notat că astfel de forțe acționează în toate materialele solide, aducând o contribuție redusă forțelor de tip ionic sau covalent. De asemenea astfel de legături sunt mult mai slabe decât cele descrise anterior, considerate legături tari, iar intensitatea lor descrește repede cu creșterea distanței dintre atomi sau molecule.
Raza Van der Waals se calculează ca jumătate din distanța cea mai mică observată între atomii aceluiași element, măsurată în molecule neutre învecinate sau între strate (pachete) neutre de atomi. Distanțele dintre atomii implicați în legături Van der Waals depășesc cu 50-100% distanțele caracteristice legăturilor mai puternice amintite mai sus și, în consecință razele Van der Waals ale elementelor chimice depășesc cu mult valoarea razelor atomice, ionice sau covalente.
2.2.5. Modelul legăturii de hidrogen
 Prin dimensiunile sale reduse și prin
configurația electronică simplă (1s1),
atomul de hidrogen are o valoare deosebită în stabilirea unor legături
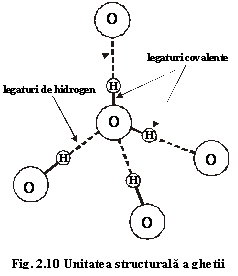
interatomice. Un exemplu în acest sens în constituie legătura realizată în
unele cristale de gheață unde un atom de oxigen este înconjurat de patru atomi
de hidrogen, iar un atom de hidrogen este înconjurat de doi atomi de oxigen. În
această structură atomii de oxigen (cu configurația inițială a stratului de
valență 2s22p4)
sunt hibridizați sp3,
având o configurație tetraedrică: patru orbitali hibrizi dintre care doi sunt
ocupați cu câte un electron, iar doi sunt ocupați cu câte doi electroni. Cei
doi orbitali hibrizi ocupați cu câte un electron se întrepătrund cu doi
orbitali s provenind de la doi din
cei patru atomi de hidrogen vecini formând legături covalente. Ceilalți doi
orbitali ocupați cu câte doi electroni vor realiza legături mai slabe cu atomii
de hidrogen legați covalent de alți atomi de oxigen. Astfel fiecare moleculă H2O
este înconjurată de alte patru molecule, legătura principală (covalentă, mai
puternică) realizându-se prin intermediul atomilor de hidrogen. Distanța O-O
între două molecule vecine este 2,76Å.
Prin dimensiunile sale reduse și prin
configurația electronică simplă (1s1),
atomul de hidrogen are o valoare deosebită în stabilirea unor legături
interatomice. Un exemplu în acest sens în constituie legătura realizată în
unele cristale de gheață unde un atom de oxigen este înconjurat de patru atomi
de hidrogen, iar un atom de hidrogen este înconjurat de doi atomi de oxigen. În
această structură atomii de oxigen (cu configurația inițială a stratului de
valență 2s22p4)
sunt hibridizați sp3,
având o configurație tetraedrică: patru orbitali hibrizi dintre care doi sunt
ocupați cu câte un electron, iar doi sunt ocupați cu câte doi electroni. Cei
doi orbitali hibrizi ocupați cu câte un electron se întrepătrund cu doi
orbitali s provenind de la doi din
cei patru atomi de hidrogen vecini formând legături covalente. Ceilalți doi
orbitali ocupați cu câte doi electroni vor realiza legături mai slabe cu atomii
de hidrogen legați covalent de alți atomi de oxigen. Astfel fiecare moleculă H2O
este înconjurată de alte patru molecule, legătura principală (covalentă, mai
puternică) realizându-se prin intermediul atomilor de hidrogen. Distanța O-O
între două molecule vecine este 2,76Å.
Așadar, legăturile dintre oxigen și hidrogen într-o moleculă H2O sunt covalente, iar legăturile dintre moleculele H2O se fac prin punți de hidrogen (fig.2.10). Distanțele dintre atomul de oxigen și patru atomi de hidrogen nu sunt egale: două sunt mici (reflectă legătura covalentă) și două sunt mari (reflectă legătura de hidrogen), astfel încât atomul de hidrogen nu se află la jumătatea distanței dintre atomii de oxigen vecini. Această simetrie creează un moment electric dipolar responsabil pentru legătura de hidrogen.
2.3. Modelul geometric al structurii cristaline
Teoria formării structurii cristaline dintr-o asociație de atomi care interacționează este bazată pe principii generale de termodinamică, fizica solidului și mecanica cuantică. În același timp, rezultatul acestei interacțiuni este surprinzător de simplu privit geometric: în celula elementară a unei structuri periodice tridimensionale atomii ocupă poziții fixate la distanțe definite unul de celălalt. Abordând aceasta geometrie fără se ține seama de cauzele sale fizice, folosind anumite date chimice și fizice relativ simple, geometrizate, se pot înțelege multe dintre caracteristicile structurii atomice a mineralelor. O astfel de abordare se referă la modelul geometric al structurii cristaline.
În acest model se iau în considerare doar atomii și moleculele, distanțele dintre ele și coordinarea lor. Pornind de la razele cristalochimice, atomii pot fi considerați drept sfere rigide, iar moleculele ca solide cu aspect mai complex. Apoi se analizează împachetarea acestora. Considerațiile geometrice sunt completate cu informații asupra legăturilor chimice. Modelul geometric al structurii cristaline este astfel versiunea cea mai simplificată a modelului său fizic. Bineînțeles că el nu poate explica structura în toate detaliile, dar poate descrie anumite particularități într-o formă grafică.
2.4. Unitățile structurale ale mineralelor. Tipuri de structuri
Conceptul "structură atomică a mineralului" implică faptul că unitatea structurală ultimă a mineralului este atomul. În anumite cazuri însă, înainte de formarea propriu-zisă a mineralului sau în timpul formării sale, atomii se combină în anumite grupuri stabile care sunt păstrate în cristale ca entități și pot fi privite ca unități structurale ale mineralului; exemple SiO4 la silicați, CO3 la carbonați, SO4 la sulfați etc. Aceste unități sunt finite dimensional; ele pot fi insulare sau se pot grupa între ele în complexe unidimensionale (ex.: lanțuri), bidimensionale (ex.: rețele plane) sau tridimensionale (ex.: carcase).
Divizând cristalele în unități structurale potrivit tipurilor de asociere ale atomilor se poate urmări dacă forțele de legătură chimică ce acționează între atomi sunt aceleași în întreaga structură. Dacă forțele sunt aceleași, structurile se numesc homodesmice; exemple: structurile metalelor și unele structuri covalente sau ionice. Dacă tipurile de legătură diferă, structurile se numesc heterodesmice. În cazul acestora se pot separa anumite unități structurale cu legături total sau parțial covalente, legate de restul structurii prin alte tipuri de legături (ionice, Van der Waals etc.).
2.5. Împachetări atomice compacte
În lumea minerală, în formarea structurii guvernează principiul ocupării maxime: atomii sau unitățile structurale complexe ale mineralului tind întotdeauna să se apropie unii de alți astfel încât să asigure contactul maxim permisibil. Aceasta se traduce la nivelul structurilor printr-o tendință de ocupare maximă a spațiului tridimensional. Pentru a urmări cum se reflectă acest principiu vom utiliza modelul structural geometric al structurii minerale, considerând atomii niște sfere rigide, cu raza constantă.
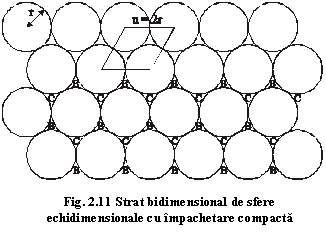 Considerăm un sistem de atomi echidimensionali
cu raza atomică r și vom urmări modul
în care trebuie să se așeze pentru a ocupa la maximum un spațiu bidimensional.
Așezarea cea mai compactă o constituie o rețea plană în care o sferă este
înconjurată de alte șase sfere identice (fig.2.11). Celula
elementară a motivului este hexagonală, având parametrul a=2r.
Considerăm un sistem de atomi echidimensionali
cu raza atomică r și vom urmări modul
în care trebuie să se așeze pentru a ocupa la maximum un spațiu bidimensional.
Așezarea cea mai compactă o constituie o rețea plană în care o sferă este
înconjurată de alte șase sfere identice (fig.2.11). Celula
elementară a motivului este hexagonală, având parametrul a=2r.
Acest strat structural este caracterizat prin trei poziții structurale:
- poziția A reprezentată prin centrele atomilor;
- poziția B dată de centrele golurilor (interstițiilor) orientate cu vârful în sus;
- poziția C dată de centrele golurilor (interstițiilor) orientate cu vârful în jos.
Datorită faptului că centrele sferelor acestui strat ocupă pozițiile A, stratul se numește strat A.
Pentru a obține o rețea tridimensională cu ocuparea maximă a spațiului trebuie să suprapunem peste acest strat un strat echivalent, astfel încât atomii celui de-al doilea strat să se suprapună peste golurile stratului inferior. Dacă stratul următor ca avea sferele poziționate peste golurile de tip B se va numi strat B, iar împachetarea va fi caracterizată prin succesiunea AB; dacă stratul următor va avea sferele poziționate peste golurile de tip C se va numi strat C, iar împachetarea va fi caracterizată prin succesiunea AC.
Poziționarea celui de-al treilea strat se poate face în mai multe moduri, dintre care vom descrie două, ambele suprapunându-se peste o împachetare AB:
a) sferele celui de-al treilea strat se vor poziționa în pozițiile A, rezultând împachetarea ABAB..., numită împachetare (structură) hexagonală compactă, caracteristică structurii magneziului (fig.2.12);
b)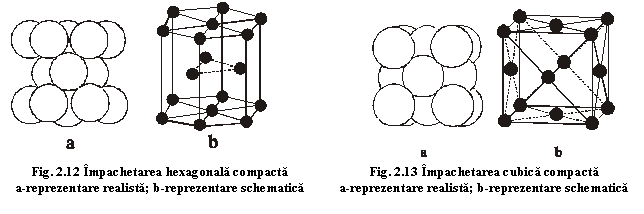 sferele
celui de al treilea strat se vor poziționa în pozițiile C, rezultând împachetarea ABCABC...,
numită împachetare (structură) cubică
compactă, caracteristică structurii
cuprului (fig.2.13).
sferele
celui de al treilea strat se vor poziționa în pozițiile C, rezultând împachetarea ABCABC...,
numită împachetare (structură) cubică
compactă, caracteristică structurii
cuprului (fig.2.13).
2.6. Coordinarea
Analizând structura unui mineral este importantă investigarea vecinătății atomilor, a unităților structurale sau a interstițiilor, definită de: numărul vecinilor, caracteristicile acestora, distanțele până la ei. Aceste caracteristici sunt descrise de conceptul de coordinare.
Analiza câtorva structuri simple (structurile metalelor și ale unor compuși ionici) arată faptul că vecinii din imediata apropiere a unui atom (interstițiu) dat, sunt poziționați simetric în raport cu acesta și se află dispuși la distanțe egale; numărul lor se numește număr de coordinare NC. Acești atomi, numiți liganzi formează prima sferă de coordinare a atomului (interstițiului) dat. Următorii vecini formează în continuare a doua, a treia etc. sferă de coordinare. În structurile mai complexe distanțele până la liganzi pot fi ușor diferite, dar ei se includ total în prima sferă de coordinare, întrucât distanțele până la ei sunt mult mai mici decât distanțele până la atomii din următoarele sfere de coordinare.
Unind centrele atomilor din prima sferă de coordinare (liganzilor) prin linii drepte, obținem un poliedru convex numit poliedru de coordinare; numărul vârfurilor acestuia este egal cu numărul de coordinare. Distanțele dintre centrul și vârfurile poliedrului au semnificația distanțelor dintre atomul (interstițiul) coordinat și liganzii săi, iar distanțele dintre vârfuri sunt egale cu distanțele dintre liganzi.
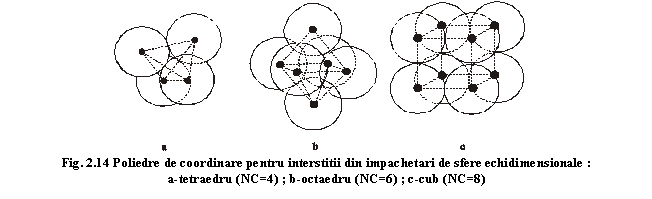 Pentru înțelegerea conceptului de coordinare
vom analiza mai întâi coordinarea interstițiilor din câteva împachetări ale
unor sfere echidimensionale, reprezentate în fig.2.14.
Pentru înțelegerea conceptului de coordinare
vom analiza mai întâi coordinarea interstițiilor din câteva împachetări ale
unor sfere echidimensionale, reprezentate în fig.2.14.
În împachetarea compactă reprezentată în fig. 2.14a interstițiul este înconjurat (coordinat) de patru atomi cu dispoziție spațială; rezultă un număr de coordinare (NC=4), cei patru atomi fiind dispuși în vârfurile unui tetraedru care constituie poliedrul de coordinare. Putem spune simplu că acest interstițiu este coordinat tetraedric. Interstițiul împachetării compacte reprezentate în fig.2.14b este coordinat de șase atomi (NC=6) situați în vârful uni octaedru, deci se spune că este coordinat octaedric. În fine, interstițiul împachetării din fig.2.14c este coordinat de opt atomi situați în vârfurile uni cub: NC=8 și coordinare cubică.
În structurile mai complexe atomii nu sunt echidimensionali, însă majoritatea structurilor cu atomi inechidimensionali pot fi privite ca împachetări de atomi echidimensionali cu interstiții ocupate de atomi cu dimensiuni mai reduse. Analiza acestor structuri arată faptul că există anumite restricții dimensionale privind ocuparea interstițiilor și în plus există o anumită legătură între dimensiunile atomilor și tipul de coordinare.
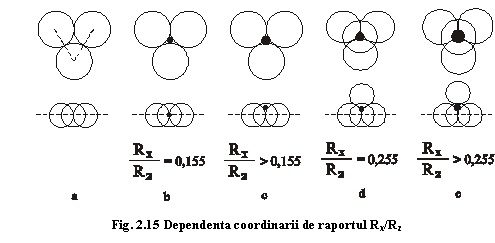 Să urmărim așadar cum evoluează raporturile de
coordinare în împachetările compacte în funcție de atomii care pot ocupa
interstițiile acestora. Pornim de la un interstițiu coordinat trigonal planar
dintr-un strat bidimensional cu împachetare compactă (fig.2.15a). Dacă în acest interstițiu
poziționăm un alt atom, el trebuie să respecte principiul ocupării maxime,
adică să aibă contact cu toți cei trei atomi care îl coordinează. Această
condiție este îndeplinită în situația în care raportul razelor atomice g=Rx/Rz este egal
cu 0,155 (fig.2.15b),
unde Rx este raza atomului central, coordinat triunghiular, iar Rz
raza atomilor care formează prima sferă de coordinare. Dacă atomul poziționat
în interstițiu are o rază mai mare (adică raportul Rx/Rz depășește 0,155), centrul său nu se mai
află în același plan cu atomii învecinați, deci nu mai avem o coordinare
trigonal planară în care atomul central și liganzii săi să se afle în același
plan (fig.2.15c). Această
situație se menține valabilă până la un raport Rx/Rz egal cu 0,255, situație în care atomul
central se află în contact cu patru sfere echidimensionale cu centrele dispuse
în vârfurile unui tetraedru; trecem așadar la o coordinare tetraedrică (fig.2.15d). Pentru un
raport Rx/Rz care
depășește această valoare, deși atomul central este coordinat tetraedric,
aranjamentul nu mai respectă principiul ocupării maxime, deoarece liganzii nu
se mai ating; se iese astfel dintr-o coordinare tetraedrică tipică.
Să urmărim așadar cum evoluează raporturile de
coordinare în împachetările compacte în funcție de atomii care pot ocupa
interstițiile acestora. Pornim de la un interstițiu coordinat trigonal planar
dintr-un strat bidimensional cu împachetare compactă (fig.2.15a). Dacă în acest interstițiu
poziționăm un alt atom, el trebuie să respecte principiul ocupării maxime,
adică să aibă contact cu toți cei trei atomi care îl coordinează. Această
condiție este îndeplinită în situația în care raportul razelor atomice g=Rx/Rz este egal
cu 0,155 (fig.2.15b),
unde Rx este raza atomului central, coordinat triunghiular, iar Rz
raza atomilor care formează prima sferă de coordinare. Dacă atomul poziționat
în interstițiu are o rază mai mare (adică raportul Rx/Rz depășește 0,155), centrul său nu se mai
află în același plan cu atomii învecinați, deci nu mai avem o coordinare
trigonal planară în care atomul central și liganzii săi să se afle în același
plan (fig.2.15c). Această
situație se menține valabilă până la un raport Rx/Rz egal cu 0,255, situație în care atomul
central se află în contact cu patru sfere echidimensionale cu centrele dispuse
în vârfurile unui tetraedru; trecem așadar la o coordinare tetraedrică (fig.2.15d). Pentru un
raport Rx/Rz care
depășește această valoare, deși atomul central este coordinat tetraedric,
aranjamentul nu mai respectă principiul ocupării maxime, deoarece liganzii nu
se mai ating; se iese astfel dintr-o coordinare tetraedrică tipică.
Aplicând acest principiu în continuare se poate urmării modul în care raportul Rx/Rz influențează tipul de coordinare a unui atom poziționat în interstițiile unei împachetări de sfere echidimensionale; această influență este reprezentată în tabelul 2.1. Am amintit în capitolul precedent faptul că modelul geometric structural simplifică foarte mult situațiile existente în structurile minerale. În consecință această dependență pur geometrică a coordinării de raportul dimensional al atomilor nu poate explică total structurile minerale. Ea se poate aplica însă cu suficient succes în structurile predominant ionice care pot fi privite ca împachetări compacte ale anionilor (Z) în interstițiile cărora se poziționează cationii (X). Astfel razele cristalochimice care se iau în considerație în calculul raportului Rx/Rz sunt razele ionice.
Evident că nici în cazul structurilor preponderent ionice acest model geometric nu este universal valabil deoarece, după cum am arătat, practic nu există legături pur ionice, ele conținând totdeauna o anumită fracție covalentă, astfel încât razele cristalochimice ale ionilor din structură diferă de cele calculate pentru o legătură pur ionică. Totuși au existat preocupări ale cristalochimiștilor de a rezolva această problemă. Dată fiind posibilitatea cunoașterii unor distanțe interatomice din difractometrie, calculul coordinării se poate baza pe acestea, ignorând razele ionice care nu reprezintă decât niște valori convenționale. Acest criteriu de calcul este g'=d(XZ)/rz, unde d(XZ) este distanța dintre centrul și vârfurile poliedrului de coordinare (adică distanța cation-anion), iar 2rz reprezintă distanța dintre doi anioni alăturați (muchia poliedrului de coordinare). În tabelul 2.1 sunt reprezentate relațiile dintre valorile g, g' și coordinare.
Tabelul 2.1 Relația dintre coordinare și dimensiunile atomilor
|
g'=d(XZ)/rz |
g=Rx/Rz |
NC |
Poliedru de coordinare |
|
|
triunghi |
|
|||
|
tetraedru |
|
|||
|
|
octaedru |
|
||
|
cub Thompson (dodecaedru trigonal) |
|
|||
|
cub |
|
|||
|
cuboctaedru |
|
|||
Conceptul de coordinare se folosește și pentru unitățile structurale sau molecule. În această situație se analizează vecinătatea unității structurale (moleculei) pornind din centrul acesteia, procedându-se ca și în cazul atomilor izolați sau a interstițiilor.
Un poliedru de coordinare dat poate fi izolat în structură sau legat de alte poliedre identice sau diferite, prin vârfuri, muchii sau fețe. Poliedrul de coordinare nu este doar o metodă de a descrie structurile mineralelor; el are și o semnificație fizică și chimică atunci când reprezintă fie o unitate structurală (SiO4 la silicați), fie o combinație a unui atom central cu atomii înconjurători, combinație comună în multe structuri complexe (octaedrul MeO6, Me=metal). În fig.2.16 sunt reprezentate poliedre de coordinare descrise în structurile cristaline în general, unele dintre acestea fiind caracteristice și structurilor minerale. Cele mai frecvente poliedre de coordinare din structurile mineralelor sunt tetraedrul și octaedrul; cu răspândire mai redusă întâlnim triunghiul, cubul și dodecaedrul trigonal.
Trebuie să notăm faptul că în structurile minerale poliedrele de coordinare nu sunt totdeauna regulate, adică distanțele dintre atomul central și liganzii săi pot fi ușor diferite. Aceste diferențe dimensionale reflectă diferențe în ceea ce privește legăturile chimice existente în interiorul poliedrului de coordinare ca urmare a influenței celorlalți atomi din structură (interacțiunea colectivă).

2.7. Poziții interstițiale în structurile compacte
 Unele structuri minerale mai complexe, formate
din mai
Unele structuri minerale mai complexe, formate
din mai
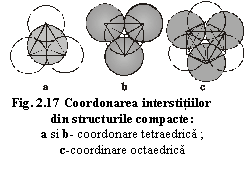
multe tipuri de atomi, reprezintă în fapt împachetări compacte ale atomilor de dimensiuni mari (de obicei anioni), în interstițiile cărora se află alte tipuri de atomi de dimensiuni mai mici (în general cationi). Aceste interstiții se află între oricare două strate de atomi ale împachetării compacte și pot prezenta două tipuri de coordinări. (fig.2.17):
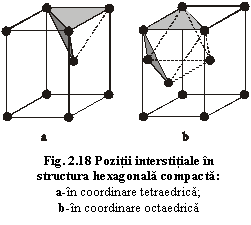
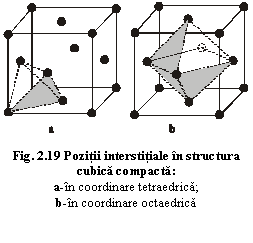
a) coordinare tetraedrică: între trei anioni ai unui strat și un anion al unui strat inferior (fig.2.17a) sau superior (fig.2.17b);
b) coordinare octaedrică: între trei anioni ai unui strat și trei anioni ai unui strat superior sau inferior (fig.2.17c).
În celula elementară a structurii hexagonale compacte există două interstiții în coordinare octaedrică și patru în coordinare tetraedrică ce pot fi ocupate de doi și respectiv patru cationi (fig.2.18). În celula elementară a structurii cubice compacte există patru interstiții în coordinare octaedrică și opt în coordinare tetraedrică ce pot fi ocupate de patru respectiv opt cationi (fig.2.19).
 Tipul cationilor care pot ocupa aceste
interstiții este limitat printre altele de criteriile geometrice g=Rx/Rz (0,225
pentru interstițiile tetraedrice și 0,414 pentru cele octaedrice) și g'=d(XZ)/rz (1,225 pentru
interstițiile tetraedrice și 1,414 pentru cele octaedrice). Din cauza faptului
că anionii care coordinează un cation se resping reciproc, ei pot să nu se
atingă. Această repulsie a anionilor permite ca raza cationului din interstițiu
să poată fi puțin mai mare, crescând astfel valoarea raportului g (respectiv g') permis. În consecință valorile celor două raporturi vor fi
următoarele pentru interstiții:
Tipul cationilor care pot ocupa aceste
interstiții este limitat printre altele de criteriile geometrice g=Rx/Rz (0,225
pentru interstițiile tetraedrice și 0,414 pentru cele octaedrice) și g'=d(XZ)/rz (1,225 pentru
interstițiile tetraedrice și 1,414 pentru cele octaedrice). Din cauza faptului
că anionii care coordinează un cation se resping reciproc, ei pot să nu se
atingă. Această repulsie a anionilor permite ca raza cationului din interstițiu
să poată fi puțin mai mare, crescând astfel valoarea raportului g (respectiv g') permis. În consecință valorile celor două raporturi vor fi
următoarele pentru interstiții:
- tetraedrice: g=0,225-0,414; g'=1,225-1,414;
 - octaedrice: g>0,414; g'>1,414.
- octaedrice: g>0,414; g'>1,414.
Limitele utilizării criteriului geometric g al ocupării pozițiilor interstițiale de către cationi se datorează existenței unei fracții de legătură covalentă în orice legătură ionică, fapt ce determină ca razele cristalochimice ale ionilor să fie diferite de razele ionice folosite în calculul raportului. Este preferabilă utilizarea raportului g' care exclude valorile razelor ionice și utilizează distanțe interatomice ce pot fi măsurate direct (distanța cation-anion și distanța anion-anion), fără a se ține seama de tipul de legătură chimică.
2.8. Valența electrostatică
Având în vedere faptul că aranjamentul tridimensional al atomilor care
caracterizează structura unui mineral reprezintă rezultatul interacțiunii
colective la nivelul cristalului, conceptul de valență chimică definit în
chimia moleculară nu poate explica total legăturile chimice dintre atomii unui
cristal. Un exemplu în acest sens îl poate oferi structura halitului NaCl. Am
arătat deja faptul că legăturile chimice dintre Na și Cl în această structură
sunt preponderent ionice, având drept cauză transferul electronilor de la Na
spre Cl. Valența chimică a ionului de Na este 1+, astfel încât,
potrivit chimiei moleculare, ionului de Na+ îi este suficient un ion
de Cl- pentru a-și satisface sarcina electrică. În realitate, în
structura halitului fiecare ion de Na este coordinat octaedric de șase ioni de
Cl (și invers), situație ce nu poate fi explicată de valențele chimice 1+
pentru Na și 1- pentru Cl. Existența a șase ioni de coordinare nu
poate fi explicată decât dacă acceptăm că ionul central se leagă de toți cei
șase liganzi ai săi. Pentru a calcula sarcina efectivă cu care ionul central se
implică în legătură se folosește conceptul de valență electrostatică: ![]() , unde n =
valența chimică a ionului central, iar NC = numărul său de coordinare (numărul
liganzilor). În situația halitului, veNa veCl 1/6.
Alte exemple: Si din unitatea structurală SiO4, coordinat tetraedric
de oxigen, are valența electrostatică 1+; Al din unitatea structurală AlO4,
coordinat tetraedric de oxigen are valența electrostatică +3/4; C din unitatea
structurală CO3, coordonat trigonal planar de oxigen, are valența
electrostatică +2/3 etc.
, unde n =
valența chimică a ionului central, iar NC = numărul său de coordinare (numărul
liganzilor). În situația halitului, veNa veCl 1/6.
Alte exemple: Si din unitatea structurală SiO4, coordinat tetraedric
de oxigen, are valența electrostatică 1+; Al din unitatea structurală AlO4,
coordinat tetraedric de oxigen are valența electrostatică +3/4; C din unitatea
structurală CO3, coordonat trigonal planar de oxigen, are valența
electrostatică +2/3 etc.
|