REAC II REDOX. ELECTROZI. POTENŢIAL DE ELECTROD
Īn procesele ELECTRO-CHIMICE se transforma reciproc energia chimica si energia electrica a reactiilor chimice. Transformarile se fac prin reactii REDOX care au loc īn sistemele electrochimice, alcatuite din electroliti si electrozi. Reactiile RED-OX sunt alcatuite din doua reactii simultane: reactia de REDucere si reactia de Oxidare, ambele avānd loc prin transfer de electroni si deci prin modificarea numerelor de oxidare (N.O).
N.O. - numarul de oxidare sau starea de oxidare, īnlocuieste notiunea de valenta si este numarul care reprezinta sarcina electrica, pozitiva sau negativa, pe care o are particula participanta la reactia redox. Pentru elementele chimice din compusii ionici , N.O. reprezinta sarcini electrice reale.
Reactia de reduCERE este o reactie īn care o particula dintr-o anumita specie chimica (atom, ion, radical liber, molecula), notata Ox1 , CERE electroni (accepta electroni) de la o alta particula, transformāndu-se īn forma redusa, notata Red1, adica:
Ox1 + ze- Red1 (reactie de reducere)
Ox1 - este forma oxidata iar Red1- forma redusa a particulei (1) dintr-o specie chimica.
Reactia de oxiDARE este o reactie īn care o particula dintr-o anumita specie chimica , notata Red2 da electroni (cedeaza electroni) altei particule transformāndu-se īn forma oxidata (Ox2), adica:
Red2 ze- + Ox2 (reactie de oxidare) unde:
Ox2 - forma oxidata a particulei (2) dintr-o alta specie chimica, iar Red2 este forma redusa.
Ecuatia rectiei finale RED-OX rezulta din īnsumarea algebrica a celor doua ecuatii (reducere + oxidare), respectānd conservarea sarcinilor electrice, astfel īncāt īn reactia finala sa nu apara electroni:
Ox1 + Red2 Red1 + Ox2
Īn reactiile de oxidare, valoarea algebrica a N.O. creste (devine mai pozitiva) indiferent daca la reactie participa oxigenul, specia chimica se oxideaza si are caracter reducator.
Īn reactiile de reducere, valoarea algebrica a N.O. scade (devine mai negativa); specia chimica se reduce si are caracter oxidant.
La echilibru, cele doua viteze ale reactiilor de reducere si oxidare sunt egale. Suprafata metalului se īncsrca electric cu + sau - , īn fun 747j93h ctie de natura metalului iar īn portiunea de electrolit vecina se vor acumula sarcini electrice de semn contrar (suprafata de separare rīmāne neutra). Se formeaza astfel un strat dublu electrochimic si apare o diferenta de potential electric numita potential de electrod de echilibru, notat eech, masurat īn V.
Pilele electrochimice sunt alcatuite din "lanturi electrochimice" formate din doua semielemente unite:
īn interiorul lor prin "punte de sare" sau printr-o diafragma prin care circula ioni;
īn exterior- prin conductori metalici, prin care circula electroni.
Fiecare semielement contine un electrod iar electrolitii pot fi comuni sau diferiti.
De ex., pila Daniell-Iacobi este astfel constituita:
(-)Zn/ZnSO4 (c2;a2)//CuSO4(c1;a1)/Cu(+)
Tensiunea electromotoare a unei pile electrice (t.e.m.)-la bornele pilei (īn circuit deschis) - este diferenta de potential electric dintre potentialele de electrod ale celor doi electrozi. Folosind potentialele de electrod de reducere:
E=ecatod eanod e e e e
Prin conventie, t.e.m. a pilei trebuie sa fie totdeauna pozitiva E>O, deci electronii trebuie sa circule īn circuitul exterior de la anod la catod.
Valorile numerice ale potentialelor de electrod de reducere pentru anod si catod, precum si pentru t.e.m. a pilei respecta ecuatia lui Nerst, de forma:
ei eio + (RT/(zF))lnAi
unde: F- numarul lui Faraday;
Ai - concentratia generalizata a componentului i;
eio - potentialul de electrod standard a componentului i.
īn functie de reversibilitatea proceselor de electrod: - pile reversibile si pile ireversibile;
īn functie de regenerarea reactantilor de la electrozi deosebim; - pile primare, - pile secundare, - pile de combustie, - pile hibride.
O pila reversibila īndeplineste urmatoarele conditii:
cānd circuitul este deschis, īn pila nu are loc nici o rectie chimica;
t.e.m. debitata este
sub actiunea unei tensiuni electrice exterioare, reactiile chimice sunt inverse fata de cele care au loc la functionarea pilei.
Īn practica se folosesc numai pile reversibile cu electrozi revrsibili, de ex: pila Daniell-Iacobi, pilele de gaze, pilele de concentratie. Acestea pot fi readuse totdeauna la starea initiala, trecānd prin ele un curent electric de sens invers celui furnizat.
Īn pilele de concentratie (de electrolit) nu au loc reactii chimice; se produce un transport de substanta de la o solutie de electrolit mai concentrata la una mai diluata. Contin doi electrozi identici, introdusi īn solutiile aceleasi sari dar de concentratii diferite, de ex:
(-)Ag/AgNO3(c2;a2)//AgNO3(c1;a1)/Ag (+), pentru care: E = (RT/F)ln(a1/a2)
Pila H2/O2 poate constitui un ex. de pila reversibila cu gaz:
(-)(Pt), H2(g)/sol. acida sau alcalina/O2(g),(Pt)(+).
Pile ireversibile - īndeplinesc urmatoarele conditii:
īn pila se produc transformari chimice chiar si atunci cānd nu debiteaza curent;
reactia chimica din pila decurge īntr-un singur sens;
t.e.m. scade foarte repede la functionarea pilei.
Pile primare - energia electrica este produsa prin consumarea unor reactanti aflati īn pila īn cantitati limitate. Regenerarea lor nu se face prin electroliza. Sunt folosite pentru alimentarea cu c.c. a radioreceptoarelor, calculatoare, ceasuri, stimulatoare cardiace, proteze auditive, sisteme de alarma, instalatii de telecomunicatii, sisteme de semnalizare, etc.
1. Pila primara Leclanche - cea mai larga utilizare practica.
(-)Zn/NH4Cl sol.ap. saturata absorbita pe material poros/MnO2,C(+)
Eo =1,5-1,6V
(-)Zn +2(OH)- Zn(OH)2 +2e-
(+)2MnO2 +2H2O +2e- 2MnO(OH) +2(OH)-
: 2H2O +2MnO2 Zn(OH)2 +2MnO(OH)
Anodul din Zn este folosit drept container pentru pila din 1888. Azi anodul este un aliaj Zn-Pb-Cd; electrolitul poate fi NH4Cl + ZnCl2 sol.ap. sau ZnCl2 sol.ap.; varianta alcalina contine o sol. ap. KOH 30%, imobilizata īn gel. Se pot lega īn serie, mixt sau paralel, formānd baterii cu Eborne (1,5-510)V.
2. Pile primare activate īn momentul folosirii - prin adaos de apa sau electrolit special. Se pot pastra inactive ani de zile. Ex:
(-)Mg/apa sau apa de mare/AgCl (sau CuCl sau PbCl2), C(+); Eo=1,7-1,9V
Mg +2AgCl MgCl2 +2Ag
Se poate asocia īn baterii mari de sute de volti, pentru scopuri speciale (ex. motoare de torpile).
3. Pila primara cu anod de Litiu - (varianta 1)
(-)Li/LiBr dizolvat īn AN/SO2 (l), C(+); Eo =3V.
functioneaza īntre -54 si +70oC.
2Li +2SO2 Li2S2O4
Se foloseste la balize sonore, echipamente cu vizibilitate nocturna, īn aviatie, programe spatiale, memorii de microprocesoare, amorsare rachete.
3. (varianta 2) - (-)Li/LiAlCl4;SOCl2/(C+10%PTFE)(+); Eo =3V.
functioneaza īntre -40-75oC.
4Li +2SOCl2 4LiCl +SO2 + S (PTFE - politetrafluoretena).
Se foloseste pentru radiosonde meteorologice, sisteme de alarma, masuratori submarine, aplicatii militare, actionari torpile, stimulatoare cardiace din 1974.
PILE SECUNDARE (ACUMULATORI)
Īn cazul ac., reactantii consumati īn timpul producerii energiei electrice -prin "descarcarea acumulatorului" se regenereaza prin electroliza, adica prin "īncarcarea acumulatorului".
Ca acumulator se poate folosi orice pila reversibila. Practic sunt preferate pilele īn care substantele initiale si cele finale sunt insolubile īn electrolit.
Acumulatorul cu electrolit acid (Plante 1859) - 90% din productia mondiala de ac. foloseste aprox. 1/3 din productia mondiala de plumb.
(-)Pb/H2SO4sol.ap.33% cu r =1,26g/cm3/PbO2(Pb) (+)
Cānd r scade la 1,19 g/cm3 (pentru ac. folosit la pornirea autovehiculelor) ac. se considera "descarcat" si trebuie "īncarcat" prin legarea electrozilor īn paralel cu polii unei surse de c.c.
(-)Pb + (SO4)2- PbSO4 + 2e-; e o =0,303 V; DGo =-13,95kcal;
(+)PbO2 + 4H+ + (SO4)2- + 2e- PbSO4 +2H2O; e o =1,682 V; DGo =-77,60kcal;
:Pb +PbO2 +2H2SO4 2PbSO4 +2H2O; Eo=1,985 V; DGo =-91,55kcal
Pentru micsorarea masei ac. si marirea rezistentei la coroziune, electrozii de plumb au fost confectionati sub forma de gratare, din aliaje Pb-Cd-Sb, apoi din plumb cu fibre de carbon si recent din plumb cu tesaturi din fibre de sticla. O solutie tehnica relativ noua din 1987 recurge la folosirea electrolitului imobilizat īn gel (cu ajutorul silicatului de sodiu-sticla solubila). Electrozii (+) si (-) sunt separati prin straturi izolatoare , rezistente la oxidare si stabile īn electrolit, pe baza de polimeri sintetici (polietilena, policlorura de vinil, rasini fenolice). Randamentul de curent al ac. cu Pb ajunge la 94-98% si suporta obisnuit 250-300 cicluri īncarcare-descarcare.
Acumulatorul Zn/Ni; acumulatorul Fe/Ni si acumulatorul Cd/Ni - sunt alcatuite astfel:
(-)Zn(sau Fe sau Cd)/KOH sol.ap.20+34% +(1-2%)LiOH/Ni(OH)3
Zn (sau Fe sau Cd) + 2NiO(OH) + 2H2O (descarcare-īncarcare) 2Ni(OH)2 +Zn(OH)2 sau Fe(OH)2 sau Cd(OH)2)
Eo =1,73 V (sau, respectiv 1,65; 1,38V)
Acumulatorul Fe/Ni suporta 3000 cicluri si se poate folosi īn conditii grele de lucru (iluminare trenuri sau actionare locomotive miniere).
Pile de combustie - sunt pile la care reactantii sunt alimentati continuu la electrozi īn tot timpul functionarii pilei. Reactantul de la anod se numeste combustibil si poate fi: H2, CO, NH3, N2H4. Reactantul de la catod se numeste oxidant si poate fi: O2, sau aer sau alt oxidant adecvat.
Reactiile generale care au loc la functionarea pilei sunt:
(-)combustibil ze- + produsi de oxidare a combustibilului;
(+)oxidant +ze- produsi de reducere a oxidantului.
Cei doi reactanti combustibilul si reactantul dau reactii de reducere si oxidare numai pe suprafata unor catalizatori metalici depusi pe suporturi: Pt, Pd, Ir, Au, Ag, Fe, Co, Ni. Pilele de combustie si-au gasit aplicatii terestre, spatiale si speciale. Se folosesc pentru: - alimentarea electrica a automobilelor ca baterii de 900W-max 2kW;
alimentarea cu energie electrica a navelor spatiale (Gemini, Apollo, Skylab, Soiuz) īn conditii de inponderabilitate, radiatii, variatii mari de temperatura;
ca surse de energie electrica independente si mobile pentru alimentarea locomotivelor electrice, statiilor radar mobile, propulsie submarine, etc.
O categorie speciala o reprezinta p.c. biochimice folosite pentru depoluarea apelor (energia electrica fiind un subprodus) sau pentru reciclarea deseurilor umane, cu ajutorul enzimelor īn cadrul misiunilor spatiale.
Pile cu electrolit solid - pot avea unii sau toti componentii īn stare solida. Electrolitii solizi trebuie sa aiba conductibilitate electrica predominant ionica, temperatura de topire mare si stabilitate structurala la temperaturi ridicate. Au aplicatii īn domeniul aerospatial (electroliti ceramici), stimulatoare cardiace si domenii speciale (dispozitive pentru circuite electronice sau senzori electrochimici).
Dispozitivele pentru circuite electronice pot fi sisteme cu memorie binara sau dispozitive cu afisare luminoasa. De ex. pila electrica solida folosita ca element de afisare a cifrelor cu 7 segmente:
Fig. 1 - Pila electrica
solida folosita ca element de afisare a cifrelor cu 7
segmente.
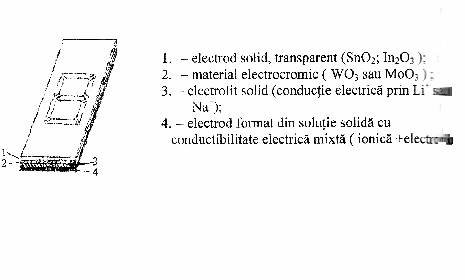
Ionii Li+ sau Na+ pot fi introdusi la
aplicarea unei tensiuni electrice de polarizare corespunzatoare īn filmul
subtire de material cu WO3 sau MoO3 modifcāndu-i
caracteristicile benzilor de absorbtie īn domeniul vizibil, deci culoarea
īn functie de cantitatea de ioni pozitivi.
Senzorii electrochimici - au importante utilizari īn tehnica, īn domenii largi de temperatura (300-1900K); de ex. senzori electrochimici de temperatura īnalta bazati pe pile de concentratie cu O2, care sunt detectori de oxigen de temperatura īnalta. O astfel de pila de concentratie cu O2 este:
(-)O2(a2), electrod poros/electrolit solid cu O2- mobil/electrod poros, O2(a2) (+)
Senzorii chimici pentru oxigen se pot folosi la:
-controlul compozitiei atmosferei īn timpul proceselor de combustie (pentru marirea eficientei arderii si optimizarea proceselor de combustie);
-controlul poluarii apei (prin masurarea cantitatii de oxigen necesar oxidarii substantelor organice impurificatoare din apa;
- masurarea cantitatii de oxigen dizolvat īn metale si aliaje topite sau īn sticle topite.
Din punct de vedere al domeniului de utilizare deosebim:
-apa potabila;
- apa industriala;
-apa folosita īn scop urban;
-apa folosita īn scop agricol.
Apa industriala īnseamna apa folosita:
-ca materie prima īn diferite industrii (alimentara, chimica, farmaceutica);
-ca substanta auxiliara īn diferite industrii (agent de racire sau īncalzire, solvent, mediu de reactie, agent de spalare, mijloc de transport al substantelor solide).
Īn natura nu exista apa pura, H2O, ci numai solutii foarte diluate de diferite substante anorganice si organice.
Prin tratarea apei se īntelege un ansamblu de procedee fizico-chimice de purificare a apelor naturale, pentru īmbunatatirea calitatii si caracteristicilor astfel īncāt sa corespunda indicilor de calitate standardizati.
Tratarile curente se refera la retinerea impuritatilor fine si grosiere prin: deznisipare, predecantare, perclorare (tratare cu Cl2, pentru reducerea cantitatii de materiale organice), aerare, coagulare (cu Al2(SO4)3, FeSO4), decantare, filtrare, dezinfectare (pentru reducerea īncarcaturii bacteriene) realizata prin prin procedee fizice (folosirea de radiatii g, UV, ultrasunete) sau prin procedee chimice (reactii chimice cu Cl2 (g), NaClO, CaOCl (clorura de var), cloramina, O3, KMnO4, īn anumite doze).
Tratarile speciale , necesare īn anumite cazuri, urmaresc: neutralizarea, dedurizarea si demineralizarea cu schimbatori de ioni, oxidarea, dezactivarea (pentru reducerea activitatii naturale), īndepartarea totala a O2 dizolvat din apele de alimentarea a cazanelor si generatoarelor de aburi.
Dupa utilizare, indiferent de domeniu, rezulta ape reziduale sau ape uzate, care se pot reutiliza si recicla dupa aducerea la parametrii corespunzatori.
Apele naturale contin:
gaze dizolvate din atmosfera obisnuita si din atmosfera regiunilor industriale;
substante anorganice, īn principal saruri dizovate (ioni) si chiar acizi (H2SO4, HNO3) ce determina ploi acide cu efect distrugator asupra vegetatiei si constructiilor metalice;
substante organice cu cele mai diferite proveniente;
organisme vii ce reprezinta microflora si microfauna apei;
Īn functie de solubilitatea lor, gazele dizolvate īn apa sunt:
usor solubile īn apa (CO2, NH3, H2S, HCl, SO2, SO3) ce pot chiar reactiona cu apa;
moderat solubile īn apa (aer, O2, N2);
greu solubile īn apa (H2, CO, CH4).
CO2 apare sub urmatoarele forme: liber agresiv si legat.
CO2 este CO2 aflat īn echilibru chimic cu ionii bicarbonat (HCO3);
CaCO3+H2O +CO2 (liber) Ca(HCO3)2
CO2 agresiv este CO2 īn exces, peste cantitatea de CO2 liber si necesar mentinerii echilibrului chimic. CO2 agresiv este capabil sa dizolve cantitati suplimentare de CaCO3.
CO2 legat se gaseste īn combinatii chimice sub forma ionilor bicarbonat (HCO3)- si carbonat (CO3)2-.
Continutul total de saruri dizolvate (ioni), reprezinta gradul de mineralizare al apei. Na+, K+, Ca2+, Mg2+, Al3+, Fe3+. si Cl-, (HCO3)-, (NO3)-, (OH)-, (SO4)2-, (CO3)2-, (PO3)3-. Continutul īn ioni al apei difera īn functie de sursa.
Duritatea apei este conferita de ionii de Ca2+ si Mg2+ prezenti īn apa sub forma de saruri solubile (bicarbonati, cloruri, sulfati, azotati). Īn multe industrii nu se poate folosi apa dura din cauza fenomenelor de depunere si pietrificare pe suprafetele metalice. Apa naturala contine peste 30 elemente chimice.
Duritatea totala a apei este o suma a duritatilor temporare si permanente, astfel:
-duritatea temporara (sau duritatea carbonica), dtp, datorata prezentei Ca(HCO3)2 si Mg(HCO3)2.
-duritatea permanenta, dp, datorata prezentei: CaCl2, CaSO4, Ca(NO3), MgCl2, MgSO4, Mg(NO3)2.
dT=dtp+dp sau dT= dCa +dMg, unde: dCa, respectiv dMg reprezinta duritatea de Ca respectiv Mg datorata tuturor sarurilor de Ca, respectiv Mg prezente īn apa.
Īn mod obisnuit, azotatii se gasesc īn cantitati foarte mici si nu se iau īn consideratie.
Duritatea apei se masoara si se exprima īn UM speciale, numite grade de duritate. Exista si se folosesc grade de duritate: german, francez, englez, american, rusesc. Īn Romānia se foloseste gradul german de duritate (od), care reprezinta un continut de saruri solubile de Ca si Mg īn apa dura, echivalent cu 10mg CaO/litrul de apa.
Īn functie de duritate, apele se clasifica īn:
-ape foarte moi dT<5od;
-ape moi cu duritate mica 5od <dT<10 od;
-ape cu duritate mijlocie 10 od <dT<20 od;
-ape dure 20 od <dT<30 od;
-ape foarte dure dT> 30 od.
Aciditatea apei este total nedorita din cauza accelerarii coroziunii metalelor: se datoreaza prezentei ionilor H+, proveniti din acizi minerali, prezentei CO2 liber, precum si prezentei sarurilor acizilor tari asociate bazelor slabe (BslabaAtare), care prin hidroliza dau solutii cu caracter acid;
(NH4)+ +H2O H+ +NH4OH
Sarurile care confera duritate apei deranjeaza prin coroziunea avansata a suprafetei metalelor si prin depunerile īn sistemele de īncalzire care au efecte directe asupra:
-consumului suplimentar de combustibil;
-supraāncalziri locale;
-transfer termic defectuos.
Natura chimica a depunerilor depinde de natura sarurilor continute īn apa dura.
Depunerile datorate dtp sunt constituite din CaCO3 si Mg(OH)2.
Ca(HCO3)2 t 60oC CaCO3 +H2O +CO2
CaCO3 este aproape insolubil īn apa si se depune pe suprafata metalelor ca o crusta spongioasa īn zonele reci si ca namol īn zonele mai calde. Similar:
Mg(HCO3)2 t 60oC MgCO3 +H2O +CO2
MgCO3 +H2O Mg(OH)2 +CO2 reactia globala va fi:
:Mg(HCO3)2 t 60oCMg(OH)2 +2CO2
Mg(OH)2 este si mai putin solubil decāt MgCO3 si se depune pe suprafetele metalice ca geluri, namoluri sau cruste.
Depunerile datorate dp contin numai CaSO4. Solubilitatea CaSO4 īn apa scade cu cresterea temperaturii, iese din solutie si se depune pe suprafetele metalice formānd cruste foarte dure, aderente si compacte īn zonele mai calde.
Celelalte saruri care confera apei duritate permanenta: MgSO4, MgCl2, CaCl2 sunt foarte solubile apa si ramān īn solutie chiar la temperaturi ridicate. Aceste saruri hidrolizeaza. Dānd nastere la acizi anorganici tari, care produc coroziunea metalelor.
Depunerile datorate SiO2 (ppm) prezente īn apa, simultan cu duritatea temporara sunt alcatuite din silicati de Ca si Mg: CaSiO3 si MgSiO3.
Ca(HCO3)2+SiO2 CaSiO3 +H2O +2CO2
Mg(HCO3)2+SiO2 MgSiO3 +H2O +2CO2
Crustele de silicati de Ca si Mg sunt cele mai periculoase depuneri, fiind compacte si aderente la suprafata metalelor cu o conductivitate termica foarte redusa.
METODE DE TRATARE A APEI
Metode chimice - aproape īntotdeauna se foloseste Ca(OH)2 sub forma de praf sau lapte de var (45-55g CaO/litru de solutie).
Este metoda practica cea mai moderna folosita pentru dedurizare, dezalcanizare si demineralizare partiala si totala.
Pentru eliminarea completa a duritatii se mai utilizeaza Na2CO3 si NaPO4. O solutie avantajoasa cupleaza doi reactivi: Ca(OH)2 si Na2CO3 (procedeul var-soda), unul din ei īndeparteaza dtp iar celalat dp.
# Ca(OH)2 va servi la īndepartarea dtp conform reactiilor:
Ca(HCO3)2 +Ca(OH)2 2CaCO3 +2H2O
Mg(HCO3)2 + Ca(OH)2 CaCO3 + MgCO3 + 2H2O
MgCO3 + Ca(OH)2 CaCO3 +Mg(OH)2
#Na2CO3 va servi la īndepartarea dp si transforma CaCl2 si CaSO4 īn CaCO3, iar MgCl2 si MgSO4 īn Mg(OH)2:
CaCl2 +Na2CO3 CaCO3 + 2NaCl
CaSO4 + Na2CO3 CaCO3 + Na2SO4
MgCl2 + Na2CO3 +H2O Mg(OH)2 + 2NaCl +CO2
MgSO4 +Na2CO3 +H2O Mg(OH)2 +Na2SO4 +CO2
Metoda cu schimbatorii de ioni - folosita pentru purificarea avansata a apei. Schimbatorii de ioni sunt substante organice si anorganice, generatoare de ioni, pe care īi pot schimba īn cantitati echivalente, prin reactii chimice cu ioni de acelasi semn din mediul cu care vin īn contact.
Exemple de schimbatori de ioni:
anorganici: argilele din sol;
anorganici-organici: complexul adsorbativ al solului (CAS);
organici sintetici: rasini sintetice schimbatoare de ioni.
Īn functie de sarcina electrica a ionilor de schimb, deosebim:
cationiti, capabili sa schimbe cationi; au forma generala R-H+;
anioniti, capabili sa schimbe anioni; au forma generala R+(OH)-, de obicei, sau R+Cl-, dupa cum ionul de schimb este (OH)-, respectiv Cl-.
Reactiile generale de schimb ionic pot fi notate astfel, (pentru R- radical organic macromolecular):
R-H+ + A-C+ R-C+ + H+A-
R+(OH)- + A-C+ R+A- +C+(OH)-
unde: C- cation: Ca, Mg, Na; A- anion: (HCO3), Cl, (NO3).
Folosind cationiti si anioniti se realizeaza demineralizarea totala a apei īn doua variante:
-se trece apa dura, succesiv, pe coloane cu s.i. RH si cu s.i. ROH;
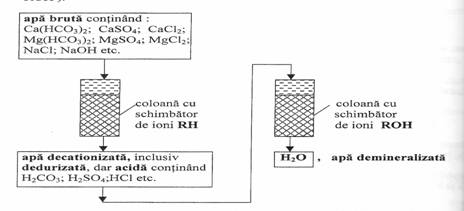
se trece apa dura pe coloane cu pat mixt de s.i.
(continānd un amestec de RH si ROH).
Īn ambele variante, reactiile de schimb ionic sunt aceleasi si anume:
reactii chimice de schimb ionic cu cationiti;
apa acida rezultata dupa tratarea cu RH sufera, īn continuare, reactii chimice de schimb ionic cu ROH, notate sub forma generala:
R+(OH)- + H+X- R+X- +H2O (apa demineralizata)
Reactia de schimb ionic cu anionitul ROH a ionilor carbonat si bicarbonat explica si retinerea CO2 legat pe s.i. si implicit, folosirea anionitilor pentru īndepartarea din ape a CO2 responsabil de coroziunea metalelor.
Dupa un timp de folosire, s.i. se epuizeaza si nu se mai pot folosi decāt prin regenerare, adica pot fi adusi la starea initiala prin tratarea cu reactivi corespunzatori.
Cationitii se regenereaza prin tratare cu o solutie apoasa diluata acida (HCl 3-5%) pentru a reveni la forma RH initiala:
R2-M2+ + 2H+Cl- 2R-H+ + M2+Cl-
s.i. epuizat s.i. regenerat
Anionitii se regenereaza prin tratare cu o solutie apoasa diluata alcalina (NaOH 3-5% ) pentru a reveni la forma ROH initiala:
R+X- + Na+(OH)- R+(OH)- + Na+X-
s.i. epuizat s.i. regenerat
Pentru obtinerea apei potabile din ape puternic mineralizate sau din apa de mare se folosesc membrane schimbatoare de ioni, cu care se realizeaza un schimb ionic continuu, schimbul de ioni si regenerarea au loc simultan pe ambele fete ale membranei.
La temperatura si presiune obisnuita, apa este lichida, īn timp ce elementele chimice vecine cu oxigenul īn sistemul periodic formeaza cu H2 combinatii chimice īn stare gazoasa:
NH3 (g); H2O(l); HF(g)
PH3 (g) ; H2S (g); HCl(g)
temperaturile de fierbere si de topire sunt anormal de ridicate;
densitatea apei variaza anormal cu temperatura, adica nu scade monoton cu temperatura, ca la celelalte lichide, ea prezinta un maxim la 4oC.;
de obicei, densitatea solidelor este mai mare decāt densitatea lichidelor, pentru aceeasi substanta; īn cazul apei este invers. La īnghetarea apei volumul creste cu aprox. 10%, ceea ce explica plutirea ghetii pe suprafata apei cu implicatii directe asupra vietii acvatice si a spargerii conductelor cu apa sub 0oC;
gheata sublimeaza; aprox. 30% din zapada cazuta se evapora;
temperatura de solidificare scade cu cresterea presiunii (la lichidele obisnuite-creste);
valoarea constantei dielectrice este anormal de ridicata;
caldura latenta de vaporizare a apei este anormal de mare;
tensiunea superficiala a apei este considerabil mai mare decāt a celorlalte lichide (cu exceptia Hg);
presiunea interna, ca masura a fortelor de legatura intermoleculara dintre moleculele de apa īn interiorul lichidului este de 22000at, mult mai mare decāt pentru celelalte lichide (2000-5000 at); presiunea interna se opune volatilizarii lichidului.
|