Cei 3 parametrii care determina complet starea termodinamica (TD) a unui gaz sunt:
Presiunea = Forta / Suprafata pe care actioneaza; p=F/S
Cei trei parametrii de stare ai gazului sunt legati intre ei prin ecuatia de stare (Clapeyron-Mendeleev):
pV = mRT
unde m este masa de gaz, iar R este o constanta proprie gazului;
Initial, ecuatia de stare a fost det 141e42b erminata experimental, apoi a fost reconfirmata de teoria cinetico-moleculara.
Sistemele termodinamice ( ∑TD ) sunt de doua feluri:
I. Primul principiu al termodinamicii (pentru sisteme inchise).
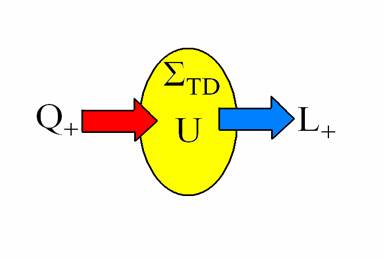
Caldura care intra in sistemul termodinamic este considerata prin conventie cu semnul ( + ).
Lucru mecanic pe care il presteaza sistemul catre mediul exterior este considerat prin conventie cu semnul (+).
Caldura aportata sistemului TD este suma intre lucru mecanic prestat de sistem si variatia energiei sale interne (PrI).
II. Principiul al doilea al termodinamicii.
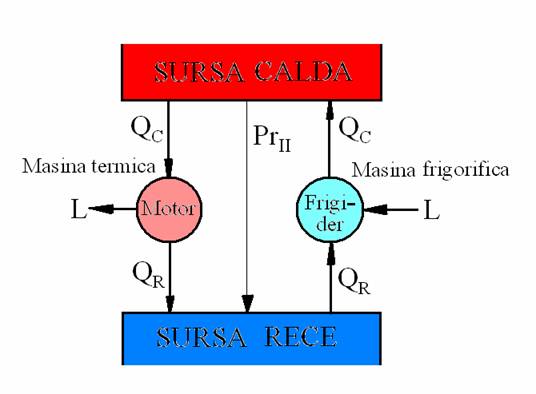
In mod natural
caldura se transfera de la corpul mai cald (sursa calda SC), la
corpul mai rece (sursa rece SR) (PrII).
Motorul termic (masina termica) este un agregat energetic interpus pe un flux de caldura intre o sursa calda si o sursa rece.
Qc reprezinta caldura preluata de la sursa calda, iar Qr caldura cedata sursei reci.
Din bilantul energetic aplicat unei masini termice, tinand cont ca acestea lucreaza dupa o evolutie ciclica, avem:
Qc = L + |Qr| , unde s-a considerat valoarea pozitiva pentru Qr, adica |Qr|, sau:
L = Qc - |Qr|
Definitie:
Se numeste randament termic, eficienta cu care masina termica transforma in lucru mecanic energia primita de la sursa calda.
ηT = L/Qc sau ηT = (Qc - |Qr|) /Qc = 1 - |Qr|/Qc
ηT = 1 - |Qr|/Qc
2.1.1. Relatii diferentiale de calcul
Un gaz se considera perfect daca sunt respectate urmatoarele ipoteze simplificatoare:
moleculele nu au volum propriu;
deplasarea moleculelor intre 2 ciocniri succesive se face rectiliniu si fara interactiuni intermoleculare;
moleculele se comporta perfect elastic in timpul ciocnirilor.
Definitie: Se numeste kilomol de substanta, cantitatea in kilograme numeric egala cu masa moleculara M a substantei (raportata la masa moleculara a hidrogenului, care este considerata egala cu 1).
Un kilomol de substanta contine acelasi numar de molecule si anume numarul lui Avogadro (N=6,0228 1026 molecule).
N = m / M , unde N este numarul de kilomoli dintr-o substanta, m este masa de substanta si M este masa moleculara a substantei.
M R = R , unde R este constanta gazului (proprie fiecarui gaz) iar R este constanta universala a gazelor perfecte (R=8314,3 +/- 0,4 J/kmol K).
Cum m = N M => pV = mRT = NMRT = NRT.
Daca N = 1 atunci pV = RT, si pentru conditii standard, adica p0=760 mmHg si T0=273,16 K, volumul este acelasi pentru orice gaz si se numeste volum molar (VN = 22,414 m3/kmol).
Marimile raportate la N se numesc marimi molare (caracter cursiv), iar marimile raportate la m se numesc marimi specifice (caracter mic).
Q = L + ∆U / d => dQ = dL + dU (d(∆U) = d(U U0) = dU)
daca impartim la m, avem:
q = l + ∆u dq = dl + du
Pentru un gaz perfect, conform ipotezei lui Joule, energia interna a gazului este numai functie de temperatura acestuia.
U=U(T) si u=u(T), iar pentru o evolutie reversibila (fara frecari) avem dL = p(V,T) dV deci:
dQ = dU + dL = dU + pdV
dq = du + pdv
Definitie: Se numeste entalpie suma intre energia interna U si lucrul mecanic de dislocatie pV al unui gaz perfect. Entalpia se noteaza cu I.
I = U + pV / : m => i = u + pv / d => di = du + d(pV) = du + pdV + Vdp
du = di - pdv - vdp => dq = du + pdv = di - pdv - vdp + pdv
dq = di - vdp
si i = u + pv = u + RT = u(T) + RT = i(T), deci si i, si similar I depind numai de T
Definitie: Se numeste caldura specifica, cantitatea de caldura necesara pentru a incalzi cu un grad un kilogram de substanta.
∆Q ∆q ∂q
c = ─── , sau c = ; In cazul gazelor, q=q(p,V,T), si atunci, pentru gaze, c =
m∆T ∆T ∂T
In evolutii particulare simplificatoare, in care schimbul de caldura se poate face la presiune constanta si/sau la volum constant (tempertura nu poate fi constanta), vom avea:
∂q │
cx = │ , unde x poate fi p sau V.
∂T│x=ct.
deci, din dq = du + pdv = di - vdp / dT si vom avea pentru v=ct.
dq du ∂q │
= = │= cv deoarece la v=ct., si dv=0, q=q(p,T), iar din ecuatia de stare
dT dT ∂T │v=ct.
pv=RT => p=R/vT=p(T), deci
q=q(p(T),T)=q(T)
si, similar:
dq di ∂q │
= = │= cp deoarece la p=ct., si dp=0, q=q(v,T), iar din ecuatia de stare
dT dT ∂T │p=ct.
pv=RT => v=R/pT=v(T), deci
q=q(v(T),T)=q(T).
deci:
du di
= cv = cp
dT dT
si cum di = du +pdv / :dT =>
iar pentru p=ct.
di du dv dv
= + p => pentru pv = RT, v(T) = R/pT si = R/p => cp = cv + pR/p
dT dT dT dT
cp cv = R
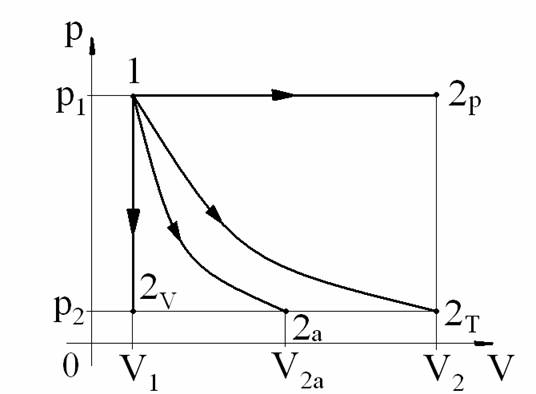
1. Evolutia izobara p=ct.
p1V1=mRT 1; si p2V2=mRT2 se impart cele doua relatii si p1=p2 si rezulta:
V1/T1=V2/T2=V/T=ct.
2. Evolutia izocora V=ct.
p1V1=mRT 1; si p2V2=mRT2 se impart cele doua relatii si V1=V2 si rezulta:
p1/T1=p2/T2=p/T=ct.
3. Evolutia izoterma T=ct.
p1V1=mRT 1; si p2V2=mRT2 se impart cele doua relatii si T1=T2 si rezulta:
p1V1=p2V2=pV=ct.
4. Evolutia adiabatica ΔQ=0 sau dQ=0; dq=0.
dq=du+pdv=0 => du+pdv=0 unde du=cvdT si avem cvdT=-pdv
dq=di vdp=0 di vdp=0 si di=cpdT cpdT= vdp
ultimele doua relatii se impart, si avem:
cp vdp cp dv dp
= - ; => + =0; ultima relatie se integreaza si avem:
cv pdv cv v p
cp ⌠ dv ⌠ dp cp
│ +│ = C1 => ln v + ln p = C1 si p>0, v>0; notam
cv ⌡ v ⌡ p cv
cp/cv=k numit exponent adiabatic
si avem:
kln v + ln p = ln vk + ln p = ln pvk = C1 => pvk = eC1 = C2; unde C1 si C2 sunt constante.
Deci, pentru evolutia adiabatica avem:
pvk=ct. unde k se numeste exponent adiabatic propriu fiecarui gaz (pentru aer k=1,4)
Deci, putem scrie pentru doua stari 1 si 2:
p1V1k=p2V2k=pVk=ct.
5. Evolutia politropica in care du/dq=α=ct. si atunci avem o caldura specifca de transformare de forma cn=dq/dT.
dq=du+pdv => cndT = cvdT + pdv unde du=cvdT si cndT=dq si avem (cn- cv)dT= pdv
dq=di vdp cndT = cpdT vdp si di=cpdT (cn - cp)dT= -vdp
ultimele doua relatii se impart, si avem:
cn - cp vdp
= - ; in aceasta relatie avem α=du/dq=(du/dT)/(dq/dT)=cv/cn => α=cv/cn
cn - cv pdv
si (cn cp)/(cn cv)=n si se prelucreaza similar ca la evolutia adiabatica si obtinem:
pvn=ct.
Si, similar:
p1V1n=p2V2n=pVn=ct.
unde pentru n=o avem: evolutie izobara;
n=1 evolutie izoterma;
n=k evolutie adiabatica;
n→∞ evolutie izocora.
|
Param.Evol. |
Izobara |
Izocora |
Izoterma |
Adiabatica |
|
p=p1 |
p2=p1 |
def. p2 |
p2=p1V1/V2 |
p2=p1(V1/V2)k |
|
V=V1 |
def. V2 |
V2=V1 |
def. V2 |
def. V2a |
|
T=T1 |
T2=T1V2/V1 |
T2=T1p2/p1 |
T2=T1 |
T2=T1(V1/V2)k-1 |
Se va studia variatia celor 3 parametrii energetici ai gazului perfect si anume Q, U si L.
1.Evolutia izobara (p1=p2)
mcp=ΔQ / ΔT => ΔQ=mcp(T2-T1);
L1,2= ΔL=p1(V2-V1)=p2V2-p1V1=mRT2-mRT1=mR (T2-T1);
ΔU= ΔQ ΔL=m (cp-R)(T2-T1)=mcv(T2-T1).
2.Evolutia izocora (V1=V2)
ΔL=0
mcv= ΔQ / ΔT => ΔQ=mcv(T2-T1)= ΔU.
3.Evolutia adiabatica (ΔQ=0)
mcv= ΔU / ΔT => ΔU= - ΔL=mcv(T2-T1).
4.Evolutia izoterma (T1=T2)
U=U(T) => ΔU=0; p1V1=pV => p(V)=p1V1(1/V);
V2 V2 V2 V2
L1,2= ΔL=∫ p(V) dV=∫p1V1(1/V) dV= p1V1 ∫(1/V) dV=p1V1lnV│= p1V1(lnV2 lnV1)=
V1 V1 V1 V1
= p1V1ln(V2/V1)=mRT1ln(V2/V1)= ΔQ.
|
Param.Evol. |
Izobara |
Izocora |
Izoterma |
Adiabatica |
|
ΔQ |
mcp(T2-T1) |
mcv(T2-T1) |
mRT1ln(V2/V1) |
|
|
ΔL |
mR(T2-T1) |
|
mRT1ln(V2/V1) |
-mcv(T2-T1) |
|
ΔU |
mcv(T2-T1) |
mcv(T2-T1) |
|
mcv(T2-T1) |
Arderea este procesul chimic prin care o substanta intra in reactie cu oxigenul ducand la degajare de caldura (reactia chimica exoterma). Substanta ce intra in reactie se numeste substanta combustibila sau combustibil. Acesta poate fi in stare de agregare solida, lichida sau gazoasa.
In general, combustibilul este un compus al carbonului si de aceea se mai numeste si carburant. In general, in carburant, pe langa carbon mai se gaseste si hidrogen, substantele carburante mai numindu-se hidrocarburi.
Din reactia chimica a unei hidrocarburi cu oxigenul rezulta, pe langa o cantitate de energie degajata sub forma de caldura, dioxid de carbon si apa.
Pentru a arde carburantul, MAS4t, foloseste oxigenul din aerul atmosferic.
Pentru a analiza procesul de ardere, exista doua metode principial diferite, prima definind carburantul prin formula sa chimica (destul de rar carburantii se prezinta sub forma chimic pura, in general acestia intalnindu-se sub forma de amestec de hidrocarburi) sau a doua definind carburantul prin participatia masica a elementelor chimice componente.
Analiza procesului de ardere urmareste determinarea compozitiei amestecului de carburant si aer ce urmeaza sa arda in MAS4t, compozitia gazelor arse evacuate, cantitatea de energie eliberata prin ardere si parametrii termodinamici din timpul si la finele arderii.
La modul general, o hidrocarbura chimic pura este data de formula CnHm, aceasta insemnand ca hidrocarbura contine n atomi de carbon si m atomi de hidrogen.
Reactia de ardere are urmatoarea forma (s-a trecul deasupra fiecarui element chimic masa sa atomica):
4 Cn Hm + (m+4n) O2 = 4n CO2 + 2m H2O
adica:
4(12n+m) kg CnHm + (m+4n)216 kg O2 = 4n44 kg CO2 + 2m18 kg H2O
4(12n+m) kg CnHm + 32 (m+4n) kg O2 = 176n kg CO2 + 36m kg H2O / : 4(12n+m)
1 kg CnHm + 32(m+4n)/(4(12n+m)) kg O2 = 176n/(4(12n+m)) kg CO2 + 36m/(4(12n+m)) kg H2O
1 kg CnHm + 8(m+4n)/(12n+m) kg O2 = 44/(12n+m) kg CO2 + 9/(12n+m) kg H2O
Deci pentru fiecare kg de carburant sunt necesare 8(m+4n)/(12n+m) kg de O2 pentru a arde chimic corespunzator (stoechiometric).
sau:
minO kg = 8(m+4n)/(12n+m) kg O/kg comb. = cantitatea stoechiometrica de oxigen pentru arderea hidrocarburii.
Cum, aerul atmosferic are o compozitie volumetrica aproximativa de 21% O2 si 79% N2, compozitia sa masica va fi:
21 O2 + 79 N2 = (2132 + 7928) L (aerul se va simboliza cu L, de la germanul Luft)
sau:
672 kg O2 + 2212 kg N2 = 2884 kg L => 0,233 kg O2 + 0,767 kg N2 = 1 kg L
deci, vom gasi 1 kg O2 in 1 / 0,233 kg L = 4,292 kg L / kg O2 (si, respectiv 3,292 kg N2 / kg O2)
in aceste conditii:
min(L) kg = 4,292minO kg = 4,2928(m+4n)/(12n+m) kg L/kg comb. = cantitatea stoechiometrica de aer pentru arderea hidrocarburii.
Deci bilantul masic global al arderii este:
1 kg comb. + (minL) kg L = 44/(12n+m) kg CO2 + 9/(12n+m) kg H2O + 3,2928(m +4n)/(12n+m) kg N2
2.1.4.2. Arderea combustibilului definit prin participatia masica
Combustibilul este definit prin participatia masica a elementelor componente, astfel:
12 32 1 16 14 18 (r)
c + s + h + o + n + a + r = 1
combusti- │ neutre
bili oxidant
Reactiile tipice de ardere ale elementelor combustibile sunt:
1. C + O2 = CO2 => 12 kg c + 32 kg o = 44 kg CO2/ : 12 => 1 kg c + 32/12 kg o = 44/12 kg CO2 / x =>
x kg c + (8/3)x kg o = (11/3)x kg CO2
2. S + O2 = SO2 => 32 kg s + 32 kg o = 64 kg SO2/ : 32 => 1 kg s + 32/32 kg o = 64/32 kg SO2/ x =>
x kg s + x kg o = 2x kg SO2
3. 2H2 + O2 = 2H2O => 4 kg h + 32 kg o = 36 kg a/ : 4 => 1 kg h + 32/4 kg o = 36/4 kg a/ x =>
x kg h + 8x kg o = 9x kg a
Considerand in relatia 1. x=c, in relatia 2. x=s si in relatia 3. x=h, va rezulta ca, pentru fiecare kg de combustibil definit prin participatie masica avem nevoie de:
minO kg = (8/3c + s + 8h o) kg O / kg comb. = cantitatea stoechiometrica de oxigen pentru arderea hidrocarburii.
in aceste conditii:
minL kg = 4,292(8/3c + s + 8h o) kg L / kg comb. = cantitatea stoechiometrica de aer pentru arderea hidrocarburii.
Deci bilantul masic global al arderii este:
1 kg comb. + (minL) kg L = (11/3)c kg CO2 + 2s kg SO2 + 9h kg a + a kg a +
+ [3,292((8/3)c + s + 8h o) + n] kg n +r kg r
sau:
1 kg comb. + (minL) kg L = (11/3)c kg CO2 + 2s kg SO2 + (9h + a) kg a +
+ [3,292((8/3)c + s + 8h o) + n] kg n +r kg r
In realitate, combustibilul in motor nu arde cu cantitatea stoechiometrica de aer, ci aceasta este corectata cu un coeficient λ, numit coeficient de exces de aer. Daca λ>1, arderea se face cu exces de aer (amestec 'sarac'), iar daca λ<1, arderea se face cu lipsa de aer (amestec 'bogat').
Daca corectam cantitatea de aer ce intra in motor cu λ, vom obtine un bilant masic cu exces de aer:
1 kg comb. + λ(minL) kg L = (1+minL) kg gaze arse + (λ-1)minL kg L, pentru λ>1 sau:
1 kg comb. + λ(minL) kg L = λ(1+minL) kg gaze arse + (1-λ) kg comb., pentru λ<1
In cazul in care λ<1 (ardere cu amestec 'bogat'), arderea este insotita de reactii de disociere. Aceste reactii preiau o parte din energia rezultata din ardere, pe care o elibereaza spre finele procesului de ardere. Reactiile de disociere au un rol stabilizator al procesului de ardere.
Reactiile de disociere (reversibile) cel mai frecvent intalnite sunt:
- H2O + CO ↔ CO2 + H2 (disocierea monoxidului de carbon cu apa);
- 2 CO + O2 ↔ 2 CO2 (disocierea monoxidului de carbon cu oxigen);
- 2 H2 + O2 ↔ 2 H2O (disocierea apei);
- 2 OH + H2 ↔ 2 H2O (disocierea oxidrilului);
- 2 NO ↔ N2 + O2 (disocierea oxidului de azot);
- 2 H ↔ H2 (disocierea hidrogenului);
- 2 O ↔ O2 (disocierea oxigenului).
|