FORMAREA RADICALILOR LIBERI ÎN SISTEME BIOLOGICE sI MECANISME ENZIMATICE DE NEUTRALIZARE
L. Gilau* , R. D. Gilau**
*Facultatea de Medicina si Farmacie din Oradea, Catedra de Biochimie, ** Facultatea de Medicina si Farmacie din Oradea, Catedra de Anestezie si Terapie Intensiva
Free radicals result from normal metabolism. They are energetic species with high reactivity which can interact with other biologic molecules. On the other side, they have a cetain role în antimicrobial defence.
Conceptul de radical a fost introdus de catre Lavoisier în 1785. Un radical liber este o molecula care contine la unul din atomii ei un orbital ocupat par&# 828g69i 355;ial, de un singur electron. Radicalul liber poseda un numar impar de electroni în molecula, motiv pentru care sunt foarte reactivi (viata medie de 10-15s). Orice proces radicalic comporta o reactie initiala de homoliza, din care iau nastere atomi liberi sau radicali liberi, urmata de o reactie de stabilizare (sau mai multe) în care aceasta particula tinde sa se cupleze, în final, cu un alt radical liber.
Identificarea radicalilor liberi se realizeaza prin rezonanta electronica de spin. Metoda rezonantei electronice de spin (rezonanta paramagnetica electronica) se bazeaza pe observarea spectroscopica a unor tranzitii între niveluri de energie diferite, depinzând de orientarea spinului electronic.
|
|
Una dintre aceste orientari,
"paralela" cu câmpul exterior, mai saraca în energie,
poseda Un electron necompensat poseda,
datorita rotatiei în jurul axei, un moment magnetic de spin. Din
aceasta cauza electronul se comporta ca un mic magnet si
tinde sa se alinieze în sensul câmpului magnetic exterior. Fenomenul la
scara electronica este cuantificat, asa ca momentul
magnetic, m, nu poate adopta decât
doua orientari diferite, determinate de numarul cuantic de
spin |
Din punct de vedere electric radicalii liberi manifesta un caracter ponderat deoarece în general nu au sarcina. Din acest motiv fortele de atractie sau repulsie coulombiene sunt foarte mici iar în reactiile lor vor domina caile controlate de catre orbitali.
Orbitalul ocupat de catre electronul radicalului liber este SOMO ("Lowest Unoccupied Molecular Orbital"). Acest orbital interactioneaza cu un partener de reactie neradicalic HOMO ("Highest Occupied Molecular Orbital") si LUMO ("Lowest Unoccupied Molecular Orbital") Fig. 1.
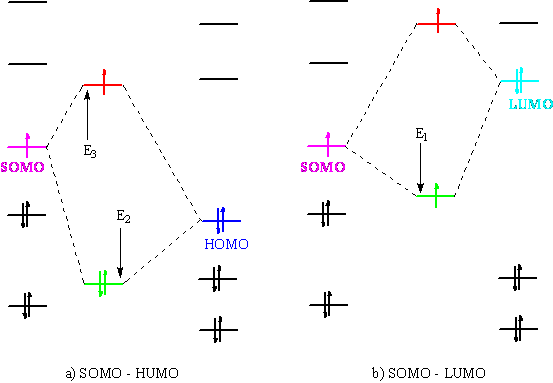
Fig. 1 Interactiunea orbitalilor SOMO cu partenerii de reactie HOMO (a)
si LUMO (b)
Interactiunea cu un orbital LUMO duce la un câstig de energie marcat în figura nr. (b) dar un rezultat similar se obtine si în cazul interactiunii HOMO. Deoarece pe orbitalul HOMO exista doi electroni si pe orbitalul SOMO un singur electron, câstigul de energie este 2E2 - E3. Radicalii bogati energie reactioneaza rapid cu molecule care poseda orbitali LUMO cu energie joasa si invers reactioneaza rapid cu orbitali HOMO cu nivel energetic ridicat [3].
Radicalii liberi sunt în multe situatii produsi normali de metabolism. Un numar mare de radicali liberi pot prezenta importanta si în urma proceselor de metabolizare a substantelor medicamentoase.
Cei mai importanti radicali liberi cu continut de oxigen sunt [2,4,5,6,7]:
- radical hidroxil .OH
- radical peroxil ROO.
- radical alcooxil RO.
- radicali fenoxil sau semichinone ArO., HO-Ar-O.
- radical superoxid ![]()
Starea fundamentala a
moleculei NO are simbolul 2P (tabel 1), ceea ce
arata ca un electron neîmperechiat ocupa orbitalul pp. Cele doua structuri
electronice posibile, ![]() si
si ![]() , pot fi combinate între ele în doua moduri -
simetric si asimetric. Combinatia simetrica stabilizeaza
molecula, despre care se spune ca, în afara de legatura
dubla si una simpla, mai are si o legatura prin
trei electroni. Lungimea legaturii, 1,15 Ĺ, observata pentru starea
fundamentala, corespunde structurii
, pot fi combinate între ele în doua moduri -
simetric si asimetric. Combinatia simetrica stabilizeaza
molecula, despre care se spune ca, în afara de legatura
dubla si una simpla, mai are si o legatura prin
trei electroni. Lungimea legaturii, 1,15 Ĺ, observata pentru starea
fundamentala, corespunde structurii ![]() . Starea antisimetrica 2P va avea legatura dubla
slabita de o antilegatura prin trei electroni; ne putem
astepta ca lungimea legaturii sa fie între valorile pentru o
legatura dubla si una simpla, asa cum este aceasta
observata pentru starea B (1,33 Ĺ). Celelalte trei stari excitate, A,
C si D, au toate lungimea legaturii de 1,09 Ĺ, ce corespunde unei
legaturi triple. Aceste trei stari pot fi descrise ca cuprinzând un
miez NO+ si un electron într-un orbital exterior, care are
numarul cuantic total egal sau mai mare de 3. Pentru fiecare dintre aceste
stari se poate folosi formula structurala (
. Starea antisimetrica 2P va avea legatura dubla
slabita de o antilegatura prin trei electroni; ne putem
astepta ca lungimea legaturii sa fie între valorile pentru o
legatura dubla si una simpla, asa cum este aceasta
observata pentru starea B (1,33 Ĺ). Celelalte trei stari excitate, A,
C si D, au toate lungimea legaturii de 1,09 Ĺ, ce corespunde unei
legaturi triple. Aceste trei stari pot fi descrise ca cuprinzând un
miez NO+ si un electron într-un orbital exterior, care are
numarul cuantic total egal sau mai mare de 3. Pentru fiecare dintre aceste
stari se poate folosi formula structurala (![]() ) [8].
) [8].
Tabel Nr. 1
Starea fundamentala si starile excitate ale NO
|
Starea |
Energia (eV) |
Simbolul |
Lungimea legaturii |
|
D* |
|
S |
|
|
C |
|
S |
|
|
B |
|
P |
|
|
A |
|
S |
|
|
X |
|
P |
|
Principalele actiuni ale radicalilor liberi într-un sistem biologic sunt oxidarea acizilor grasi nesaturati din membrana celulara, oxidarea aminoacizilor din proteine, depolimerizarea acidului hialuric, degradarea oxidativa a ADN, modularea activitatii nucleotid ciclazelor, modularea activitatii si sintezei de prostaglandine etc.
Conform mecanismului general al reactiilor înlantuite, un radical initial provoaca extragerea unui atom de hidrogen din pozitia alilica a unui acid gras nesaturat, deosebit de reactiva si da un radical liber conjugat II, de acelasi tip cu radicalul alil. Aceasta se poate lega cu molecula de oxigen în pozitiile 1, 3 sau 5, caci radicalii hidroperoxidici III si V contin legaturi duble conjugate, spre deosebire de IV ce prezinta legaturi duble izolate. Sistemele conjugate sunt mai stabile [9].
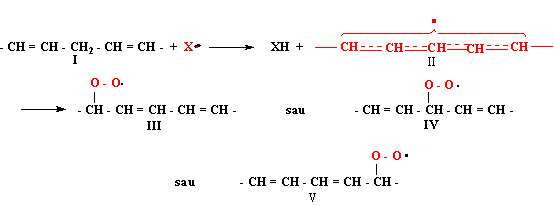
Radicalul peroxidic III sau V reactioneaza cu compusul initial I, la fel cum reactioneaza X. si da un nou radical conjugat II, continuându-se astfel lantul de reactii. Totusi radicalii peroxidici III sau V se transforma în hidroperoxizi de tipul
R - O - OH. Acesti hidroperoxizi se pot rupe termic sau catalitic în câte doi radicali, RO. sau HO., explicându-se astfel mersul autocatalitic al reactiei de autoxidare [11].
Cu agenti oxidanti cum ar fi peroxidul de hidrogen proteinele reactioneaza la capatul N-terminal cu formare de proteine carbonilate.
![]()
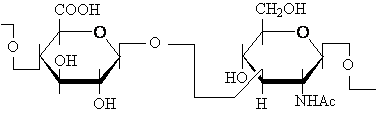
Acidul hialuric care este un copolimer ce se realizeaza între acidul D-glucuronic si N-Acetil-glucozamina sufera un proces de depolimerizare si în felul acesta modifica tensiunea superficiala a lichidului sinovial.
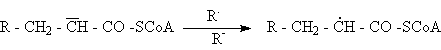
Un alt exemplu de reactie radicalica este introducerea în molecula a unei noi legaturi duble. Radicalii liberi manifesta o reactivitate ridicata si participa la extragerea atomilor de hidrogen, aditie radicalica, scindarea legaturilor covalente si la reactii de anihilare. La modul general în prezenta unui agent nucleofil puternic acil-CoA se poate transforma într-un carboanion care în prezenta unui radical liber trece într-un acid nesaturat dupa urmatoarea schema:
![]()
![]()
Radicalii liberi ai oxigenului sunt specii moleculare din sistemele aerobe. Mitocondria este locul în care se desfasoara reducerea oxigenului la apa prin intermediul citocrom oxidazei. De fapt citocromul P450 reduce oxigenul la metaboliti activi, care apoi oxideaza o varietate larga de substraturi. Produsii de reactie includ radicali liberi intermediari, care ori sunt redusi mai departe, ori sunt eliberati din situsul activ al enzimei si reactioneaza cu gruparile nucleofile din imediata vecinatate [9]. Mecanismul de formare a radicalilor liberi este ilustrata în schema din figura 2.
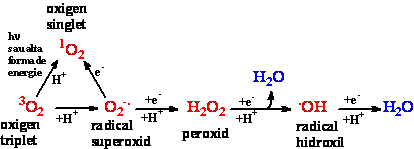
Fig. 2 Schema de reducere a oxigenului la apa prin intermediul de specii reactive
Radicalii liberi formati pot fi identificati direct prin capcane de spin (RES) sau indirect urmarind metabolitii modificati în urma trecerii radicalilor liberi sau urmarind activitatea principalelor enzime implicate în proces (tabel 2)
Tabel 2. Metode de identificare a radicalilor liberi si a altor specii reactive ale oxigenului în sistemele biologice [12].
|
Specia |
Direct |
Indirect |
|
HOO. (pKa = 4,8) |
Capcane de spin [13] |
Inhibarea SOD de catre nitro-blue-tetrazolium |
|
H2O2 (pKa = 10,6) |
Nu |
Numeroase metode |
|
OH |
Nu |
Formarea de produsi specifici [14]. |
|
O2 |
Chemiluminiscenta [15] |
"Stingerea" de caroten |
|
hidrochinona |
|
Spectrofotometric [16] |
|
tetraclorura de carbon |
Capcane de spin |
Produsi specifici |
Sistemele de aparare constau în: a) actiunea sinergica la diferite nivele ale formarii radicalilor liberi; b) se concentreaza în principal pe primul radical si pe ultimul peroxid; c) sunt localizate intracelular si extracelular; d) sistemele de antioxidanti sunt cuplate cu principalele reactii metabolice din celula; e) superoxid dismutaza si catalaza au o viteza mare de reactie (figura 3); f) au o actiune cu caracter dublu proxodanti si antioxidanti (tabel 3); g) sunt lipsiti de specificitate.
Tabel 3. Sisteme de prooxidanti si antioxidanti
|
Proxodanti |
Antioxidanti |
|
Lipooxigenaza |
Glutationperoxidaza |
|
Prostaglandin sintetaza |
Vitamina E (tocoferol) |
|
Ioni metalici Fe, Co |
Vitamina C (acid ascorbic) |
|
Acid folic |
Acid uric |
|
Vitamina B6 (piridoxina) |
Chelatori de fier |
|
Vitamina D2 si D3 |
Metionina |
|
Adrenalina |
Tiroxina |
|
Nitril |
Estrogeni |
|
Compusi aromatici |
Flavonoide |
În figura 3 am prezentat modul în care superoxid dismutaza transforma ionul superoxid în peroxid de hidrogen. Peroxidul de hidrogen format este apoi descompus de catre catalaza în apa si oxigen molecular. Pe de alta parte glutationul (forma redusa) este oxidata de catre peroxidul de hidrogen la glutation (forma oxidata). Reversibilitatea procesului este asigurata de un sistem de doua enzime glutation peroxidaza si glutation reductaza [9].
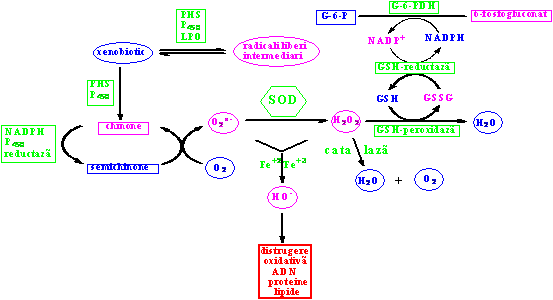
Figura 3 Modul de anihilare a unor specii reactive de catre sistemul superoxid dismutaza si catalaza
Superoxid dismutaza CuZn (CuZnSOD) (figura 4) catalizeaza reactia de dismutatie a radicalului superoxid toxic la oxigen molecular si peroxid de hidrogen, având un rol crucial în sistemul de aparare celulara [19]:
![]()
![]()
|
SOD-ul este o enzima cu importanta medicala ca un agent terapeutic în diferite maladii legate de stresul oxidativ. CuZnSOD este un dimer cu masa moleculara 32 kD. Fiecare monomer contine 151 aminoacizi care se pliaza sub forma unui opt rasucit si conectat prin trei bucle externe [18]. |
|
|
Situsul activ al SOD-ului bovin (CuZnSOD) prezinta o baza de 15 Ĺ cavitatea formata are doua ochiuri. Aici gasim un reziduu de sarcina care faciliteaza ghidarea superoxidului la situsul activ. Situsul activ de oxidare, contine o punte dintre ionii de cupru si zinc si inelul imidazolic a His61. Cupru coordineaza în plus trei liganzi de histidina pe când zincul aditioneaza doar doua resturi de histidina si un acid aspartic [18]. |
|
Figura 4 Structura superoxid dismutazei si modul de asezare a ionilor de cupru si zinc în situsul activ.
Catalaza (hidrogenperoxid oxidoreductaza) este o enzima care contine hem si catalizeaza reactia:
![]()
unde R este fie un hidrogen, fie un radical alchil sau o grupa acil si HQOH este un donor de doi electroni. Catalaza prelucreaza peroxidul de hidrogen (H2O2) printr-o reactie de disproportionare:
![]()
Reactia se desfasoara dupa schema din fig. 5.
Gruparea prostetica (tabelul 4) leaga diferitele forme de specii radicalice. Fiecare molecula de catalaza este alcatuita din patru catene, fiecare contine 500 de aminoacizi, si contine ca si grupare prostetica patru grupe porfirinice de tip hem, care este foarte asemanatoare cu hemul din hemoglobina, citocrom, cloroplaste sau cu enzimele fixatoare de azot din legume.

Figura 5 Schema de descompunere a peroxidului de hidrogen în prezenta catalazei
În absenta catalazei, aceasta reactie se desfasoara spontan dar foarte încet. Catalaza mareste viteza acestei reactii de câteva mii de ori.
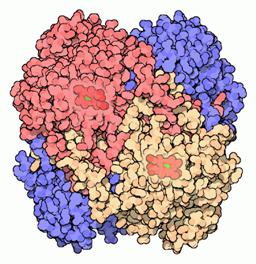
Figura 6
Figura 6. Structura catalazei
Ciclul de reactii ale catalazei încep cu starea de ion feric (FeIII) care reactioneaza cu o molecula de peroxid de hidrogen si duce la un intermediar, o porfirina, cu un radical cationic de FeIV. Mai departe, urmeaza oxidarea intermediarului cu restabilirea starii initiale [17].
Un rol important în activitatea catalazei consta în echilibrele ce se stabilesc între diferitele stari de oxidare a fierului. De fapt în urma acestui joc ionul de fier vor accepta electronii de la peroxidul de hidrogen, electroni care apoi sunt transferati la alte sisteme reducatoare.
Tabel 4
|
Tipul de hem |
Coordinarea fierului cu hem |
Liganzii axiali ai fierului |
Forma de oxidare / starea de spin |
|
sau
Hem d |
|
|
FeII (S=2); |
|
|
O H2O2, O2 sau alt ligand |
FeIII (S=1/2) |
|
|
|
O O (O·) |
FeIV (S=1) |
Glutationul este o tripeptida care se gaseste în toate celulele mamiferelor, cu exceptia neuronilor. El se caracterizeaza prin legatura γ-peptidica, care nu este atacata de catre peptidaze dar este un substrat pentru γ-glutamiltransferaza. Gruparea functionala tiolica este principala responsabila pentru proprietatile glutationului, de aceea este abrevia ca GSH în forma redusa. Forma oxidata a doua astfel de molecule este abreviata GSSG. În una din cele mai importante reactii la care participa glutationul, catalizata de catre glutation peroxidaza, sunt inactivate peroxidul de hidrogen si alti peroxizi [21].
![]()
GSSG este apoi redus din nou la GSH cu NADPH de catre glutationreductaza (vezi fig. 3).
BIBLIOGRAFIE
1. Bor, D. "Free Radical in Biolog.", Academic Presa, New York, p.69 (1978).
2. Proctor, P. H. Physiol. Chem. Phys, 4:349 (1972).
3. Szantaz Cs. "Elmeleti Szerves Kemia", Műszaki Könyvkiadó, Budapest, p.371 (1984).
4. Reynolds, E. S. si Moslen, M. T. "Free radicals in biology" vol. 4, Academic Presa, New York, p.49 (1980).
5. Reynolds, E. S., Moslen, M. T. si Treinen, R. J. "Oxygen and Oxy-Radicals in Chemistry and Biology" Academic Presa, New York, p.169 (1981).
6. Mason, R. F. si Ching nell, C. F., Pharmacological Reviews 33:189 (1981).
7. Kalinaraman, B. Rev. Biochem. Tox. 4:73 (1982)
8. Pauling, L. "Chimie Generala" Ed. stiintifica, Bucuresti, p.19 (1972).
9. Cros, C. E., Haliwel B, Borish E. T., "Oxygen radicals and human disease, Davis Conference Ann. Int. Med. 107:526 (1987)
10. Cope F.V si colab Arch. Biochem. Biofiz. 100:174 (1983).
Lloyd L. Ingraham, John Wiley & Sons, Inc., New York - London p.234 (1979).
12. Sutties, J. W., si Kaliner, M., Trends in Biochemical Sciences 5:302 (1980).
13. Rinaldo, J. E., si Rogers, R. M. N. Engl. J. Med. 306:900 (1982)
14. Trager, W. F., Drug Metabolism Reviews, 13:51 (1982)
15. Rosen, H., si Klebanoff S. J., J. Biol. Chem. 252:4803 (1977).
Tiffany - Castiglione, E., si colab., Biochem. Pharm. 31:181 (1982).
Andersson, L.A. si Dawson, L.A. EXAFS spectroscopy of hemecontaining oxygenases and peroxidases. Structure and Bonding 64:1-40 (1991).
18. H. Ukeda, Y. Hasegawa, T. Ishii and M. Sawamura, Biosci. Biotech. Biochem., 61: 2039 (1997).
Nicholls, D.G., si Budd, S.L., Mitochondria and neuronal survival, Physiol. Rev., 80:315-360 (2000).
20. Wen-Chi Hou, Yeh-Lin Lu, Sin-Yie Liu, si Yaw-Huei Lin, Bot. Bull. Acad. Sin. 44: 37-41 (2003)
21. Cambell P. N., si Smith A. D., "Biochimie ilustrata" pag.131, Ed. Acad. Române, 2004.
|