Identificarea si cuantificarea organismelor modificate genetic
1. Cum se detecteaza organisme modificate genetic ?
Asa cum a fost prezentat anterior, plantele transgenice sunt caracterizate de insertia unei noi gene (sau unui nou set de gene) in genomii acestora. Noua/noile gena/gene sunt transpuse si este exprimata noua proteina. Acest lucru confera plantei o noua caracteristica cum ar fi rezistenta la anumite insecte sau toleranta la erbicide. Baza fiecarei tehnologii de detectie a organisme modificate genetic este reprezentata de exploatarea diferentelor dintre varietatea nemodificata si planta transgenica. Acest lucru poate fi facut prin detectarea noului ADN transgenic ce a fost inserat, sau noile proteine exprimate, sau (daca proteina actioneaza ca o enzima), prin utilizarea analizelor chimice pentru detectarea produsului reactiei enzimatice.
Exista doua abordari (metode) stiintifice utilizate in general pentru detectarea modificarii genetice in vegetale cum ar fi soia, porumbul, bumbacul si altele.
Una, ELISA, implica testarea pentru detectia proteinelor specifice prin exploatarea specificitatii legaturii intre antigenul exprimat si anticorpul tinta; cealalta, PCR, se bazeaza pe detectia secventelor noi de ADN inserate in genom. Aceste metode arata prezenta sau absenta organisme modificate genetic in proba dar pot furniza de asemenea anumite indicatii cu privire la cantitatea organisme modificate genetic din proba testata.
Prima metoda validata la nivel European, a fost metoda de screening bazata pe PCR, capabila sa detecteze majoritatea organisme modificate genetic aprobate in prezent pentru comercializare.
Acesta metoda elaborata de Pietsch (1997), este bazata pe detectia secventelor de control ce flancheaza gena nou introdusa. Validarea a fost coordonata de JRC - Food Products and Consumer Goods Unit al IHCP (JRC) si efectuata in colaborare cu Institutul pentru Materiale de Referinta si Masuratori din cadrul JRC, care a fost responsabil pentru productia materialelor de referinta certificate necesare.
Asa cum este mentionat mai sus, eforturile de cercetare sunt directionate pentru elaborarea metodelor bazate pe proteine. O metoda specifica pentru detectia soiei Roundup Ready® utilizand ELISA, a fost validata si altele au fost elaborate. (https://biotech.jrc.it/methodsdatabase.htm) .
2.Avantajele si dezavantajele abordarii detectiei ADN
comparativ cu detectia de proteina specifica
2.1. Abordarea bazata pe detectia de ADN
Metodele analitice bazate pe tehnologia PCR sunt utilizate din ce in ce mai frecvent pentru detectia secventelor de ADN asociate cu organisme modificate genetic.
PCR permite, amplificarea selectiva a segmentelor specifice de ADN ce apar la frecventa redusa intr-un amestec complex de alte secvente ADN. In PCR, piesele mici de ADN sunt numite primeri ce sunt utilizati in perechi. Printr-o serie de cicluri termale, repetitive si diferentiale, enzima ADN polimeraza ajuta la replicarea si amplificarea exponentiala a secventei intre perechea de primeri. In final aceste parti amplificate fac subiectul unei electroforeze standard in gel, asa incat prezenta lor poate fi detectata pe baza determinarii marimii lor.
Au fost elaborate numeroase metode bazate pe PCR ce pot detecta si cuantifica organisme modificate genetic in bunurile agricole. Determinarea identitatii genetice permite segregarea si trasabilitatea pe intreg lantul de aprovizionare al recoltelor organisme modificate genetic.
PCR este o tehnica de laborator ce necesita personal instruit si echipament special. Caracteristici de baza ale analizei prin PCR:
- poate fi foarte sensibila, capabila de detectia uneia sau mai multor copii ale genelor sau secventei tinta de interes in cadrul unui material genetic al unui organism sau genom. Trebuie luate toate masurile pentru evitarea contaminarii incrucisate.
- necesita putin timp de reactie in comparatie cu testele imunologice.
- aproape toti reactivii necesari, sunt disponibili in comert si pot fi usor obtinuti. Totusi, anumiti reactivi necesita licenta pentru utilizare.
- timpul de analiza a probelor este de aproximativ o zi.
- PCR faciliteaza diferentierea intre anumite tipuri de modificari genetice. Metodele de diagnostic pentru identificarea evenimentelor transgenice specifice necesita timp de dezvoltare aditional si eforturi de validare.
2.2.Abordarea bazata pe identificarea proteinei specifice
Metoda de testare bazata pe proteina utilizeaza anticorpi specifici proteinei de interes.
ELISA detecteaza sau masoara cantitatea de proteina de interes intr-o proba ce poate contine alte numeroase proteine. ELISA utilizeaza un anticorp pentru a fixa proteina specifica, un anticorp pentru a amplifica detectia (optional) si un anticorp legat de o enzima a carui produs genereaza o reactie colorata ce poate fi usor vizualizata si cuantificata in comparatie cu curba standard a proteinei de interes.
De asemenea, pentru executia optima a testului sunt necesare echipamente speciale si personal instruit.
Principale caracteristici ale analizelor ELISA
- mai putin sensibila decat PCR, de aceea mai putin susceptibila decat PCR in rezultate "pozitive false" cauzate de mici nivele de contaminare;
- costuri mari pentru dezvoltarea testelor si generarea de standarde pentru anticorpi si proteine;
- cost mic pentru proba din momentul elaborarii rectivilor;
- metodele bazate pe proteina necesita timp pentru reactivi si dezvoltarea metodei;
- testarea bazata pe proteina furnizeaza un proces de testare cantitati 656f59g va in cazul in care este produsa proteina detectabila. Totusi produsele MG pot fi produse numai urmand anumite etape sau numai in anumite parti ale plantelor si aceste organisme modificate genetic sunt putin probabil de a fi usor detectate prin ELISA. Aditional, procesarea industriala denatureaza usor proteinele, lucru ce face problematica utilizarea metodelor ELISA pentru alimentele procesate.
Luand in considerare acestea, atat ELISA cat si PCR trebuie privite ca si complementare decat exclusive, datele succinte sunt prezentate in tabelul 4.
Tabelul 4. Comparatie sumarizata intre metodele PCR si ELISA
|
Metoda |
Teste pentru: |
Durata |
Usurinta in utilizare |
Rezultate |
|
ELISA |
Proteina |
2-8 ore |
Moderata; necesita familiarizarea cu practicile de laborator |
Confirma modificarea genetica specifica si permite cuantificarea |
|
PCR |
ADN |
1-3 zile |
Dificila; necesita echipament special si instruire |
Foarte sensibile; inclinat spre "pozitive false"; confirma prezenta ADN MG si permite cuantificarea |
In fig 8 este prezentata schema de analiza a produselor ce contin soia modificata genetic.
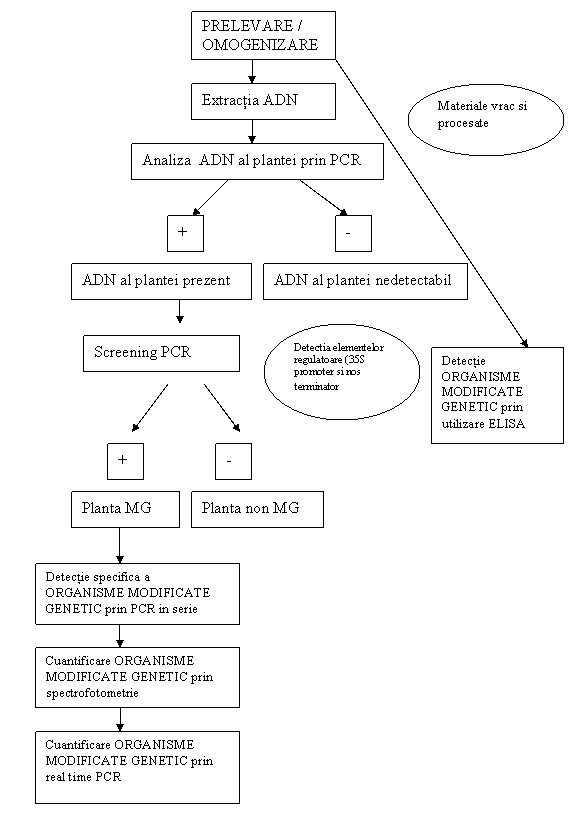
FIG.8 - Metode propuse pentru identificarea si cuantificare organismelor modificate genetic-soia
Validarea metodelor
Validarea metodei este dificila atat pentru laboratoare cat si pentru autoritatile de control. Ideal, fiecare metoda trebuie confirmata pentru verificarea performantei intr-un numar limitat de laboratoare pentru a furniza rezultate specifice si reproductibile. JRC din cadrul Comisiei Europene a fost primul care a validat metodele ELISA si PCR pentru materii prime ce constau din soia Roundup Ready, metode PCR pentru porumbul MG Bt176 si metoda PCR atat pentru soia Roundup Ready si pentru porumbul MG Bt176 in alimente procesate (Lipp et al., 1999, 2000 si 2001). De atunci, au fost elaborate si validate alte metode atat pentru analiza calitativa cat si cantitativa.
Pregatirea probei, atat pentru metodele bazate pe ADN cat si pentru cele bazate pe identificarea proteinei specifice, este foarte importanta pentru dedectie si/sau cuantificare. Atat masa probei cat si procedurile de prelevare au un mare impact asupra rezultatelor ce pot fi obtinute prin aceste metode de testare.
Disponibilitatea materialelor de referinta certificate este o cerinta fundamentala pentru fiecare metoda de detectie. Un alt punct de maxima importanta, este omogenizarea probei.
Extractia ADN optimizata este fundamentala pentru asigurarea calitatii si prezentei ADN extras. Acest aspect este deosebit de important deoarece majoritatea bunurilor alimentare de pe piata produse din soia sau porumb sunt procesate foarte mult. Este bine cunoscut ca ADN-ul se poate degrada considerabil in timpul procesarii alimentelor, in special prin tratament termic in prezenta apei. Aditional, o metoda corespunzatoare de extractie a ADN trebuie sa asigure inlaturarea substantelor inhibitoare prezente in proba. Au fost elaborate metode pentru extractia ADN si foarte multe companii au produs kituri specializate.
Dupa extractia ADN, ampliconii (produsele reactiei PCR) sunt analizati prin electroforeza in gel de agaroza.
Asa cum a fost mentionat anterior, utilizarea eficienta a tehnicilor moderne de detectie a organisme modificate genetic depinde de disponibilitatea informatiilor precise. Detectia organisme modificate genetic necesita cel putin cunoasterea secventei tinta a genei si tipul de modificare genetica.
Au fost elaborate diferite tehnici PCR pentru detectia organisme modificate genetic. Specificitatea PCR depinde de alegerea primerilor. Primerii PCR pot fi directionati catre elemente diferite utilizate in procesul de transformare.
Plantele modificate genetic pot fi impartite in categorii in conformitate cu gena structurala introdusa. O metoda aditionala pentru a directiona specificitatea reactiei este alegerea primerilor specifici secventelor ADN localizati in diferite elemente genetice.
Asa cum a fost descris mai sus, nevoia cuantificarii organisme modificate genetic prezente intr-o proba duce catre elaborarea multor protocoale bazate pe PCR, ce permit nu numai un raspuns calitativ (prezenta/absenta) cat si o indicatie mai mult sau mai putin precisa (depinde de metoda utilizata) asupra cantitatii de organisme modificate genetic prezente in proba data. Cele 2 abordari bazate pe ADN, cel mai des utilizate sunt competitive - PCR si real-time PCR. Real time PCR este efectuata utilizand instrumente specifice si sofisticate, disponibile numai la cateva companii comerciale.
OBIECTIVE GENERALE
Realizarea unei cercetari complexe interdisciplinare, prin interconectarea domeniilor biologic (genetica), biochimic (biologie moleculara) si veterinar (asigurarea sigurantei alimentare). Aplicarea unor metode moderne de biologie moleculara pentru imbunatatirea radicala a conceptelor procesului de identificare si cuantificare a organismelor modificate genetic (porumb modificat genetic - MON810) in alimente.
Caracteristicile porumbului MON810
Scurta descriere
Dennumire Porumb MON810 ( marca inregistrata YieldGard )
Aplicant Monsanto canada Inc.
Specia Zea Mays L.( porumb)
Metoda Accelerare particule ( biolistica)
Caracteristice noi Rezistenta
Informatii primare
In conformitate cu prevederile Deciziei 98/294/ EC singurul soi de porumb modificat genetic, acceptat pentru cultivare in Uniunea Europeana si, implicit in Romania, este MON 810.
Porumbul MON 810 este un soi de porumb modificat genetic, obtinut prin introducerea unei gene specifice din bacteria Bacillus thuringiensis care se gaseste in sol in mod natural - intr-un porumb conventional. Aceasta gena a fost introdusa cu ajutorul metodei de accelerare a particulelor, unul din instrumentele biotehnologiei. Gena introdusa protejeaza porumbul impotriva anumitor daunatori lepidopteri (molii si fluturi), inclusiv Sfredelitorul european al tulpinilor de porumb (Ostrinia nubilalis) si Sfredelitorul mediteranean al tulpinilor de porumb (Sesamia spp.) ale caror larve ataca porumbul hranindu-se cu boabe de pe stiuleti si sapand galerii in interiorul tulpinilor. La nivel european, porumbul MON 810 este autorizat atat pentru a fi cultivat, cat si pentru a fi utilizat in alimentatia animalelor si a oamenilor.
Insectele lepidoptere, cum este Ostrinia nubilalis, sunt daunatori importanti ai porumbului, prin faptul ca sapa galerii in tulpini si in stuleti, larvele sfredelitorului afecteaza plantele, determinand in fiecare an pierderi insemnate de productie. Prin urmare, pentru a proteja cultura porumbului de acesti daunatori, este importanta elaborarea unor cai eficiente de combatere (James, 2003).
Sfedelitorul european al porumbului ierneaza ca omida complet dezvoltata pe/sau in vecinatatea plantelor atacate in anul anterior.
Porumbul este vulnerabil la atacurile larvelor sfredelitorului de la sfarsitul stadiului de plantula pana la recoltare. Larvele sfredelitorului patrund in tulpinile porumbului si sapa galerii hranindu-se cu tesuturile interne. Slabit, porumbul este mult mai expus la frangere si nu se dezvolta normal. Leziunile provocate de larve pe planta ofera conditii favorabile de dezvoltarea ciupercilor patogene.

Fig 1. Stulete de porumb atacat de larvele Sfredelitorul european al tulpinilor de porumb
Cele mai importante pagube economice sunt determinate de atacul la nivelul stuletilor. Larvele mananca boabele. Stuletii infestati cu cu omizi, cu rumegusul produs de acestea sau care au boabele afectate, constituie un mediu favorabil pentru instalarea ciupercilor care produc micotoxine, depreciind calitatea boabelor. Mai mult, un camp de porumb infestat cu sfredelitor va atrage in mai mare masura pasarile aflate in cautare de insecte, care nu vor ezita insa sa ciuguleasca stuletii.
In vederea combaterii sfredelitorului europen al porumbului, fermierii aloca sume importante pentru cumpararea insecticidelor. Eficienta aplicarii acestora este insa limitata. Pentru a fi eficient, tratamentul trebuie repetat de mai multe ori intr-un sezon, ceea ce determina cheltuieli suplimentare. Dar ceea ce este foarte important, o larva care se afla in interiorul plantei nu este expusa actiunii toxinei, care este aplicata pe frunze. Prin urmare, utilizarea toxinei Bt traditionale nu este foarte eficienta in cazul sfredelitorului, ale carui larve se afla in tulpini si stuleti.
Plantele transgenice care produc toxina Bt, similara cu cea utilizata in cazul combaterii prin metoda microbiologica, ofera o noua solutie pentru protectia culturilor impotriva lepidopterelor daunatoare.
Avantajele utilizarii tehnologiei Bt la porumb
Biodiversitatea este conditia bine cunosctuta pentru:
desfasurarea principalelor cicluri biogeochimice de pe planeta;
existenta unor surse constante si variate de hrana, medicamente si materii prime;
permanenta unor surse de material genetic util in procesul continuu de ameliorare a speciilor de interes economic.
Efecte indirecte:
- proliferarea peste pragul economic de daunare a unor specii care anterior aplicarii tratamentelor, nu aveau un impact semnificativ asupra culturilor fiind hrana si gazde pentru pradatori si, respectiv, paraziti;
- periclitarea existentei nivelurilor trofice superioare (pasari insectivore), ca urmare a reducerii drastice a resurselor de hrana.
Evenimentul modificat genetic MON810 a fost
dezvoltat de compania Monsanto Canada, ca un soi rezistent
Aceasta proteina este activa impotriva unor anumite specii de Lepidoptera, ordin din care fac parte fluturii si moliile, inclusiv Sfredelitorul european al tulpinilor de porumb.
Proteina exprimata in MON810 este o forma truchiata a proteinei insecticide, CRIYA(b) δ-endotoxina, si protejeaza porumbul de atacul larvei sfredelitorului european asupra tulpinii.
Descierea noilor caracteristici
Rezistenta
Bacillus Thuringienis ssp. kurstaki este o bacterie de pamant, forma endospora, gram-pozitiva. In stadiul sporogenic, pe langa endospor, produce citeva cristale proteice insecticide, incluzind proteina activa δ-endotoxina CRIYA(b), proteina activa impotriva catorva insecte lepidoptere printre care si Sfredelitorul european al tulpinilor de porumb. S-a demonstrat ca proteina nu are efecte toxice asupra organismului uman, altor insecte sau vertebrate ( Lee et al.1995).
MON810 a fost obtinut prin: inserarea unei singure copii a genei crylA(b) sub controlul unui promotor constitutiv puternic amplificator CaMV 35S, si introducerea unei secvente leader, a intronului, care contine gena HSP70 (fig.2).

Fig.2- Reprezentarea schematica a constructului cryIA(b) din plasmida PV-ZMBK07
utilizata in transformatrea MON 810, include promotorul amplificator CaMV 35S,
intronul
Secventa de codare crylA(b) din Bacillus thuringiensis ssp.kurstaki HD-
Proteina devine toxica pentru larvele lepidoptere urmand clivajul unui miez rezistent bioactiv de tripsina. Activitatea insecticida depinde de legarea fragmentului activ la receptori specifici prezenti in celulele epiteliale medii a insectelor susceptibile si formarea ulterioara a porilor intrerupind balanta osmotica si rezultind liza celulara.
Daunatorii lepidoptere specifici porumbului, sensibili la proteina δ-endotoxina CRIYA(b), sunt Sfredelitorul european al tulpinilor de porumb si viermele de porumb.
Secventa de aminoacid a toxinei exprimata in porumbul modificat genetic s-a gasit a fi identica cu cea existenta in mod natural, si echivalenta proteinei produsa ca un biopesticid fiind folosita in mod considerabil in industria alimentara.
Dezvoltarea metodei
MON810 a fost obtinut din genotipul Hi-II prin transformare biolistica cu o mixtura de plasmide ADNs, PV-ZMBK07 si PV-ZMGT10.
Plasmida PV-ZMBK07 contine gena crylA(b) (Fig.3) iar plasmida PV-ZMGT10 contine genele CP4EPSPS si gox. Amandoua plasmidele contin de asemenea gena nptII (pentru selectia bacteriana) sub controlul unui promotor bacterian.
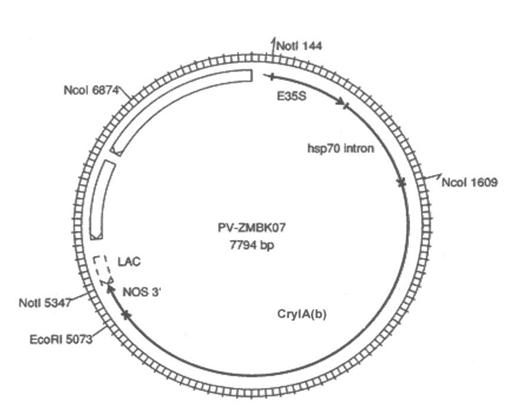
Fig.3 Reprezentarea schematica a plasmidei PV-ZMBK07 folosita in obtinerea tipului de porumb MON810 ( preluata din Agbios Database on Essential Biosafety)
Cei doi vectori au fost introdusi prin metoda bombardarii cu microproiectile (electroni) in celulele pantei de cultura. Toleranta la glifosat a transformat celulele care au fost selectate si ulterior cultivate in mediul de cultura pentru regenerarea plantei (Armstrong et al., 1991).
Analizele moleculare furnizate de autori au indicat ca numai elementele
constructiei PV-ZMBK07 au fost integrate in genomul liniei MON810 ca singur
insert, compus din promotorul amplificator CaMV 35S (E35S), secventa leader hsp70 si gena trunchiata
crylA(b). Semnalul terminator nos
Stabilitatea caracteristicilor noi date de insert
Informatiile furnizate de autori au demonstrat ca segregarea si stabilitatea a fost in acord cu un singur situ de insertie a genei crylA(b) in genomul MON810. Stabilitatea insertiei a fost demonstrata prin multiple generatii de incrucisari.
Linia de porumb a fost incrucisata cu cateva genotipuri diferite de porumb de-a lungul a 4 generatii demonstrindu-se mentinerea protectiei impotriva Sfredelitorul european al tulpinilor de porumb. MON810 a fost derivat din a treia generatie de incrucicisari. Stabilirea faptului ca in evenimentul MON 810 exista o singura insertie s-a realizat pe parcursul a trei generatii de cultura utilizandu-se tehnica Southern Blot.
Legislatie
Plantarea liniei de porumb MON810 a fost aprobatat de Statele Unite in
iulie 1996 de catre Agentia de Protectie a Mediului. Comercializarea in Europa
a fost autorizata ca urmare a comisiei Decizionale 98/294/EC din data de 22
aprilie 1998. MON810 a fost aprobat si in Argentina,Australia, Japonia, Africa
de Sud si Elvetia. Dupa aderarea Romaniei
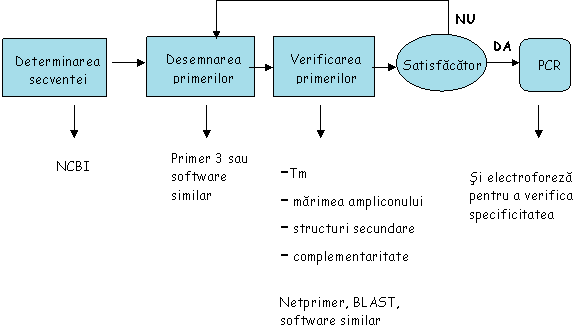
Desemnare de primeri pentru amplificarea PCR si
Real Time PCR
Utilizarea eficienta a tehnicilor moderne de detectie a OMG depinde de disponibilitatea informatiilor precise. Detectia OMG necesita cel putin cunoasterea secventei tinta a genei si tipul de modificare genetica. Caracteristicile specifice ale liniilor transgenice porumb MON 810 sunt prezentate in urmatoarele capitole.
Au fost elaborate diferite tehnici PCR pentru detectia OMG aprobate pentru introducerea in mediu si implicit pentru consumul populatiei. Specificitatea PCR depinde de alegerea primerilor.
Plantele modificate genetic pot fi impartite in categorii in conformitate cu gena structurala introdusa. O metoda aditionala pentru a directiona specificitatea reactiei este alegerea primerilor specifici secventelor ADN.
Asa cum a fost descris mai sus, nevoia cuantificarii OMG prezente intr-o proba duce catre elaborarea multor protocoale bazate pe reactia PCR, care permit nu numai un raspuns calitativ (prezenta/absenta) cat si o indicatie mult mai precisa asupra cantitatii de OMG prezente in proba analizata. Cele doua abordari bazate pe analiza ADN, cel mai des utilizate sunt competitive - PCR si real-time PCR.
Reactia PCR utilizeaza doua secvente oligonucleotidice (primeri) care se hibridizeaza pe catenele opuse de ADN si flancheaza secventa tinta care trebuie amplificata. Extensia primerilor este catalizata de o polimeraza ADN termostabila. Acumularea exponentiala a fragmentului specific de ADN rezulta in urma unei serii de cicluri repetitive alcatuite din cele trei etape: denaturarea acidului nucleic de interes (sablonul), atasarea primerilor si extensia acestora sub actiunea polimeazei. Capetele fragmentului de amplificat sunt definite de catre capetele 5' ale primerilor. Deoarece produsii sintetizati prin extensia primerilor intr-un anumit ciclu pot servi drept sablon in urmatorul ciclu, numarul copiilor ADN tinta se dubleaza aproximativ la fiecare ciclu; astfel un numar de 20 de cicluri produc aproximativ un milion de copii (220) din ADN tinta de studiat.
Ce afecteaza interca iile ADN-ADN?
Temperatura
Secven a de baze
Concentra ia primerilor
Timp
Ce proprieta i ale reac iei PCR sunt afectate?
Specificitatea
Eficien a
Sensibilitatea
Caracteristicile primerilor:
18-24 baze
Continutul G/C curpins intre 40-60%
Tm ce
permit realizare etapei de anelare la 55-
Fara structuri secundare (hair-pin)
Desemnarea la nivelul jonctiunilor exon-exon
Temperaturi similare de melting
Fara grad de complementaritate crescut (>2-3pb)
Mai ales la nivelul capatului
Reducerea posibilitatii de aparitie a primerilor:
Desemnare corecta (a se evita complementaritate la capatul 3)
Timpul de annealing sa fie minim
HotStart
TouchDown
Utilizarea sondelor specifice
Mana de lucru
Pentru desemnarea primerilor se utilizeaza software dedicate. In practica curenta am utilizat Primer3, care il exemplificam ca si aplicatie.
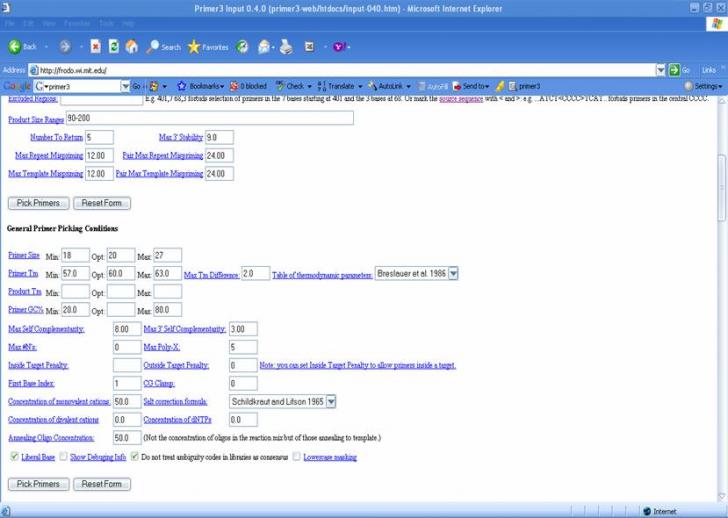
Primeri desemnati si utilizati pentru identificarea porumbului modificat genetic MON 810 prin PCR conventional:
- Primerii utilizati pentru identificare 'gena zein' specifica plantei:
ZEIN3 5¢-AGT GCG ACC CAT ATTCCA G-3¢
ZEIN4 5¢- GAC ATT GTG GCA TCA TCA TTT-3¢
- Primerii utilizati pentru identificare 'invertase' specifica plantei:
IVR1 (F) 5¢- CCG CTG TAT CAC AAG GGC TGG TAC T-3¢
IVR1(R) 5¢- GGA GCC CGT GTA GAG CAT GAC GAT C-3¢
- Primerii utilizati pentru identificarea 'promotorului E35S' si regiunea exon 1/intron1 pentru leader hsp70, specifice MON810:
mg1 5`- TAT CTC CAC TGA CGT AAG GGA TGA C - 3`
mg2 5` - TGC CCT ATA ACA CCA ACA TGT GCT T - 3`
mg3 5`- ACT ATC CTT CGC AAG ACC CTT CCT C - 3`
mg4 5` - GCA TTC AGA GAA ACG TGG CAG TAA C - 3`
- Primerii utilizati pentru identificarea ' promotorului E35S ' specific MON810:
VW01 5`- TCG AAG GAC GAA GGA CTC TAA CG - 3`
VW03 5` - TCC ATC TTT GGG ACC ACT GTC G - 3`
Primerii utilizati pentru gen tinta "cryIA (b)"
CRYIA1 5`- CGG CCC CGA GTT CAC CTT - 3`
CRYIA2 5`- CTG CTG GGG ATG ATG TTG TTG - 3`
CRYIA3 5`- CCG CAC CCT GAG CAG CAC - 3`
CRYIA4 5`- GGT GGC ACG TTG TTG TTC TGA - 3`
Primerii sunt produsi de firma TibMol Biol.
- Reactivi auxiliari: Tampon 5X PCR si Taq DNA polimeraza (Promega)
In PCR-ul in timp real (Real-Time PCR), produsul de amplificare este detectat prin intermediul colorantilor fluorescenti ("probes").
. In chimia reactiei sunt incluse diferite tipuri de sonde ("probes") oligonucleotidice care, intr-o anumita etapa a amplificarii, se prind specific fie de produsul amplificat, fie de fragmentul-tinta ce urmeaza a fi copiat.
. FRET = Fluorescence Resonance Energy Transfer; fenomenul are loc numai cand fragmentul marcat fluorescent si quencer-ul sunt apropiati in spatiu, si ei pot reactiona. Fluorescenta emisa se cumuleaza si creste in intensitate pe masura ce cantitatea de ampliconi creste.
Monitorizarea intensitatii fluorescentei chiar in timpul reactiei PCR permite detectia si cuantificarea produsului acumulat, fara a fi evoie de a mai deschide tuburile dupa terminarea reactiei.
. Asadar, un instrument de Real-Time PCR este in acelasi timp si un analizor in sine (spre deosebire, un PCR simplu realizeaza doar etapa de amplificare urmand ca analiza si detectia produsilor sa fie facuta intr- o etapa post PCR)
Pentru reactia
Real Time PCR s-a utilizat kit-ul dedicat: "foodproof GMO Soya Quantification"
producator BITECON Diagnostics. Detectia se realizeaza in timp real prin
atasarea sondelor de hibridizare la secventa tinta. Sondele sunt fragmente scurte de
oligonucleotidecare se leaga la o secventa tinta in timpul fazei de atasare. O
oligonucleotida este marcata la capatul
Tipul de probe analizate si rezultate obtinute
In laborator am testat diferite materii prime (porumb boabe) si produse alimentare care contin porumb sub forma de faina sau ca produs alimentar (fulgi de porum, pufuleti). Probele au fost testate prin tehnici de biologie moleculara (PCR conventional si Real Time PCR), iar rezultatele sunt prezentate pentru fiecare proba in parte. In cadrul prezentarii rezultatelor specifice activitatilor II.3 si II.4 sunt analizate rezultatele pe baza electroforezelor si a diagramelor real time PCR.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 1 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR - 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 2 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 3 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 4 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 5 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 6 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 7 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 8 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 0.2% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 9 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 0.6% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 10 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 0.2% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 11 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 0.8% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 12 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 1.2% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 13 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 1.6% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 14 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 0.9% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 15 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 16 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 17 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 18 (faina de porumb) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 19 (faina de porumb IRMM MON810 5%) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 20 (faina de porumb IRMM MON810 2%) au fost identificate:
gena zein - gena de referinta;
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta ;
promotor E35S - element tinta
gena cryIA(b) - gena tinta.
Cuantificare ADN folosind tehnica Real Time PCR- 100% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 21 (faina de porumb) au fost identificate:
gena invertase - gena de referinta;
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta - NEGATIV;
promotor E35S - element tinta - NEGATIV;
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 22 (faina de porumb) au fost identificate:
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta-POZITIV;
promotor E35S - element tinta - POZITIV
Cuantificare ADN folosind tehnica Real Time PCR-0.6% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 23 (faina de porumb) au fost identificate:
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta-POZITIV;
promotor E35S - element tinta-POZITIV
Cuantificare ADN folosind tehnica Real Time PCR-0.38% modificat genetic
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 24 (faina de porumb) au fost identificate:
gena invertase - gena de referinta;
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta - NEGATIV;
promotor E35S - element tinta - NEGATIV;
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 25 (faina de porumb) au fost identificate:
gena invertase - gena de referinta;
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta - NEGATIV;
promotor E35S - element tinta - NEGATIV;
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 26 (faina de porumb) au fost identificate:
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta-POZITIV;
promotor E35S - element tinta-POZITIV
Cuantificare ADN folosind tehnica Real Time PCR-0.76% modificat genetic.
Screening pentru identificare ADN specific prin tehnica PCR conventional.
La proba 27 (faina de porumb) au fost identificate:
gena invertase - gena de referinta
promotor E35S si regiunea exon1/intron1 hsp70 - elemente tinta-POZITIV;
promotor E35S - element tinta-POZITIV
Cuantificare ADN folosind tehnica Real Time PCR-0.29% modificat genetic
Screening prin tehnica PCR a porumbului modificat genetic
MON810 continut in alimente
Extractia si purificarea acizilor nucleici este primul pas in cele mai multe studii de biologie moleculara si in tehnicile de ADN recombinat. In acest studiu obiectivul metodei de extractie a acidului nucleic este obtinerea acizi nucleici puri din diverse surse cu scopul supravegherii analizelor specifice GM folosind lantul reactiei polimerazei (Polymerase chain Reaction - PCR).Calitatea si puritatea acizilor nucleici sunt unii dintre cei mai cririci factori pentru analizele PCR. In vederea obtinerii acizilor nucleici de inalta puritate liberi de contaminanti inhibitori ar trebui aplicate metode potrivite de extractie.
In vederea evitarii obtinerii unui rezultat fals negativ datorat prezentei inhibitorilor de PCR in proba, se recomanda efectuarea unui experiment de control pentru a testa inhibitia PCR..
Pentru acest scop este deseori utilizata o planta specifica ( eucariota sau cloroplasta) sau specii specifice analizei PCR.
Tabel 1. Inhibitori ai procesului PCR
Inhibitori Concentratia de inhibare
SDS > 0.005%
Fenol >0.2%
Etanol > 1%
Isopropanol >1%
Acetat de sodiu >5mM
Clorura de sodiu >25mM
EDTA >0.5mM
Hemoglobina >1mg/ml
Heparina >0.15 i.m/ml
Uree >20mM
Deoarece exista o varietate de metode de a extrage si purificare a acizilor nucleici alegerea celei potrivite se bazeaza pe urmatorul criteriu:
Metode de extractie
Extractia acizilor nucleici din materialul biologic are la baza liza celulelor, inactivarea nucleazelor celulare si separarea acidului nucleic dorit de resturile celulare.
Deseori, procedurile de liza celulara constau in tehnici sigure folosite pentru a rupe legaturile materiei prime (starter) de ex. tesutul, dar suficient de fin pentru a pastra intreg acidul nucleic vizat.
Procedurile de liza celulara includ:
Rupere mecanica ( ex.liza hipotonica, macinare etc);
Tratament chimic ( ex. liza cu ajutorul detergentilor, reducerea tiolului, agenti chaotropici)
Digestie enzimatica ( ex.proteinaza K)
Pot fi combinate ruperea membranelor celulare si inactivarea nucleazeor intracelulare. De exemplu o singura solutie poate contine detegenti care solubilizeaza membranele celulare si saruri chaotropice care sa inactiveze enzimele intraceulare. Dupa liza celulara si inactivarea nucleazei, resturile celulare pot fi usor indepartate prin filtrare si precipitare.
Metode de purificare
Metodele de purificare a acizilor nucleici din extractele celulare sunt de obicei combinatii de doua sau mai multe din urmatoarele tehnici:
Metoda utilizata in labororator pentru extractia acizilor nucleici este cea propusa de producatorul de kit-uri ROCHE -"High Pure GMO Sample Preparation Kit".
Pe parcursul studiului s-au analizat un numar de 27 probe de: alimente care contin porumb sau materii prime (porumb boabe) SI Material de referinta certificat IRMM MON810.
Materiale necesare aplicarii tehnicilor PCR conventional si Real time PCR
Disponibilitatea materialelor de referinta certificate este o cerinta fundamentala pentru fiecare metoda de detectie. Materialele de referinta certificate sunt produse din faina de porumb deshidratata: MON810 - CRM ERM -BF413a (0%MG), CRM ERM -BF413b (1%MG) SI CRM ERM -BF413c (5%MG).
Un alt punct de maxima importanta este omogenitatea probei.
I) Reactivi necesari pentru extractia acizilor nucleici
- Kit pentru extractia acizilor nucleici specifici OMG -"High Pure GMO Sample Preparation Kit"-Roche
II) Reactivi necesari pentru identificarea porumbului modificat genetic (MON810) prin PCR conventional
- Primerii utilizati pentru identificare 'gena zein' specifica plantei:
ZEIN3 5¢-AGT GCG ACC CAT ATTCCA G-3¢
ZEIN4 5¢- GAC ATT GTG GCA TCA TCA TTT-3¢
- Primerii utilizati pentru identificare 'invertase' specifica plantei:
IVR1 (F) 5¢- CCG CTG TAT CAC AAG GGC TGG TAC T-3¢
IVR1(R) 5¢- GGA GCC CGT GTA GAG CAT GAC GAT C-3¢
- Primerii utilizati pentru identificarea 'promotorului E35S' si regiunea exon 1/intron1 pentru leader hsp70, specifice MON810:
mg1 5`- TAT CTC CAC TGA CGT AAG GGA TGA C - 3`
mg2 5` - TGC CCT ATA ACA CCA ACA TGT GCT T - 3`
mg3 5`- ACT ATC CTT CGC AAG ACC CTT CCT C - 3`
mg4 5` - GCA TTC AGA GAA ACG TGG CAG TAA C - 3`
- Primerii utilizati pentru identificarea ' promotorului E35S ' specific MON810:
VW01 5`- TCG AAG GAC GAA GGA CTC TAA CG - 3`
VW03 5` - TCC ATC TTT GGG ACC ACT GTC G - 3`
Primerii utilizati pentru gen tinta "cryIA (b)"
CRYIA1 5`- CGG CCC CGA GTT CAC CTT - 3`
CRYIA2 5`- CTG CTG GGG ATG ATG TTG TTG - 3`
CRYIA3 5`- CCG CAC CCT GAG CAG CAC - 3`
CRYIA4 5`- GGT GGC ACG TTG TTG TTC TGA - 3`
Primerii sunt produsi de firma TibMol Biol.
- Reactivi auxiliari: Tampon 5X PCR si Taq DNA polimeraza (Promega)
1. Extractia ADN optimizata, este fundamentala pentru asigurarea calitatii si prezentei ADN extras. Acest aspect este deosebit de important deoarece majoritatea produselor alimentare de pe piata ce contin soia sunt procesate foarte mult. Este cunoscut faptul ca ADN se poate degrada considerabil in timpul procesarii alimentelor, in special prin tratament termic. Aditional, o metoda corespunzatoare de extractie a ADN trebuie sa asigure inlaturarea substantelor inhibitoare prezente in proba.
Au fost elaborate metode pentru extractia ADN si foarte multe companii au produs kituri specializate.
In cadrul temei noastre de cercetare pentru extractia acizilor nucleici specifici OMG din diferite tipuri de probe s-a utilizat kit-ul "High Pure GMO Sample Preparation Kit" de la firma ROCHE.
Liza celulara
s-a obtinut prin incubarea probelor (30 min. la
Reactia de
legare apare in de
Eventualele reziduuri contaminante de ADN sunt supuse digestiei directe cu DNaza aplicata direct pe suprafata filtrelor, acizii nucleici fiind ulterior purificati de saruri, proteine si alte impuritati prin spalari succesive cu tampoane de spalare.
Proba de analizat se trateaza cu tamponul de legare suplimentat cu proteinaza K si poliadenina, reactiv specific pentru legarea si transportul ADN, se incubeaza la 72 C pentru 10 min.
Amestecul se centrifugheaza 2 minute la 13000
rpm, supernatantul se pipeteaza pe suprafata filtrelor alcatuite din fibra de
sticla, se indeparteza eluatul obtinut in urma centrifugarii timp de 1min. la
13000 rpm. In final produsul se spala de mai multe ori cu tampoane de spalare
si se recupereaza in tampon de elutie, prin centrifugare la
Cuantificarea ADN cu ajutorul spectrofotometriei
Putitatea ADN poate fi masurata direct in solutii apoase in forma diluata sau nediluata prin masurarea absortiei "A" ( definita si densitate optica, OD) in UV.
Daca proba este pura (de ex. fara cantitati semnificative de contaminanti cum ar fi proteinele, fenolul sau agaroza), masuratoarea spectrofotometrica a cantitatii de radiatii ultravolete absorbita este proportionala cu puritatea ADN. Pentru aceasta metoda, solutiile apoase tampon avand concentratii scazute de ioni ( ex. solutie tampon TE) sunt ideale. Concentratia de acizi nucleici este determinata de obicei prin masurarea la 260 nm, proba martor fiind blank. Deoarecee proteinele absorb la 280 nm, raportul A260/A280 este folosit pentru a estima puritatea acidului nucleic.
ADN pur ar trebui sa aibe o marime a raportului de aprox.1,8.
Absortia la 230 nm reflecta contaminarea probei cu substante ca peptidele, carbohidrati, fenoli sau compusi aromatici.
In cazul unei probe pure raportul A260/A280 ar trebui sa fie aprox. 2.2
Rezultatele obtinute in urma masuratorii spectrofotometrice pentru 18 probe de ADN obtinut din diverse produse care contin porumb modificat genetic sau conventional suntprezentate in tabelul 1
Tabelul 1 Rezultatele obtinute in urma masuratorii spectrofotometrice a puritatii ADN.
Ratio 260nm/280nm and ds DNA Concentration
Method : APPLIC15 Instrument: Lambda 25
Wavelengths : 260,00 , 280,00 nm Factor: 50
Date : 20.01.2009 Time : 09:49:46
=
SampleID A(260nm) A(280 nm) Ratio Dil.Factor dsDNA Conc. Sample Info
-------- ----- ------ -------- ----- ------ -----------
1 0,3439 0,2388 1,4398 50,000 859,67 [µg/mL]
2 0,2812 0,1812 1,5520 50,000 703,10 [µg/mL]
3 0,3584 0,2177 1,6462 50,000 895,92 [µg/mL]
4 0,3314 0,2050 1,6167 50,000 828,52 [µg/mL]
5 0,2970 0,1882 1,5785 50,000 742,55 [µg/mL]
6 0,3771 0,2404 1,5688 50,000 942,80 [µg/mL]
7 0,3449 0,2144 1,6088 50,000 862,20 [µg/mL]
8 0,3313 0,1977 1,6757 50,000 828,15 [µg/mL]
9 0,4539 0,2595 1,7489 50,000 1134,7 [µg/mL]
10 0,5090 0,2874 1,7709 50,000 1272,5 [µg/mL]
11 0,3498 0,2105 1,6620 50,000 874,60 [µg/mL]
12 0,3572 0,2141 1,6682 50,000 893,02 [µg/mL]
13 0,4641 0,2629 1,7653 50,000 1160,2 [µg/mL]
14 0,4682 0,2661 1,7595 50,000 1170,4 [µg/mL]
15 0,3439 0,2088 1,6473 50,000 859,72 [µg/mL]
16 0,2935 0,1889 1,5538 50,000 733,77 [µg/mL]
17 0,2616 0,1643 1,5924 50,000 654,05 [µg/mL]
18 0,2334 0,1549 1,5069 50,000 583,60 [µg/mL]
Ratio 260nm/280nm and ds DNA Concentration
Method : APPLIC15 Instrument: Lambda 25
Wavelengths : 260,00 , 280,00 nm Factor: 50
Date : 04.02.2009 Time : 12:35:55
=
SampleID A(260nm) A(280 nm) Ratio Dil.Factor dsDNA Conc. Sample Info
-------- ----- ------ -------- ----- ------ -----------
19 0,1681 0,1151 1,4600 50,000 420,25 [µg/mL]
20 0,1016 0,0554 1,8326 50,000 253,90 [µg/mL]
21 0,2024 0,1090 1,8563 50,000 505,87 [µg/mL]
22 0,1640 0,0878 1,8684 50,000 410,02 [µg/mL]
23 0,1390 0,1028 1,3521 50,000 347,60 [µg/mL]
24 0,4920 0,3141 1,5663 50,000 1230,0 [µg/mL]
25 0,3555 0,2331 1,5252 50,000 888,77 [µg/mL]
26 0,1350 0,0751 1,7966 50,000 337,50 [µg/mL]
27 0,3773 0,2519 1,4980 50,000 943,22 [µg/mL]
Testul PCR coventional este utilizat pentru studierea a cinci zone din genomul plantei de porumb:
- 'gena zein' - gena de referinta;
- 'gena invertase' - gena de referinta;
- 'promotorului E35S' si regiunea exon 1/intron1 pentru leader hsp70, specifice MON810
- ' promotorului E35S ' specific MON810
- gena tinta "cryIA (b)"
Pentru toate reactiile PCR s-au folosit ca si controale:
Control pozitiv: ADN provenit din material de referinta (MON810 1%)
Control negativ: ADN provenit din material de referinta (0% MG)
Control negativ master-mix: Utilizarea apei in locul probei de ADN.
Identificarea genei "zein"
Preparare Master mix, programul PCR, electroforeza
Componentele Master mix specifice testului PCR coventional, pentru un volum final de 48 ml / tub de reactie, sunt redate in tabelul 2:
Tabel 2 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional a geneide referinta 'zein'
|
MIX ZEIN3/ ZEIN4 |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
32,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
ZEIN3 20mM |
0,5 mM |
1,25 |
|
ZEIN4 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
48 |
|
Protocolul de amplificare s-a realizat in thermocyclerul
ICycler-BIO-RAD dupa urmatorul profil: Denaturare initiala
Denaturare
Atasare
Numar de cicluri 40
Extensie
finala
Racire
Electroforeza se efectueaza in gel de agaroza (1.5% agaroza in TBE 1x + 2 ml EtBr 10 mg/ml), fiecare godeu se incarca cu 10 ml amplicon si 2 ml tampon incarcare. Parametrii pentru electroforeza: - Migrare: 100V; 1,5A; timp: 1 ora; in tamponul de migrare se adauga 12 ml EtBr 10 mg/ml; Marker folosit: 15ml de 100 pb Rezultatul electroforezei: banda specifica de 277 pb.
Identificarea genei de referinta "invertase"
Preparare Master mix, programul PCR, electroforeza
Componentele Master mix specifice testului PCR coventional, pentru un volum final de 48 ml / tub de reactie, sunt redate in tabelul 3:
Tabel 3 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional a geneide referinta 'zein'
|
MIX IVR1(f)/IVR1(r) |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
32,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
IVR1(f) 20mM |
0,5 mM |
1,25 |
|
IVR1(r) 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
48 |
|
Protocolul de amplificare s-a realizat in thermocyclerul ICycler-BIO-RAD dupa urmatorul profil:
Denaturare
initiala
Denaturare
Atasare
Extensie
Numar de cicluri 45
Extensie
finala
Racire
Electroforeza se efectueaza in gel de agaroza (1.5% agaroza in TBE 1x + 2 ml EtBr 10 mg/ml), fiecare godeu se incarca cu 8 ml amplicon si 2 ml tampon incarcare. Parametrii pentru electroforeza: - Migrare: 100V; 1,5A; timp: 1 ora; in tamponul de migrare se adauga 12 ml EtBr 10 mg/ml; Marker folosit: 15ml de 100 pb Rezultatul electroforezei: banda specifica de 226 pb.
Identificarea 'promotorului E35S si a regiunii exon1/intron1 a proteinei hsp'prin reactia nested PCR.
Preparare Master mix 1, programul PCR
Componentele Master mix specifice testului PCR conventional, pentru un volum final de 48 ml /tub de reactie la care se adauga 2ml ADN, sunt redate in tabelul 4:
Tabel 4 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional
|
MIX mg1/mg2 |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
32,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
mg1 20mM |
0,5 mM |
1,25 |
|
mg2 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
48 |
|
Protocolul de amplificare s-a realizat in thermocyclerul thermocyclerul ICycler BIO-RAD dupa urmatorul profil:
Denaturare
initiala
Denaturare
Atasare
Extensie
Numar de cicluri 35
Extensie
finala
Racire
Preparare Master mix 2, programul PCR
Componentele Master mix specifice testului PCR conventional, pentru un volum final de 49 ml /tub de reactie la care se adauga 1ml de produs preamplificat in urma primei reactii PCR, sunt redate in tabelul 5:
Tabel 5 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional
|
MIX mg3/ mg4 |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
33,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
mg3 20mM |
0,5 mM |
1,25 |
|
mg4 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
49 |
|
Protocolul de amplificare s-a realizat in thermocyclerul ICycler BIO-RAD dupa urmatorul profil:
Denaturare
initiala
Denaturare
Atasare
Extensie
Numar de cicluri 40
Extensie
finala
Racire
Electroforeza se efectueaza in gel de agaroza (2.5% agaroza in TBE 1x + 2 ml EtBr 10 mg/ml), fiecare godeu se incarca cu 8 ml amplicon si 2 ml tampon incarcare. Parametrii pentru electroforeza: Migrare: 100V; 1,5A, timp: 1 ora, in tamponul de migrare se adauga 12 ml EtBr 10 mg/ml; Marker folosit: 15ml de 100 pb.
Rezultatul electroforezei: banda specifica de 149 pb.
Identificarea a "promotorului E35S"
Preparare Master mix, programul PCR, electroforeza
Componentele Master mix specifice testului PCR coventional, pentru un volum final de 48 ml / tub de reactie la care s-a adaugat 2 ml /tub ADN sunt redate in tabelul 6:
Tabel 6 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional a geneide referinta 'zein'
|
MIX VW01/VW03 |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
32,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
VW01 20mM |
0,5 mM |
1,25 |
|
VW03 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
48 |
|
Protocolul de amplificare s-a realizat in thermocyclerul ICycler-BIO-RAD dupa urmatorul profil:
Denaturare
initiala
Denaturare
Atasare
Extensie
Numar de cicluri 40
Extensie
finala
Racire
Electroforeza se efectueaza in gel de agaroza (1.5% agaroza in TBE 1x + 2 ml EtBr 10 mg/ml), fiecare godeu se incarca cu 8 ml amplicon si 2 ml tampon incarcare. Parametrii pentru electroforeza: - Migrare: 100V; 1,5A; timp: 1 ora; in tamponul de migrare se adauga 12 ml EtBr 10 mg/ml; Marker folosit: 15ml de 100 pb Rezultatul electroforezei: banda specifica de 170 pb.
Identificarea genei tinta 'cryIA(b)' prin reactia nested PCR.
Preparare Master mix 1, programul PCR
Componentele Master mix specifice testului PCR conventional, pentru un volum final de 48 ml /tub de reactie la care se adauga 2ml ADN, sunt redate in tabelul 7:
Tabel 7 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional
|
MIX CRYIA1/CRYIA2 |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
32,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
CRYIA1 20mM |
0,5 mM |
1,25 |
|
CRYIA2 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
48 |
|
Protocolul de amplificare s-a realizat in thermocyclerul thermocyclerul ICycler BIO-RAD dupa urmatorul profil:
Denaturare
initiala
Denaturare
Atasare
Extensie
Numar de cicluri 25
Extensie
finala
Racire
Preparare Master mix 2, programul PCR
Componentele Master mix specifice testului PCR conventional, pentru un volum final de 49 ml /tub de reactie la care se adauga 1ml de produs preamplificat in urma primei reactii PCR, sunt redate in tabelul 8:
Tabel 8 - Compozitia amestecului de reactie pentru identificarea prin PCR conventional
|
MIX CRYIA3/CRYIA4 |
||
|
Reagenti |
Conc. finala |
ml/proba |
|
Apa (RNase free) |
33,75 |
|
|
Tampon 5X PCR |
1x |
5,0 |
|
MgCl2 |
|
5,0 |
|
dNTPs |
|
2,5 |
|
CRYIA3 20mM |
0,5 mM |
1,25 |
|
CRYIA4 20mM |
0,5 mM |
1,25 |
|
Taq DNA polimeraza |
0,025 U/ml |
0,25 |
|
TOTAL (ml) |
49 |
|
Protocolul de amplificare s-a realizat in thermocyclerul ICycler BIO-RAD dupa urmatorul profil:
Denaturare initiala
Denaturare
Atasare
Extensie
Numar de cicluri 35
Extensie
finala
Racire
Electroforeza se efectueaza in gel de agaroza (2.5% agaroza in TBE 1x + 2 ml EtBr 10 mg/ml), fiecare godeu se incarca cu 8 ml amplicon si 2 ml tampon incarcare. Parametrii pentru electroforeza: Migrare: 100V; 1,5A, timp: 1 ora, in tamponul de migrare se adauga 12 ml EtBr 10 mg/ml; Marker folosit: 15ml de 100 pb.
Rezultatul electroforezei: banda specifica de 189 pb.
Cuantificarea prin tehnici Real Time PCR a porumbului modificat genetic
(MON 810)
Sistemul Light Cycler produs de firma Roche, Germania
Sistemul este un thermocycler in timp real,
autorizat de firma germana, fiind produs sub licenta companiei Hoffmann
Sistemul este alcatuit din doua elemente principale (fig. 19):
A) Thermocycler-ul, care contine la randul sau alte doua unitati importante:
Caruselul
cu probe: este elementul central in cadrul incintei termice cilindrice si
contine locasuri pentru 32 de probe depuse in capilare de sticla, care au
diametrul exterior de
Incinta termica: este conectata direct la sistemul optic al fluorimetrului. Temperaturile din interiorul incintei sunt controlate de catre un sistem de masurare integrat care este echipat cu un senzor de temperatura instalat in vecinatatea capilarelor din carusel. O alta trasatura care permite desfasurarea cu viteza deosebita a ciclurilor de amplificare este faptul ca aerul este folosit ca mediu de transfer al caldurii.
B) Fluorimetrul cu urmatoarele componente:
Sursa de energie pentru excitarea probelor, reprezentata de o dioda de inalta performanta ("blue LED"). Lumina emisa de dioda este filtrata si adusa la aceeasi lungime de unda prin intermediul unui sistem optic care produce 1mW de lumina la o lungime de unda de 470 nm; aceasta lumina este apoi directionata pe capilarele de sticla care contin probele de analizat.
Un motor rotativ de inalta precizie care roteste caruselul cu probe pentru a aduce capilarele de sticla in pozitia optima pentru excitare si masurare.
Oglinzi care disperseaza lumina emisa de probe catre unul din cele trei canale de detectie: 530 20 nm, 640 20 nm, 710 20 nm. Fluorocromii care pot fi folositi cu sistemul Light Cycler sunt Fluoresceina, SYBR Green I, LC-Red 640 (Light Cycler-Red-640-N-hydroxy-succinimide ester) si LC-Red 705 (Light Cycler-Red-705-Phosphoramidite).
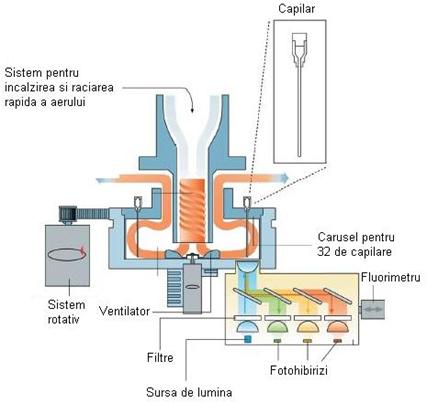
Fig. 19 - Structura interna a sistemului Light Cycler
Comunicarea dintre Light Cycler si computerul dedicat (PC cu procesor Pentium) se realizeaza printr-o interfata seriala, prin intermediul celor trei microprocesoare integrate in sistem, care asigura comunicarea, reglarea temperaturii si controlul procedurilor de masurare. PC-ul monitorizeaza de asemenea temperaturile si semnalele de fluorescenta din timpul etapelor de amplificare si opereaza toate programele analitice specifice.
Cele doua componente de baza, thermocyclerul si fluorimetrul, lucreaza impreuna intr-un sistem simplu si rapid, aplicatii practice precum analiza produsilor amplificati, cuantificarea acestora, analiza mutatiilor. Thermocyclerul a fost optimizat pentru efectuarea testelor rapide PCR: in timp ce un test conventional dureaza mai multe ore, analizele de PCR realizate cu Light Cycler dureaza 20-30 minute.
Flexibilitatea modului de detectie permite nu numai monitorizarea datelor in timp real ci si posibilitatea modificarii parametrilor de lucru chiar in timpul derularii testului, ceea ce permite optimizarea maxima a protocolului in timp real.
Datele obtinute din analiza fluorimetrica sunt evaluate direct cu ajutorul soft-ului specific, fara alte proceduri suplimentare consumatoare de reactivi, timp si cu risc de contaminare.
Conditiile pentru realizarea unui test performant PCR in timp real
Desi testul PCR este un concept relativ simplu, succesul acestuia depinde de mai multi factori: obtinerea sablonului de acid nucleic, prevenirea contaminarii in timpul lucrului, optimizarea componentelor amestecului de reactie, optimizarea reactiei generale.
Ø Obtinerea sablonului de acid nucleic
Primul factor in stabilirea unui test PCR eficient il constituie calitatea sablonului de acid nucleic care contine secventa tinta. Pentru utilizarea sistemului Light Cycler se recomanda folosirea urmatoarelor cantitati maxime de sablon:
- 500 ng ADN genomic
- 1 ng ADN plasmidic
- 500 ng ARN total
- 10 ng ARN mesager
Principalele etape ale metodelor folosite pentru prepararea sablonului sunt: a) extractia acizilor din materialul biologic prin liza celulara, inactivarea nucleazelor si indepartarea resturilor celulare. Tehnicile includ distrugeri mecanice (maruntire, omogenizare, liza hipotonica), tratament chimic sau digestii enzimatice cu proteinaza K.
b) purificarea acizilor nucleici din extrasul preparat, prin tehnici precum extractie/precipitare, cromatografie, centrifugare, electroforeza, separari pe coloane de afinitate sau combinatii intre aceste tehnici.
In functie de tipul de acid nucleic de interes, se recomanda kituri dedicate, bazate pe metode de purificare specifice (adsorbtie pe silicagel, purificare de afinitate, etc.).
Ø prevenirea contaminarii in timpul lucrului; se respecta masurile de biosecuritate impuse de testul PCR.
Ø optimizarea componentelor amestecului de reactie: se tatoneaza si selecteaza concentratiile optime pentru Taq ADN polimeraza, clorura de magneziu, dezoxiribonucleozide trifosfat si primerii specifici.
Ø adaptarea unui protocol conventional PCR la sistemul Light Cycler si optimizarea reactiei generale; trei aspecte importante trebuie urmarite in acest caz: adaptarea testului PCR la sistemul Light Cycler, programarea protocolului experimental pe sistemul Light Cycler si aplicarea strategiilor de optimizare pentru reactiile realizate pe sistemul Light Cycler.
Principiile detectiei fluorimetrice in timp real
Pentru detectia si evaluarea fluorimetrica a produsilor PCR in capilarele de sticla s-a aplicat tehnica: prin intermediul fluorocromilor care se cupleaza la sonde de hibridizare oligonucleotidice cu secvente specifice "Hybridisation probes" si care detecteaza numai anumiti produsi PCR.
Protocolul PCR in timp real pentru detectia porumbului modificat genetic a fost elaborat in conformitate cu procedura generala aplicata pentru acest tip de test, parcurgand etapa mentionta anterior. Punctul de pornire in acest demers il reprezinta testul PCR clasic, cu evidentierea benzilor specifice prin electroforeza in gel de agaroza.
Optimizarea testului Real Time PCR in timp real folosind kit-ul "foodproof GMO Maize Quantification kit - Hybridizitation Probes"
Tehnica utilizata pentru optimizare foloseste sondele de hibridizare. Aceasta metoda reprezinta in acest moment, cel mai performant mod de analiza in timp real al secventelor tinta amplificate, putand sa detecteze chiar si secventa unei singure copii din complexul de esantioane de acizi nucleici. Sondele de hibridizare se folosesc pentru cuantificarea produsilor obtinuti prin amplificare cu ajutorul unui soft specific de evaluare.
Metoda foloseste doua sonde de hibridizare oligonucleotidice care se leaga de secventele interne adiacente ale ADN tinta, intr-un aranjament cap-coada.
Donorul oligonucleotidic 5' are un marker fluorescent la capatul sau 3'. Acceptorul oligonucleotidic 3' are colorantul Light Cycler-Red 640 (sau Light Cycler-Red 705) la capatul sau 5'.
Cei doi coloranti markeri pot sa interactioneze doar atunci cand amandoi se hibridizeaza la secventa tinta si fiind in proxima vecinatate se poate realiza un transfer de energie de rezonanta fluorescenta (FRET) intre ei (fig. 20).

Fig. 20 - Reprezentarea fenomenului FRET: emisia masurabila de fluorescenta produsa de apropierea celor doua sonde oligonucleotidice
Fenomenul FRET este un transfer energetic, dependent de distanta, intre doi fluorocromi adiacenti, fara emisie de fotoni.
Conditiile pentru realizarea FRET sunt urmatoarele:
Moleculele donor si acceptor trebuie sa fie in proxima vecinatate.
Spectrul de excitatie al acceptorului trebuie sa se suprapuna peste spectrul de emisie in fluorescenta al donorului.
Orientarile dipolare de tranzitie ale donorului si acceptorului trebuie sa fie aproximativ paralele.
In timpul etapei de atasare a primerilor, doua oligonucleotide diferite se ataseaza intr-un sistem cap-coada, la regiunile adiacente ale ADN tinta. Markerii fluorocromi, care sunt direct cuplati la oligonucleotide, sunt foarte apropiati in aceasta structura hibrida. Fluorocromul donor "F1" (fluoresceina) care este excitat de catre o sursa luminoasa externa, transfera, in cadrul fenomenului FRET, o parte din energia sa de excitatie catre acceptorul adiacent "F2" (Light Cycler-Red 640 sau 705) prin intermediul interactiunilor dipol-dipol. Fluorocromul F2 excitat emite o lumina masurabila, la diferite lungimi de unda.
Pentru optimizarea finala a testului PCR se utilizeaza kitul produs de firma Roche, denumit "foodproof GMO Maize Quantification kit Hybridizitation Probes", kit care furnizeaza rezultate deosebit de bune in variantele Real Time PCR intr-o singura etapa. Strategia de optimizare urmareste:
o Utilizarea martorului negativ (apa in locul sablonului) indica absenta contaminarii;
o Primer-dimerii nu se mai formeaza in cazul reactiei cu sonde de hibridizare;
o Alaturi de optimizarea performantelor sablonului si primerilor se mai urmareste si optimizarea sondelor de hibridizare, prin titrari ale concentratiilor in cadrul unor serii separate de reactii.
Tabelul 10- Comparatie intre testul PCR clasic si testul PCR in timp real, utilizand kitul "foodproof GMO Soya Quantification kit Hybridizitation Probes"
|
Parametrul |
Thermocycler conventional |
Light Cycler |
|
Volumul final |
ml |
ml |
|
ADN sablon |
1 pg-1 mg ADN total |
1 pg-1 mg ADN total; nu se folosesc mai mult de 8ml ADN per 20 ml amestec de reactie. |
|
Conc. finala a primerilor |
mM, fiecare primer |
mM, fiecare primer (pentru experimentele initiale: 0,5 mM) |
|
Conc. finala a sondelor de hibridizare |
mM (pentru experimentele initiale: 0,2 mM) |
|
|
Conc. finala de MgCl2 |
1- |
4- |
|
Marimea ampliconului |
Pana la 6 kB |
100-1000 pb |
|
Nucleotide |
0,2 |
Inclus in "foodproof GMO maize Quantification kit Hybridizitation Probes" |
|
Tamponul pentru Real Time PCR |
Produs comercial |
Inclus in KIT |
|
Amestecul enzimatic pentru Real Time PCR |
Produs comercial |
Inclus in "foodproof GMO maize Quantification kit Hybridizitation Probes" |
Criterii de selectare a sondelor de hibridizare:
Foarte apropiate una de alta (1-5 baze distanta intre ele).
Nu trebuie sa contina:
secvente repetitive, monotone sau auto-complementare (daca sondele se ataseaza una de alta, ele vor genera un semnal constant, independent de cantitatea de produs PCR format);
clustere de G si C la oricare din capete (sonda se poate lega prea puternic de tinta);
secvente extrem de bogate in purine (sondele bogate in G si A tind sa se ataseze relativ slab de secventa tinta).
Nu trebuie sa hibridizeze cu capatul 3' al primerilor utilizati in testul PCR (sa nu formeze dimeri primer-sonda). In acest scop, pentru o optimizare maxima, cu un risk minim de formare a dimerilor primer-sonda, se poate utiliza kitul "Light Cycler Fast start".
Sa fie modificati astfel incat sa nu poata fi elongati in timpul testului PCR.
Sa
aiba puncte de topire mai mari cu 5-
Capatul 3' al sondei donor sa fie marcat cu fluoresceina (FITC).
Capatul 5' al sondei acceptor sa fie marcat cu Light Cycler-Red 640 sau 705.
Criterii de selectare a zonelor tinta, care sa fie recunoscute de catre sondele de hibridizare:
Sa fie localizate catre capatul 3' al secventei tinta, cat mai departe de situsul de legare 5' al primerului de pe aceeasi banda a ADN de interes. Se recomanda selectarea unei zone tinta care sa fie apropiata, dar sa nu se suprapuna peste situsul de legare al primerului de pe banda opusa (fig. 21). Aceasta pozitionare permite efectuarea masuratorilor de fluorescenta inainte ca primerii sa fie complet extinsi si inainte ca sondele sa fie inlocuite de catre Taq polimeraza.
Sa fie selectata intr-o zona "echilibrata" a secventei: sa aiba o distributie relativ egala a celor patru baze, astfel incat sondele sa se lege destul de puternic.
Sa fie selectata intr-o zona care sa nu contina secvente monotone, repetitive sau auto-complementare.
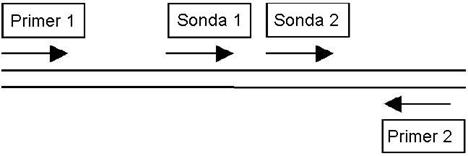
Fig. 21 - Principiul selectarii sondelor de hibridizare
Kitul "foodproof GMO Maize Quantification kit Hybridizitation Probes" contine Tth ADN polimeraza, amestecul de dNTP, tamponul de reactie si MgCl2. Se adauga primerii, clorura de magneziu si tamponul de reactie, ale caror concentratii au fost stabilite in prima etapa de optimizare a testului, sondele de hibridizare, a caror concentratie trebuie optimizata prin serii de tatonari succesive si ADN sablon; cantitatea maxima de acid nucleic care poate fi folosita este de 500 ng ADN total, cantitatile mai mari putand sa inhibe reactia. Marimea ampliconului obtinut nu trebuie sa depaseasca 400 pb.
Testul Real -Time RT-PCR aplicabil pentru gena cryIA(b) si gena invertase
Posibilitatea
cuantificarii materialului modificat genetic si stabilirii unei limite de
detectie care sa permita identificarea produselor ce contin soia modificata
genetic, au reprezentat prioritatile efectuarii acestui tip de test. Testul s-a
realizat folosind kit-ul "LightCycler GMO Maize Quantification kit" (Roche,
Componentele testului Real-Time PCR, pentru un volum final de 15ml / tub de reactie, sunt redate in tabelul 11:
Tabel 11 - Compozitia amestecului de reactie pentru Real Time RT-PCR
|
Component |
Volum |
|
H2O, puritate PCR |
11 ml |
|
Amestec de reactie ce contine sonde si primeri pentru cuantificarea gena cryIA(b), 10x conc. sau Amestec de reactie ce contine sonde si primeri pentru cuantificarea gena invertase, 10x conc. |
2 ml sau 2ml |
|
Amestec de reactie: enzima - tampon specific |
2 ml |
|
Total volum |
15 ml |
|
Mix-ul obtinut se omogenizeaza prin pipetare. Nu se vortexeaza |
|
Pipetare 15 ml PCR mix in fiecare capilar LightCycler si 5 ml ADN. Transfer capilare in carusel LightCycler si centrifugare 5 sec la 3000 rpm. Pentru a obtine cuantificarea (exprimata in procente) organismului modificat genetic provenit din porumb, este necesar sa se prepare un set de etaloane seriate conform tabelului 12.
Etalonul folosit este ADN din porumb modificat genetic si este inclus in kit-ul de lucru.
Tabel 12 - Prepararea controalelor externe (existente in kit)
|
Nr. dilutie |
Dilutie |
Concentratia standardelor utilizate pentru gena de referinta |
Concentratia standardelor utilizate pentru gena tinta |
|
1 |
Nediluat |
10000 |
3500 |
|
2 |
1:10 |
1000 |
350 |
|
3 |
1:100 |
100 |
35 |
|
4 |
1:1000 |
10 |
5 |
|
5 |
1:10000 |
1 |
0.35 |
Protocolul de amplificare s-a realizat in thermocyclerul LightCycler dupa urmatorul profil prezentat in tabelul 13:
Tabel 13 - Parametrii de functionare ai sistemului LightCycler
|
Programul |
Numar cicluri |
Temperatura |
Durata |
Mod de achizitie |
|
Pre-Incubare |
1 |
95 C |
10 min |
none |
|
Amplificare |
45 |
95 C |
10 sec |
none |
|
63 C |
20 sec |
single |
||
|
72 C |
10 sec |
none |
||
|
Racire |
1 |
40 C |
30 sec |
none |
Testul PCR in timp real
Posibilitatea cuantificarii insertului modificat genetic si stabilirii limitei de detectie care sa permita identificarea rapida a produselor ce contin porumb modificat genetic, precum si necesitatea etichetarii produselor ce contin mai mult decat 0,9 % OMG, au reprezentat prioritatile efectuarii acestui tip de test.
Au fost analizate
prin tehnica PCR in timp real, un numar de 20
probe; aceste probe au iesit pozitive prin aplicarea tehnicii de screening
pentru identificarea genei de referinta, si a genei tinta. In fig. nr. 4 sunt
prezentate rezultatele analizei PCR in timp real, efectuate pe analizorul Light
Cycler 2.0 (Roche -
Probele au fost lucrate in duplicat, iar pentru a verifica limita de detectie a metodei s-au luat in lucru doua probe ADN provenite din material de referinta certificat de concentratie 0,5%, respectiv 0,1%.
S-a utilizat curba etalon propusa in insertul kit-ului; deasemenea s-au utillizat doua master mix-uri diferite: unul pentru 'gena invertase' iar cel de-al doilea pentru 'gena cryIA(b)'. Acest mod de lucru este optim pentru a obtine rezultatele finale pentru determinarea procentuala a continutului de OMG.
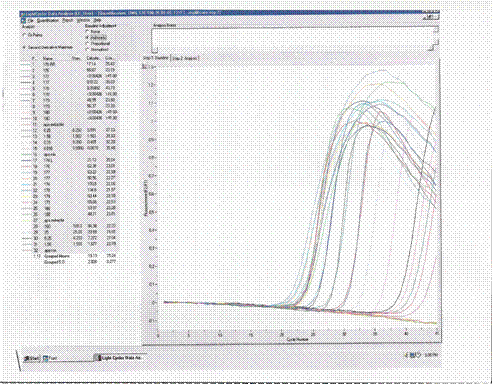
![]() Pentru
fiecare proba, pentru obtinerea rezultatului procentual de OMG in parte, se
efectueza un calcul de tipul: valoarea obtinuta pe coloana de
'Calculare' (vezi semnul din fig. 22-25), pentru
probele lucrate cu master mixul specific OMG se divide cu valoarea obtinuta
pentru gena de referinta (invertase), iar rezultatul se multiplica cu 100. Dupa
efectuarea acestor calcule pentru probele duplicat se face media aritmetica,
rezultatul reprezentand % (procent)OMG /
proba.
Pentru
fiecare proba, pentru obtinerea rezultatului procentual de OMG in parte, se
efectueza un calcul de tipul: valoarea obtinuta pe coloana de
'Calculare' (vezi semnul din fig. 22-25), pentru
probele lucrate cu master mixul specific OMG se divide cu valoarea obtinuta
pentru gena de referinta (invertase), iar rezultatul se multiplica cu 100. Dupa
efectuarea acestor calcule pentru probele duplicat se face media aritmetica,
rezultatul reprezentand % (procent)OMG /
proba.
![]()
![]()
![]()
![]()
Fig.22 - Analiza prin Real Time PCR a cinci probe alimente care contin porumb modificat genetic
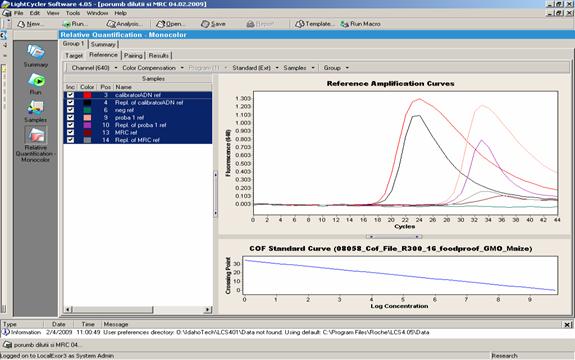
Fig.23 - Analiza prin Real Time PCR a patru probe alimente care contin porumb modificat genetic
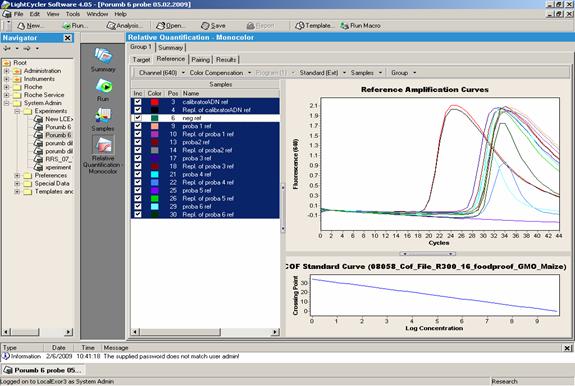
Fig.24 - Analiza prin Real Time PCR a cinci probe alimente care contin porumb modificat genetic
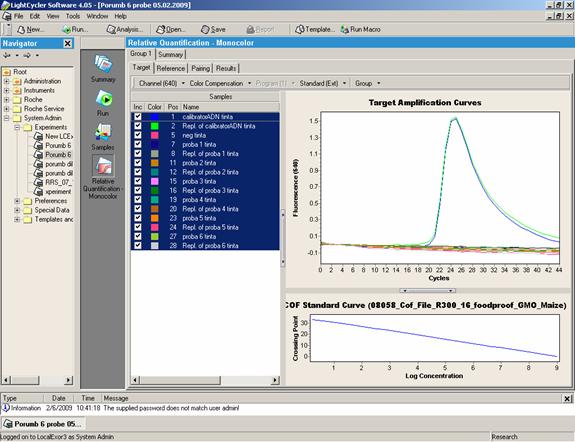
Fig.25 - Analiza prin Real Time PCR a sase probe alimente care contin porumb modificat genetic
Rezultatele reactiei de cuantificare relativa pentru cele 20 probe care contin porumb modificat genetic sunt prezentate in fig.20-25, procentul de continut MG a fost cuprins intre 0.6 si 100%.
Reactia Real Time utilizand SYBR Green I
Cinetica reactiei PCR poate fi urmarita in timp
real (Real-Time PCR) prin introducerea in amestecul de reactie a unor compusi
fluorescenti. In stuatia in care se foloseste compusul SYBR Green I, agent intercalant care se leaga in fosa
minora a ADN dublu catenar, in momentul legarii
Setul de primeri utilizati in reactia pentru amplificarea genei tinta pentru cryIA(b) sunt: (SYBR Green quantitative PCR amplification assay).
Reactivi utilizati
Ø IQ SYBR Green Supermix 2X (Bio-Rad): 100mM KCl, 40mM Tris-HCl pH 8,4
Ø
nucleotide
dATP, dCTP, dGTP, dTTP
Ø iTaq DNA polimeraza 50U/ml,
Ø 6mM MgCl2,
Ø SYBR Green I, fluoresceina 20nM, stabilizatori
Ø Primerii specifici pentru amplificarea genei tinta
CRYIA3 5`- CCG CAC CCT GAG CAG CAC - 3`
CRYIA4 5`- GGT GGC ACG TTG TTG TTC TGA - 3`
Ø ADN
Modul de lucru
Ø Din probele de ADN rezultate in urma procesului de extractie se efectueaza dilutii dilutii pana la concentratiile 10ng, in volum final de 5 ml, in apa MilliQ.
Ø Urmatorii reactivi sunt folositi pentru obtinerea amestecului de reactie PCR (concentratii finale/reactie):
o amestec iQ SYBR Green Supermix 1x;
o primeri 400nM fiecare;
o H2O MilliQ pana la volum final de 20 ml.
Ø Cate 20 ml din acest amestec se vor distribui in probele de 5 ml de ADN.
Ø Dupa amestecarea mixului cu probele acestea au fost incubate in termocycler (iCycler iQ), cu urmatorul program general de amplificare:
i)
denaturare
initiala -
ii)
45
cicluri de amplificare: denaturare - 30 sec. 95oC, hibridizare - 30
sec.
iii) program de determinare a curbei de topire: 85 de cicluri a 10 sec. fiecare, cu variatia crescatoare din 0.5o in 0.5oC a temperaturii pornind de la de la 55o C.
Temperatura de hibridizare, concentratia de ADN si concentratia primerilor au fost optimizate prin reactii PCR succesive, astfel incat amplificarea obtinuta sa fie direct proportionala cu cantitatea de ADN initiala.
Rezultate
![]()
![]()
PCR Quantification Report
PCR Base Line Subtracted Curve Fit Data
Graph Only
Current Date: 09-Feb-09 01:10 PM
Data generated on: 09-Feb-09 at 10:16 AM.
Optical data file name: porumb toate probele 09-Feb-09 1015.opd
Plate Setup file used: porumb toate probele.pts
Protocol file used: 60 Porumb.tmo
Sample volume: 25.00 ul
Hot Start? No
Well factor collection: Experimental Plate
Comments
PCR Amp/Cycle Graph for SYBR-490
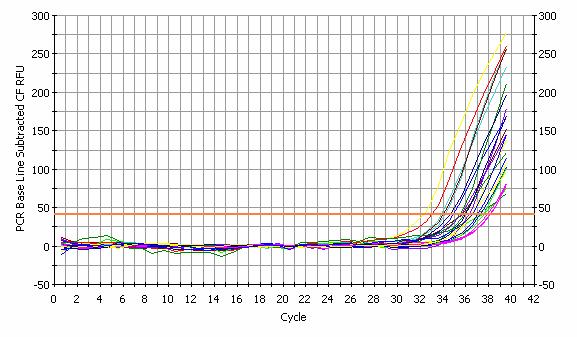
Data Analysis Parameters
Calculated threshold has been replaced by the user selected threshold 41.7.
Per-well baseline cycles have been determined automatically.
Data analysis window is set at 95.00% of a cycle, centered at end of the cycle.
Weighted Mean digital filtering has been applied. Global filtering is off.
Pentru cele 20 probe a fost optimizata o reactie Real Time PCR numai pentru gena tinta folosind ca flororor SYBR Green; toate probele au fost positive.
CENTRALIZATOR REZULTATE
|
Nr. Proba Tipul probei |
Gena de referinta invertase |
Gena de referinta zein |
Gena tinta E35 S |
Gena tinta CryIA(b) |
Regiunea promotorului CaMv 35S si intron1/exon1 Hsp70 |
Cuantificare Real Time PCR |
|
1 faina porumb DRC 4442YG | ||||||
|
2 faina porumb DKC Meb 483 YG | ||||||
|
3 faina porumb DKC 39644G | ||||||
|
4 faina porumb BD 5206 EA YG | ||||||
|
5 faina porumb DKC 5018 YG | ||||||
|
6 faina porumb TPA 422 H | ||||||
|
7 faina porumb DRC 5874 YG | ||||||
|
8 faina porumb A | ||||||
|
9 faina porumb B | ||||||
|
10 faina porumb C | ||||||
|
11 faina porumb D | ||||||
|
12 faina porumb E | ||||||
|
13 faina porumb F | ||||||
|
14 faina porumb G | ||||||
|
15 faina porumb Control Monsanto - neg | ||||||
|
16 faina porumb Control Pionner | ||||||
|
17 faina porumb 1981 Fumo porumb macinat SC Cereal Com SA | ||||||
|
18 faina porumb 2000 Fumo porumb macinat SC Agrobaraganul SRL | ||||||
|
19 MRC 5% | ||||||
|
20 MRC 2% | ||||||
|
21 faina porumb Titan gold | ||||||
|
22 faina porumb Baneasa | ||||||
|
23 faina porumb Agricorn | ||||||
|
24 faina porumb Titan gold | ||||||
|
25 faina porumb import Ungaria | ||||||
|
26 boabe porumb dulce | ||||||
|
27 boabe porumb dulce |
BIBLIOGRAFIE
Altman A., 1999, Plant biotechnology in the 21st century : the challenges ahead, EJB
Barza H., May I., Ghergariu S., Hagiu N., 1981, Patologia si clinica medical veterinara, Ed. Didactica si Pedagogica Bucuresti
Carozzi N., Warren W., Rice D.A., Evola S., Koziel M.G., 1992, Expression of chimeric CaMV 35S, Bacillus thuringiensis insecticidal protein gene in transgenic tobacco, Plant Molec.Biol.
Clive James, citat de Adevarul economic nr. 12 din 5 aprilie 2005
Constantin N., Cotrut M., Sonea A., 1998, Fiziologia animalelor domestice, Ed. Coral Sanivet
Cucu N., Stefan M., Mitru M., Gavrila L., 1998, Modification of plant genom by genetic transformation : interaction of alogenes wiyh the host genome, in Implicatii stiintifice si bioetice in analiza si manipularea genomului, Edit. Ars Docendi
Finn Holm, Food Group Danemarca, Alimente modificate genetic
Gatz C., 1997, Chemical control of gene expression, Ann. Rev. Plant Physiol. Plant Molec. Biol.
Ghergariu
S., Rowlands G.,
Ghergariu S., Pop A., Kadar L., Spanu M., 1999, Manual de laborator clinic veterinar, Ed. All
Gold J., Harder D., Smith F., Aung T., Procunier J., 1999, Development of a molecular marker for rust resistance genes Sr39 and Lr35 in wheat breeding lines, EJB
Hedden P., Phillips A.L., 2000, Manipulation of hormone biosynthetic genes in transgenic plants, Current Opinion in Biotechnology
Hileman B., 2002, What΄s hiding in transgenic foods? Ghemical Eng.news, ian. 2002
Ho
M., 2001, Horizontal gene transfer - the hidden hazards of genetic
engineering,
Larbier M., Leclercq B., 1994, Nutritia si alimentatia pasarilor, Ed. Alutus
Macilwain
C., 2005,
Martinelli L., Mandolino G., 1994, Genetic transformation and regeneration of transgenic plants in grapevine, Theor.Appl.Geneti
Parvu G. si colab., 1982, Rev. crest. Anim.
Parvu G., 1992, Supravegherea nutritional metabolica a animalelor, Ed. Ceres
Rice M., 2004, Transgenic Rootworm Corn: Assessing Potential Agronomic, Economic and Environmental Plant Management Network, published martie 2004
Riva
G., Cabrera J.G., Padron
Robinson J., 1999, Ethics and transgenic crops, Electronic Journal of Biotechnology
Serban M., Pop A., Papuc C., 2001, Metode analitice in Biochimia Veterinara, Ed. Printech
Serban M., Campeanu G., Ionescu E., 2000, Metode de laborator in Biochimie, Ed. Muntenia-Leda
Sharma H.C., Sharma K.K., Seetharama N., Ortiz R., 2000, Prospects for using transgenic resistance to insects in crop improvement, EJB
Tinland B., 1996, The integration of T-DNA into plant genomes, Trends in Plant Science
Tourte Y., 1998, Genie genetique et biotechnologie: concepts et methodes, Edit. Dunod
Walmsley A.M., Arntzen C.J., 2000, Plants for delivery of edible vaccines, Current Opinion in Biotechnology
Watson G.C., Gilman M., Witkowski J., Zoller M., 1992, Recombinant DNA, Scientific Academc Books
Weising K., Kahl G., 1996, Natural genetic engineering of plant celles: the molecula biology of crown gali and hairy root disease, World J. Microboil. Biotecnol.
Whiteman G.C., Cockburn W., Owen M., 1994, Antibody production in transgenic plants, Biochem. Society Transact
Zuo
J.,
|