Aparitia teoriei mecanicii cuantice
Neajunsurile teoriei cuantice au fost inlaturate odata cu aparitia teoriei mecanicii cuantice (1924). La baza acestei teorii sta extinderea ideii caracterului dublu de corpuscul si unda al luminii la pa 444f54e rticulele elementare in miscare, respectiv la electroni.
Fizicianul francez Louis de Broglie, creatorul acestei teorii, a aratat ca exista o analogie perfecta intre proprietatile electronilor si cele ale cuantelor de lumina, prin asocierea unei unde electronului in miscare. El a pornit de la relatiile ce leaga energia E a unui foton de frecventa n si masa sa: E = hn si E = mc2. Deci:
hn= mc2
Simplificand cu c, se obtine:
![]() sau
sau
![]() (1.31)
(1.31)
de unde,
![]() (1.32)
(1.32)
in care h este
Aceasta relatie valabila pentru fotoni a fost extinsa electronului sau oricarei alte microparticule, obtinandu-se relatia lui de Broglie:
![]() (1.33)
(1.33)
unde m este masa electronului, iar v- viteza sa. Relatia scoate in evidenta atat caracterul corpuscular al electronului cat si caracterul sau ondulatoriu punandu-se astfel bazele unei noi teorii, teoria mecanicii cuantice sau ondulatorii.
Conform relatiei (1.33) orice particula de masa m in miscarea sa poseda o unda a carei lungime de unda l creste cu scaderea masei.
Considerand miscarea electronului in jurul nucleului dupa o traiectorie circulara si admitand ca in deplasarea sa i se asociaza o unda stationara, lungimea de unda a undei asociate trebuie sa aiba o anumita valoare incat distanta parcursa 2pr, sa fie un multiplu intreg n al lungimii de unda de Broglie (fig. 8):
pr = nl (1.34)
Prin inlocuirea valorii lui l din (1.33) rezulta:
![]() (1.35)
(1.35)
Din relatia (1.35) se obtine:
![]() sau
sau
![]()
ceea ce verifica conditia de cuantificare data de Bohr (v. 1.5.2).
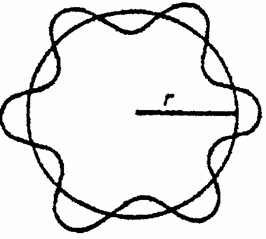
Figura 8. Unda electronica stationara (unda de Broglie in atomul de hidrogen).
De aici concluzia ca atunci cand atomul se afla intr-o stare
energetica stationara nu sunt posibile orice orbite electronice
ci numai orbite al caror moment al cantitatii de miscare
mvr prezinta un multiplu intreg de h/2p. Aceasta conditie de cuantificare impusa de Bohr sub
forma de postulat, decurge aici din proprietatile ondulatorii
ale electronului. Ulterior, s-a dovedit experimental
caracterul ondulatoriu al electronului prin experiente
de difractie electronica (C. Davisson si L.H. Germer -
Noua teorie a mecanicii cuantice bazata pe relatia lui de Broglie a fost dezvoltata de Werner Heisenberg, Erwin Schr dinger, P.A.M. Dirac, Max Born, W. Pauli etc.
|