UNIVERSITATEA POLITEHNICA BUCUREsTI
FACULTATEA DE CHIMIE INDUSTRIALĂ
Catedra de Chimie Anorganica si Protectia Mediului
INTRODUCERE
Descriere generala
Oxizii de sulf (SOX) sunt combinatii ale sulfului cu moleculele de oxigen, dioxidul de sulf (SO2) fiind forma predominanta īntālnita īn atmosfera joasa. Dioxidul de sulf este un gaz incolor, cu miros īn&# 929g65j 259;busitor si patrunzator. Dioxidul de sulf se dizolva usor īn apa prezenta īn atmosfera, formānd acidul sulfuros (H2SO3). Aproximativ 30% din sulfatul din atmosfera este convertit īn aerosol de sulfat (aerosol acid), care este īndepartat prin procese de depunere umede sau uscate. Trioxidul de sulf (SO3), un alt oxid al sulfului, este fie emis direct īn atmosfera, fie este produs din SO2 si este convertit rapid īn H2SO4. Acesta din urma sta la baza aparitiei cetii si ploilor acide.
Sursele principale
Cea mai mare parte a SO2 este produsa prin arderea de combustibili care contin sulf, sau prin prajirea minereurilor de sulfuri metalice. Centralele termoelectrice care ard carbune sau combustibili lichizi cu continut mare de sulf sunt īn general principalele surse antropogene de emisii de SO2, urmate de cazanele industriale si topitoriile de metale neferoase. Emisiile de SO2 provenite de la īncalzitul menajer, sau din esapamentele vehiculelor pot contribui de asemenea la cresterea concentratiilor locale de SO2. Exista si surse naturale de SO2 (care contribuie cu 35-65 % la totalul emisiilor de SO2), de exemplu vulcanii.
Impactul asupra sanatatii si mediului
Se considera ca episoadele de concentratii foarte mari de SO2 provoaca cele mai mari daune sanatatii si vegetatiei ca urmare a emisiilor de sulf. Īn functie de vānt, temperatura, umiditate si topografie, SO2 se poate concentra aproape de nivelul solului. Īn timpul cetii de la Londra din 1952, nivelele de SO2 au ajuns la 3500 mg/m3 (medie pe 48 de ore) īn centrul orasului si s-au mentinut ridicate timp de 5 zile.
Expunerea la SO2 īn aerul ambiant a fost asociata cu o functie diminuata a plamānilor, incidenta sporita a simptomelor si bolilor respiratorii, iritarea ochilor, nasului si gātului si mortalitate prematura. La un risc deosebit sunt expusi copiii, batrānii si persoanele care sufera deja afectiuni respiratorii cum ar fi astmaticii. Impactul asupra sanatatii pare a fi legat mai ales de expuneri de scurta durata la concentratii ambiante de peste 1000 mg/m3 (expuneri acute masurate timp de peste 10 minute). Unele studii epidemiologice au aratat īnsa o asociere īntre nivele relativ scazute ale mediilor anuale si mortalitatea excesiva. Nu este clar daca efectul pe termen lung este legat de valorile mediei anuale, sau de expunerea repetata la valori de vārf.
Efectele oxizilor de sulf asupra sanatatii sunt atribuite expunerii la SO2, la aerosoli de sulfati si la SO2 adsorbit pe particule materiale. Cānd este singur, SO2 se dizolva īn fluidele apoase ale sistemului respirator superior si este absorbit īn fluxul sangvin. SO2 reactioneaza cu alte substante din atmosfera, formānd aerosoli de sulfati. Īntrucāt majoritatea aerosolilor de sulfati fac parte din grupa PM2.5, ei pot avea un rol important īn impactul particulelor fine asupra sanatatii. Īn orice caz, aerosolii de sulfati pot fi transportati pe distante lungi prin atmosfera, īnainte de a se depune. Concentratiile medii de aerosoli de sulfati reprezinta īn medie cam 40% particule fine, īn regiunile īn care se folosesc īn mod obisnuit combustibili cu continut mare de sulf. SO2 adsorbit pe particule poate fi transportat adānc īn sistemul pulmonar. Cele mai daunatoare pentru sanatate sunt particulele mici datorita abilitatii lor de a ajunge repede īn structurile inferioare ale sistemului respirator si contribuie negativ la respiratie, agravānd-o si determinānd boli cardiovasculare, anomalii īn sistemele de aparare ale organismului la aparitia unor substante necunoscute, distrugānd tesutul pulmonar si determinānd moartea prematura. Aerosolii acizi afecteaza functiile respiratorii si senzoriale.
Emisiile de SOX au un impact negativ asupra vegetatiei, inclusiv asupra padurilor si culturilor agricole. Studiile efectuate īn special īn SUA au aratat ca plantele expuse la concentratii ridicate de SO2 īsi pot pierde frunzisul, pot deveni mai putin productive sau pot muri prematur. Unele specii sunt mai sensibile la expunere decāt altele. Plantele din imediata vecinatate a surselor de emisie sunt mai vulnerabile. Impactul asupra ecosistemelor forestiere variaza foarte mult īn functie de tipul de sol, speciile de plante, conditiile atmosferice, populatiile de insecte si de alti factori care nu sunt īnca bine īntelesi.
Culturile agricole pot fi vatamate prin expunerea la depuneri. Deosebit de sensibile sunt ierburile alfalfa si de secara. Se pare ca vatamarea frunzelor trebuie sa fie extinsa pentru ca expunerea sa afecteze nivelul productiei.
Depunerile acide pot degrada lacurile cu apa dulce si ecosistemele rāurilor, micsorānd pH-ul apei. Sunt periclitate īn mod deosebit lacurile cu capacitate scazuta de tamponare (de neutralizare a ploii acide). Putine specii de pesti pot suporta variatii mari de pH, iar lacurile afectate pot ramāne fara populatie piscicola. Totodata, acidificarea micsoreaza varietatea speciilor si abundenta altor vietuitoare animale sau vegetale.
Pentru ca sunt atāt de multe schimbari, dureaza ani pāna cānd ecosistemele īncep sa se refaca de la depunerile acide, chiar si dupa ce emisiile se reduc cantitativ si ploaia devine din nou normala. De exemplu, pe cānd vizibilitatea poate sa se amelioreze īn zile, schimbari īn cursul de apa pot aparea īn luni, lacurile acidifiate cronic, rāurile, padurile, pamāntul au nevoie de zeci, chiar sute (īn cazul solului) de ani pentru a se reface.
Totusi, exista cāteva lucruri pe care oamenii le fac pentru a aduce lacurile si rāurile la nivelul initial cāt mai repede. Piatra de var (compus bazic) se poate adauga īn lacurile acide pentru a mai calma aciditatea. Acest proces poarta numele de varuire, tinde sa fie destul de scump, trebuie facut īn mod repetat pentru a pastra apa neutralizata fara a se mai īntoarce la conditia acida; este deci considerat un tratament scurt ca durata, utilizat doar pentru suprafete specifice mai mult decāt pentru un efort de a reduce si preveni poluarea. Pe deasupra, nu rezolva problemele mai extinse, mai largi ale schimbarii chimismului solului si sanatatea padurilor, a apelor si nu face nimic pentru reducerea materialelor daunatoare si pentru riscurile fata de sanatatea umana. Dar permite pestilor sa ramāna īn lacuri, sa supravietuiasca īn locurile lor pāna cānd se reduc īn zona depunerile acide.
Emisiile de SO2 pot afecta piatra de constructie precum si metalele feroase sau neferoase. Acidul sulfuros, format din reactia SO2 cu umezeala, accelereaza coroziunea fierului, otelului si zincului. Oxizii de sulf reactioneaza direct cu cuprul, producānd īnvelisuri verzi de sulfat de cupru la suprafata acestuia. Acizii sub forma de gaze, aerosoli sau precipitatii pot coroda chimic materiale de constructie ca marmura, calcarul si dolomita. Un interes deosebit prezinta eroziunea monumentelor istorice si a lucrarilor de arta.
Acizii sulfuros si sulfuric formati din SO2 si SO3, prin reactie cu umezeala, pot sa degradeze de asemenea hārtia si pielea.
Standarde si directive
Principalul obiectiv al majoritatii standardelor si directivelor nationale si internationale, elaborate īn ultimele decenii, a fost protectia vietii umane. Standardele Uniunii Europene si Organizatia Mondiala a Sanatatii recunosc posibilitatea unui efect cumulat sau sinergetic al expunerii la SO2 si la materie sub forma de particule, asupra sanatatii.
Tabelul 1
Standarde si directive de referinta pentru concentratiile de SO2 (mg/m3
|
Media Anuala |
Nivele de particule asociate |
Iarna |
Nivele de particule asociate |
24 ore |
Nivele de particule asociate |
1 ora |
|
|
Limite UE |
>40(4) <150(5) |
>60(4) >200(5) |
>150(4) >350(5) | ||||
|
Standarde SUA | |||||||
|
Directive OMS | |||||||
|
Directive OMS Europa | |||||||
|
Valoare critica CEE |
Observatii: 1- mediana valorilor zilnice luate īn cursul unui an; 2- mediana valorilor zilnice luate īn cursul iernii; 3- a 98-a functie de repartitie a tuturor valorilor zilnice dintr-un an, care nu trebuie depasita mai mult de 7 zile pe an; 4- metoda fumului negru; 5- metoda gravimetrica; 6- media aritmetica; 7- a nu se depasi mai mult de o data pe an.
Surse: OMS (1979, 1987); US-EPA (1990); Directiva CE 80 779 (5 iulie 1980); Directiva de amendare 89 427 (14 iulie 1989).
Valoarea limita trebuie sa fie egala cu standardul tarii, sau mai mica decāt acesta. Valoarea limita nu este un standard de calitate a aerului ambiant, ci pur si simplu un prag.
CAPITOLUL I
REFERAT DE LITERATURĂ
Aproape toata electricitatea care domina viata moderna provine din arderea carburantilor (carbune, gaz natural si petrol). Poluarea se datoreaza SO2 si NOx care sunt eliminati īn atmosfera atunci cānd acesti carburanti sunt arsi. Exista mai multe optiuni de a reduce emisiile de SO2, incluzānd folosirea unui carburant ce contine mai putin sulf, spalānd carburantul, si folosind dispozitive numite scrubere care īndeparteaza SO2 din gazele care parasesc furnalele; arzānd gazul natural se creeaza mult mai putin SO2 decāt din arderea carburantilor. Exista si alte surse de electricitate pe lānga carburanti. Ele includ: putere nucleara, hidroenergie, energie eoliana, energie geotermala si energia solara. Dintre acestea, energia nucleara si hidroenergia sunt cele mai considerabile; energia eoliana, solara si geotermala nu au fost īnca valorificate la scara larga īn Romānia. Sunt alternative de energie si pentru automobile, incluzānd gazul natural, bateriile masinilor, celulele carburante si combinatii alternative cu gazolina. Trebuie sa se investeasca īn energia alternativa, deoarece protectia mediului este o problema din ce īn ce mai importanta īn viata omenirii.
Poluarea atmosferei este un proces dinamic deosebit de complex, determinat de un numar foarte mare de factori mai mult sau mai putin identificati. Abordarea problemei de depoluare a atmosferei se face īn termeni de limitare sau de reducere a poluarii atmosferei la un nivel suficient de scazut astfel īncāt efectele sa fie minime. Reducerea poluantilor atmosferici nu este posibila prin eliminarea lor din atmosfera, ci prin eliminarea surselor de emisie sau reducerea cantitatii de poluanti emisi de sursa. Luarea unor masuri īn vederea depoluarii atmosferei presupune:
Identificarea surselor de emisie
Identificarea naturii poluantilor
Evaluarea cantitatii acestora
Identificarea si cuantificarea efectelor poluante ale acestora
Stabilirea unor norme care sa limiteze nivelul emisiilor pe tipuri de surse de emisie.
Masurile de depoluare sunt de natura tehnologica si vizeaza sursele antropogene si nu pe cele naturale. Aplicarea masurilor tehnologice de depoluare trebuie sa realizeze o emisie a emisiilor cāt mai semnificativa, dar cu costuri scazute suportabile economic si social. Īn plan legislativ - administrativ, orice unitate care desfasoara o activitate economica si nu numai, trebuie sa aiba un aviz al autoritatilor de mediu. Autoritatile de mediu elibereaza un acord de mediu pentru o noua investitie si se refera la documentele tehnologice care stau la baza investitiei. Autorizatiile de mediu se elibereaza la punerea īn functiune sau la exploatarea unitatii specifice. Unitatile au obligatia de a furniza autoritatilor de mediu, urmatoarele date despre:
- natura si cantitatea poluantilor emisi īn atmosfera;
- variatia emisiilor īn timp;
- locul si modul de emisie;
- alte date strict necesare unei evaluari corecte a emisiilor.
PROCEDEE sI INSTALAŢII PENTRU ELIMINAREA COMPUsILOR CU SULF DIN GAZELE REZIDUALE
Directiile generale de prevenire a poluarii atmosferei cu compusi cu sulf Cresterea performantelor tehnice ale procedeelor de prelucrare si obtinere a compusilor cu sulf:
Reducerea consumului general de energie (cea mai sigura cale de prevenire a poluarii atmosferei);
Reducerea ponderii de energie obtinuta prin procesele de ardere;
Utilizarea unor combustibili cu continut redus de sulf;
Reducerea continutului de sulf a combustibilului īnainte de utilizare;
Eliminarea compusilor cu sulf pa parcursul desfasurarii procesului tehnologic;
Introducerea unor procedee eficiente de desulfurare a gazelor reziduale.
Schema clasica a unui proces de ardere este de forma:

Desulfurarea se poate realiza atāt la nivelul gazelor reziduale cāt si la nivelul procesului de ardere si al combustibilului.
Procedeul de desulfurare a combustibililor īnainte de utilizare, are ca avantaje o cantitate mult mai mica de combustibil comparativ cu gazele reziduale, īnlatura problemele pe care compusii cu sulf le pun ulterior (coroziune, formarea de alti compusi etc.) si posibilitatea recuperarii compusilor cu sulf si valorificarea lor. Astfel, procedeele devin eficiente din punct de vedere economic.
Procedeele de desulfurare sunt strāns legate de natura combustibilului:
gazosi: gaz metan si gaze sintetice - de cocserie, de gazogen, petrochimice etc.;
lichizi: petrol si derivate din petrol - pacura, motorina;
solizi: carbunii (lignitii, īn general si huilele necocsificabile).
Desulfurarea combustibililor gazosi
La concentratii mici ale compusilor cu sulf īn combustibil, desulfurarea este avansata, nerecuperativa cu scopul de a proteja sistemele catalitice la otravirea cu sulf. Desulfurarea īn cazul concentratiilor mari de compusi cu sulf are scop recuperativ si se realizeaza prin procedee umede, iar īn final are loc convertirea la sulf elementar prin procedeul Claus.
Productia totala de sulf pur din Franta si Canada este realizata prin recuperarea sulfului prin metoda Claus. Īn SUA 50% din productia de sulf este realizata prin prelucrarea gazului metan, iar 50% prin prelucrarea titeiului.
Desulfurarea combustibililor lichizi (petrol
Se utilizeaza procedee de hidrofinare sau dehidrosulfurare prin hidrogenare catalitica. Aceste procedee sunt extinse si la petrolul brut.
Desulfurarea combustibililor solizi (carbuni)
Aceste tipuri de procese sunt mai complicate si mai putin eficiente. Se poate realiza o desulfurare:
directa - prin procedee fizice (extractie, flotatie etc.);
- eliminarea sulfului anorganic sau piritic īn proportie de 10-50% (randamentul de eliminare creste daca mineralele cu sulf au dimensiuni mari).
indirect - gazeificarea carbunilor cānd compusii cu sulf trec īn H2S;
- desulfurarea gazelor obtinute din carbune.
a) Desulfurarea combustibilului īnainte de utilizare
Avantaje:
procedeul vizeaza o cantitate mult mai mica de combustibil comparativ cu gazele reziduale;
eliminarea compusilor cu sulf īn aceasta faza īnlatura problemele pe care acestia le pun ulterior (coroziune, formarea altor compusi etc.);
posibilitatea recuperarii compusilor cu sulf si valorificarea lor, procedeele devenind astfel eficiente din punct de vedere economic.
b) Desulfurarea īn timpul procesului de ardere
Acest lucru se poate realiza prin injectia īn focarele de ardere a unor materiale solide capabile sa lege SO2 sub forma unor saruri cu sulf. Reducerea SO2 este de 30 - 70%, iar investitia este de 50 - 100$/kW (Kataoka, 1992). Procesul este mai eficient decāt desulfurarea combustibililor. Desulfurarea īn timpul procesului de ardere este nerecuperativa si neregenerativa. Īn urma acestui proces, se consuma cantitati foarte mari de materiale care devin deseuri si polueaza solul.
c) Desulfurarea īn treapta finala
Acest procedeu este cel mai utilizat chiar daca s-a dovedit ca nu este foare eficient:
eficienta tehnologica este relativ mica deoarece:
volumele de gaze reziduale sunt foarte mari (mil. m3/h
concentrasi SO2 este foarte mica (0.1 - 0.2 %);
temperatura gazelor este mare;
īn gaze sunt prezente si alte specii chimice (CO2, H2Ovap, cenusa, suspensii solide, compusi organici netransformati)
eficienta economica este redusa sau chiar negativa datorita:
cheltuielilor foarte mari de investitii (aparate voluminoase, rezistente la coroziune);
cheltuielilor foarte mari de exploatare (consum mare de materiale si de energie).
Īn urma desfasurarii acestui proces se obtin produse secundare, cu compusi cu sulf, nevalorificabile sau greu valorificabile. Are loc un transfer de poluare din zona atmosferei catre apa si sol.
Eliminarea SO2 din gazele reziduale este un proces care vizeaza limitarea poluarii atmosferei si mai putin recuperarea sulfului.
Clasificare procedeelor de desulfurare
Īn functie de posibilitate de recuperare a compusilor cu sulf :
Procedee recuperative: - eficienta economica mare (vizeaza reintroducerea sulfului īn circuitul economic);
- limiteaza foarte mult poluantii secundari.
Procedee nerecuperative: - eficienta economica scazuta;
- conduc la formarea poluantilor secundari.
Īn functie de posibilitate de regenerare a agentului de desulfurare:
Procedee regenerative: - consum mare de energie;
- consum redus de materiale.
Procedee neregenerative: - consum mic de energie;
- consum mare de materiale;
- conduc la formarea poluantilor secundari.
Īn functie de starea de agregare a agentului de desulfurare:
Procedee umede: - gazele sunt contactate cu solutii sau suspensii;
- absorbtie + reactii chimice reversibile sau ireversibile, īn solutii alcaline;
- reducerea SO2 este de peste 90% (Kataoka, 1992);
- investitia este de 80 - 150 kW (Kataoka, 1992).
Procedee uscate: - folosirea de materiale solide;
- adsorbtia + procese catalitice;
- racirea nu mai este obligatorie;
- reducerea SO2 este de 70 - 90% (Kataoka, 1992);
- investitia este de 80 - 100 $/kW (Kataoka, 1992).
Procedee semiuscate sau semiumede: - agent de desulfurare de tip suspensii sau solide hidratate.
Īn functie de natura proceselor de desulfurare:
Procedee bazate pe procese fizice: - absorbtia si adsorbtia fizica.
Procedee bazate pe procese chimice: - neutralizare, oxidare, reducere etc.;
pot fi catalitice sau nu.
Procedee bazate pe procese combinate: - fizice si chimice;
- cele mai imp. si cele mai utilizate.
Aplicarea unuia sau altuia din procedee este īn strānsa corelatie atāt cu eficienta tehnica cāt si cu cea economica. Cele mai mari progrese se fac īn cadrul eficientei economice cānd se ating randamente de desulfurare de 99%. Eficienta economica se atinge mai greu. Procedeele eficiente din punct de vedere economic sunt īn general procedeele regenerative si recuperative.
Exista un numar foarte mare de procedee de desulfurare care se numesc procedee de tip FGD (Flue Gas Desulfurization - Untea, 2001).
I. PROCEDEE CLASICE DE DESULFURARE
Eliminarea SO2 prin absorbtie īn apa (Stratula, 1980):
- dioxidul de sulf este putin solubil īn apa;
- absorbtia SO2 īn apa este īnsotita de o reactie de hidroliza:
![]()
![]() SO2 + H2O H+ + HSO3-
SO2 + H2O H+ + HSO3-
- exista o tendinta de hidratare care crestere cu descresterea temperaturii:
![]()
![]() SO2 + nH2O SO2nH2O
SO2 + nH2O SO2nH2O
- procedeul poate fi aplicat doar gazelor cu continut ridicat de SO2 (10 - 15%).
- desorbtia se face prin stripare cu abur, SO2 stripat fiind uscat, comprimat si lichefiat.
Eliminarea SO2 prin procedeul Battersea (Stratula, 1980 si Untea, 2001):
- procedeu vechi, aplicat īn Anglia;
- absorbtia SO2 īn apa este īnsotita de urmatoarele procese:
![]()
![]() dizolvare fizica: SO2 (g) SO2 (aq)
dizolvare fizica: SO2 (g) SO2 (aq)
![]()
![]() reactie chimica: SO2 (aq) + H2O H2SO3
reactie chimica: SO2 (aq) + H2O H2SO3
![]()
![]() ionizare: H2SO3 H+ + HSO3-
ionizare: H2SO3 H+ + HSO3-
![]()
![]() HSO3- H+ + SO3-
HSO3- H+ + SO3-
- īn apa de rāu absorbtia SO2 este mai buna, deoarece bicarbonatii de Ca si Mg au un efect pozitiv asupra procesului de absorbtie;
- se poate creste capacitatea de absorbtie a apei prin adaugare de CaCO3 care furnizeaza ionii Ca2+;
- solubilitatea SO2 pur este foarte mare, dar īn gazele reziduale SO2 nu este pur;
- solubilitatea SO2 poate fi marita prin reducerea concentratiei ionilor de hidrogen (adaugarea unei baze - solutie alcalina foarte diluata);
- procesul a fost abandonat datorita:
consumului foarte mare de apa;
gradului de absorbtie foarte redus, deci randament scazut;
neregenerativ si nerecuperativ;
produce o poluare secundara prin poluarea apei.
- oxidarea cu aer se realizeaza īn prezenta unui catalizator (sulfat de mangan) īn scopul epurarii apei reziduale īnaintea deversarii la canal.
|
Figura.1 Schema tehnologica de eliminare a SO2 prin procedeul Battersea |
Eliminarea SO2 prin procedeul Wellman - Lord (Untea, 2001):
- procedeu umed (absorbtia īn solutii alcaline);
- absorbantul propriu-zis este Na2SO3;
- prin absorbtia suplimentara de SO2 rezulta bisulfit de sodiu care la temperaturi ridicate regenereaza SO2;
- reactii principale:
![]() 2NaOH + SO2 + H2O Na2SO3 + 2H2O
2NaOH + SO2 + H2O Na2SO3 + 2H2O
![]() 2Na2CO3 + SO2 + H2O Na2SO3 +
2NaHCO3
2Na2CO3 + SO2 + H2O Na2SO3 +
2NaHCO3
![]() 2NaHCO3 + SO2 Na2SO3 + 2CO2
+ H2O
2NaHCO3 + SO2 Na2SO3 + 2CO2
+ H2O
- sulfitul de sodiu participa la reactia finala:
![]() Na2SO3 + SO2 + H2O 2NaHSO3
Na2SO3 + SO2 + H2O 2NaHSO3
- au loc reactii secundare īn urma carora se formeaza un numar mare de compusi nedoriti, īn principal NaCl si Na2SO4;
- amestecul de NaCl si Na2SO4 este inactiv īn faza de absorbtie si consuma Na din faza activa;
- pentru limitarea formarii acestor compusi se realizeaza prespalarea gazelor reziduale, racirea lor, eliminarea suspensiilor;
- pentru a limita reactia de oxidare a sulfitului la sulfat se pot introduce inhibitori de oxidare din clasa fenolilor dar care sunt poluanti pentru apa;
- la īnceputul operatiei de absorbtie pH = 7.2 - 7.4 iar la final pH = 5;
- avantaje: - randament ridicat;
capacitate mare de prelucrare a gazelor;
prezinta o siguranta mare īn exploatare;
se adapteaza usor pentru debite variabile de gaz si pentru concentratii variabile de SO2 īn gazele reziduale.
- dezavantaje: - instalatii voluminoase;
- absorbanti scumpi;
- eliminarea produsilor secundari (de ex.-Na2SO4) este fie scumpa, fie un semideseu.
Eliminarea SO2 prin procedeul Ionic - Stone - Webster (Untea, 2001):
- o varianta īmbunatatita a procedeului Wellman - Lord;
- solutia de sulfat de sodiu se supune unui proces de electroliza īn urma caruia rezulta H2SO4 si NaOH iar mai apoi NaHSO4, care devine agent de regenerare:
![]() NaHSO4 + NaHSO3 Na2SO4 + SO2
+ H2O
NaHSO4 + NaHSO3 Na2SO4 + SO2
+ H2O
- SO2 rezultat se separa īn gaze;
- Na2SO4 se īntoarce la electroliza;
- dezavantaj: - este un procedeu mai scump.
5. Eliminarea SO2 prin absorbtie īn solutie de hidroxid sau carbonat de calciu (Stratula, 1980):
- īntr-o prima etapa are loc absorbtia SO2 īntr-o solutie de hidroxid sau carbonat de calciu (suspensie), cu formare de sulfit de calciu:
Ca(OH)2 + SO2 = CaSO3 + H2O
- īn a doua etapa sulfitul se oxideaza rapid la sulfat cu oxigenul din solutie (oxigen absorbit din gazul de cos);
- pentru cresterea vitezei de oxidare este necesar ca pH-ul solutiei sa se mentina la o valoare mai mica de 6.4
- dezavantaj: - sulfitul si sulfatul de calciu constituie produsele secundare ale procedeului;
|
Figura 2. Schema tehnologica de eliminare a SO2 prin absorbtie īn solutie de hidroxid sau carbonat de calciu |
6. Eliminarea SO2 prin absorbtie īn solutie de sulfit si bisulfit de sodiu (Stratula, 1980):
- procedeul se bazeaza pe reactiile:
SO2 + 2NaOH = Na2SO3 + H2O
Na2SO3 + SO2 + H2O = 2NaHSO3
- o cantitate din sulfit (cca 5 - 10%) este oxidat la sulfat;
Na2SO3 + O2 = Na2SO4
- regenerarea solutiei de sulfit de sodiu se poate realiza conform reactiilor:
2NaHSO3 + CaCO3 = Na2SO3 + CaSO3 + CO2 + H2O
2NaHSO3 + Ca(OH)2 = Na2SO3 + CaSO3 + H2O
Na2SO3 + Ca(OH)2 = 2NaOH + CaSO3
Na2SO4 + Ca(OH)2 = 2NaOH + CaSO4
- regenerarea solutiei de sulfit de sodiu se mai poate realiza si prin utilizarea oxidului de zinc, conform reactiilor:
NaHSO3 + ZnO = ZnSO3 + NaOH
ZnSO3 = ZnO + SO2
|
Figura 3. Schema tehnologica de eliminare a SO2 prin absorbtie īn solutie de sulfit si bisulfit de sodiu |
7. Eliminarea SO2 prin absorbtie īn xilidina (Stratula, 1980 si Untea,2001):
- procedeu dezvoltat īn Germania;
- ca absorbant se utilizeaza un amestec de xilidina (orto, meta si para) si apa īn proportie de 1:1;
- reactia care are loc este:
2 C H3(CH2)2NH2 + SO2 + H2O [C6H3(CH3)2NH3]2 SO3
[C6H3(CH3)2NH3]2 SO3 + SO2 + H2O [2 C6H3(CH3)2NH3] H SO3
ag. desulf. propriu-zis
- are loc si o reactie secundara, īn urma careia rezulta un produs insolubil care blocheaza o parte din xilidina:
2 [C6H3(CH3)2NH3]2 SO3 + ½ O2 C H3(CH2)2NH3]2 SO4
- pentru rezolvarea problemei, se descompune sulfatul de xilidina format cu solutie de sulfit, bisulfit de sodiu;
Ţinānd cont de acest fapt s-a dezvoltat un nou procedeu combinat de eliminare a SO2 si anume - Procedeul sulfidine +Wellman Lord;
- continutul de SO2 īn gazul purificat, la final este de 0.05 - 0.1%;
- regenerarea absorbantului si recuperarea SO2 se face īntr-o coloana obisnuita de stripare la temperatura de 95 - 1000C;
- procedeu regenerativ si recuperativ
8. Eliminarea SO2 prin procedeul Asareo (Stratula, 1980):
- procedeu dezvoltat de American Smelting Refining Company;
- constituie o īmbunatatire a procedeului cu xilidina prin faptul ca reduce pierderile de absorbant, consumul de abur si necesarul de forta de munca;
- ca absorbant se utilizeaza dimetilanilina sau chiar si xilidina;
- dimetilanilina are avantajul ca nu necesita adaos de apa care sa dizolve compusul format cu SO2 absorbit ca īn cazul xilidinei si ea poate absorbi cantitati mai mari de SO2 decāt xilidina īn cazul gazelor cu un continut ridicat de SO2.
- pentru gazele cu continut scazut de SO2 xilidina este mai eficienta din punct de vedere economic.
9. Eliminarea SO2 prin procedeul Cominco (Stratula, 1980):
- procedeu dezvoltat īn Canada;
- ca absorbant se utilizeaza solutie apoasa de sulfit de amoniu;
- punerea īn libertate a SO2 absorbit se realizeaza prin tratarea solutiei cu H2SO4, rezultānd ca produs secundar sulfatul de amoniu;
- gradul de recuperare al SO2 poate fi de 85 - 97%;
- reactia care sta la baza procedeului este puternic exoterma:
![]()
![]() SO2 (g) + NH3 (sol.28%) + H2O NH4HSO4
(sol.)
SO2 (g) + NH3 (sol.28%) + H2O NH4HSO4
(sol.)
- datorita acestui fapt, īn coloana de absorbtie se degaja o cantitate foarte mare de caldura (DH = -90080kJ kmol);
- eliminarea caldurii de reactie din coloana se realizeaza prin trecerea solutiilor recirculate prin racitoare cu tuburi de aluminiu. Se realizeaza astfel o temperatura medie de contact īntre gaz si solutie de 350C.
10. Eliminarea SO2 prin procedee de tip Lime sau Limestone (Untea, 2001):
- absorbtia are loc la un pH slab alcalin īn cazul procedeului cu var;
- reactiile chimice care caracterizeaza procesul sunt numeroase si complexe;
- suspensia de lapte de var, creeaza un mediu alcalin si furnizeaza Ca2+ care leaga SO2 sub cele doua forme: gips si sulfit semihidratat;
- absorbtia are loc la un pH mai acid īn cazul procedeului cu calcar;
- aceste procedee sunt foarte utilizate īn Japonia si SUA;
- gipsul obtinut este valorificat ca material de constructii;
- avantaje: - materiale ieftine
- capacitate mare de desulfurare
- putin sensibil la variatiile de concentratie
- randamente de aproximativ 90%
- eficient economic, numai daca se valorifica gipsul.
- dezavantaje: - instalatii voluminoase
- consum mare de energie.
11. Eliminarea SO2 prin procedeul Chemico (Untea, 2001):
- absorbtia are loc īn suspensii de oxid sau hidroxid de magneziu, care au o reactivitate mai mare īn comparatie cu laptele de var sau calcarul, dar care sunt si mai scumpe;
- reactiile chimice care caracterizeaza procesul sunt:
MgO + SO2 MgSO3
Mg(OH)2 + SO2 MgSO3 + H2O
MgSO3 + SO2 + H2O Mg(HSO3)2
- acumularea sulfitului de magneziu duce la aparitia unei faze solide īn care predomina MgSO3 . 6H2O care se separa;
- fata de procedeul Lime si Limestone, acest procedeu permite regenerarea absorbantului: - umed (nu este eficient)
- uscat (termic): - la peste 2000C sau calcinare la 800-9000C
- procedee derivate: - procedeul Grillo - utiliz. unui amestec de MgO si MgO2
- procedeul japonez - solutiile sunt evacuate īn mare
- avantaj: - randamente mari de retinere a SO2.
12. Eliminarea SO2 prin absorbtia īn suspensii de Al2(SO4)3.Al2O3 (Untea, 2001):
- procedeul se desfasoara īn trei etape:
absorbtia SO2:
Al2(SO4)3.Al2O3 + 3SO2 Al2(SO4)3.Al2(SO3)3
oxidarea:
Al2(SO4)3.Al2(SO3)3 + 3/2O2 2Al2(SO4)3
regenerarea:
2Al2(SO4)3 + 3CaCO3 + 6H2O Al2(SO4)3 + 3CaSO4 . 2H2O + 3CO2
- avantaj: - gipsul rezultat īn urma procesului se valorifica ca material de constructii.
13. Eliminarea SO2 prin procedee uscate - adsorbtie (Untea, 2001):
- materiale folosite ca adsorbanti: carbune activ, semicocs, silicagel, argile, bentonite, zeoliti, rasini poroase - anionit IRA 400;
- īn functie de capacitatea de adsorbtie la 250C pentru SO2:
IRA 400 zeoliti CA silicagel
- avantajele CA: - disponibil pe piata (cantitativ si ca pret de cost)
- capacitate mare de adsorbtie
- permit o regenerare usoara
- procedeul se desfasoara īn etape:
SO2 (g) SO2 adsorbit pe CA
SO2 adsorbit pe CA + ½ O2 SO3 adsorbit pe CA
SO3 adsorbit pe CA + H2O H2SO4 adsorbit pe CA
- regenerarea se poate face - umed (cu apa sau solutii amoniacale)
- uscat (termic).
14. Eliminarea SO2 prin procedeul Hitachi (Untea, 2001):
- regenerare umeda;
- absorbtia are loc īn strat fix;
- desorbtia se face prin stropire cu apa 10-15% H2SO4 utilizat la obtinerea gipsului;
- instalatia de adsorbtie este formata din baterii de adsorbtie formate din trei adsorbere care functioneaza alternativ si ciclic (adsorbtie, desorbtie si uscare);
15. Eliminarea SO2 prin procedeul Bergau-Forschung (Untea, 2001):
- regenerare umeda iar absorbtia si desorbtia se face īn strat mobil;
- contactarea gazului cu adsorbantul se face transversal;
- procedeu continuu;
- regenerarea CA se face prin spalare cu apa H2SO4 20%;
- utilajul de adsorbtie este compact;
- CA urmeaza un circuit īnchis.
16. Eliminarea SO2 prin procedeul Tsugio-Takeuchi (Untea, 2001):
- deosebirea de procedeul Bergau-Forschung este faza de regenerare, unde nu se mai utilizeaza apa la spalarea CA ci solutii amoniacale, rezultānd ca produs sulfatul de amoniu valorificat ca īngrasamānt.
17. Eliminarea SO2 prin procedeul Reinluft (Untea, 2001):
- regenerare termica (uscata) a CA se realizeaza īn strat mobil cu gaze calde si cu oxigen rezidual pentru a preveni aprinderea carbunilor;
- la adsorbtie se realizeaza contactarea īn doua trepte īn strat mobil - īn prima treapta gazele au temperatura de 120-1500C iar īn treapta a II-a aprox.1000 C;
- SO2 separat se valorifica sub forma de H2SO4 sau SO2 lichid;
- la cicluri repetate are loc o distrugere progresiva a adsorbantului prin procese erozive, mecanice, chimice - destabilizarea mecanica a materialului adsorbant.
18. Eliminarea SO2 prin procedeul Bergau-Forschung (Untea, 2001):
- regenerare termica (uscata) a CA se face cu nisip fierbinte;
- avantaje: - valorificarea termica a CA sfarāmat
- crearea unei atmosfere reducatoare cu putin O2 necesar reactiei de regenerare
19. Eliminarea SO2 prin procedeul Takeda (Untea, 2001):
- īn adsorbant (CA) se introduce V2O5 cu rolul de a oxida SO2 la SO3;
- desorbtia se realizeaza cu diversi agenti reducatori (CO, H2 etc.) la 250-3500C
- avantaje: - regenerare īn domenii scazute de temperatura
- protejarea materialului adsorbant
- dezavantaje: - apare o impurificare cu COS, CS2 impurificare care de altfel, se gaseste si la celelalte procedee de ardere.
20. Eliminarea SO2 prin procedeul Westvaco (Untea, 2001):
- adsorbant (CA) si agent de regenerare H2S;
- instalatia este formata dintr-un singur aparat (multistrat, fluidizat) īn care se realizeaza tot procesul;
- procesul se desfasoara īn trei etape:
adsorbtia are loc la 1050C H2SO4 īn CA
regenerarea se face prin reducere cu H2S la 1500C
H2SO4 + 3H2 4S + 4H2O
desorbtia S sub forma de vapori - ¼ productia de S
- ¾ recirculat pentru regenerare:
S + H2O H2S (reactia are loc la 500-5500C )
dezavantaje: - necesita un control termic foarte riguros, pe etape
- degradarea mecanica a CA este foarte avansata.
21. Eliminarea SO2 prin procedee bazate pe chemosorbtie (Untea, 2001):
materiale folosite sunt oxizii metalici (MexOy): CuO, MnO2, CaO etc;
conditii: trebuie sa fie foarte reactivi, ieftini, disponibili pe piata, cu posibilitati de regenerare etc.;
a) utilizarea CuO:
pentru asigurarea unui suport termic, poroziv cu suprafata specifica mare se foloseste CuO depus pe suport de alumina;
retinerea SO2 se face la 300-3500C;
reactie relativ rapida;
regenerarea se poate face termic (7000C) sau catalitic (ag. De reducere si 4000C).
Exemplu:
H2 - cel mai utilizat: - sub 4000C rezulta CuS
- la 4000C rezulta CuO
- peste 4000C rezulta Cu
trebuie realizat un control foarte riguros al temperaturii;
b) utilizarea MnO2
- īn urma reactiei de adsorbtie se formeaza un produs cancerigen - MnSO4
c) utilizarea CaO
- se realizeaza injectia īn focar a unei suspensii fine de CaO, la 700-10000C
- reactiile care au loc:
CaO + SO CaSO3
CaCO3 + SO CaSO3 + CO2
CaSO3 + ½ O CaSO4
CaO + SO CaSO4
- mecanism complex;
- dezavantaje: - timp de stationare scurt reactii incomplete ;
- randament scazut (60-80%);
- exces de CaCO3 raportat la SO2;
- necesitatea eliminarii suspensiilor din gaze;
- depozitarea suspensiilor la halde de cenusa.
- pare cel mai simplu si cel mai eficace procedeu de eliminare a SO2.
22. Eliminarea SO2 prin procese catalitice (Untea, 2001):
mai putin aplicate si se poate realiza:
- oxidarea SO3 la H2SO4 78% folosind un catalizator foarte activ īn strat fix multistrat - CAT-OX (pe baza de V2O5)
- reducerea SO2 la S - folosind agenti de reducere (CO,CH4 etc) dar rezulta produsi secundari (COS, CS2, H2S)
- catalizatori (CeO2, ZrO2, Ln2O3, Li2O3 dopati cu Cu, Ni, Fe etc.) la 400-5000C
cu H2S, Al2O3 catalizator - procedeul Claus.
II. PROCEDEUL DE DESULFURARE CHIMICĂ sI BIOCHIMICA A GAZELOR REZIDUALE CARE CONŢIN SO2
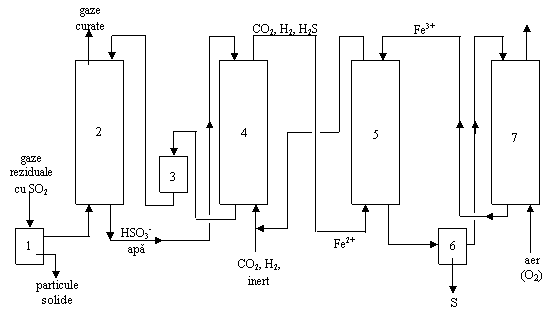
1 - separator tip ciclon de particule solide
2 - coloana de absorbtie fizica a SO2 (reactor cu umplutura udata)
3 - reactor de oxidare a urmelor de H2S din apa
4 - reactor cu umplutura udata si film biologic de transformare a HSO3- īn H2S
5 - reactor cu pulverizare de transformare a H2S īn S
6 - separator de sulf
7 - reactor biochimic cu barbotare pentru oxidarea Fe2+ la Fe3+
Īn reactorul biochimic 4 are loc o transformare microbiana īn prezenta unor microorganisme, realizāndu-se transformarea HSO3- īn H2S cu randament de peste 96%.
CAPITOLUL II
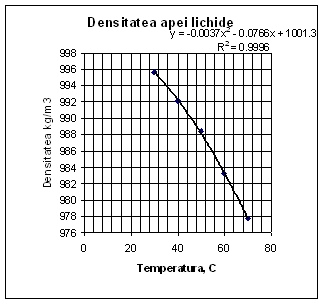 Determinarea densitatii apei la 550C:
Determinarea densitatii apei la 550C:
|
Temperatura [grd. Celsius] |
Densitatea apei [kg/m3] |
|
30 | |
![]() [kg/m3]
[kg/m3]
Determinarea densitatii HSO-3 la 550C:
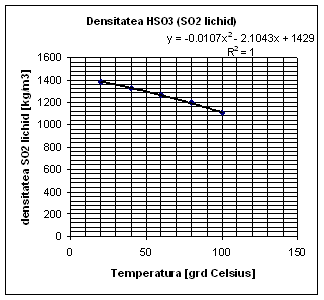
|
Temperatura [grd. Celsius] |
Densit. SO2 lichid [kg/m3] |
![]() [kg/m3]
[kg/m3]
Determinarea densitatii NH+4 la 550C:
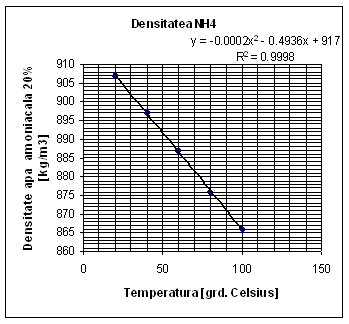
|
Temperatura [grd, Celsius] |
Densitatea apei amoniacale 20% [kg/m3] |
![]() [kg/m3]
[kg/m3]
Determinarea vāscozitatii H2S la 550C
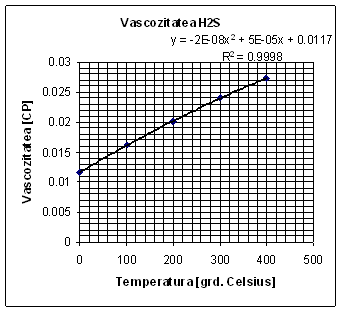
|
Temperatura [grd. Celsius] |
Vascozitatea H2S [CP] |
![]() [kg/m3]
[kg/m3]
Determinarea vāscozitatii H2, CO2 si N2 la 550C
- se utilizeaza nomograma pentru determinarea vāscozitatii gazelor (Floarea, Operatii si utilaje, pag. 516, Anexa XX):
![]() [N s/m2]
[N s/m2]
![]() [N s/m2]
[N s/m2]
![]() [N s/m2]
[N s/m2]
Determinarea coeficientilor de difuziune
- se utilizeaza Tabelul XII.1, pag. 321, Floarea-" Operatii si utilaje":
Īn faza gazoasa: (t = 0oC si p = 1atm)
![]() [m2/s]
[m2/s]
![]() [m2/s]
[m2/s]
![]() [m2/s]
[m2/s]
(NH - aer)
Īn faza lichida: (t = 20oC si p = 1atm)
![]() [m2/s]
[m2/s]
![]() [m2/s]
[m2/s]
![]() [m2/s]
[m2/s]
(SO -apa
Determinarea coeficientilor de difuziune la temperatura de lucru (55 grade C), conform relatiei Wilhelm - Chang:
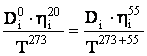
- determinarea coeficientului de difuziune pentru H2 , la temperatura de lucru:
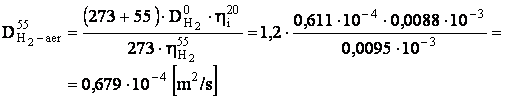
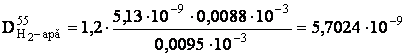 [m2/s]
[m2/s]
- determinarea coeficientului de difuziune pentru CO2 la temperatura de lucru:
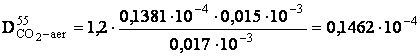 [m2/s]
[m2/s]
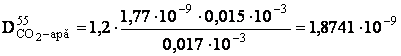 [m2/s]
[m2/s]
- determinarea coeficientului de difuziune pentru HSO3ˉ la temperatura de lucru:
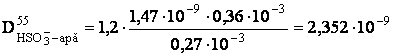 [m2/s]
[m2/s]
(SO -apa
Determinarea unor proprietati ale amestecului gazos
- densitatea medie a amestecului gazos:
![]()
![]() [kg/m3]
[kg/m3]
- vāscozitatea medie a fazei gazoase:
![]()
![]()
![]() [N s/m2]
[N s/m2]
- masa molara medie a amestecului gazos:
![]()
![]() [kg/kmol]
[kg/kmol]
- debitul molar al amestecului gazos:
![]() =2450.893Kmol/h
=2450.893Kmol/h
Determinarea unor proprietati ale fazei lichide
- din nomograma pentru determinarea vāscozitatii lichidelor (Floarea," Operatii si utilaje", pag. 494, Anexa VI):
![]() [N s/m2]
[N s/m2]
![]() [N s/m2]
[N s/m2]
- vāscozitatea medie a lichidului:
![]()
= 0.9972·0.52·10-3 + 0.27·10-2·0.27·10-3=0.52·10-3 [N s/m2]
- densitatea medie a lichidului:
![]()
= 0.9972·985.8945 + 0.27·10-2·1280.896=986.592 [kg/m3]
CAPITOLUL III
![]()
H2
Debitul molar al hidrogenului:
![]()
DM![]() ,i =
,i =![]() DM
DM![]() ,i =1715,62 Kmol/h
,i =1715,62 Kmol/h
Debitul masic al hidrogenului
Dm![]() , i = DM
, i = DM![]() ,i · MH2 Dm
,i · MH2 Dm![]() , i =3431,25 Kg/h
, i =3431,25 Kg/h
Determinarea densitatii hidrogenului la 55oC:
MH2 =2 [kg/kmol]![]() Vo =22,4
[m3/kmol] po
=1 [atm] p1=P
Vo =22,4
[m3/kmol] po
=1 [atm] p1=P
T1=To +t To =273oC T1 =328oC
Vo=22,4 [m3/kmol]
![]()
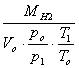
![]() =0,07431 [kg/m3]
=0,07431 [kg/m3]
Debitul volumetric al hidrogenului:
DV![]() ,i =Dm
,i =Dm![]() ,i /
,i / ![]() H2 DV
H2 DV![]() ,i =46174,80824 [m3/h]
,i =46174,80824 [m3/h]
Presiunea partiala a hidrogenului:
PH2=YH2 · P pH2 =0,7 [atm]
Concentratia molara a hidrogenului:
R=0,082 [l·atm/mol·K] pH2 =0,7 [atm]
PH2 ·V =nH2 · R·T1 pH2 =![]() pH2=CH2·R·T1
pH2=CH2·R·T1
CH2 =![]()
![]() CH2=0,02603
[mol/l]
CH2=0,02603
[mol/l]
CO2
Debitul molar al dioxidului de carbon:
DM![]() ,i =
,i = ![]() DM
DM![]() ,i= 490,1785714 [kmol/h]
,i= 490,1785714 [kmol/h]
Debitul masic al dioxidului de carbon:
MCO2=44 [kg/kmol]
Dm![]() ,i = DM
,i = DM![]() ,i · MCO
,i · MCO![]() Dm
Dm![]() ,i =21567,85714 [kmol/h]
,i =21567,85714 [kmol/h]
Debitul volumetric al dioxidului de carbon:
Determinarea densitatii dioxidului de carbon la 55oC:
MCO2=44 [kg/kmol] Vo=22,4 [m3/kmol] po=1 [atm] p1=P
T1=To+t To=273oC T1=328 K
![]() =
=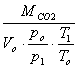
![]() =1,63491 [kg/m3]
=1,63491 [kg/m3]
DV![]() ,i = Dm
,i = Dm![]() ,i /
,i /![]() DV
DV![]() ,i =13192,08819 [m3/h]
,i =13192,08819 [m3/h]
Presiunea partiala a dioxidului de carbon:
PCO2=YCO2·P pCO2=0,2 [atm]
Concentratia dioxidului de carbon:
CCO2=![]() CCO2=0,007436
[mol/l]
CCO2=0,007436
[mol/l]
N2
Debitul molar al azotului:
DM![]() , i =
, i = ![]() DM
DM![]() , i = 245,0892857[kmol/h]
, i = 245,0892857[kmol/h]
Debitul masic al azotului:
Dm![]() ,i = DM
,i = DM![]() , i · MN2 Dm
, i · MN2 Dm![]() ,i =6865,5 [kg/h]
,i =6865,5 [kg/h]
Determinarea densitatii azotului:
![]() =
=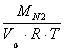
![]() [kg/h]
[kg/h]
Presiunea partiala a azotului:
PN2=YN2·P PN2=0,1 [atm]
Concentratia molara a azotului:
CN2=![]() CN2=0,003718
[mol/l]
CN2=0,003718
[mol/l]
INTRARE -LICHIDE:
HSO![]()
Debitul molar:
DM![]() , i = DVL · CHSO
, i = DVL · CHSO![]() DM
DM![]() , i = 83,5 [kmol/h]
, i = 83,5 [kmol/h]
Debitul masic:
Dm HSO![]() ,i = DM
,i = DM![]() , i· MHSO
, i· MHSO![]() Dm
HSO
Dm
HSO![]() ,i = 6763,5 [kg/h]
,i = 6763,5 [kg/h]
Debitul volumetric:
-conform graficului, valoarea
densitatii HSO3 este: ![]() =1280,896[kg/m3]
=1280,896[kg/m3]
DV![]() ,i = Dm HSO
,i = Dm HSO![]() ,i /
,i / ![]() DV
DV![]() ,i= 5,280288[m3/h]
,i= 5,280288[m3/h]
H2O
Debitul volumetric:
DV![]() ,i = DVL - DV
,i = DVL - DV![]() ,i DV
,i DV![]() ,i = 2494,719712[m3/h]
,i = 2494,719712[m3/h]
Debitul masic:
-conform
graficului, densitatea apei la 55oC este: ![]() =985,8945[kg/m3]
=985,8945[kg/m3]
Dm![]() , i = DV
, i = DV![]() ,i ·
,i · ![]() Dm
Dm![]() , i = 2459530,443[kg/h]
, i = 2459530,443[kg/h]
Debitul molar:
DM![]() ,i = Dm
,i = Dm![]() , i / MH2O DM
, i / MH2O DM![]() ,i =136640,580[kmol/h]
,i =136640,580[kmol/h]
REACŢIA CHIMICĂ:
30,75* 2 44 0,2*18 9,35 24,6 9,55*34 30,15*18
HSO3 + H2 + CO2 + NH![]() + H+ = X + H2S + H2O
+ H+ = X + H2S + H2O
Dm,tr a b c d e f g
Determinarea debitului de HSO3 transformat(debit molar):
![]() =96,9%
=96,9%
DM![]() = DVL·CHSO
= DVL·CHSO![]() ·
· ![]() DM
DM![]() = 80,9115[kmol/h]
= 80,9115[kmol/h]
Determinarea debitului masic:
Dm,HSO3 tr= DM![]() · MHSO3 Dm,HSO3
tr= 6553,8315[kg/h]
· MHSO3 Dm,HSO3
tr= 6553,8315[kg/h]
Din reactia chimica rezulta urmatoarele debite masice:
-a - debitul de hidrogen consumat īn reactie:
Dm H2,cons=521,05312[kg/h]
-b - debitul de dioxid de carbon consumat īn reactie:
Dm CO2,cons=372,859686[kg/h]
-c - debitul de NH![]() introdus:
introdus:
Dm NH![]() , introdus=30,50067[kg/h]
, introdus=30,50067[kg/h]
-e - debitul de celule care se formeaza:
Dm,X=208,4212[kg/h]
-f - debitul de hidrogen sulfurat care se formeaza īn reactie:
Dm H2S, format =2750,991[kg/h]
-g - debitul de apa care se formeaza īn reactie:
Dm H2O, format=4597,976026[kg/h]
IEsIRE - GAZE:
Debitul masic de hidrogen:
Dm H![]() ,e = Dm
,e = Dm![]() , i - Dm H2,cons Dm H
, i - Dm H2,cons Dm H![]() ,e = 2910,1969[kg/h]
,e = 2910,1969[kg/h]
Debitul molar de hidrogen:
DM H![]() , e = Dm H
, e = Dm H![]() ,e / MH
,e / MH![]() DM
H
DM
H![]() , e = 1455,09844[kmol/h]
, e = 1455,09844[kmol/h]
Debitul volumetric:
DV H![]() , e = Dm H
, e = Dm H![]() ,e /
,e / ![]() DV H
DV H![]() , e = 39162,92397[m3/h]
, e = 39162,92397[m3/h]
Debitul masic de dioxid de carbon:
Dm CO![]() , e= Dm
, e= Dm![]() ,i - Dm
CO2,cons Dm CO
,i - Dm
CO2,cons Dm CO![]() , e= 21195,07145[kg/h]
, e= 21195,07145[kg/h]
Debitul molar de dioxid de carbon:
DM CO![]() , e = Dm CO
, e = Dm CO![]() , e / MCO
, e / MCO![]() DM CO
DM CO![]() , e = 481,704488[kmol/h]
, e = 481,704488[kmol/h]
Debitul volumetric de dioxid de carbon:
DV CO![]() , e = Dm CO
, e = Dm CO![]() , e /
, e / ![]() DV
CO
DV
CO![]() , e = 12964,0267[m3/h]
, e = 12964,0267[m3/h]
Debitul masic de azot:
Dm N![]() , e = Dm
, e = Dm![]() ,i (inert)
,i (inert)![]() Dm
N
Dm
N![]() , e = 6862,5[kg/h]
, e = 6862,5[kg/h]
Debitul molar de azot:
DM N![]() , e = Dm N
, e = Dm N![]() , e / MN
, e / MN![]() DM
N
DM
N![]() , e = 245,0892857[kmol/h]
, e = 245,0892857[kmol/h]
Debitul volumetric de azot:
DV N![]() , e = Dm N
, e = Dm N![]() , e /
, e / ![]() DV
N
DV
N![]() , e = 6596,046121[m3/h]
, e = 6596,046121[m3/h]
Debitul masic de hidrogen sulfurat:
Dm H2S, e =Dm H2S, format Dm H2S, e = 2750,991[kg/h]
Debitul molar de hidrogen sulfurat:
DM H2S, e = Dm H2S, e / MH2S DM H2S, e = 80,9115[kmol/h]
Debitul volumetric de hidrogen sulfurat:
DV H2S, e = Dm H2S, e /
![]() DV
H2S, e = 2177,557392[m3/h]
DV
H2S, e = 2177,557392[m3/h]
IEsIRE - LICHIDE:
Debitul masic de apa:
Dm H2O, e = Dm H2O, i + Dm H2O, format Dm H2O, e = 2464128,419[kg/h]
Debitul molar de apa:
DM H2O,e = Dm H2O, e / MH2O DM H2O,e = 136896,0233[kmol/h]
Debitul volumetric de apa:
DV H2O, e= Dm H2O, e /
![]() DV
H2O, e= 2499,383473[m3/h]
DV
H2O, e= 2499,383473[m3/h]
Debitul masic de HSO3:
Dm HSO![]() , e =Dm HSO
, e =Dm HSO![]() , I - Dm
HSO
, I - Dm
HSO![]() , trans Dm
HSO
, trans Dm
HSO![]() , e = 209,6685[kg/h]
, e = 209,6685[kg/h]
Debitul molar de HSO3:
DM HSO![]() , e = Dm HSO
, e = Dm HSO![]() , e / MHSO
, e / MHSO![]() DM
HSO
DM
HSO![]() , e = 2,5885 [kmol/h]
, e = 2,5885 [kmol/h]
Debitul volumetric de HSO3:
DV HSO![]() , e = Dm HSO
, e = Dm HSO![]() , e /
, e / ![]() DV
HSO
DV
HSO![]() , e = 0,1636889[m3/h]
, e = 0,1636889[m3/h]
INTRARE:
|
specii |
DM (Kmol/kg) |
Dm (kg/h) |
DV (m3/h) |
X |
Y |
C (mol/l) |
|
H2 | ||||||
|
CO2 | ||||||
|
N2 | ||||||
|
NH | ||||||
|
HSO3 | ||||||
|
H2O | ||||||
|
TOTAL |
IEsIRE:
|
specii |
DM (kmol/h) |
Dm (kg/h) |
DV (m3/h) |
X |
Y |
C (mol/l) |
|
H2 | ||||||
|
CO2 | ||||||
|
N2 | ||||||
|
H2S | ||||||
|
X | ||||||
|
HSO3 | ||||||
|
H2O | ||||||
|
TOTAL |
3.2. DEDUCEREA VITEZEI PROCESULUI
Ipoteze simplificatoare model curgere piston (deplasare) DG - DL;
abordare izoterma a īntregului sistem;
regim stationar;
concentratia celulelor īn reactor este constanta
debitul molar de amestec gazos este constant pe toata lungimea reactorului;
Procesul de transfer este alcatuit din urmatoarele etape:
etapa externa: transfer de masa
etape interne: reactie microbiana si difuzie interna īn structura filmului biologic (etape simultane)
Etapele simultane si etapa de transfer de masa sunt īnseriate. Etapa externa genereaza gradienti inter-particula, iar etapele interne genereaza gradienti intra-particula. Rezulta deci, ca procesul studiat (care se desfasoara īn reactorul biochimic) este īn prezenta gradientilor intra si inter-particula de concentratie.
Īn situatia data, reactantul limitativ este H2, iar deducerea ecuatiei de viteza se va realiza īn functie de concentratia acestuia īn faza gazoasa.

Figura 1. PROFILUL CONCENTRAŢIEI H2
Etapele elementare care au loc sunt:
1 - difuzia H2 si CO2 īn faza gazoasa spre interfata gaz-lichid;
2 - difuzia H2 si CO2 īn faza lichida de la interfata gaz-lichid;
3 - transport convectiv īn faza lichida;
4 - difuzia īn faza lichida spre interfata lichid-film biologic;
5 - difuzia īn structura poroasa a filmului biologic si reactia microbiana (aceste doua fenomene se desfasoara simultan).
Toate cele cinci etape sunt īnseriate.
Hidrogenul este un gaz putin solubil īn apa si de aceea īn prima etapa nu opune rezistenta la transferul de masa. Īn acest caz concentratia hidrogenului la interfata este:

Conform legii lui Fick:
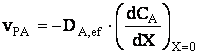
Cercetarile spun ca viteza procesului poate fi descrisa de un model Monod:
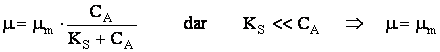
Avānd īn vedere valorile mici ale constantei Monod, se poate utiliza o expresie de viteza de pseudo-ordinul zero:
![]()
Deoarece s-a considerat ca: CX = ct. vRA = k (1)
Dar viteza se mai poate scrie:
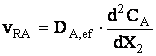 (2)
(2)
Din (1) si (2) ![]()
![]() (3)
(3)
Conditii la limita:
CL1: x = 0 C2 = CAS
CL2: x = δ CAS = 0
CL3: x = δ ![]()
Prin integrarea relatiei (3) se obtine:
![]() si
si ![]()
Din conditiile la limita obtinem:
CL1 CA = CAS = C2 adica C2 = CAS
![]()
![]()
CL3 ![]()
Se īnlocuieste expresia lui C1 īn CL2 si se determina expresia pentru δ:
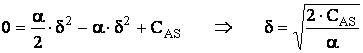
Relatia de definitie pentru δ se introduce īn expresia lui C1
![]()
Īn final, relatia pentru C1 este de forma:
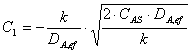
Dar: ![]()
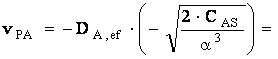
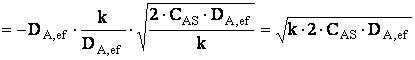
Se va obtine relatia expresiei de viteza
![]()
Se face notatia:
![]()
Expresia de viteza este de forma:
![]()
DETERMINAREA EXPRESIEI vPA·aVGL UTILIZATĂ ĪN REZOLVAREA ECUAŢIEI DE DIMENSIONARE A REACTORULUI
![]()
Se noteaza vPA·aVGL = φ
φ
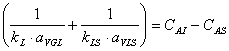
![]()
![]()
![]()
![]()
Se noteaza :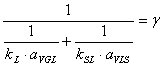
Relatia de calcul va deveni: ![]()
![]()
Se rezolva urmatorul sistem de ecuatii:
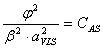
![]()
![]()
![]()
Se face notatia: ![]()
Astfel: 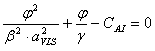
unde: 
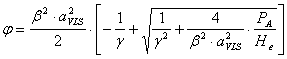
Solutia obtinuta īn final este de forma:
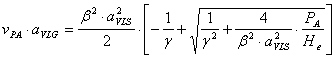
3.2 ECUAŢIA DE DIMENSIONARE A REACTORULUI
Ecuatia de dimensionare a reactorului este de forma:
![]()
Calculul sectiunii transversale a reactorului:
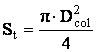
Diametrul coloanei are valoarea: Dcol = 12 [m]
Valoarea sectiunii transversale a reactorului va fi: St = 113.04 [m2]
Valoarea debitului molar gazos este: DMG = 2450.893[kmol/h].
aVGL·vPA
Expresia este de forma:
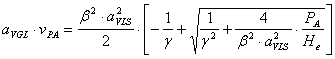
p calculul constantei b
![]()
unde: ![]()
k = 4.382 [mol H2/m3r h
![]() [mol CX/m3reactor]
[mol CX/m3reactor]
Valoarea coeficientului efectiv de difuziune pentru hidrogen este:
![]() [m2/s]
[m2/s]
![]() [m2/s]
[m2/s] ![]() [m2/h]
[m2/h]
Valoarea constantei b este:
![]() [mol H2/m h2]
[mol H2/m h2]
p Calculul ariei laterale a particulei:
![]()
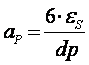 e=o.6 [m3]
e=o.6 [m3]
![]() [m]
[m]
Valoarea ariei laterale a particulei este:
![]() [m2]
[m2]
CALCULUL COEFICIENŢILOR PARŢIALI DE TRANSFER DE MASĂ ĪN FAZĂ LICHIDĂ sI SOLIDĂ
p calculul vitezelor superficiale:
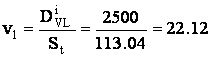 [m/h]
[m/h] ![]() [m/s]
[m/s]
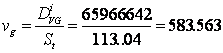 [m/h] =0.162[m/s]
[m/h] =0.162[m/s]
p Calculul criteriului Reynolds pentru faza lichida:
ReL= 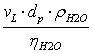 =
= ![]() =68.22
=68.22
p Calculul criteriului Reynolds pentru faza gazoasa:
ReG=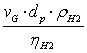 =
=![]() =39.12
=39.12
p Determinarea criteriului Schmidt:
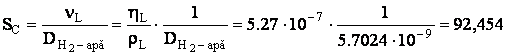
p Determinarea criteriului Sherwood:
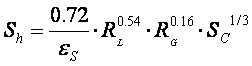
unde: ![]()
![]()
Sh=95.408
p
Determinarea valorii produsului ![]() :
:
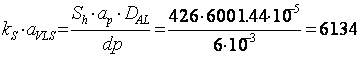 [m3/h] =
0.017[m3/s]
[m3/h] =
0.017[m3/s]
p
Determinarea valorii produsului ![]() :
:
![]()
![]()
= 0.16[m3/s]
p Determinarea valorii constantei g
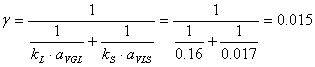 [m3/s]
[m3/s]
p
Determinarea valorii produsului ![]() :
:
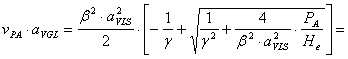
![]()
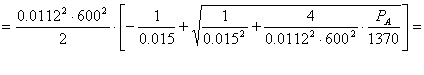
![]()
REZOLVAREA ECUAŢIEI DE DIMENSIONARE A REACTORULUI
Ecuatia de dimensionare a reactorului biochimic este de forma:
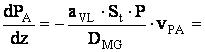
![]()
=-1.04(-33.33+![]()
=34.64-1.04![]()
Se utilizeaza un increment: Dz = 0,04 m
La baza coloanei, z = 0 presiunea partiala a hidrogenului va avea valoarea:
![]()
Pe masura ce gazul parcurge reactorul, el se va consuma iar presiunea partiala va scadea, conform formulei (metoda Euler):
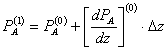
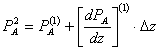
- - - - - - - - - - - - - - - - -
![]()
Program de rezolvare a ecuatiei de dimensionare a reactorului biochimic
(Mathcad Professional 7.0)
CAPITOLUL IV
CALCULUL DIAMETRELOR RACORDURILOR PENTRU FAZELE GAZOASĂ sI LICHIDĂ LA INTRAREA sI IEsIREA DIN REACTOR
p Calculul diametrului racordului de alimentare a fazei gazoase
Formula de calcul a diametrului racordului este:
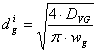
unde: DVG - debitul volumetric de gaz alimentat īn reactor, [m3/s];
wg - viteza de curgere a gazului prin racord, [m/s].
Valoarea vitezei de curgere a gazului prin racordul de alimentare, se alege din intervalul: (15-20) m/s.
Aleg valoarea: wg = 15 [m/s].
Prin īnlocuirea valorilor corespunzatoare īn formula de calcul a diametrului racordului de intrare a gazelor īn reactorul biochimic, se va obtine:
 [m] STAS:
[m] STAS: ![]() [m]
[m]
p Calculul diametrului racordului de alimentare a fazei lichide:
Formula de calcul a diametrului racordului este:
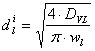
unde: DVL - debitul volumetric de lichid alimentat īn reactor, [m3/s];
wl - viteza de curgere a lichidului prin racord, [m/s].
Valoarea vitezei de curgere a lichidului prin racordul de alimentare, se alege din intervalul: (0.1 - 1) m/s.
Alegem valoarea: wl = 1 [m/s].
Prin īnlocuirea valorilor corespunzatoare īn formula de calcul a diametrului racordului de intrare a lichidului īn reactorul biochimic, se va obtine:
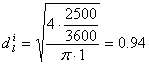 [m] STAS: 1[m]
[m] STAS: 1[m]
Calculul diametrului racordului de evacuare a fazei gazoase:
Formula de calcul a diametrului racordului este:
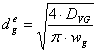
unde: DVG - debitul volumetric de gaz evacuat din reactor, [m3/s];
wg - viteza de curgere a gazului prin racord, [m/s].
Valoarea vitezei de curgere a gazului prin racordul de evacuare, se alege din intervalul: (10 - 15) m/s.
Aleg valoarea: wg = 14 [m/s].
Prin īnlocuirea valorilor corespunzatoare īn formula de calcul a diametrului racordului de evacuare a gazelor din reactorul biochimic, se va obtine:
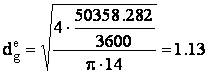 [m] STAS:
[m] STAS: ![]() [m]
[m]
p Calculul diametrului racordului de evacuare a fazei lichide:
Formula de calcul a diametrului racordului este:
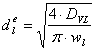
unde: DVL - debitul volumetric de lichid evacuat din reactor, [m3/s];
wl - viteza de curgere a lichidului prin racord, [m/s].
Valoarea vitezei de curgere a gazului prin racordul de evacuare, se alege din intervalul: (0.1 - 1) m/s.
Aleg valoarea: wl = 0.5 [m/s].
Prin īnlocuirea valorilor corespunzatoare īn formula de calcul a diametrului racordului de evacuare a lichidului din reactorul biochimic, se va obtine:
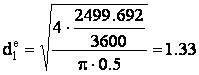 [m] STAS:
[m] STAS: ![]() [m]
[m]
BIBLIOGRAFIE
Octavian Floarea, Gheorghita Jinescu si altii, Operatii si utilaje īn industria chimica - Culegere de probleme, Ed. Didactica si Pedagogica, Bucuresti, 1980;
Emilian A. Bratu, Operatii unitare īn ingineria chimica, Vol. III, Ed. Tehnica , Bucuresti, 1985;
R. Mihail, O. Muntean si altii, Īndrumar proiect de an la reactoare chimice, Centrul de multiplicat cursuri I.P.B., Bucuresti;
Octavian Floarea, Romulus Dima, Procese de transfer de masa si utilaje specifice, Ed. Didactica si Pedagogica, Bucuresti, 1984;
Ovidiu Muntean si Grigore Bogza, Reactoare chimice, Vol. I - Reactoare omogene, Colectia UNIVERSITARIA, Editura Tehnica, Bucuresti, 2001;
M. Barnea si C. Papadopol, Poluarea si protectia mediului, pag. 38-40, Editura stiintifica si Enciclopedica, Bucuresti, 1975;
Ilie C. Zaharia, Studii de ecologie: Influenta poluarii chimice asupra covorului vegetal din Romānia, pag. 30-31, Editura Economica, Bucuresti 1999;
M. Negulescu si colaboratorii, Protectia mediului īnconjurator, pag. 81, Editura Tehnica, Bucuresti, 1995;
Buletin de informare nr.3, Controlul poluarii aerului, pag. 34-38, Editura Infoterra, Romānia, 1999;
Buletin de informare curenta, Protectia mediului nr. 3, pag. 18-23, Bucuresti 1993 - Oficiul de Informare si Documentare OID;
Mihaela Mihai, Note de curs, 2000-2001;
Ion Untea, Note de curs, 2000-2001;
INTERNET.
CUPRINS :
CAPITOLUL I - Referat de literatura.......... ..... ...... .......pg. 7
CAPITOLUL II - Proprietati fizice.......... ..... ...... ..............pg. 27
CAPITOLUL III - 3.1 Bilant de materiale.......... ..... ...... .....pg. 33
3.2 Rezolvarea ecuatiei de dimensionare.......pg. 47
a reactorului
CAPITOLUL IV - Calculul racordurilor pentru fazele lichida si gazoasa
la intrarea si iesirea din reactor.....................pg. 52
BIBLIOGRAFIE.......... ..... ...... .......... ..... ...... ................pg. 55
|