SISTEMUL PERIODIC AL ELEMENTELOR
3.1 Structura sistemului periodic
Încercari de clasificare a elementelor chimice:
A. Lavoisier; J. Berzelius - elementele au fost împartite în metale si nemetale (sfârsitul sec. al XIX-lea);
J. Döbereiner (1829) - clasificarea în triade (familii de elemente);
B. de Chancourtois (1828) - aranjare elicoidala;
J. Newlands (1864) - regula octavelor (la fiecare al optulea element proprietatile sunt asemanatoare)
Clasificarea cea mai ingenioasa a elementelor a fost propusa de Mendeleev[10] în anii 1869-1871. Pe vremea acestei mari descoperiri, notiunea de numar atomic nu era cunoscuta. La baza clasificarii lui Mendeleev a stat masa atomica a elementelor. Considerând sirul elementelor în ordinea crescatoare a maselor atomice, se constata ca din loc în loc apar elemente cu proprietati chimice asemanatoare. 242i89c În consecinta se poate scrie sirul elementelor pe mai multe rânduri, asa încât elementele cu proprietati asemanatoare sa se potriveasca unele sub altele. Se obtine astfel un tabel numit sistemul periodic al elementelor. În tabel apar neregularitati numai în trei locuri si anume: plasând în coloanele verticale elementele cu proprietati asemanatoare, apar în tabel trei perechi de elemente, Co-Ni, Ar-K si Te-I, în ordinea inversa a maselor lor atomice crescatoare (dar în ordinea corecta a numerelor atomice). Aceste neregularitati sunt fara însemnatate, fiindca nu masa atomica si numarul atomic determina locul unui element în sistemul periodic, multe elemente fiind amestecuri de izotopi cu mase atomice diferite.
Pe vremea lui Mendeleev erau cunoscute numai 63 elemente. O grupa întreaga de elemente, aceea a gazelor rare, nu fusese înca descoperita. De asemenea nu se cunosteau elementele radioactive. Dar chiar printre elementele mai comune multe nu fusesera izolate, asa ca în tabelul lui Mendeleev multe patratele erau înca neocupate. Cu atât mai de admirat este intuitia clasificarii periodice a lui Mendeleev. Acesta a prevazut existenta mai multor elemente, printre care omologii superiori ai: borului (scandiul), aluminiului (galiul) si manganului (technetiul si reniul), care au fost descoperite mai târziu.
Asezarea elementelor pe grupe (verticale) si perioade (orizontale) este si în prezent cel mai bun sistem de clasificare al elementelor chimice conform proprietatilor lor. Acest sistem se bazeaza pe structura învelisului de electroni al atomilor.
Exista mai multe forme tabelare pentru a reprezenta sistemul periodic al elementelor, fiecare din ele cu anumite avantaje si dezavantaje. Forma adoptata aici (tabelul 6) este întrucâtva diferita de cea initiala a lui Mendeleev, de asemenea putin schimbata:
grupa gazelor nobile, numita de obicei grupa 0 (pornind de la parerea ca aceste elemente nu formeaza combinatii chimice si deci au valenta 0) este notata aici VIIIA (pentru a se tine seama de structura învelisului electronic al acestor elemente si de faptul ca unele dintre aceste elemente formeaza combinatii cu fluorul si cu oxigenul);
cele trei familii de elemente tranzitionale, Fe, Co, Ni, Ru, Rh, Pd si Os, Ir, Pt, cuprinse înainte într-o singura grupa (grupa VIII) sunt încadrate aici în trei subgrupe, notate cu VIIIB, IXB, XB .
Aceasta varianta a sistemului periodic al elementelor (forma lunga) a fost propusa de Werner si prezinta avantajul de a reflecta cauza interna a periodicitatii.
Utilizarea formei lungi a sistemului periodic a fost propusa în anul 1985 de catre IUPAC, ulterior fiind adoptata definitiv. Majoritatea savantilor sustin si solicita utilizarea acestui tabel în cercetare, precum si în procesul de învatamânt.
Tabelul 6.Sistemul periodic al elementelor (forma lunga)
|
IA (1) |
IIA (2) |
IIIB (3) |
IVB (4) |
VB (5) |
VIB (6) |
VIIB (7) |
VIIIB (8) |
IXB (9) |
XB (10) |
IB (11) |
IIB (12) |
IIIA (13) |
IVA (14) |
VA (15) |
VIA (16) |
VIIA (17) |
VIIIA (18) |
|
H |
He |
||||||||||||||||
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
||||||||||
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
||||||||||
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
|
Cs |
Ba |
La* |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
|
Fr |
Ra |
Ac** |
Unq[13] |
Unp[14] |
Unh[15] |
Uns[16] |
Uno[17] |
Une[18] | |||||||||
Lantanide
|
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Actinide
|
Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Numarul de ordine al fiecarui element este numarul care marcheaza succesiunea elementelor în sistemul periodic. În acest caz este valabila relatia:
Numarul de ordine= numarul de sarcini nucleare = numarul protonilor din nucleu = numarul de electroni din învelisul electronic
Perioada este sirul orizontal din sistemul periodic. Exista 7 perioade care se noteaza cu cifre arabe. Elementele ai caror atomi au acelasi numar de straturi electronice ocupate sunt ordonate în aceeasi perioada:
Numarul de straturi electronice ocupate = numarul stratului electronic exterior = numarul perioadei.
Grupa - coloana verticala care cuprinde elementele cu aceeasi configuratie electronica pe ultimul strat. Forma lunga a sistemului periodic cuprinde 18 grupe ( 8 principale si 10 secundare).
Elementele unei grupe principale contin în atomii lor acelasi numar de electroni pe ultimul strat. Numarul grupei corespunde, în cazul grupelor principale ale sistemului periodic, sumei electronilor s si p de pe stratul exterior (ultimul strat) al atomului:
Numarul electronilor de pe ultimul strat = numarul grupei principale
În perioade, numarul electronilor de pe ultimul strat al atomilor elementelor din grupele principale se schimba continuu, o data cu numarul de sarcini nucleare.
Pozitia fiecarui element în sistemul periodic se bazeaza pe structura atomului sau.
|
Legatura dintre |
Sulf |
||
|
Structura atomului |
Pozitia elementului în sistemul periodic |
Structura atomului |
Pozitia elementului în sistemul periodic |
|
Numarul protonilor= numarul electronilor = |
Numarul de ordine |
16 protoni 16 electroni |
numarul de ordine 16 |
|
Numarul straturilor electronice ocupate = numarul ultimului strat electronic= |
Numarul perioadei |
3 straturi electronice ocupate al 3-lea strat electronic |
Perioada a 3-a |
|
Numarul electronilor de pe ultimul strat = |
Numarul grupei principale |
6 electroni pe ultimul strat |
Grupa a VI-a principala |
În perioade, numarul electronilor de pe ultimul strat al atomilor elementelor din grupele principale de schimba continuu, o data cu numarul de sarcini nucleare. La trecerea dintr-o perioada în urmatoarea, numarul electronilor se modifica brusc.
La atomii elementelor din grupele secundare se completeaza treptat un subnivel d (cu maxim 10 electroni), la atomii lantanidelor si actinidelor un subnivel f (cu maxim 14 electroni).
3.2. Proprietati periodice ale elementelor
Legea periodicitatii (Mendeleev, 1869): proprietatile fizice si chimice ale elementelor sunt functii periodice ale maselor lor atomice. În baza lucrarilor fizicianului englez Moseley si a fizicianului danez N. Bohr, privind structura atomului, legea periodicitatii a obtinut o noua formulare, moderna: proprietatile fizice si chimice ale elementelor sunt functii periodice ale sarcinilor nucleelor atomice ale elementelor.
Proprietatile aperiodice (nepriodice) sunt proprietatile determinate de nucleu, care variaza liniar.
Exemplu: numar izotopic, masa atomica, spectru raze X.
Proprietatile periodice sunt proprietatile determinate de configuratia electronica periferica a atomilor.
Exemplu: volum atomic, raze atomice, energie de ionizare, valenta, caracter metalic, caracter nemetalic etc.
3.2.1. Proprietati fizice periodice ale elementelor
3.2.1.1. Raza covalenta (atomica) a atomului
Consideram o molecula A2 (pentru ca la ea avem legatura covalenta). Se poate determina exact distanta dintre cele doua nuclee. Daca cele doua nuclee sunt identice, prin conventie se considera ca jumatate din distanta dintre cele doua nuclee va fi raza covalenta. Raza covalenta ne arata pâna la ce distanta se poate apropia un atom de o molecula vecina. Cel mai bine se defineste raza covalenta la moleculele formate din atomi identici. Pentru ca tot din atomi identici, dar fara sa formeze molecule, sunt alcatuite si metalele, jumatate din distanta dintre doua nuclee vecine reprezinta raza atomica.
S-a constatat ca distanta dintre anumite nuclee de atomi este constanta. Exemplu:
distanta C-C din combinatiile alifatice si din diamant este întotdeauna
1,54 Ĺ;
distanta C-Cl : 1,77 Ĺ;
distanta C-H: 1,09 Ĺ;
distanta Si-Si: 2,34 Ĺ.
Astfel de distante sunt egale mereu, ceea ce a dus la presupunerea ca aceasta distanta este suma razelor celor doi atomi (razele covalente sunt aditive).
Exemplu: C-Si
- experimental: d = 1,92 Ĺ
- calculat: d = 0,77 Ĺ+ 1,17 Ĺ = 1,94 Ĺ
Rezulta o eroare neglijabila.
Razele covalente sunt aditive, dar ele nu mai ramân unice daca atomul respectiv da mai multe tipuri de legaturi.
Exemplu:
C-C d=1,54
Ĺ ![]() rC = 0,77 Ĺ
rC = 0,77 Ĺ
C=C d=1,35 Ĺ ![]() rC = 0,675 Ĺ
rC = 0,675 Ĺ
![]() d= 1,20 Ĺ
d= 1,20 Ĺ ![]() rC = 0,60 Ĺ.
rC = 0,60 Ĺ.
Raza covalenta în perioada descreste cu cresterea numarului de ordine iar în grupa creste cu cresterea numarului de ordine.
Exemplu:
- în perioada: B - 0,91 Ĺ , C - 0,77 Ĺ, N - 0,71 Ĺ
- în grupa: F- 0,72 Ĺ, Cl - 0,99 Ĺ, Br - 1,14 Ĺ, I - 1,33 Ĺ.
Când o legatura simpla este învecinata cu o legatura dubla sau tripla, ea se scurteaza.
Exemplu:
- în etan -C-H dC-H=1,094 Ĺ
- în etena =C-H dC-H=1,079 Ĺ
- în etina ![]() dC-H=1,057
Ĺ.
dC-H=1,057
Ĺ.
Raza covalenta a hidrogenului ramâne aceeasi, 0,31 Ĺ.
Razele covalente ale atomilor pot sa se modifice datorita:
- legaturilor învecinate si pe care le fac ei;
- coordinatiei elementului;
- gradul de oxidare al elementului;
- polaritatea moleculei;
- respingerile dintre atomii care nu participa direct la legatura.
3.2.1.2. Razele ionice
Nu toate substantele au caracter covalent. Sarurile în stare solida sunt alcatuite din ioni (un atom sau grupuri de atomi care au sarcina electrica). Prin metoda difractiei de raze X se determina distanta dintre doua nuclee contrare ca sarcina.
Raza unui ion pozitiv (cation) este mai mica decât raza atomului de la care a provenit.
Exemplu: K - 2,03 Ĺ; K+ - 1,33 Ĺ.
Raza unui ion negativ (anion) este mai mare decât a raza atomului de la care a provenit.
Exemplu: Cl - 0,99 Ĺ; Cl- - 1,81 Ĺ.
Pe masura ce a pierdut mai multi electroni ionul pozitiv este mai mic si pe masura ce a primit mai multi electroni anionul devine mai mare.
Exemplu: Li+ - 0,60 Ĺ; Be2+ - 0,31 Ĺ; B3+ - 0,20 Ĺ;
N3- - 1,71 Ĺ; O2- - 1,40 Ĺ; F- -1,36 Ĺ.
În grupa, raza ionica creste de sus în jos.
Exemplu: Li+ - 0,60 Ĺ; K+ - 1,33 Ĺ.
3.2.1.3. Volumul atomic
Este definit prin relatia:
![]()
![]()
![]()
si este o functie periodica de numarul atomic.
Variatia densitatii elementelor chimice cu numarul de ordine este prezentata în figura 7.
Volumul atomic molar al unui element este definit ca raportul dintre masa molara medie a elementului si densitatea extrapolata la 0 K; la metalele alcaline (grupa I principala) se înregistreaza valorile cele mai mari, la elementele din grupele secundare, se înregistreaza în general, valori scazute.
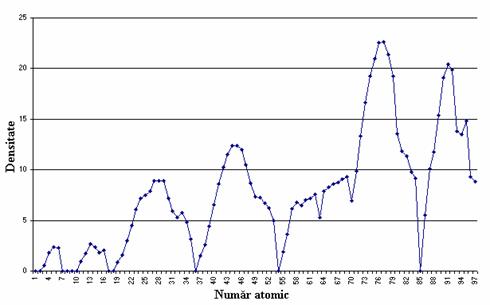 Figura 7. Variatia
densitatii elementelor cu numarul atomic
Figura 7. Variatia
densitatii elementelor cu numarul atomic
3.2.1.4. Energia de ionizare (I)
Este energia pe care trebuie sa o dam unui atom izolat si aflat în stare fundamentala, pentru a pierde un electron. Se mai numeste potential de ionizare. Energia de ionizare se exprima de obicei în eV.
Variatia energie de ionizare cu numarul atomic este prezentata în figura 8.
Cele mai mici energii de ionizare le au metalele alcaline, deoarece ele pot pierde cel mai usor electronul de pe ultimul strat.
De asemenea se constata ca o tendinta generala, o crestere a energiei de ionizare paralele cu cresterea lui Z pentru elementele din aceeasi perioada. Aceasta se explica prin cresterea puterii de atractie a electronilor de catre nucleu.
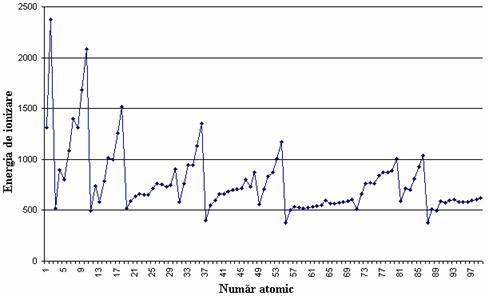
Figura 8. Variatia energiei de ionizare cu numarul atomic
Asa cum se poate elimina primul electron dintr-un atom, se poate elimina si al doilea, al treilea etc. Potentialul de ionizare (energia de ionizare) necesar creste foarte mult. Se constata ca unii electroni se elimina mai usor din atom decât altii; numarul acestora este egal cu numarul grupei si se numesc electroni de valenta.
|
Elementul |
Potential de ionizare la eliminarea: |
|
|
Primului electron (P1) |
Celui de-al doilea electron (P2) |
|
|
Be | ||
|
Sr | ||
|
Li | ||
|
Rb | ||
3.2.1.5. Afinitatea pentru electroni
Este energia pe care o elibereaza un atom izolat si în stare fundamentala când fixeaza un electron în plus.
|
Element |
Afinitate pentru e- [eV] |
Element |
Afinitate pentru e- [eV] |
|
F |
Li | ||
|
Cl |
Be | ||
|
Br |
B | ||
|
I |
C | ||
|
Hidrogen |
N | ||
|
Na |
O | ||
|
Mg |
Si | ||
|
Al |
S |
Faptul ca atomul neutru poate sa accepte electroni, arata ca nucleul nu are câmpul electric complet saturat si tinde spre o saturare formând ioni negativi prin acceptare de electroni. Stabilitatea ionului negativ astfel format este mult mai mare decât a atomului neutru. Asa se explica de ce ionul F- este mai stabil decât atomul de F.
3.2.1.6. Punctele de topire si de fierbere
Desfacerea retelei cristaline prin topire, depinde de fortele de legatura dintre particulele constituente. Acest forte depind de caracteristicile particulelor (volum, sarcina electrica, învelis electronic, etc.).
Elementele cu volum mic si valenta mare formeaza cristale în care fortele de legatura sunt foarte mari si deci si temperaturile de topire sunt mari.
Exemplu: C si Si.
Elementele cu volum atomic mare interactioneaza mai slab si elementele respective au puncte de topire mai scazute.
Punctele de topire variaza în functie de numarul atomic. În grupele principale I-IV, temperatura de topire scade cu cresterea numarului de ordine Z. În grupele principale V-VII, temperatura de topire creste cu cresterea lui Z.
În perioada temperatura de topire a elementelor creste pâna la grupa a IV-a A, apoi scade.
În acelasi mod variaza si temperatura de fierbere.
Variatia temperaturii de fierbere cu numarul atomic este prezentata în figura 9.
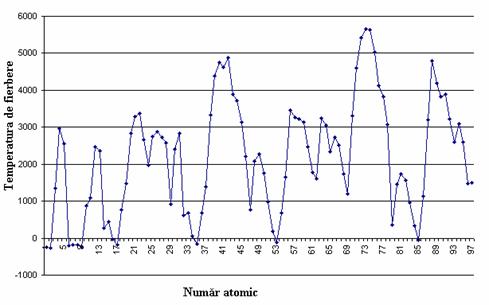
Figura 9. Variatia temperaturii de fierbere cu numarul atomic
Variatia temperaturii de topire cu numarul atomic este redata în figura 10.
3.2.2. Proprietati chimice periodice
3.2.2.1. Starea de oxidare
Se mai numeste numar de oxidare sau treapta de oxidare si este o sarcina electrica formala, pozitiva sau negativa ce se atribuie unui element în combinatiile sale. Astfel starile de oxidare ale elementelor din perioada a treia sunt:
|
Na2O |
MgO |
Al2O3 |
SiO2 |
P2O5 |
SO3 |
Cl2O7 |
|
|
Starea de oxidare |
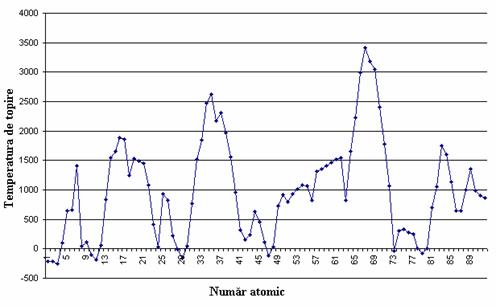
Figura 10. Variatia temperaturii de topire cu numarul atomic
Se atribuie sarcina pozitiva sau negativa în functie de caracterul electropozitiv sau electronegativ a partenerului.
Exemplu:
- în SO2 si SO3, starea de oxidare a sulfului este 4+, respectiv 6+, deoarece oxigenul este mai electronegativ decât sulful;
- în H2S si Na2S, starea de oxidare a sulfului este 2-, deoarece sulful este mai electronegativ decât hidrogenul si sodiul.
Ca regula se poate spune ca în cominatiile cu elemente mai electronegative decât ele, starile de oxidare maxime ale elementelor sunt pozitive si egale cu numarul grupei principale din sistemul periodic; în combinatiile lor cu elemente mai electropozitive decât ele, starile de oxidare sunt negative si egale cu 8 minus numarul grupei principale în care se gaseste elementul.
Valenta elementelor într-o perioada creste de la stânga la dreapta de la 1 la 4 si apoi scade din nou la 1.
|
LiH |
BeH2 |
BH3 |
NH3 |
H2O |
HF |
|
|
Starea de oxidare |
Aceasta se explica prin faptul ca starea de oxidare a hidrogenului în primele trei hidruri este 1- si 1+ în ultimele trei hidruri.
La stabilirea numarului de oxidare se tine seama de urmatoarele:
- substantele elementare au starea de oxidare 0;
- numarul de oxidare al unui ion monoatomic dintr-o substanta preponderent ionica este egal cu sarcina lui electrica;
- numarul de oxidare al unui element dintr-o combinatie preponderent covalenta este egal cu sarcina electrica pe care ar avea-o daca electronii de legatura se atribuie elementului cu electronegativitate mai mare;
- atomul de fluor este cel mai electronegativ element si are în combinatii numarul de oxidare 1-;
- atomul de oxigen urmeaza dupa fluor în scara electronegativitatii si are în cominatii numarul de oxidare 2- (exceptie F2O, unde numarul de oxidare este 2+ si H2O2 unde starea de oxidare este 1-);
- hidrogenul are în hidrurile ionice numarul de oxidare 1- si în hidrurile covalente 1+;
- numarul de oxidare maxim pozitiv al unui element este dat de numarul grupei din care face parte elementul;
- elementele grupei a IV-a A pot avea numarul de oxidare 4+ sau 4- în functie de electronegativitatea lor.
Unele exceptii fata de regulile enuntate ar fi urmatoarele:
- la gazele nobile, numarul de oxidare egal cu numarul grupei (VIII) este semnalat numai la Xe, celelalte sunt nereactive sau au numere de oxidare inferioare;
- la grupa VII A, nu toate elementele ating numarul maxim de oxidare (F are numai 1- si bromul maxim 5+);
- la grupa a VI-a A, oxigenul are numarul de oxidare 2+ fata de fluor, 1- în apa oxigenata si 2- în ceilalti compusi;
- la grupa IB, elementele au si numere de oxidare mai mari decât numarul grupei (Cu are si 2+, Au are si 3+);
- în general se constata ca pentru acelasi element numerele de oxidare pozitive pot lua mai multe valori, iar numarul de oxidare negativ numai o valoare;
- cu cât un element are numarul de oxidare mai mare, cu atât are un caracter electronegativ si oxidant mai pronuntat.
Starea de oxidare (numarul de oxidare) înlocuieste notiunea mai veche de valenta, fiind mai precis definita.
Valenta unui element este capacitatea sa de combinare cu alt element (H, O sau F) care are valenta cunoscuta. Definitia data pentru notiunea de valenta este imprecisa si nu tine seama de tipul si numarul legaturilor pe care le formeaza atomul cu alti atomi.
3.2.2.2. Electronegativitatea si electropozitivitatea
Dupa cum se stie, fiecare perioada a sistemului periodic se termina cu un gaz nobil. Aceste elemente se caracterizeaza printr-o mare inertie chimica, explicata printr-o structura electronica stabila. Dupa gazele nobile urmeaza metalele alcaline din grupa IA (1) care se caracterizeaza prin usurinta de a ceda electronul s, transformându-se într-un ion pozitiv. Gazele nobile sunt precedate de halogenii din grupa a VII-a A (17) care se caracterizeaza prin tendinta de a accepta un electron, transformându-se într-un ion negativ.
Elementele care prezinta o tendinta accentuata de a primi electroni se numesc electronegative iar cele care pierd electroni periferici cu usurinta, electropozitive.
Caracterul electronegativ creste de la stânga la dreapta în perioada iar caracterul electropozitiv, invers.
În grupe, se constata o scadere a caracterului electronegativ de sus în jos. Aceasta înseamna ca cele mai electronegative elemente se gasesc în partea dreapta sus a sistemului periodic, iar cele mai electropozitive elemente în partea stânga jos.
În grupele din mijlocul sistemului periodic se gasesc elemente care nu au un caracter electropozitiv sau electronegativ pronuntat, ele sunt practic electroneutre.
Cunoscându-se energia de ionizare I si afinitatea pentru electroni A, se pot da valori comparative ale electronegativitatii.
Pentru aceasta, consideram ca se apropie doi atomi A si B care vor putea forma, sau nu, între ei legaturi chimice.
Este posibil sa se formeze perechea A+B-. Energia necesara formarii acestei perechi este data de suma dintre energia de ionizare a atomului A (IA) si afinitatea pentru electroni a atomului B (AB): IA+AB.
Daca se formeaza perechea B+A-, energia necesara este data de: IB+AA.
Daca energia formarii perechii A+B- este aceeasi cu energia formarii perechii B+A- ,
![]() , si atomii sunt la fel de electronegativi.
, si atomii sunt la fel de electronegativi.
Daca atomul A este mai electronegativ decât B, între cele doua energii necesare formarii celor doua combinatii, exista relatia:
![]() sau
sau ![]() .
.
Aceasta înseamna ca smulgerea electronului de la atomul A si alipirea lui la B se poate realiza mai greu decât procesul invers se trecere de la B la A.
Una din metodele de exprimare a electronegativitatii, pentru a înlesni caracterizarea comparativa a comportarii atomilor, este electronegativitatea relativa dupa Pauling. Aceasta se raporteaza la atomul de litiu ca referinta:
![]() .
.
Alta
metoda de a calcula electronegativitatea diferitelor elemente, este cea
propusa de Mulliken, care porneste de la premiza ca
electronegativitatea este proportionala cu ![]() , în eV.
, în eV.
3.2.2.3. Caracterul acido-bazic
Exista un paralelism între electronegativitate si caracterul acid sau bazic al elementelor. Elementele electropozitive (sau cu electronegativitate redusa) formeaza oxizi cu caracter bazic iar elementele electronegative (sau cu electronegativitate mare) formeaza oxizi cu caracter acid.
Caracterul acid creste în grupa de jos în sus iar în perioada de la stânga la dreapta. Cel mai puternic caracter acid se întâlneste la elementele situate în coltul din dreapta sus a sistemului periodic.
Caracterul bazic creste în perioada de la dreapta la stânga iar în grupa de sus în jos. Elementele cu caracterul bazic cel mai pronuntat sunt situate în coltul din stânga jos al sistemului periodic.
Elementele din grupele secundare nu se supun regulilor de mai sus. Majoritatea elementelor din grupele secundare apar în mai multe stari de oxidare. Starile de oxidare inferioare corespund unui caracter bazic iar cele superioare corespund unui caracter acid.
3.3. Importanta sistemului periodic
Sistemul periodic a fost confirmat de un numar mare de fapte experimentale, fiind în strânsa corelare cu teoria electronica a atomului, care a evidentiat sensul profund al periodicitatii si genialitatea lui D.I. Mendeleev.
Importanta deosebita didactica si stiintifica consta în faptul ca:
este un pretios instrument de cunoastere, cercetare si prevedere a
proprietatilor,
sta la baza studiului chimiei elementelor si compusilor,
este una din cele mai cuprinzatoare realizari ale stiintelor naturii.
Legea periodicitatii si sistemul periodic au stimulat gândirea stiintifica în domeniul chimiei si fizicii si au constituit un cadru potrivit pentru interpretarea rezultatelor experimentale din fizica atomului. Numarul de 109 elemente în sistemul periodic nu este limitat, fiind posibil ca prin tehnicile de sinteza nucleara cunoscute sa se obtina elemente cu Z>109. Desi pe masura cresterii numarului de particule din nucleu scade energia de legatura, nu este exclusa posibilitatea descoperirii unor elemente supergrele, stabile. De altfel, oamenii de stiinta sunt preocupati pe de o parte de folosirea unor metode de calcul adecvate pentru prevederea proprietatilor fizice si chimice ale elementelor supergrele nedescoperite înca, iar pe de alta parte de a gasi noi metode de cercetare pentru stabilirea proprietatilor izotopilor cu viata foarte scurta.
Numirile acestea arbitrare au origine istorica. În locul acestui nume, unii autori utilizeaza pe acela de "elemente principale" sau "elemente reprezentative". Elementele tranzitionale sunt uneori numite "elemente tranzitionale d", spre deosebire de lantanide sau actinide care sunt numite "elemente tranzitionale f".
|