ALTE DOCUMENTE |
SPECTROSCOPIE UV-Viz
Spectroscopia in domeniul Ultraviolet si Vizibil (UV-Viz) este o metoda de analiza aplicabila compusilor organici in a caror structura exista legaturi multiple in conjugare (compusi nesaturati si aromatici). Desi aceasta metoda poate fi aplicata unui tip relativ restrans de compusi organici, totusi ea prezinta avantajul selectivitatii absorbtiei radiatiei UV-Viz de catre sistemele polienice, fapt care permite identificarea cu usurinta a prezentei acestor sisteme in structuri moleculare complexe. De exemplu, urmarind modificarile care apar in spectrul UV-VIS pot fi diferentiate: structuri dienice conjugate de cele neconjugate, structuri dienice conjugate de cele polienice conjugate, structuri de izomeri geometrici Z E, sau poate fi identificata aparitia unor efecte sterice care afecteaza geometria moleculelor si altereaza conjugarea extinsa.
In spectrul radiatiei electromagnetice, domeniul UV se situeaza intre regiunea de raze X si regiunea vizibil, cuprinzand lungimi de unda situate in intervalul 10-400 nm. Subdivizarea domeniului UV pe trei regiuni UV-A (400-320 nm), UV-B (320-280 nm) si UV-C sau indepartat (280-10 nm) a fost facuta tinand cont de efectele biologice ale acestor radiatii asupra organismelor vii. Radiatia electromagnetica folosita in analiza compusilor organici prin aceasta metoda, se situeaza in domeniul UV apropiat (caracterizata prin lungimi de unda cuprinse in domeniul 200-400 nm), sau in domeniul vizibil (caracterizata de lungimi de unda cuprinse in domeniul 400-800 nm).
Spectrul UV-Viz este o reprezentare grafica a intensitatii absorbtiei in functie de lungimea de unda a radiatiei electromagnetice cu care se iradiaza proba continand compusul organic studiat.
2.1. PRINCIPII SI REGULI DE SELECTIE
Nivelele energetice ale starilor electronice ale moleculelor organice se situeaza la diferente energetice care corespund ordinului de marime al energiei transportate de radiatia UV sau vizibila. In conditii de rezonanta, moleculele pot absorbi o cantitate cuantificata de energie transportata de radiatia electromagnetica, efectul constand in promovarea electronilor din orbitali moleculari de energie joasa (stare fundamentala) in orbitali moleculari de energie mai inalta (stare excitata). Din acest motiv, spectroscopia UV-Viz a fost denumita si spectroscopie electronica.
Spre deosebire de starile energetice ale electronilor din invelisul electronic al unui atom, diferitele stari energetice ale unei molecule se situeaza pe domenii mult mai largi datorita aditivitatii nivelelor energetice corespunzatoare starilor electronice cu nivele energetice de vibratie ale legaturilor si nivele energetice de rotatie ale atomilor. Astfel, un nivel energetic determinat al unei molecule (Etotal) corespunde sumei dintre: energia starii electronice, energia de vibratie a legaturilor si energia de rotatie a atomilor, prima dintre acestea fiind caracterizata de valorile cele mai mari.
Etotal= Eelectroni+ Evibratie + Erotatie
Gruparea functionala din molecula compusului organic, care participa la tranzitiile electronice responsabile pentru absorbtia radiatiei UV-Viz se numeste cromofor (termenul deriva de la cuvantul grecesc chromophorus=purtator de culoare). Intr-o prima aproximatie se poate presupune ca prin absorbtia radiatiei UV-Viz un singur electron din molecula compusului organic efectueaza tranzitia de la o stare de energie joasa spre o stare de energie mai inalta, ceilalti electroni ramanand neafectati. Conditia de rezonanta dintre energia absorbita in decursul unei tranzitii electronice si lungimea de unda a radiatiei din domeniul UV-Viz care produce aceasta tranzitie este:
Unde: ΔE=energia absorbita in tranzitia electronica
h=constanta lui Planck
c=viteza luminii
λ=lungimea de unda a radiatiei UV-Viz
Deoarece tranzitia electronica este rapida, iar starea excitata are un timp de viata foarte scurt (10-6-10-9 s), conform principiului Franck-Condon se considera ca molecula va avea in timpul absorbtiei radiatiei aceeasi configuratie (distante internucleare nemodificate) si aceeasi energie cinetica de vibratie, atat in starea fundamentala cat si in starea excitata. In figura 2.1a sunt redate curbele Morse (reprezentari grafice ale energiei potentiale in functie de distanta interatomica) pentru doua stari electronice ale unei molecule biatomice; in aceasta diagrama a starilor electronice, tranzitiile electronice posibile sunt reprezentate prin linii verticale. In timpul tranzitiei electronice nu actioneaza nici o regula de selectie generala restrictiva privind modificarea starii de vibratie. Tranzitiile electronice pot avea loc intre starea vibrationala fundamentala (v=0) a starii electronice fundamentale si diferite stari de vibratie excitate (v'=1, v'=2, etc) ale unei anumite stari electronice excitate. Aceste tranzitii pot conduce la o structura fina de vibratie a benzii electronice de absorbtie (figura 2.1b). In cazul tranzitiilor electronice care se petrec intre orbitali moleculari de legatura si orbitali moleculari de antilegatura, curba energiei potentiale pentru starea fundamentala este diferita de cea a starii excitate datorita unei densitati electronice de legatura mai scazute in starea excitata. Ca rezultat, distanta de echilibru internucleara va fi mai mare, iar curba energiei potentiale va fi mai larga pentru starea excitata. Datorita acestei deplasari a curbei energiei potentiale a starii excitate, tranzitiile electronice vor avea loc spre stari de vibratie caracterizate de numere cuantice mai mari ale starii electronice excitate.
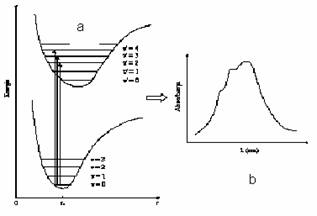
Fig. 2.1. a) Curbele Morse E potentiala=f(r) unde r=distanta interatomica, pentru doua stari electronice ale unei molecule diatomice si tranzitii electronice 2←0, 3←0, 4←0
b) alura benzii de absorbtie rezultate prin suprapunere
In cazul spectrelor moleculelor poliatomice inregistrate in solutie, nivelele energetice de vibratie sunt foarte apropiate intre ele astfel incat banda de absorbtie reprezinta doar conturul determinat de suprapunerea tranzitiei electronice peste o structura fina determinata de stari energetice de vibratie si rotatie. Benzi de absorbtie cu o structura fina de vibratie sunt previzibile doar pentru molecule cu structuri rigide. In general, benzile de absorbtie UV-Viz au aspectul unor benzi largi, adesea influentat de conditiile de inregistrare (solvent, temperatura).
Probabilitatea ca o tranzitie intre doua nivele electronice sa duca la absorbtia radiatiei UV-Viz este dependenta de modificarile de moment de dipol in timpul tranzitiei. Se poate discuta astfel despre: tranzitii permise (tranzitii care se petrec cu probabilitate mare, producand in spectrul UV-Viz benzi intense) si tranzitii interzise (tranzitii care se petrec cu probabilitate mica producand in spectrul UV-Viz benzi de intensitate redusa). Tinand cont de principiul conservarii momentului dipolar, au fost stabilite urmatoarele reguli de selectie pentru tranzitiile electronice permise intre doua nivele electronice diferite:
a) Regula excluziunii de spin arata ca spinul global (multiplicitatea sistemului electronic M=2S+1) nu se modifica in timpul tranzitiei electronice. Astfel, dintr-o stare fundamentala singlet (continand electroni cu spin opus) se poate trece prin absorbtie de radiatie intr-o stare excitata tot de tip singlet si nu intr-o stare de tip triplet (continand electroni cu spin paralel); cu alte cuvinte, in decursul tranzitiei electronice nu are loc inversarea spinului electronului.
b) Principiul antisimetrizarii tine cont de faptul ca modificarea momentului dipolar in decursul tranzitiei (momentul tranzitiei) poate fi nula datorita simetriei orbitalilor in care se situeaza electronii in decursul tranzitiei. Astfel, pentru molecule cu simetrie centrala principiul antisimetrizarii arata ca tranzitiile electronice intre orbitali de aceeasi paritate sunt interzise (legea Laporte); tranzitia electronica poate avea loc intre stari avand simetrii diferite la aplicarea operatiei de inversie. In moleculele cu simetrie joasa, sau datorita miscarilor de vibratie ale nucleelor din structura moleculei, simetria poate fi redusa si in consecinta tranzitii electronice interzise prin simetrie devin observabile in spectrul UV-Viz.
c) Legea suprapunerii orbitalilor indica o alta posibilitate de anulare a momentului tranzitiei electronice, atunci cand orbitalii participanti se suprapun foarte putin (sau deloc) in spatiu. De exemplu, in cazul tranzitiilor electronice intermoleculare de transfer de sarcina de la o molecula electrono-donoare spre o molecula electrono-acceptoare sau intramoleculare din orbitali neparticipanti la legaturi spre orbitali moleculari.
Tranzitii electronice interzise prin aceste reguli de selectie se petrec totusi adesea, insa benzile de absorbtie determinate au intensitati slabe.
Revenirea moleculei din starea excitata la starea fundamentala se poate face prin cedarea energiei absorbite moleculelor invecinate sub forma de caldura (interconversie interna), sau in unele cazuri prin procese de emisie de radiatie electromagnetica (in fenomenele de fluorescenta si fosforescenta). Excesul de energie de care dispune molecula in starea excitata poate determina pe de alta parte si procese de disociere sau ionizare, figura 2.2.

Fig. 2.2. Procese de relaxare din starea electronica excitata in starea fundamentala prin conversie interna sau fluorescenta.
Cu ajutorul tehnicilor laser pot fi create densitati fotonice mari, astfel incat devine posibila absorbtia simultana a doi fotoni de catre o molecula (spectroscopie bifotonica). In acest caz regulile de selectie sunt modificate. Aceasta metoda poate furniza informatii complementare de mare valoare
pentru studiul moleculelor in stare electronica excitata si al gradului de polarizare al moleculelor in solutie.
2.2 TIPURI DE TRANZITII ELECTRONICE
Tranzitiile electronice in domeniul UV-Viz constau in excitarea unui electron de valenta situat intr-un orbital molecular (OM) de legatura σ sau π, sau intr-un orbital de nelegatura n, spre un OM de antilegatura σ* sau π*.
In cazul spectrelor UV-Viz ale compusilor organici cu structura complexa, cea mai probabila este tranzitia notata π→π* care determina promovarea unui electron din orbitalul molecular ocupat de energia cea mai inalta HOMO (Highest Occupied Molecular Orbital) in orbitalul molecular vacant cu energia cea mai joasa LUMO (Lowest Unoccupied Molecular Orbital). Totusi, in multe cazuri pot fi observate si alte tranzitii din OM ocupati in OM liberi, cu conditia sa fie indeplinite regulile de selectie. Tranzitiile electronice care pot avea loc intre orbitalii moleculari ai moleculelor organice pot fi reprezentate astfel:
-tranzitii , conform carora un electron poate fi promovat dintr-un OM de legatura σ in cel de antilegatura σ*. Datorita valorilor mari corespunzatoare diferentei dintre nivelele energetice ale OM de legatura σ si OM de antilegatura σ* (aprox. 185 kcal/mol), producerea acestor tranzitii necesita radiatii UV cu lungimi de unda scurte (λ≈150 nm). Benzile de absorbtie corespunzatoare tranzitiilor σ→σ* se situeaza in afara domeniului uzual de masura. Astfel de tranzitii electronice se produc in cazul moleculelor alcanilor, care din acest motiv pot fi folositi drept solventi "transparenti" pentru inregistrarea spectrelor UV-Viz.
-tranzitii n in care un electron provenind dintr-o pereche de electroni neparticipanti la legaturi (n) ai unui heteroatom, poate fi promovat dintr-un orbital atomic intr-un orbital molecular de antilegatura σ*. Sunt tranzitii permise de regulile de selectie si conduc la inregistrarea unor benzi intense in spectrul UV, situate la valori mici ale lungimii de unda (λmax≈150-250 nm). Compusii organici care duc la inregistrarea acestui tip de benzi de absorbtie sunt compusi saturati continand grupari functionale formate din atomi ce prezinta perechi de electroni neparticipanti la legaturi (derivati halogenati, alcooli, eteri, amine, tioli). Acesti compusi sunt adesea folositi drept solventi la inregistrarea spectrelor UV-Viz ale unor molecule cu absorbtii intense situate la lungimi de unda mai mari.
-tranzitii in decursul carora un electron poate fi promovat dintr-un orbital molecular de legatura π in cel de antilegatura π*. Aceste tranzitii apar la lungimi de unda situate in domeniul de masura uzual (UV apropiat si vizibil) si sunt cele mai mult studiate din punct de vedere experimental. Benzile corespunzatoare tranzitiilor π→π* au intensitatile cele mai mari din spectrele UV-Viz. Ele apar in compusii organici in care exista grupari nesaturate cum ar fi: alchene, alchine, aldehide si cetone, acizi carboxilici, amide, nitroderivati, azoderivati etc.
-tranzitii n in care un electron provenind dintr-o pereche de electroni neparticipanti la legaturi (n) ai unui heteroatom, poate fi promovat dintr-un orbital atomic intr-un orbital molecular de antilegatura π*. Aceste tranzitii sunt "interzise" din punct de vedere al regulilor de selectie (din considerente de simetrie) astfel incat probabilitatea producerii lor este destul de mica, iar intensitatea benzilor corespunzatoare din spectrele UV-Viz este destul de scazuta.
In figura 2.3 sunt redate schematic tranzitiile electronice posibile intre orbitali moleculari ai formaldehidei. Prin absorbtia radiatiei electromagnetice din domeniul UV, pot aparea urmatoarele tranzitii electronice din starea fundamentala S0 in starea excitata S1:
-un electron poate fi promovat dintr-un orbital molecular de legatura σ in cel de antilegatura σ* (tranzitie σ→σ*)
-un electron poate fi promovat dintr-un orbital molecular de legatura π in cel de antilegatura π * (tranzitie π→π*)
-un electron din cele doua perechi de electroni neparticipanti la legaturi ai atomului de oxigen (n) poate fi promovat dintr-un orbital atomic intr-un orbital molecular de antilegatura π* (tranzitie n→π*).
-un electron din cele doua perechi de electroni neparticipanti la legaturi ai atomului de oxigen (n) poate fi promovat dintr-un orbital atomic intr-un orbital molecular de antilegatura σ* (tranzitie n→ σ*).
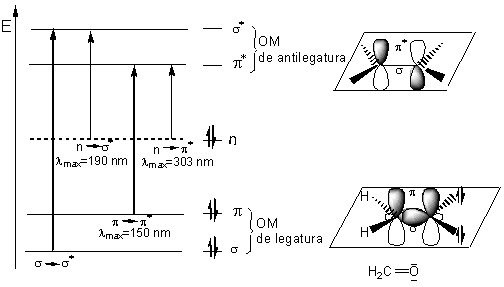
Fig. 2.3. Tranzitii electronice S0→S1 in molecula de formaldehida
FACTORI STRUCTURALI CARE DETERMINA POZITIA BENZILOR DE ABSORBTIE UV-Viz.
Pozitia in spectrul UV-Viz la care se situeaza o anumita banda de absorbtie este dependenta de o serie de factori care influenteaza nivele energiilor relative ale orbitalilor moleculari: efecte de conjugare ale legaturilor π, natura substituentilor la sistemul cromofor, natura solventului folosit la inregistrarea spectrului de absorbtie.
EFECTUL CONJUGARII LEGATURILOR π
In structura cromoforului etilenic (H2C=CH2) exista un singur OM de legatura π si un singur OM de antilegatura π*; tranzitia π→π* intre acesti doi OM duce la aparitia unei benzi de absorbtie intense situate la λmax≈165 nm.
Starea electronica a unor molecule continand sisteme polienice conjugate poate fi descrisa conform metodei orbitalilor moleculari (R. S. Mulliken si E. Hückel) printr-un calcul aproximativ care ia in considerare numai orbitalii atomici p (nehibridizati) de la fiecare atom de carbon hibridizat sp2 din sistemul conjugat. Prin combinarea liniara a acestor orbitali atomici (metoda LCAO -Linear Combination of Atomic Orbitals-) rezulta un numar de OM egal cu cel al orbitalilor atomici din sistemul conjugat. Energia acestor orbitali moleculari are valori crescatoare, cea mai joasa valoare corespunzand unui OM extins, de legatura intre toti atomii de carbon sp2 ai sistemului conjugat. Astfel, in timp ce etena prezinta doi OM de tip π, dienele conjugate prezinta 4 OM de tip π (doi de legatura si doi de antilegatura), trienele conjugate prezinta 6 OM de tip π (trei de legatura si trei de antilegatura) s.a.m.d, numarul total al orbitalilor moleculari in polienele conjugate respectand principiul conservarii numarului orbitalilor atomici. Aparitia orbitalilor moleculari de tip π suplimentari, determina scaderea diferentei energetice intre orbitalii de frontiera HOMO si LUMO intre care are loc tranzitia π→π* si in consecinta deplasarea spre valori mai mari ale lungimilor de unda la care se situeaza benzile de absorbtie din spectrul UV-Viz. Fiecare legatura dubla care extinde conjugarea produce o deplasare a pozitiei maximului de absorbtie spre valori mai mari ale lungimii de unda (efect batocrom) cu aprox. 30 nm. In figura 2.4 sunt prezentate nivelele energetice electronice ale unor sisteme polienice si tranzitiile π→π* care determina aparitia benzilor de absorbtie UV-Viz.
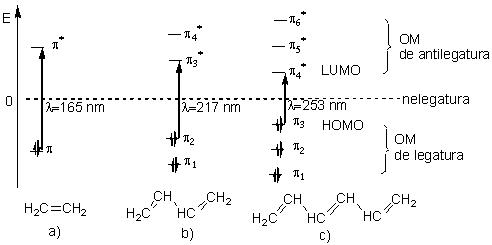
Fig. 2.4. Nivele energetice electronice ale unor sisteme polienice si tranzitiile π→π* care determina aparitia benzilor de absorbtie UV-Viz.
a) etena, b) 1,3-butadiena, c) 1,3,5-hexatriena
In compusii carbonilici α,β-nesaturati (enone) datorita conjugarii electronilor π din legatura dubla omogena (>C=C<) cu cei ai legaturii duble heterogene (>C=O) pot fi descrisi conform teoriei mecanic cuantice patru OM de energii diferite (figura 2.5). Spectrele UV ale enonelor sunt caracterizate de aparitia unei benzi intense situata la λmax=215-250 nm datorata tranzitiei permise π→π* insotite de o banda de absorbtie slaba situata la λmax=310-330 nm datorata tranzitiei interzise n→π*.
Spre deosebire 1,3,5-hexatriena, sistemul π aromatic din structura benzenului produce in spectrul UV-Viz trei benzi de absorbtie de intensitati diferite: o banda larga de absorbtie intensa situata la λmax=184 nm si doua benzi de absorbtie de intensitate slaba situate la λmax=203 nm si respectiv λmax=256 nm cu o structuri fine datorate suprapunerii tranzitiilor electronice peste absorbtii datorate sub-nivelelor de vibratie ale nivelelor electronice.

Fig. 2.5. Nivele energetice electronice ale enonelor si tranzitiile care determina aparitia benzilor de absorbtie UV-Viz a) formaldehda, b) 2-butenal
Tabelul 2.1 prezinta notatiile utilizate in literatura pentru desemnarea acestor benzi si tipul tranzitiilor electronice aferente. Conform teoriei OM in structura benzenului exista trei OM de tip π de legatura ocupati cu cei 6 electroni ai sextetului aromatic si trei OM de tip π de antilegatura vacanti.
In figura 2.6 este prezentata diagrama care reda distributia energetica a OM de tip π ai benzenului si tranzitiile electronice posibile intre cele doua perechi de orbitali moleculari de frontiera de aceeasi energie (degenerati) π2/π3 si respectiv π4*/π5*. Cele 4 tranzitii electronice π2,3→π*4,5 care pot avea loc conduc din starea fundamentala 1A1g in starile excitate singlet: 1B2u, 1B1u si 1E1u (doua stari degenerate) prin absorbtia unor cuante de radiatie electromagnetica de energii diferite.
Banda β corespunde unor tranzitii permise de regulile de selectie, in timp ce celelalte doua benzi corespund unor tranzitii interzise prin simetrie si care devin observabile datorita modificarilor de simetrie impuse de miscarile de vibratie (aceste benzi prezinta o structura fina observabila mai ales la inregistrarea spectrului in faza de vapori).
Tabel 2.1. Benzi de absorbtie UV-Viz ale benzenului
|
λmax |
184 nm (εmax=60.000) |
203 nm (εmax=7400) |
256 nm (εmax=204) |
ClarDenumire Braude |
p | ||
|
E1 |
E2 |
B |
|
Platt*Tranzitii electronice Teoria grupurilor** |
B←1A |
La←1A |
Lb←1A |
|
E1u←1A1g |
B1u←1A1g |
B2u←1A1g |
simbolizarea starii electronice : A stare fundamentala, B stare excitata
Simbolizarea claselor de simetrie din teoria gruprilor:
-rotatie in jurul axei Cn de ordin maxim: A simetric, B antisimetric
E stare dublu degenerata, T stare triplu degenerata.
Indici:
-inversie: g simetric, u antisimetric
-axe C2 perpendiculare pe Cn:1 simetric, 2 antisimetric
-plan de simetrie σn (perpendicular pe Cn): ' simetric, " antisimetric

Fig. 2.6. a) Diagrama energetica a OM de tip π ai benzenului b) tranzitii electronice din starea fundamentala in stari excitate.
In spectrele UV-Viz ale hidrocarburilor aromatice policiclice cu nuclee condensate se inregistreaza acelasi tip de benzi de absorbtie ca si in cazul benzenului, insa o data cu cresterea numarului de nuclee benzenice condensate liniar pozitia maximelor de absorbtie corespunzatoare celor trei benzi se deplaseaza spre valori mai mari ale lungimilor de unda. Astfel, benzenul, naftalina (2 nuclee benzenice condensate) si antracenul (3 nuclee benzenice condensate liniar) sunt incolore datorita situarii maximelor de absorbtie in domeniul UV, insa tetracenul (4 nuclee benzenice condensate liniar) apare colorat in galben datorita benzii de absorbtie situate la limita inferioara a domeniului vizibil (aprox. 450 nm). O data cu cresterea in continuare a numarului de nuclee benzenice condensate liniar se observa acelasi efect batocrom (pentacenul apare colorat in violet-albastru, hexacenul in verde), care insa nu se manifesta in cazul hidrocarburilor aromatice policiclice cu nuclee condensate angular.
NATURA SUBSTITUENTILOR GREFATI PE SISTEMUL CROMOFOR
Un substituent alchil legat de un atom de carbon cu hibridizare sp2 care face parte dintr-un sistem cromofor format din una sau mai multe legaturi duble omogene sau heterogene in conjugare, deplaseaza pozitia maximului de absorbtie corespunzator tranzitiei π→π* spre lungimi de unda mai mari cu aproximativ 5 nm, datorita unui efect de hiperconjugare.
Atasarea unui substituent format dintr-un heteroatom continand perechi de electroni neparticipanti (halogen, oxigen, azot, sulf) la un atom de carbon cu hibridizare sp2 care face parte dintr-un sistem cromofor etilenic produce o deplasare batocroma a benzii de absorbtie corespunzatoare tranzitiei π→π* explicabila prin efectul electromer +E al heteroatomului care presupune extinderea sistemului conjugat (prin conjugare p-π) si crearea a trei OM (doi de legatura si unul de antilegatura) avand energii cu valori crescatoare. In figura 2.7 sunt prezentate diagramele energetice schematice pentru tranzitiile π→π* in cromoforul etilenic si cromoforul etilenic conjugat cu o grupare functionala cu efect electromer electronodonor. O astfel de grupare functionala este denumita auxocrom.
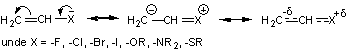
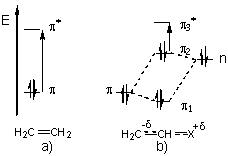
Fig.2. 7. Diagramele energetice ale tranzitiilor π→π* in: a) cromoforul etilenic,
b) cromofor etilenic conjugat cu o grupare auxocroma.
Introducerea unor substituenti pe nucleul benzenic determina reducerea simetriei moleculelor, extinderea sistemului cromofor prin conjugare si modificarea nivelelor energetice ale orbitalilor moleculari. Substituentii alchil interactioneaza cu sistemul cromofor prin hiperconjugare, gruparile auxocrome prin conjugare p-π, iar substituentii care contin legaturi multiple prin conjugare π-π. Benzile de absorbtie ale acestor derivati substituiti ai benzenului se deplaseaza spre valori mai mari ale lungimilor de unda, uneori pozitia benzii p a cromoforului benzenic depasind valoarea corespunzatoare maximului de absorbtie al benzii α. Efectul batocrom este foarte puternic in cazul derivatilor para-disubstituiti ai benzenului in care, intre cele doua grupari functionale se stabileste un efect capto-donor (engl. "push-pull") soldat cu aparitia unui sistem cromofor mai extins si un transfer intramolecular de sarcina. In figura 2.8 sunt prezentate schematic efectele electronice din structura unor derivati mono- si disubstituiti ai benzenului cu grupari auxocrome impreuna cu pozitia maximelor de absorbtie corespunzatoare benzii p a cromoforului benzenic.

Fig. 2.8. Pozitia maximelor de absorbtie corespunzatoare benzii p a cromoforului benzenic din: a) fenol, b) nitrobenzen, c) 4-nitrofenol (in solutie apaosa).
Conditia de coplanaritate a orbitalilor atomici care prin intrepatrundere laterala formeaza orbitali moleculari extinsi, poate fi urmarita prin identificarea pozitiei maximului de absorbtie corespunzator cromoforului conjugat. Efectele sterice ale unor substituenti voluminosi care determina intreruperea conjugarii prin scoaterea orbitalilor atomici din coplanaritate, determina o scadere a valorii la care se situeaza maximul de absorbtie al cromoforului (efect hipsocrom). Astfel, substituenti voluminosi situati in pozitia orto a nucleului benzenic disubstituit pot determina inregistrarea maximului de absorbtie la valori mai mici comparativ cu derivatii para-disubstituiti. In cazul izomerilor geometrici cis si trans ai alchenelor si ai polienelor, izomerul trans prezinta benzi de absorbtie situate la valori usor mai ridicate ale λmax comparativ cu izomerul cis in structura caruia efectele sterice pot afecta conjugarea din sistemul cromofor.
2.3.3. EFECTUL SOLVENTULUI FOLOSIT LA INREGISTRAREA SPECTRULUI UV-Viz
Spectrele electronice se inregistreaza in solutii foarte diluate (10-3-10-4 M) si de aceea solventul folosit trebuie sa fie transparent pe domeniul spectral analizat. Un solvent poate fi utilizat la inregistrarea spectrului UV-Viz pe domenii cuprinzand lungimi de unda mai mari decat cele la care apar absorbtii proprii cromoforului din structura sa. Daca solventul si substanta de analizat prezinta benzi de absorbtie in regiuni apropiate, absorbtiile proprii cromoforului din structura solventului devin excesive acoperind benzile caracteristice ale compusului studiat. Lungimile de unda limita pentru cei mai utilizati solventi in spectroscopia UV-Viz sunt prezentate in tabelul 2.2.
Tabel 2.2. Lungimi de unda limita ale celor mai uzuali solventi folositi in spectroscopia UV-Viz.
|
Solvent |
λlim [nm] |
|
Apa | |
|
Etanol | |
|
Hexan | |
|
Ciclohexan | |
|
Metanol | |
|
Dietil eter | |
|
Acetonitril | |
|
Tetrahidrofuran | |
|
Diclorometan | |
|
Cloroform | |
|
Tetraclorura de carbon | |
|
Benzen |
Energiile tranzitiilor electronice si implicit pozitiile benzilor in spectrele UV-Viz sunt influentate de natura solventului in care este dizolvat compusul organic analizat si de aceea compararea spectrelor inregistrate pentru compusi diferiti poate fi facuta numai in acelasi solvent.
Polaritatea solventului produce o mica deplasare a benzilor de absorbtie caracteristice sistemului cromofor din diene, poliene conjugate si ale hidrocarburi aromatice.
Pentru compusii carbonili α,β-nesaturati, se observa fenomenul de solvatocromie, constand in deplasarea benzilor de absorbtie datorate tranzitiilor π→π* spre valori mai mari ale lungimilor de unda (deplasare spre rosu) in timp ce benzile de absorbtie datorate tranzitiilor n→π* se deplaseaza spre lungimi de unda mai mici (deplasare spre albastru). Aceasta comportare este explicata prin figura 2.9. Un solvent polar stabilizeaza diferit orbitalii moleculari n, π si π*. Stabilizarea orbitalilor de nelegatura este in particular accentuata de utilizarea unor solventi care au tendinta de a forma legaturi de hidrogen puternice (de exemplu apa sau etanolul).

Fig. 2.9. Tranzitii electronice π→π* si n→π* din structura compusilor carbonilici in prezenta solventilor de polaritati diferite
Orbitalii moleculari π* (stari de polaritate mai ridicata) sunt mai puternic stabilizati prin solvatare de catre un solvent polar decat orbitalii π. Astfel, in urma solvatarii compusilor carbonilici energia tranzitiei permise π→π* scade (deplasare batocroma a benzii de absorbtie) pe cand cea a tranzitiei n→π* creste (deplasare hipsocroma a benzii de absorbtie). Valorile λmax ale compusilor carbonilici nesaturati inregistrate in diferiti solventi pot fi corectate in mod conventional prin insumarea unor constante.
2.4. SPECTROMETRUL UV-VIZ.
Spectrele electronice se obtin cu ajutorul aparatelor numite spectrometre UV-Viz. O schema de principiu a unui astfel de spectrometru este reprezentata in figura 2.10. Radiatia emisa de sursa (lampa cu hidrogen sau deuteriu pentru domeniul UV si lampa halogen-tungsten pentru domeniul Viz.) este transformata intr-un fascicul paralel de un sistem de lentile, iar un monocromator sau o retea de difractie realizeaza dispersia spectrala.
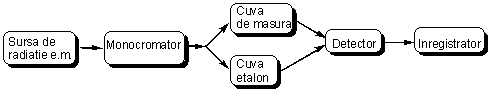
Fig. 2.10. Schema de principiu a unui spectrometru UV-Viz
Majoritatea aparatelor contin o oglinda pivotanta care descompune radiatia monocromatica in doua fascicule care sunt conduse peste cuva de referinta (continand solventul) si respectiv peste cuva de masura in care este amplasata solutia diluata de concentratie aprox. 10-4 molxL-1 (pentru domeniul UV cuvele sunt confectionate din cuart, care este un material transparent pentru domeniul de lucru; pentru domeniul vizibil cuvele pot fi confectionate din sticla). Radiatia emergenta ajunge la un detector (multiplicator fotoelectronic) care masoara cantitatea de radiatie transmisa prin aceasta. Inregistratorul traseaza spectrul UV-Viz sub forma unei reprezentari grafice a absorbtiei in functie de lungimea de unda A=f(λ).
Principalele caracteristici ale unei benzi de absorbtie sunt pozitia si intensitatea ei. Pozitia absorbtiei corespunde lungimii de unda λmax a radiatiei electromagnetice a carei energie este egala cu energia necesara pentru producerea unei tranzitii electronice. Intensitatea absorbtiei, depinde de doi factori: probabilitatea interactiunii dintre radiatia electromagnetica si sistemul electronic astfel incat sa devina posibila efectuarea unei tranzitii din starea fundamentala intr-o stare excitata si polaritatea starii excitate. Probabilitatea tranzitiei este proportionala cu patratul momentului de dipol electric al tranzitiei (dat de modificarea distributiei de sarcina electronica in timpul excitarii sistemului).
Pentru exprimarea intensitatii absorbtiei se pot utiliza marimile:
-Transmitanta T, definita prin raportul:
T = I/I0
unde: I0 este intensitatea radiatiei incidente pe proba
I este intensitatea radiatiei transmise prin solutia probei
- Absorbanta A, data de relatia:
A = log(I0/I) = log(1/T)
Astfel, daca solutia probei nu absoarbe deloc radiatia e.m. incidenta, atunci transmitanta T este de 100%, iar absorbanta este nula. Daca intreaga cantitate de radiatie e.m. este absorbita, atunci T = 0%, iar absorbanta este infinita.
Legea Lambert-Beer stabileste o legatura empirica intre absorbanta A (numita si densitate optica), lungimea drumului parcurs de radiatia e.m. prin proba l (exprimata in cm) si concentratia probei c (mol∙L-1):
A = log(I0/I) =ε c l
Unde: ε este absorbtivitatea molara (sau coeficientul de extinctie molara) exprimat in L∙mol-1 ∙cm-1.
Acest coeficient are o valoare constanta caracteristica substantei absorbante la o anumita lungime de unda. Prin conventie, ε este adeseori lipsit de unitatile de masura.
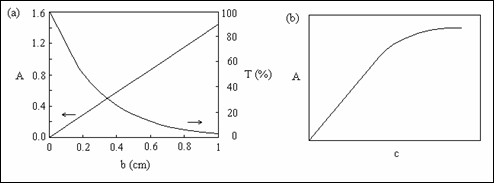
In figura 2.11 este ilustrata dependenta absorbantei si
transmitantei de parcursul radiatiei in proba precum si dependenta absorbantei
de concentratia probei.
Fig. 2.11 (a) Dependenta absorbantei si transmitantei de parcursul radiatiei in proba; (b) dependenta absorbantei de concentratie
Atunci cand nu se cunoaste formula moleculara a substantei absorbante analizate se poate folosi marimea absorbtivitate pe unitate de drum (un centimetru unu la suta):
E1%1cm = A/c.l
unde: c este concentratia exprimata in g/100 cm3.
Reprezentarea spectrului UV-Viz se face in mod uzual folosind valorile de absorbanta inregistrate in functie de lungimea de unda a radiatiei e.m. A = f(λ). Este preferata reprezentarea grafica a absorbantei si nu a transmitantei, datorita dependentei liniare a absorbantei de concentratie si de parcursul radiatiei prin proba conform legii Lambert-Beer (Fig. 2.11a). Aceasta lege nu este respectata decat la concentratii relativ mici (in solutii diluate), la concentratii mai mari absorbanta avand o crestere mai lenta cu concentratia (Fig. 2.11.b). Pentru prepararea unei solutii de proba oarecare cu o concentratie corespunzatoare inregistrarii unui spectru putem sa consideram absorbanta egala cu unitatea si atunci pentru o cuva cu grosimea de un centimetru conform legii Lambert-Beer cε ≈1; pentru εmax=10n trebuie sa efectuam masuratorile la o concentratie c=10-nmol/L.
O alta varianta de reprezentare grafica a spectrelor UV-Viz reda variatia absorbtivitatii molare in functie de lungimea de unda log ε=f(λ), sau variatia absorbtivitatii molare in functie de numarul de unda exprimat in cm-1 log ε=f(ν) ; acest mod de reprezentare devine mai avantajos atunci cand intr-un spectru o banda intensa se situeaza in vecinatatea unei benzi de intensitate slaba.
O metoda mai recenta utilizeaza metoda matematica de derivare a curbei de absorbtie ε = f(λ) pentru observarea unor diferente foarte mici intr-un spectru (spectroscopie derivata). Astfel, unui punct de maxim al curbei de absorbtie ii corespunde un punct de zero (schimbare de semn) pe curba corespunzatoare derivatei intai, iar unui punct de inflexiune greu de determinat ii corespunde un maxim, astfel incat curba apare mult mai net conturata. Spectroscopia derivata este utilizata pentru rezolvarea problemelor dificile de cuantificare in analiza de urme si mecanisme de reactie.
Intensitatea benzii de absorbtie a unui compus se exprima uzual ca absorbtivitatea molara in punctul de absorbtie maxima, εmax sau logεmax.
Se considera ca absorbtiile sunt intense atunci cand εmax > 104 (tranzitii permise) si slabe atunci cand εmax < 103. Tranzitiile cu probabilitate scazuta sunt tranzitii interzise de regulile de selectie. Conjugarea conduce de obicei la cresterea coeficientului de extinctie εmax.
2.5. ATRIBUIRI STRUCTURALE BAZATE PE ABSORBTII CARACTERISTICE INREGISTRATE IN SPECTRELE UV-Viz.
Hidrocarburi
Hidrocarburile saturate (alcanii si cicloalcanii) sunt substante care produc benzi de absorbtie in domeniul UV-indepartat datorita tranzitiilor permise σ →σ*. In domeniul uzual de inregistrare al spectrelor UV-Viz, hidrocarburile saturate nu produc benzi de absorbtie si din acest motiv pot fi folosite drept solventi transparenti pe acest domeniu.
Spectrele UV-Viz ale hidrocarburilor nesaturate cu legaturi duble izolate sunt determinate de prezenta cromoforului etilenic caracterizat prin inregistrarea unei benzi de absorbtie intense situate in domeniul 165-200 nm (ε=104). Substitentii alchil determina o deplasare batocroma a pozitiei maximului de absorbtie
Cromoforul acetilenic din structura alchinelor produce o banda absorbtie intensa situata la λ=173 nm (ε=103).
Pentru studiul structurii polienelor conjugate, pozitia benzii de absorbtie celei mai intense poate fi corelata cu natura substituentilor. Woodward si Fieser si au propus cateva reguli empirice utilizate in determinarea pozitiei maximului de absorbtie al structurii polienei pornind de la valoarea lungimii de unda la care apare maximul de absorbtie corespunzator tranzitiei π→π* din structura dienei nesubstituite, numita lungime de unda de baza. In functie de natura si numarul substituentilor, la lungimea de unda de baza se adauga valorile unor incremente prezentate in Tabelul 2.3.
Regulile Fieser si Woodward sunt aplicabile intr-o serie de cazuri particulare; cateva exemple de calcul al pozitiei maximului de absorbtie corespunzator tranzitiei π→π* a cromoforului 1,3-butadienic substituit pe baza acestor reguli empirice sunt prezentate in tabelul 2.4.
Tabel 2.3. Incremente pentru calcului maximului de absorbtie corespunzator tranzitiei π→π* din structura dienelor si trienelor conjugate (in solvent etanol)
|
Valoarea de baza |
λmax [nm] |
|
-diene aciclice (s-trans) | |
|
-diene homoanulare (s-cis) | |
|
- diene heteroanulare (s-trans) | |
|
Valoarea adaugata pentru grupare auxocrom | |
|
-R (alchil) | |
|
-OR (O-alchil) | |
|
-SR (S-alchil) | |
|
-Cl, -Br | |
|
-OCOR (O-acil) | |
|
-CH=CH- extinde conjugarea | |
|
-legatura dubla exociclica | |
|
-N(R2) (dialchilamino) |
Valorile experimentale nu concorda cu estimarile facute prin acest tip de calcul atunci cand asupra cromoforului 1,3-butadienic actioneaza efecte sterice puternice sau atunci cand in structura compusului analizat apare o conjugare incrucisata. Regulile din tabelul 2.4 conduc la valori ale lui λmax apropiate de cele experimentale pentru sistemele polienice continand cel mult patru legaturi duble conjugate.
Pentru polienele cu mai mult de patru astfel de legaturi, se pot aplica regulile aproximatiei Fieser-Kuhn. In cadrul acestei aproximatii, atat λmax cat si εmax depind de numarul legaturilor duble conjugate, conform ecuatiilor:
λmax = 114 + 5M + n(48,0 +1,7n) + 16,5Rendo + 10Rexo
εmax = (1,74x104)n
unde: n este numarul legaturilor duble conjugate,
M este numarul substituentilor alchil sau de tip alchil ai sistemului conjugat
Rendo este numarul ciclurilor cu legaturi duble endociclice in sistemele conjugate,
Rexo este numarul ciclurilor cu legaturi duble exociclice.
Aceasta ecuatie aplicata de exemplu in cazul β-carotinei pentru M=10, n=11, Rendo =2, Rexo=0 duce la valorile calculate: λmax = 453.3 nm si εmax = 191000 comparabile cu cele experimentale: λmax = 452 nm si εmax = 152000.

Tabel 2.4 Exemple de calcul al λmax pentru structuri dienice conjugate
|
Structura |
baza diena |
Incremente |
calculat [nm] |
|
|
(aciclica) |
+2 x 5 (alchil) | |
|
|
(heteroanulara) |
+2 x 5 (alchil) legatura dubla exociclica) | |
|
|
(homoanulara) |
+2 x 5 (alchil) | |
|
|
(homoanulara) |
+30 (legatura dubla extinde conjugarea +3 x 5 alchil) legatura dubla exociclica) |
Benzenul prezinta trei benzi de absorbtie situate la: 184 nm (εmax=60000) (banda notata E1 sau β), 204nm (εmax 7900) (E2 sau p) si 256 nm (εmax 200) (banda B sau α), corespunzatoare unor tranzitii π→π*. Banda B contine o structura fina, in cazul unei probe in stare de vapori sau in solventi nepolari, provenind de la tranzitiile intre subnivele de vibratie ale nivelelor electronice. In solventi polari, interactiunea dintre solvent si moleculele de benzen tind sa acopere structura fina.
Substituirea cu grupari alchil al nucleului benzenic produce o deplasare a pozitiei benzii B spre lungimi de unda mai mari. Adaugarea celei de-a doua grupari alchil produce o deplasare spre rosu suplimentara, mai accentuata daca substitutia are loc in pozitie para. Izomerul para absoarbe la cea mai mare valoare λmax si prezinta cea mai mare valoare εmax dintre toti izomerii. Izomerul orto de obicei absoarbe la lungimi de unda mai mici si are valori εmax mai mici datorita interactiunilor sterice.
Substituirea unui nucleu benzenic cu grupari auxocrome de tipul -OH, -NH2, deplaseaza benzile E si B spre lungimi de unda mai mari, intensifica banda B si mascheaza structura sa fina, datorita conjugarii n- π*.
Transformarea unei molecule de fenol in anionul fenolat determina deplasarea benzilor E2 si B spre lungimi de unda mai mari si cresterea extinctiei deoarece este favorizata conjugarea electronilor de nelegatura de la atomul de oxigen cu sistemul de electroni π ai nucleului aromatic. In mod contrar, in anilina convertita in cationul fenilamonium, perechea de electroni ai atomului de azot nu mai participa la conjugarea cu sistemul de electroni π ai nucleului aromatic, iar spectrul UV apare aproape identic cu cel al benzenului.
Atasarea directa a unei grupari nesaturate la inelul benzenic determina o deplasare spre lungimi de unda mai mari puternica pentru banda B si aparitia unei benzi a cromoforului etilenic in regiunea 200-250 nm (εmax > 10000).
Datele din Tabelul 2.5 permit calculul empiric al pozitiei maximului benzii de absorbtie corespunzator tranzitiei π→π* pentru o serie de derivati monosubstituiti ai benzenului in functie de natura substituentului.
Tabel 2.5 Incremente pentru calculul empiric al pozitiei benzii de absorbtie corespunzatoare tranzitiei pentru benzen monosubstituit
(in CH3OH). λmax =203,5 + I (nm)
|
Substituent |
I |
Substituent |
I |
Substituent |
I |
|
-CH3 |
-Br |
-OH | |||
|
-CN |
-Cl |
-O- | |||
|
-CHO |
-NH2 |
-OCH3 | |||
|
-COCH3 |
-NHCOCH3 | ||||
|
-CO2H |
-NO2 |
Valorile incrementelor din tabelul 2.6 permit calculul empiric al pozitiei maximului benzii de absorbtie corespunzator tranzitiei π→π* pentru o serie de derivati disubstituiti ai benzenului in functie de natura substituentului si de pozitia acestuia, tinand cont si de urmatoarele reguli:
1) substituenti in pozitie para:
a) ambele grupari sunt fie donoare fie acceptoare de electroni: in acest caz se considera numai efectul gruparii care produce cea mai mare deplasare λmax.
b) o grupare cu efect donor de electroni (+I sau +E), iar cea de-a doua cu efect acceptor de electroni (-I sau -E): valoarea calculata λmax va fi in mod uzual mult mai mica decat valoarea observata.
2) substituenti in pozitie orto si meta: efectele substituentilor sunt aditive.
Factorii sterici pot determina modificari ale geometriei compusilor ducand la reducerea conjugarii prin suprimarea suprapunerii intre orbitalii atomici. In structura bifenilului intre cele doua nuclee benzenice poate aparea o conjugare π-π conjugare desi molecula nu este complet plana, cele doua cicluri formand un unghi de aproximativ 45º.
Tabel 2.6. Calculul empiric al pozitiei benzii de absorbtie corespunzatoare tranzitiei pentru derivati ai benzenului de tipul Ar-COG (in EtOH). λmax = λbaza + I (nm)
|
ArCOR/ArCHO/ArCO2H/ArCO2R |
Izomer |
λbaza (nm) |
|
Cromoforul de plecare: Ar = C6H5 | ||
|
G = alchil sau rezidu ciclic (ArCOR) | ||
|
G = H (ArCHO) | ||
|
G = OH, Oalchil (ArCO2H, ArCO2R) | ||
|
Corectia pentru fiecare substituent |
Increment |
|
|
alchil sau rezidu ciclic |
o-, m- p- | |
|
-OH, -OCH3, -Oalchil |
o-, m- p- | |
|
-O- (oxianion) |
o- m- p- | |
|
-Cl |
o-, m- p- | |
|
-Br |
o-, m- p- | |
|
-NH2 |
o-, m- p- | |
|
-NHCOCH3 |
o-, m- p- | |
|
-NHCH3 |
p- | |
|
-N(CH3)2 |
o-, m- p- |
In derivati substituiti ai bifenilului, unghiul dintre planele celor doua cicluri creste, ceea ce are ca efect diminuarea suplimentara a suprapunerii orbitalilor π si intreruperea conjugarii. In spectrul UV-Viz acest efect produce o deplasare hipsocroma a pozitiei maximului benzii de absorbtie si o scadere a intensitatii benzilor de absorbtie (efect hipocrom). Astfel in spectrul UV-Viz al bifenilului λmax= 250 nm (ε=19000), in timp ce in spectrul 2-metilbifenilului λmax=237 nm (ε=10250).
Pozitiile benzilor de absorbtie din spectrele UV-Viz ale hidrocarburilor aromatice policiclice cu nuclee condensate: naftalina, antracen si fenantren sunt prezentate in tabelul 2.7.
2.5.2. COMPUSI HETEROCICLICI AROMATICI
Compusii heterociclici saturati cu inel de 5 sau 6 atomi sunt
transparenti la lungimi de unda mai mari de 200 nm, numai compusii heterociclici aromatici absorbind radiatia in domeniul UV apropiat.
Compusii aromatici monoheteroatomici cu inel de 5 atomi prezinta spectre UV-Viz continand 2 benzi de absorbtie situate in domeniul UV apropiat. In tabelul 2.7 sunt cuprinse pozitiile principalelor benzi de absorbtie ale furanului, pirolului si tiofenului. Substituirea acestor structuri heterociclice determina o deplasarea batocroma a pozitiei maximelor de absorbtie si o intensificare a lor.
Piridina, compus heterociclic aromatic cu inel de 6 atomi, este caracterizata de un spectru UV-Viz continand trei benzi de absorbtie a caror pozitie este descrisa in tabelul 2.7. Spectrul UV al piridinei este similar cu cel al benzenului, diferentiat printr-o intensitate de absorbtie mai mare corespunzatoare benzii B (datorata unei tranzitii permise de regulile de selectie in cazul piridinei dar interzisa prin simetrie in cazul benzenului) si cu o structura fina mai putin distincta. Cresterea polaritatii solventului are un efect foarte slab de deplasare asupra benzii B a benzenului, dar produce o deplasare a acestei benzi in cazul piridinei (datorita legaturii de hidrogen in care se poate implica perechea de electroni neparticipanti de la atomul de azot). Chinolina (benzo[b]piridina) prezinta un spectru UV-Viz cu trei maxime de absorbtie similar naftalinei, iar acridina (dibenzo[b,e]piridina) prezinta un spectru UV-Viz similar cu cel al antracenului, pozitiile benzilor de absorbtie caracteristice fiind prezentate in tabelul 2.7.
Spectrele diazinelor: 1,2-diazina (piridazina), 1,3-diazina (pirimidina) si 1,4-diazina (pirazina) sunt similare celor ale piridinei, observandu-se insa o intensificare a benzii n→π*.
Tabel 2.7. Pozitii ale maximelor benzilor de absorbtie UV-Viz caracteristice hidrocarburilor aromatice policiclice cu nuclee condensate si compusilor heterociclici aromatici.
|
Compus |
λmax [nm], (ε) |
Solvent |
|
naftalina |
etanol |
|
|
antracen |
etanol |
|
|
fenantren |
etanol |
|
|
furan |
hexan |
|
|
pirol |
hexan |
|
|
tiofen |
hexan |
|
|
piridina |
hexan |
|
|
chinolina |
etanol |
|
|
acridina |
etanol |
|
|
piridazina |
hexan |
|
|
pirimidina |
hexan |
|
|
pirazina |
hexan |
2.5.3. COMPUSI CARBONILICI
Cetonele si aldehidele saturate prezinta trei benzi de absorbtie, doua dintre ele fiind observate in domeniul UV indepartat. Tranzitiei permise π→π* ii corespunde o banda de absorbtie intensa situata la λmax=150 nm, iar tranzitiei n →σ* o banda de absorbtie situata la λmax= 190 nm. Cea de-a treia banda, n→π*, este de intensitate slaba (εmax < 300) si apare in domeniul UV apropiat in regiunea 270-300 nm. Aceasta banda sufera o deplasare hipsocroma (spre albastru) o data cu cresterea polaritatii solventului, mai ales in prezenta unor solventi protici. De exemplu, acetona absoarbe la λmax= 264.5 nm in apa si la λmax= 279 nm in hexan.
Spectrele cetonelor si aldehidelor α,β-nesaturate sunt caracterizate de o banda intensa corespunzatoare tranzitiei π→π* situata in domeniul 215-250 nm (εmax=10000-20000) si o absorbtie slaba corespunzatoare tranzitiei n→π* situata in intervalul 310-330 nm. Estimarea valorii λmax corespunzatoare tranzitiei π→π*, care produce banda cea mai intensa din spectrul UV-Viz. se poate realiza cu ajutorul regulilor empirice Woodward, intr-un mod similar cu cel descris pentru cromoforul butadienic. La valoarea lungimii de unda de baza caracteristica cromoforului carbonil α,β-nesaturat se adauga incremente datorate substituentilor conform datelor din tabelul 2.8a. Valorile obtinute prin calcul sunt comparabile cu cele masurate utilizand solvent etanol. Pentru compararea cu rezultate experimentale obtinute utilizand alti solventi cu polaritate diferita de cea a etanolului, valorile calculate trebuie corectate adaugand incrementele caracteristice efectului de solvent cuprinse in tabelul 2.8b.
Tabel 2.8a. Calculul valorilor λmax corespunzatoare tranzitiei π→π* pentru compusi de tip carbonil nesaturat (Fieser) in etanol. λmax λbaza + Σ I
|
|
λbaza (nm) |
|||
|
cetone aciclice sau cicluri cu 6 atomi | ||||
|
cicluri cu 5 atomi | ||||
|
aldehide | ||||
|
acizi si esteri | ||||
|
Grupari functionale |
Incremente I |
|||
|
legatura dubla externa unui ciclu | ||||
|
legatura dubla externa simultan la doua cicluri | ||||
|
Conjugare aditionala C=C : aciclica sau heterociclica homoclicica | ||||
|
|
||||
|
Substituent | ||||
|
-R alchil (incluzand parti ale ciclului carbonilic) |
| |||
|
-OR alcoxi | ||||
|
-OH hidroxi | ||||
|
-SR tioeter | ||||
|
-Cl cloro | ||||
|
-Br bromo | ||||
|
-OCOR aciloxi | ||||
|
-NH2, -NHR, -NR2 amino | ||||
Tabel 2.8b. Corectarea valorilor calculate λmax corespunzatoare tranzitiei π→π* pentru compusi de tip carbonil α,β--nesaturat datorita efectului de solvent.
|
Solvent Increment |
|
|
Apa | |
|
Metanol | |
|
Cloroform | |
|
Dioxan | |
|
Dietil eter | |
|
Hexan | |
|
ciclohexan | |
Aplicarea regulilor lui Woodward in cazul cetonelor si aldehidelor nesaturate este ilustrata prin cateva exemple cuprinse in tabelul 2.9.
Tabel 2.9. Exemple de calcul al valorilor λmax corespunzatoare tranzitiei π→π* pentru compusi de tip carbonil α,β--nesaturat (Woodward) in etanol.
|
Formula structurala |
λbaza |
I |
λmax |
|
|
(aldehida) |
+12 (β metil) | |
|
|
215 (ciclohexanona) |
+39 (legatura dubla in conjugare homoanulara) +10 (α metil) +17 (δ rest ciclic) | |
|
|
202 (ciclopentanona) |
2 x 12 (2 resturi alchil β) | |
|
|
197 (ester) |
+ 30 (β alcoxi) |
Valorile calculate sunt diferite de cele masurate in cazul compusilor cu conjugare incrucisata a legaturilor π si efecte sterice care scot din coplanaritate orbitalii atomici participanti la formarea orbitalilor moleculari extinsi.
2.5.4. Complecsi de transfer de sarcina
Spectroscopia UV-Viz este o metoda potrivita pentru a pune in evidenta formarea unor complecsi de transfer de sarcina prin interactiunea dintre o molecula cu densitate mare de electroni (hidrocarburi aromatice si derivatii lor substituiti cu grupari electrono-donoare de tipul amino, alcoxi, etc) si o molecula cu un deficit de electroni (hidrocarbura aromatica sau nesaturata avand substituenti electrono-atragatori de tipul nitro, ciano, carbonil, cloro, etc.). Un exemplu clasic consta in formarea picratilor hidrocarburilor aromatice, reactie utilizata in scopuri analitice; astfel, prin amestecarea unei solutii alcoolice de acid picric de culoare galbena cu solutia unei hidrocarburi aromatice (de exemplu naftalina) incolora, precipita o substanta solida, cristalina, de culoare portocalie (complexul de transfer de sarcina). Aparitia unei legaturi intre molecula donoare de electroni (baza Lewis) si molecula acceptoare de electroni (acid Lewis) se poate explica prin formarea unor noi orbitali moleculari rezultati prin suprapunerea orbitalilor de frontiera ai celor doua molecule care participa la formarea complexului de transfer de sarcina. Molecula electrono-donoare participa la formarea acestor noi orbitali moleculari cu orbitalul HOMO ocupat cu o pereche de electroni, iar molecula acceptoare participa cu orbitalul LUMO vacant. Se obtin astfel doi orbitali moleculari, unul de energie joasa ocupat cu electroni si unul de energie inalta vacant intre care poate avea loc sub actiunea radiatiei e.m. o noua tranzitie π→π* caracterizata de o λmax specifica complexului de transfer de sarcina. In figura 2.12 sunt prezentate exemple de formule structurale ale unor molecule electrono-acceptoare si electrono-donoare care pot participa la formarea unor complecsi de transfer de sarcina, impreuna cu diagrama energetica a tranzitiilor electronice stimulate de radiatia e.m. din domeniul UV-Viz.
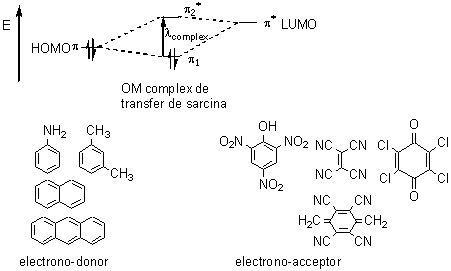
Fig. 2.12. Diagrama energetica a tranzitiilor electronice din complecsi de transfer de sarcina formati intre molecule electrono-donoare si molecule electrono-acceptoare.
Prin asocierea unui numar mare de astfel de molecule cu geometrie plana se poate imagina formarea unor OM extinsi a caror populare cu electroni poate explica fenomenul de conductie electrica (semiconducori, conductori, "metale organice") si aparitia unor proprietati neconventionale pentru astfel de compusi organici. Un exemplu este complexul de transfer de sarcina TTF-TCNQ (Tetratiafulvalena-Tetracianochinodimetan).
2.6. FLUORESCENTA SI FOSFORESCENTA
Fluorescenta este proprietatea unor molecule de a absorbi radiatia electromagnetica de o anumita lungime de unda (situata in domeniul UV-Viz) si de a emite o radiatie electromagnetica de o alta lungime de unda situata in domeniul vizibil (λabsorbit ≠ λemis). Emisia radiatiei fluorescente inceteaza o data cu intreruperea iradierii moleculelor probei cu radiatia electromagnetica ce poate produce trecerea moleculei din starea fundamentala intr-o stare excitata.
Fosforescenta este un fenomen similar celui de fosforescenta, in care insa, moleculele continua sa emita radiatie electromagnetica o anumita perioada de timp si dupa incetarea iradierii exterioare.
In figura 2.13 sunt prezentate schematic tranzitiile care pot avea loc sub actiunea unei cuante de radiatie electromagnetica, intre stari electronice caracterizate de diferite nivele energetice vibrationale ale unei molecule. In fenomenele de fosforescenta si fluorescenta procesele de relaxare (revenire la starea fundamentala) au loc prin emisie de radiatie electromagnetica. Daca in urma absorbtiei de energie, tranzitiile electronice au loc spre nivelele de vibratie superioare ale orbitalilor moleculari LUMO, atunci intr-un timp foarte scurt (de ordinul picosecundelor) poate avea loc mai intai un fenomen de relaxare prin conversie interna (proces non radiativ), conducand in starea de vibratie cea mai joasa a acestei stari electronice. Din aceasta stare energetica, prin emisia de cuante de radiatie electromagnetica poate avea loc relaxarea in continuare spre diferite stari de vibratie ale starii fundamentale; radiatiile emise astfel, numite radiatii de fluorescenta, sunt caracterizate de lungimi de unda mai mari decat cele absorbite. Toate aceste tranzitii electronice au loc cu conservarea multiplicitatii de spin electronice intre stari singlet (in care electronii au doi cate doi spin opus-sunt imperecheati).
In fenomenul de fosforescenta, tranzitiile electronice pot avea loc insa si intre stari cu multiplicitati diferite. Astfel, dintr-o stare excitata de tip singlet, prin conversie interna poate avea loc inversia spinului electronic conducand astfel spre o stare triplet T (in care doi electroni au spin paralel). Starile de tip triplet sunt mai stabile decat cele de tip singlet si au un timp de viata mai lung, ceea ce face ca relaxarea prin emisie de radiatie din starea triplet spre starea fundamentala sa fie observabila si dupa incetarea absorbtiei de radiatie electromagnetica.

Fig. 2.13. a)Tranzitii electronice implicate in procese de absorbtie si relaxare in procese de fluorescenta si fosforescenta ale unor molecule organice b) spectrul UV-Viz si spectrul de fluorescenta
De exemplu, in timp ce spectrul de absorbtie al moleculei de antracen prezinta maxime de absorbtie in domeniul UV (tabel 2.7), spectrul de fluorescenta al acestui compus contine patru maxime de emisie situate la λmax: 380, 400, 420 si respectiv 450 nm, fapt care determina aparitia unei fluorescente albastre a solutiilor continand antracen.
Exista multiple aplicatii practice ale compusilor cu proprietati de fluorescenta si fosforescenta atat in scopuri analitice cat si de marcare a unor suprafete. Compusi organici care prezinta fluorescenta albastra se folosesc in industria textila drept "inalbitori optici" (cantitati foarte mici din compusul organic, fixate pe fibra textila dupa spalarea cu un detergent care contine astfel de aditivi, vor determina in prezenta luminii solare - sau a altei surse de radiatie UV - o fluorescenta albastra, adaugand astfel materialului un plus de stralucire care creeaza ochiului uman o impresie de alb imaculat).
Solutiile apoase de fluoresceina prezinta o fluorescenta verde care le face usor de detectat in operatiuni de marcare a unor scurgeri de apa.
2.7. EXEMPLE DE SPECTRE UV-Viz.
In figura 2.14.a. sunt prezentate spectrele UV ale unor diene si poliene conjugate alaturi de spectrul UV al cromoforului etilenic izolat. Observati deplasarea batocroma a maximelor de absorbtie o data cu cresterea numarului de legaturi duble in conjugare.
Aspectul spectrului de absorbtie datorat unui compus carbonilic α,β-nesaturat poate fi comparat cu cel al cromoforului izolat in figura 2.14b. Banda de absorbtie de intensitate slaba datorata tranzitiei n→π* apare este supusa unei deplasari batocrome o data cu aparitia conjugarii din sistemul α,β-nesaturat.
Sistemele aromatice de tip benzen si naftalina produc spectrele de absorbtie UV redate in figura 2.14c. Benzile de absorbtie p si α ale cromoforului benzen din structura 1,4-dihidroantracenului apar deplasate batocrom in cromoforul naftalina din structura 9,10-dihidroantracenului.

Fig. 2.14. Spectre UV ale: a) poliene conjugate si poliene cu legaturi duble izolate, b) compus carbonilic α,β-nesaturat si compus carbonilic β,γ- nesaturat, c) 1,4-dihidroantracen si 9,10-dihidroantracen
In figura 2.15 sunt prezentate modificarile care apar in pozitiile benzilor de absorbtie ale 3-ciano-10-metil-pirido[3,2-g]chinolinei in solutie apoasa neutra, acida si respectiv bazica.
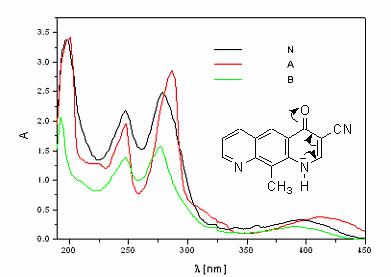
Fig. 2.15. Spectrul UV-Viz al 3-ciano-10-metil-pirido[3,2-g]chinolinei in solutie apoasa a) neutra, b) acida c) bazica
In figura 2.16 sunt prezentate spectrele UV-Viz ale complecsilor de transfer de sarcina dintre molecule electrono-donoare cu structura fenotiazinica si moleculele electrono-acceptoare TCNE, iod. Banda de absorbtie datorata complexului de transfer de sarcina apare in domeniul vizibil.
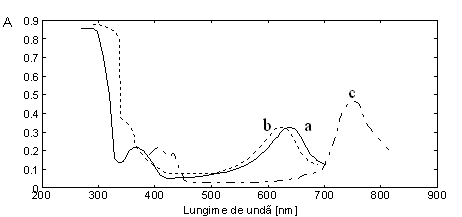
Fig. 2.16. Spectrul UV-Viz al complecsilor de transfer de sarcina: a) 1.4- benzotiazino[2,3-b]-fenotiazina:I3 in DMSO b) DDP:I3 in DMSO, c) 1.4-benzotiazino[2,3-b]-fenotiazina:TCNE in DMF.
PROBLEME
1. Explicati cum puteti distinge cu ajutorul spectroscopiei UV-Viz cei doi termeni ai urmatoarelor perechi:
a) 1,4-ciclohexadiena, 1,3-ciclohexadiena
b) bifenil, 2,2'-dimetil-bifenil
c) cis-, trans-difeniletena (stilben)
d) para-, meta-nitrofenol
Rezolvare:
Cu cat sistemul cromofor contine mai multe legaturi duble in conjugare, va aparea un efect batocrom. Elemente structurale care determina intreruperea conjugarii electronilor π determina un efect hipsocrom.
a) Pozitia maximului de absorbtie al sistemului cromofor din structura 1,3-ciclohexadienei se situeaza la o lungime de unda mai mare datorita conjugarii electronilor π din cele doua legaturi duble. Absorbtia din domeniul UV a 1,4-ciclohexadienei se datoreaza cromoforului etilenic si apare la lungimi de unda mai mici.
b) Datorita efectelor sterice introduse de gruparile metil din structura 2,2'-dimetil-bifenilului, pozitia maximului de absorbtie al sistemului cromofor din structura acestuia se situeaza la valori mai mici ale lungimii de unda comparativ cu pozitia maximului de absorbtie al sistemului cromofor din structura bifenilului.
c) Cromoforul etilenic conjugat din structura izomerului cis determina absorbtii la lungimi de unda mai mari decat cel din structura izomerului trans.
d) Gruparea auxocroma electrono-atragatoare nitro extinde sistemul cromofor din structura fenolului printr-un efect de conjugare atunci cand este situata in pozitia para fata de gruparea hidroxil electrono-donoare. Astfel, pozitia maximului de absorbtie al sistemului cromofor din structura para-nitrofenolului se situeaza la valori mai mari ale lungimii de unda comparativ cu meta-nitrofenolul.
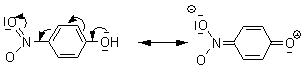
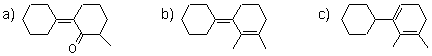
2. Calculati valoarea λmax pentru urmatoarele structuri:
Rezolvare:
Pozitia maximului de absorbtie corespunzator tranzitiei π→π* permise a sistemului cromofor poate fi calculata pe baza sistemelor empirice de incremente (vezi cap. 2.5.)
a) Pozitia maximului de absorbtie corespunde unui sistem cromofor de cetona α,β-nesaturata pentru care: λmax= 215 + 10 + 2·12 + 2·5= 259 nm
b) Pozitia maximului de absorbtie corespunde unui sistem cromofor butadienic s-trans pentru care: λmax= 217 + 6·5 + 2·5= 257 nm
c) Pozitia maximului de absorbtie corespunde unui sistem cromofor butadienic s-cis pentru care: λmax= 253 + 5·5 = 278 nm
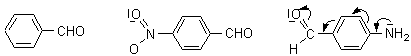
. Explicati influenta substituentilor asupra spectrului UV-Viz al benzaldehidei, para-aminobenzaldehidei, para-nitrobenzaldehidei
Rezolvare:
Gruparile auxocrome amino- si respectiv nitro- extind sistemul cromofor al benzaldehidei si in consecinta pozitia maximului de absorbtie se deplaseaza spre valori mai mari ale lungimii de unda comparativ cu benzaldehida. Astfel: λmax benzaldehida< λmax p-nitrobenzaldehida λmax p-aminobenzaldehida
. Doi compusi organici notati A si B au aceeasi formula moleculara C8H12. Atat A cat si B decoloreaza apa de brom, dar numai compusul A formeaza un precipitat la tratare cu o solutie de hidroxid diaminoargentic. Spectrul UV-Viz al compusului A nu prezinta maxime de absorbtie situate la valori mai mari de 200 nm, pe cand cel al compusului B este caracterizat de aparitia unei benzi intense cu un maxim situat la 257 nm. Propuneti formulele structurale pentru compusii notati A si B.
Rezolvare:
Nesaturarea echivalenta corespunzatore unei formule moleculare C8H12 este:
Decolorarea apei de brom poate fi explicata prin reactia de aditie a bromului la legaturi duble C=C sau triple C≡C.
Reactia cu hidroxidul diaminoargentic este specifica alchinelor terminale cu formarea acetilurii de argint. Compusul notat A poate fi o ciclohexil-acetilena deoarece cromoforul acetilenic produce o banda de absorbtie al carui maxim se situeaza la valori ale lungimii de unda ale sub de 200 nm.
Compusul notat B poate fi un izomer al unei triene continand 8 atomi de carbon al carei maxim de absorbtie se calculeaza avand in vedere un cromofor butadienic cu o legatura dubla conjugata suplimentar si 2 resturi alchil: λmax= 217 + 30 + 2·5= 257 nm

Spectrul UV-Viz al 1,3-ciclohexandionei in etanol contine o banda de absorbtie intensa situata la 253 nm; in solutie alcalina acest maxim de absorbtie se deplaseaza la 280 nm. Indicati natura sistemului cromofor din structura 1,3-ciclohexandionei care determina aparitia acestor benzi de absorbtie UV-Viz.
Rezolvare:
Tautomerul enolic al 1,3-ciclohexandionei contine un sistem cromofor carbonil α,β-nesaturat care contine in pozitie β o grupare hidroxil si un rest alchil pentru care se poate calcula: λmax= 215 + 30 + 12 = 257 nm
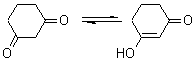
. Spectrul UV-Viz al N,N-dimetilanilinei contine o banda de absorbtie situata la λmax= 251 nm, iar in spectrul UV-Viz al 2-metil-N,N-dimetilanilinei banda de absorbtie este situata la λmax= 248 nm. Analizati natura sistemului cromofor din structura acestor doi compusi organici si explicati diferentele dintre spectrele lor de absorbtie UV-Viz.
Sistemul cromofor din structura N,N-dimetilanilinei este cel al nucleului benzenic monosubstituit in conjugare cu gruparea auxocroma dimetilamino (electrono-donoare). Efectul steric al substituentului metil din structura 2-metil-N,N-dimetilanilinei introduce un impediment asupra efectului de conjugare n-π.

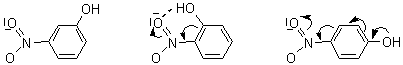
Spectrul UV-Viz al orto-nitrofenolului prezinta o banda de absorbtie intensa situata la λmax= 279 nm, spectrul UV-Viz al meta-nitrofenolului prezinta o banda de absorbtie intensa situata la λmax= 274 nm, iar cel al para-nitrofenolului prezinta o banda de absorbtie si mai intensa situata la λmax= 318 nm. Analizati natura sistemului cromofor din structura acestor trei izomeri si explicati diferentele dintre spectrele lor de absorbtie UV-Viz.
Sistemul cromofor din structura celor trei izomeri este cel al nucleului benzenic disubstituit in care efectele electronice capto-donoare ale substituentilor se manifesta diferit.
|