Raport de Cercetare
Grant: SINTEZE ÎN FAZĂ SOLIDĂ PRETABILE LA ROBOTIZARE
Autor: Prof. dr.ing. Sorin Rosca
Universitatea POLITEHNICA Bucuresti
Faza pentru anul 2002: Sinteza în faza solida a unor hidrocarburi cu structura de 1,1-diariletan, optic active.
Introducere:
În lucrarile noastre anterioare1,2 am aratat ca prin formarea compusilor tricarbonil-crom-aromatici ai acetatilor de benzil (sau ai alcoolilor benzilici - devin posibile reactii de condensare ale acestora cu compusi aromatici reactivi. Acestea decurg printr-o substitutie electrofila la nucleul aromatic reactiv prin ionul de carbeniu benzilic stabilizat prin complexare.
Prezenta lucrare vizeaza exploatarea acestei reactii pentru a obtine compusi aromatici (în deosebi hidrocarburi) cu schelet de 1,1-diariletan, optic active. Obiectivele lucrarii, asa cum au fost studiate pentru faza din anul 2002 sunt redate în Schema 1.

Dupa cum rezulta din Schema 1 au fost vizate urmatoarele sarcini:
dimetilbenzen (1) în vederea obtinerii de compusi macromoleculari cu complexare regio-controlata (2) si a hidrocarburilor cu structura de poli-(diarilmetani), (3).
pur (4-S) pentru a verifica daca reactia decurge stereospecific, cu retentia configuratiei.
Sarcinile 1-5 de mai sus corespund obiectivelor asumate pentru anul 2002 prin proiectul propus.
Prin rezolvarea acestor sarcini se obtin informatiile experimentale de baza privind posibilitatea extinderii reactiei de condensare descoperite de noi pentru sinteze enantioselective de derivati de 1,1-diariletani, si de compusi macromoleculari cu structura si configuratie controlata, precum si informatii privind posibilitatea de a efectua astfel de sinteze în faza solida (prin fixarea complexului pe suport polimer continând ca ligand un atom de fosfor).
Metodologia de lucru implica si utilizarea metodelor de chimie combinatoriala în reactia complecsilor cu amestecuri de arene reactive (a-e). Analizele structurale sunt facute în toate cazurile prin metode fizice adecvate: IR,1H-RMN, 13C-RMN, GC-SM.
Reactia de condensare cu arene reactive a complexului de diacetat de 1,4-dimetilolbenzen-tricarbonil-crom cu arene reactive.
1.1. Sinteza complexului de diacetat de 1,4-dimetilolbenzen-tricarbonil.crom a fost efectuata pornind de la 1,4-dimetilolbenzen care a fost acetilat cu un exces de anhidrida acetica în piridina pentru a obtine diacetalul corespunzator si apoi complexat prin reactie directa cu cromhexacarbonil prin încalzire la reflux într-un amestec de solventi diglim-heptan 10:1, sub inert4. Dupa efectuarea reactiei de complexare produsul a fost separat prin evaporarea solventului, cromatografie (alumina, eluent eter de petrol-dietileter) si recristalizere din n-heptan.
Caracterizarea structurala a compusului este redata în Schema 2. Sunt indicate atributiile pentru semnalele 1H-RMN si 13C-RMN (ppm, CDCl3) si principalele benzi IR (cm-1).
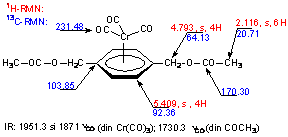
Schema 2
1.2.Reactia de condensare a complexului 1 cu arene reactive a fost efectuata în diferite conditii:
(a) Utilizând duren (a) Schema 1 ca model de compus aromatic reactiv posedând doua centre reactive si un raport molar 1:1 (complex:compus aromatic) în CHCl3 ca solvent si BF3-OEt2 drept catalizator . S-a obtinut, dupa un timp de reactie de 24h, la temperatura camerei, un compus cu caracter macromolecular. Dupa filtrare si spalare cu eter, produsul se prezinta ca un material solid, cu aspect amorf, insolubil în solventi uzuali pentru complecsi (eter, benzen, cloroform, DMSO). Spectrul IR indica disparitia practic completa a benzii de la 1730,3 cm+1 ceea ce dovedeste formarea unui compus macromolecular. Din intensitatea relativa a acestei benzi, în produs fata de reactant, rezulta un grad de policondensare de minimum 50 (cel mult 2% banda reziduala pentru gruparea COCH3).
(b) Au fost efectuate si încercari de condensare între complexul 1 si un amestec continând duren (a), mesitilen (b), anisol (c) si 1,3-dimetoxibenzen (d) la un raport molar de 1:2:2:2:2 (1:a:b:c:d). Dupa efectuarea reactiei amestecul de produsi a fost decomplexat prin oxidare blânda (NaNO2/HCl) si analizat gaz-cromatografic cu detectie prin spectrometrie de masa (GC-MS). Cromatogramele au pus în evidenta existenta, alaturi de arenele nereactionate, a unor produsi de condensare dar si de diacetilare, 11. Principalul produs de condensare identificateste cel cu structura 12d (Schema 3) indicând faptul ca m-metadimetoxibenzenul este arena cea mai reactiva.

Schema 3
În aceste conditii sistemul studiat nu este adecvat unei metode combinatoriale având în vedere posibilitatea formarii unor produsi de apolicondensare cu mase moleculare superioare neanalizabili prin GC-SM. Metoda combinatoriala a fost aplicata cu rezultate mai clare în cazul complexului minofunctional (vezi mai departe).
2.Reactia de conensare cu acetal de 1-feniletanol-tricarbonil-crom, optic pur.
2.1. Sinteza complexului optiv activ de 1-feniletanol-tricarbonil-crom (4S) a fost realizata pornind de la fenil-metil-carbinol cu configuratia S având e.e =89%. Acest compus a fost acetilat cu anhidrida acetica în piridina obtinând cu randament de 89% acetatul de metil-fenil-carbinol ([α]25D=113°; c=0,12; CHCl3) si apoi complexat prin reactie cu Cr(CO)6 în modul descries la punctul 1.1. Produsul obtinut randament de 78% se prezinta sub forma unor cristale galbene cu p.t =77°C si are rotatia specifica [α]25D=42°( c=0,12; CHCl3).
Caracterizarea spectrala este în acord cu structura admisa (Schema 4).
H-RMN C-RMN
IR: (KBr) 1899,7 m ( nCOsim), 1974,1 fi (nCOas
Schema 4
2.2 Reactii de condensare ale complexului 4S. Complexul optic activ preparat conform celor aratate în paragraful 2.1 a fost supus unor reactii de condensare cu anisol (c) si respectiv meta-dimetoxibenzen (d). A fost utilizat un mare exces de arena (20:1 fata de complex) reactia fiind efectuata în CHCl3, la 20°C, timp de 24 h, în prezenta unui catalizator de BF3-OEt21,2. Dupa reactie produsii având structurile 5c si respectiv 5d au fost separati prin spalare cu apa, evaporarea solventului, cromatografiere (alumina, eluent eter de petrol-eter etilic) si recristalizare din n-heptan. Randamentul la obtinerea produsului de condensare cu anisol a fost mai redus (35%) decât în cazul condensarii cu m-dimetoxibenzen (80%).
Caracterizarea structurala a produsilor 5c si 5d este confirmata prin metode spectrometrice, ale caror rezultate si interpretare sunt redate în Schema 5.
H-RMN C-RMN
|
5c |
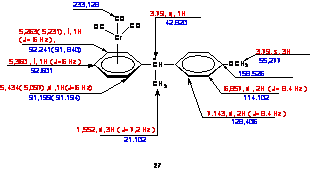 |  |
||
IR: (CHCl3) 1867 m ( nCOsim), 1957,7 fi (nCOas IR: (CHCl3) 1874 fi ( nCOsim), 1960 fi (nCOas
Schema 5
2.3. Desfasurarea stereochimica a reactiei de condensare a fost stabilita analiza gaz cromatografica a produsilor obtinuti dupa decomplexarea prin oxidare blânda cu acid azotos a complecsilor 5c si 5d. Astfel au fost obtinuti compusii aromatici "liberi" 6c si 6d (Schema 1). Analiza cromatografica a fost efectuata pe o coloana cu umplutura optic activa (β-ciclodextrine, CP-Chirasil-Dex CB, 25m, 225°C) detectia fiind efectuata prin spectrometrie de masa, si a aratat existenta unui exces enantiometric de 86% practic identic cu cel al materiei prime. De aici se deduce ca reactia a decurs stereospecific cu retentia configuratiei. Aceasta constituie prima dovada experimentala a unui curs stereochimic total controlat într-o reactie de substitutie electrofila aromatica prin ionii de carbeniu benzilici complexati si dovedeste o cale de sinteza enantioselectiva valoroasa pentru derivati de 1,1 diariletani.
3. Reactii de condensare ale complexului de acetat de 1-feniletanol-tricarbonil-crom cu arene reactive, în sistem combinatorial.
Procedura de lucru consta în efectuarea reactiei de condensare între complexul 5 si un amestec de arene cu structurile a-e în conditiile descrise mai sus (2.2) si la un raport molar de 1:1,5 complex : fiecare din hidrocarburi.
Dupa efectuarea reactiei si îndepartarea catalizatorului prin spalare cu apa produsul brut de reactie a fost decomplexat prin oxidare blânda cu acid azotos (NaNO2/HCl). Dupa o noua spalare produsul decomplexat a fost supus fara alte operatii de separare pentru a evita alterarea compozitiei, unei analize GC-SM.
Au fost obtinute urmatoarele rezultate:
complexului si ca produs principal de condensare, a compusului 6-d pic molecular 242 indicând o reactivitate maxima pentru m-dimetoxibenzen. Produsii secundari (fiecare aproximativ 10% fata de produsul principal) sunt doi stereoizometri corespunzând unei condensari a m-dimetoxibenzenului cu doua molecule de complex (diastereoizomerii RR (sau SS) si respectiv RS. Nu se observa alti produsi.
experienta ulterioara acesta a fost eliminat din amestec. În acest caz cromatograma indica o conversie incompleta (pic pentru acetat de 1-feniletil) iar drept produsi de condensare doi izomeri (fragmentari asemanatoare) corespunzând iyomerilor orto-, para- din condensarea cu anisol ( compusi 6c, pic molecular 212). Nu au putut fi identificati acesti produsi de condensare, demonstrând faptul ca anisolul este în acest caz, arena cea mai reactiva.
(datorita reactivitatii mai mici a complecsilor aromatici) si prezenta produsilor de cuplare cu mesitilena. (6b, pic molecular 224) si cu difenileter (6e, pic molecular 274) în proportii apropiate.
inertia acestui reactiv datorita, foarte probabil, unei importante împiedicari sterice.
Reactivitatea arenelor studiate variaza, asa dar, în urmatoarea ordine:
a>>c>>b~e;a-nu reactioneaza
Acest rezultat atrage atentia asupra selectivitatii de substrat caracteristica reactiei de condensare si confirma stabilitatea reactantului electrofil (ion de carbeniu benzilic complexat).
4. Studiul reactiei de substitutie de ligand CO-PPh3 în vederea fixarii pe suport solid.
Fixarea pe suport solid a complexului pentru efectuarea unei reactii de condensare enantioselectiva cu arene reactive poate fi realizata prin modalitatea predata în Schema 6 folosind drept linker un derivat de trifenilfosfina ancorat pe polimer. Astfel de materiale sunt disponibile comercial dar costul lor este foarte ridicat. În acest fel a aparut interesant sa se studieze reactia, mult mai ieftina, între complex si trifenilfosfina ca model pentru fixarea pe suport.
Astfel complecsii de tipul 7 sunt modele convenabile pentru complecsii 13 (Schema 6). Reactiile de înlocuire a ligandului CO prin PPh3 au fost efectuate fotochimic prin iradiere timp de 4h, la o lungime de unda de 254nm, sub atmosfera de argon. Utilizând complexul acetatului de fenil-metil-carbinol (4, racemic) rezultatele au fost nesatisfacatoare producându-se o descompunere a complexului în toti solventii încercati. (CHCl3, C6H6, THF). În aceasta situatie s-a recurs la hidroliza complexului de acetat cu generarea alcoolului corespunzator (KOH, în solutie MeOH-H2O). Complexul de metil-fenil-carbinol astfel generat s-a dovedit a fi stabil si a prezentat o înlocuire de ligand în proportie de cca. 60% (pe baza datelor 1H-RMN). Aceasta procedura este satisfacatoare tinând seama de faptul ca alcoolii benzilici reactioneaza în reactia de condensare analog acetatilor corespunzatori 2.

5. Sinteza si caracterizarea complexului optic activ cu structura de 1,4-di-(1-acetoxipropil) benzen-tricarbonil-crom si reactia acestuia cu compusi aromatici.
În vederea realizarii unei reactii de policondensare stereospecifica care sa conduca la compusi macromoleculari optic activi a aparut interesanta sinteza complexului difunctional 8 si reactia acestuia cu arene reactive.
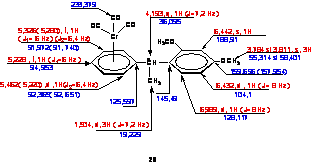
5.1. Sinteza si caracterizarea complexului 8 a fost realizata într-un mod analog procedurii descrise pentru complexul 4 (vezi 2.1) pornind de la diolul optic activ cu configuratia S,S si puritate optica avansata (e.e=96%).
Dupa acetilare si complexare a fost obtinut in produs galben, cristalin cu p.t 125°C (randament 80%). Structura complexului este confirmata de datele spectrale din Schema 7.
H-RMN C-RMN
Schema 7
![]()
![]() 9 SS
9 SS
5.2.Reactia complecsului 8 cu anisol a fost aleasa ca model pentru verificarea reactivitatii si
stereoselectivitatii complecsului difunctional. Reactia a fost condusa în modul descris anterior (2.2) si a condus la produsul de dubla condensare 9 (lichi necristalizabil, randament 20%). Structura a fost stabilita pe baza datelor spectrale redate în Schema 8
H-RMN C-RMN
Schema 9
![]() 10 SS
10 SS
Retentia configuratiei în produsul 9 a fost stabilita prin doua metode: pe de o parte analiza spectrului 1H-RMN indica pentru protonii din nucleul din nucleul aromatic complexat un cuplaj de 6,31Hz caracteristic pentru protoni orto ceea ce corespunde unei diastereotopii a acestora caracteristica pentru o configuratie de tip S,S (o configuratie R,S rezultata prin racemizare ar fi fost asociata cu un cuplaj meta de circa 3Hz); pe de alta parte dupa decomplexare produsul 10c prezinta în cromatograma 2 picuri în raport de 10:1 în buna concordanta cu excesul enantiomeric initial.
În concluzie au fost îndeplinite integral obiectivele stabilite în planul de lucru pentru anul 2002 obtinându-se rezultate originale valoroase. Acestea fac obiectivul a doua comunicari5,6 prezentate în cadrul "3rd International Conference of the Chemical Societies of the South Eastern European Countries", Bucuresti, septembrie 2002 rezultatele urmând a fi publicate în extenso. De asemeni a fost elaborata o teza de dizertatie în domeniul de aprofundare "Medicamente si cosmetice" si parti din teze de doctorat8,9.
Bibliografie:
. S.Rosca, R.Stan, A. Creanga, S.I. Rosca, Lucr. Conf. Chim. Ing. Chim., Bucuresti , 1995, II, 245.
2. S.Rosca, R.Stan, S.I. Rosca, Rev.Roum.Chim.,2002, (sub tipar).
3. W.R.Jacson si C.M.Ullen, J.Chem.Soc., 1965, 1170.
4. B. Nicholls si M.C. Whiting. J.Chem.Soc., 1959, 558.
5. D.Ciuculescu, E.Pârlea, R.Stan, S.Rosca si S.I.Rosca, "3rd International Conference of the Chemical Societies of the South Eastern European Countries", Bucharest, 2002, vol 1, 144.
6. C. Bololoi, E.Pârlea, R.Stan, S.Rosca si S.I.Rosca, "3rd International Conference of the Chemical Societies of the South Eastern European Countries", Bucharest, 2002, vol 1, 145.
7. D. Ciuculescu, "Preparare de compusi diarilmetanici prin sinteza combinatoriala" teza de dizertatie, UPB, 2002.
8. C. Ott, Teza de doctorat, UPB, în pregatire.
9. M.Chiper, Teza de doctorat, UPB, în pregatire
Faza pentru anul 2003: Reduceri enantioselective pe faza solida cu linker optic activ
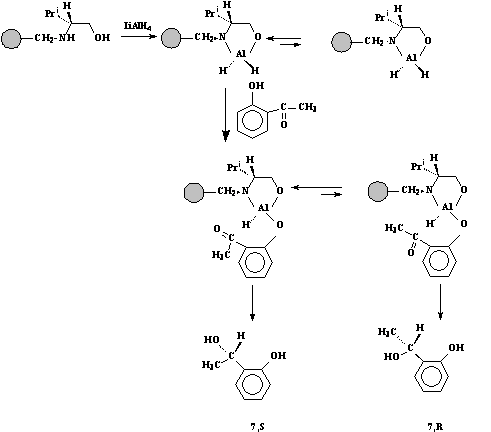
Pentru etapa pe anul 2003 a proiectului nostru a fost prevazuta sarcina de a realiza sinteze prin reactia de reducere enantioselectiva pe o faza solida cu linker optic activ. In acest scop, principiul de lucru adoptat este prezentat in Schema 1.
Schema cuprinde obtinerea fazei solide pentru reactia enantioselectiva prin atasarea la structura de polimer clorometilat a unui linker optic activ.Acesta este in cazul nostru un rest de L-valinol, optic activ rezultat prin cuplarea cu esterul L-valinei urmata de reducerea la L-valinol, cu LiAlH4. Pe faza solida astfel obtinuta se fixeaza apoi reactivul R1 care, in cazul de fata este hidroaluminatul de litiu. Pe noua faza solida astfel preparata se fixeaza al doilea reactiv, R2 constituit dintr-un compus carbonilic prochiral (cetona nesimetrica). In complexul rezultat are loc reactia de reducere a gruparii carbonil prin donorul de hidrura (Al-H). Datorita ambiantei chirotrope creata de atomul de carbon asimetric din L-valinol, este de asteptat ca reducerea sa fie enantioselectiva. Dupa ce reactia de reducere a avut loc se realizeaza detasarea de pe faza solida a produsului de reducere R1-R2 (in acest caz alcoolul secundar chiral corespunzator cetonei) printr-o simpla hidroliza care regenereaza totodata faza solida optic activa apta pentru un nou ciclu de reactii.
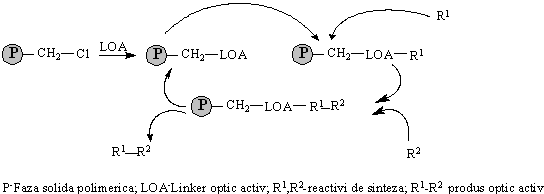
Schema 1
Obiectivele prevazute în planul de activitate pentru anul 2003
În conformitate cu Schema 1 obiectivele prevazute în "Planul de activitate" pentru anul 2003 au fost urmatoarele:
1. Obtinerea unei faze solide continând ca linker L-valinol.
2. Sinteza unor cetone utilizabile ca substrat pentru reduceri enantioselective.
3. . Reactia de reducere martor a cetonelor cu obtinere de produsi n varianta racemica
4. Reducerea enantioselectiva cu hidroaluminat de litiu fixat pe faza solida cu linker optic activ.
5. Încercari de scindare a unui amestec racemic pe faza solida cu linker optic activ
1. Obtinerea unei faze solide continând ca linker L-valinol
1.1 Sinteza fazei solide a fost realizata prin succesiunea de reactii din Schema 2.

Procedura implica utilizarea unei rasini comerciale având structura unui polimer clorometilat (1) si cuprine doua etape: condensarea cu esterul etilic al L-(+)-valinei care conduce la rasina modificata (2) urmata de reducerea gruparii esterice (cu Li Al H4) pentru a obtine faza solida pe care a fost grefat linkerul optic activ de L-valinol (3).
1.2 Caracterizarea rasinii clorometilate, 1 este facuta prin spectroscopie IR (una din putinele metode de analiza structurala aplicata în faza solida). Înregistrarea caracteristicilor spectrale este necesara pentru monitorizarea transformarilor realizate conform Schemei 2.
Spectrele IR au fost înregistrate pe un instrument Bruker Equinox- X 55 în pastila (KBr) si prezinta benzi caracteristice pentru structura de polistiren clorometilat:
Structura aromatica este reflectata de benzile datorate vibratiilor de întindere (valori în cm-1) νCH (3020-3040), vibratii de schelet (1438.9; 1508.9; 1580.2; 1601.8), vibratii de deformare (661.9; 1700-2000) iar restul alifatic prezinta benzi ale vibratiilor de întindere (2921.8; 2922.4) si de deformare (1465.2).
1.3 Condensarea L (+)-valinei cu faza solida a fost realizata pornind de la 2g rasina clorometilata 1 (cu un continut de 4,42 mmol Cl (g)) care a fost tratata cu un exces de L-(+)-valina (3 mmoli) în prezenta de bicarbonat de sodiu anhidru (6 mmoli) în THF (30ml). Reactia a fost efectuata la 65oC timp de 24 ore, cu agitare, produsul final fiind spalat succesiv cu THF, CH3OH si CH2Cl2 si uscat în vacuum.
Spectrul IR prezinta aparitia unor benzi caracteristice care confirma structura produsului 2 : 1734.08 cm-1 (νC=O); 3300 cm-1 (νNH);
1.4 Reducerea linkerului la structura deL-valinol, 3 a fost realizata prin tratarea rasinii 2 (0,5g, circa 0,45 mmol grupare de aminoester) cu un exces de LiAlH4 (50mg, 1,35 mmoli) în THF anhidru (30ml). Reactia a avut loc la temperatura camerei timp de 48 ore, sub atmosfera de argon. La sfârsit faza solida a fost filtrata, spalata succesiv cu THF, HCl dil, H2O, CH3OH si CH2Cl2 si apoi uscata în vacuum.
Spectrul IR arata o transformare completa (disparitia practic completa a benzii νC O de la 1734 cm-1 si aparitia unei benzi largi centrata la 3344 cm-1 (νC-OH asociat). Pe aceasta baza se poate evalua un randament de cca. 95-98% pentru reactia de reducere efectuata.
2.1 Alegerea substraturilor cetonice
Cetonele alese pentru a fi supuse unei reduceri enantioselective au fost 2-hidroxiacetofenona 4 si benzoina 5.
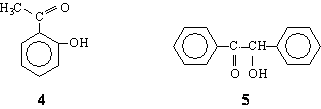
Alegerea s-a oprit asupra acestor structuri având în vedere urmatoarele criterii:
-Ambele cetone sunt nesimetrice (prochirale în raport cu reactia de reducere); compusul 5 posedând apriori un centru de chiralitate poate furniza informatii interesante referitor la diastereoselectivitatea rezultata din interactia acestuia cu centrul de chiralitate din L-valinol.
- Ambele cetone poseda o grupare OH capabila sa reactioneze cu legatura Al-H din reactivul de reducere aflat în faza solida (vezi mai departe). În acest fel, molecula de cetona este legata chimic de reactivul de reducere, marind constrângerea sterica (si, eventual, enantioselectivitatea).
2.2. Sinteza si caracterizarea 2-hidroxiacetofenonei, 4, a fost realizata prin succesiunea de reactii indicate n Schema 3 const nd n acetilarea fenolului urmata de o transpozitie Fries si separarea izomerului orto.
2.2.1. Acetatul de fenil a fost obtinut din 11,75g (0,125 moli) fenol n 80 mL solutie 10% de hidroxid de sodiu la care s-au adaugat 80g gheata si apoi 16,25g (0,16 moli) anhidrida acetica , agit nd viguros timp de 30 minute.

Dupa separarea produsului prin extractie cu cu CCl4, spalare, uscare si distilare s-a obtinut un produs cu p.f. 194oC (randament 78%).
2.2.2. 2-Hidroxiacetofenona, 4, a fost obtinuta prin ncalzirea acetatului de fenil cu AlCl3 (raport molar 1:1) la 165oC timp de 2 ore. Produsul este supus unei antrenari cu vapori (30 minute) iar din antrenat este extrasa 2-hidroxiacetofenona cu CH2Cl2; dupa uscare, ndepartarea solventului si distilare a fost obtinuta 2-hidroxiacetofenona 9p.f.93oC/13mmHg) cu un randament de 35%>
Spectrul 1H-RMN ( nregistrat pe un instrument Bruker Avance 400MHz n CDCl3; valorile d, ppm, cu TMS ca standard intern) : 2.59, s, 3H (COCH3); 6.95, dd (J=8.0; 1.2Hz), 1H, (H3); 7.44, td, (J=8.0; 1.2 Hz); 1H (H4); 6.87, td, (J=8.0; 1.2 Hz), 1H, (H5); 7.70, dd, (J=8.0; 1.2 Hz), 1H, (H6); 12.27, s, 1H, (OH).
Spectrul 13C-RMN: 26.0 (CH3); 204.5 (CO); 155.9 (C1); 162.2 (C2); 119.5 (C3); 130.6 (C4); 118.8 (C5); 155.9 (C6).
Spectrul IR (cm-1): 3012, 3047 (nCHarom dCharom nC-Carom nCH3 nC=O nC-O nOH asoc intramolec
2.3. Sinteza si caracterizarea benzoinei
Benzoina a fost obtinuta prin "condensarea benzoinica" a benzaldehidei catalizata de KCN. Din 10,6g (0,1moli) benzaldehida si 2g KCN , prin ncalzire, 30 minute n EtOH s-a obtinut benzoina cu un randament de 85%. Dupa recristalizare s-a obtinut un produs pur cu p.t. 137oC.
Asa cum se va arata mai departe (5.2) benzoina a dat o curioasa reactie de oxidare!! la benzil n prezenta de LiAlH4 astfel nc t nu a putut fi folosita pentru reducerea enantioselectiva n sistemul n faza solida
3. Reactia de reducere martor a cetonelor cu obtinere de produsi n varianta racemica
Pentru a stabili caracteristicile fizice (spectre RMN, SM, conditii de separare n sistem GC-SM) ale produsilor asteptati la reducerea cu LiAlH4 a cetonelor 4 si 5 au fost efectuate reactii de reducere cu LiAlH4 n sistem obsnuit (fara faza solida) cu formarea alcoolilor racemici. Datele spectrale obtinute sunt importante pentru identificarea ulterioara a produsilor de reducere enantioselectiva
3.1. Reducerea 2-hidroxiacetofenonei cu LiAlH4 a fost efectuata n THF sub atmosfera de argon la 0oC, utiliz nd un exces de LiAlH4 (raport molar 1:1) si un timp de reactie de 15 ore. Descompunerea produsului a fost efectuata cu o solutie 1M de NaOH urmata de acidulare atenta (HCl), extractie cu Et2O si evaporarea solventului. Produsul de reactie, 1-(2-hidroxifenil)etanol, 7, prezinta urmatoarele caracteristici spectrale:
1H-RMN: 1.54, d (J=6.4Hz), 3H, (CH3); 5.02, q (J=6.4Hz), 1H, (CH); 4.18, s, 1H (OH alcool); 6.82, d, (J=7.6 Hz), 1H, (H3); 7.13, t (J=7.6 Hz), 1H (H4); 6.81, t (J=7.6 Hz), 1H, (H5); 6.99, d (J=7.6 Hz), 1H (H6); 8.44, s, 1H, (OH fenol).
13C-RMN: 25.4 (CH3); 63.7 (CH); 128.5 (C1); 155.2 (C2); 115.3 (C3); 129.4 (C4); 119.9 (C5); 129.0 (C6).
SM: 138 (10.5) C8H10O2]+ ; 120 (100) C8H8O]+ ; 91 (89) C7H7+; 65 (15.2) C5H5+; 39 (13.0) C3H3+.
3.2. Reactia benzoinei ccu LiAlH4
Reactia benzoinei cu LiAlH4 a condus la produsi cu totul neasteptati- benzil si chiar acid benzoic . Acestia sugereaza , formal, ca n locul reducerii normal asteptate a avut loc o oxidare ( de fapt dehidrogenare). In aceste conditii benzoina a trebuit sa fie eliminata dintre candidatii pentru reducerea enantioselectiva. Rrocesul observat merita totusi atentie fiind o reactie neobisnuita , favorizata de formarea unui complex la atomul de aluminiu. Mecanismul acestei reactii noi, urmeaza sa fie studiat separat si iese din cadrul obiectivelor prezentului proiect.
4. Reducerea enantioselectiva cu reactiv de hidroaluminat de litiu
fixat pe faza solida cu linker optic activ
Reactiile care au loc sunt prezentate n Schema 4. Acestea constau n urmatoarele etape succesive:
4.1. - Fixarea hidroaluminatului de litiu pe faza solida cu linker L-valinol a cei obtinere a fost descrisa la punctul 3. Aceasta s-a realizat prin tratarea rasinii av nd ca linker L-valinol (3) (0,3g) cu LiAlH4 (3,27 mg, 0,8mmoli) la 0oC, n THF (10mL). Sistemul a fost lasat sub agitare si atmosfera de argon timp de 2 ore, la 0oC.
4.2. - Efectuarea reducerii enantuioselective a 2-hidroxiacetofenonei. La complexul rasina- LiAlH4 preparat mai sus s-a adaugat 2-hidroxiacetofenona (117 mg, 0,86 mmoli) si amestecul s-a agitat sub argon pentru nca 15 ore apoi s-a descompus cu NaOH, 10%, acidulat cu HCl 1M si extras cu Et2O. Dupa uscare si evaporare s-a obtinut produsul brut de reducere.
Schema 4
4.3. - Analiza compozitiei (structurala si enantiomerica ) a produsului de reducere a fost realizata prin nregistrarea spectrelor 1H-RMN si SM si compararea acestora cu cu datele nregistrate pe experimentul martor n varianta racemica (vezi 5.1).
Din spectrul 1H-RMN rezulta ca a avut loc o reducere la 1-(2-hidroxifenil)etanol (7) cu o conversie de 40%.
Din spectrul GC-SM nregistrat utiliz nd o coloana cromatografica optic activa rezulta formarea celor doi enantiomeri (picuri cromatografice la timpi de retentie diferiti dar av nd fragmentare perfect identica si care, deasemeni, coincide cu fragmentarea observata n experienta martor, 5.1.). Din datele cromatografice rezulta un exces enantiomeric de 18% dovedind mersul enantioselectiv al reactiei de reducere. Valoarea e.e. este sensibil mai mare dec t n cazul reducerii acetofenonei n conditii similare dovedind justetea presupunerii ca prin fixare chimica (cu grupa OH fenolica ) se obtine un control stereochimic mai avansat.
ncercarea de scindare a acidului ( )-mandelic pe faza solida optic activa
Profit nd de disponibilitatea unei faze solide optic active care contine o grupare bazica (3) a fost ncercata scindarea pe acest suport a unui amestec racemic de acid ( )-mandelic. In acest scop s-au amestecat o cantitate de rasina 3 corespunz nd unui continut de grupare bazica NH de 1,6 mmoli cu o solutie eterica contin nd 3.2 mmoli de acid ( )-mandelic (av nd c te 1,6 mmoli de din fiecare enantiomer R si S)> Dupa a o agitare de 6 ore rasina a fost filtrata , solutia eterica evaporata si rezidiul analizat polarimetric. Valoarea [a]D20 gasita indica un exces enantiomeric de 5%> Desi foarte redus, acest rezultat arata posibilitarea unei scindaricare poate fi simtitor mbunatatita daca se introduce un substituent alchil adecvat la atomul de azot pentru a evita structura achirala R1R2NH2+ a cationului rezultat n prezenta acidului mandelic si obtinerea unui cation de amoniu chiral R1R2R3NH+ mai eficient.
In concluzie toate obiectivele si activitatile prevazute n planul elaborat la contractarea proiectului au fost integral indeplinite.
Lucrarile efectuate n anul 2003 s-au concretizat ntr-o comunicare prezentata la o cionferint a internationala , un proiect de diploma 7, includerea n obiectivele unei teze de doctorat n curs de elaborare8 si urmeaza sa faca obiectul unei lucrari n curs de redactare9.
R.B.Merrifield, J.Amer.Chem.Soc., 1963, 85, 2149.
R.B.Merrifield, "Life During a Golden Age of Peptide Chemistry: The Concept and Development of Solid Phase Peptide Synthesis", ACS, Washington, 1993.
J.N.Abelson, "Combinatorial Chemistry", Academic Press, San Diego, 1996.
A.L.Marzinzik, E.R.Filder, Molecules, 1997, 2, 17.
G.Jung, "Combinatorial Chemistry: Synthesis, Analysis, Screening " Wiley-VCH, Weinheim, 1999.
C.Ott, D.Ciuculescu, F.Tutunea, S.I.Rosca, 13th Romanian International Conference on Chemistry and Chemical Engineering", Bucharest, 2003.
Florentina Tutunea, Proiect de diploma, UPB, 2003.
Eliza Ciuculescu, Teza de doctorat, ( n curs de elaborare).
C.Ott, S.Rosca, R.Stan, S.I.Rosca, Rev.Chimie (Bucuresti) n curs de publicare).
Faza unica pentru 2004 Dependenta enantioselectivitatii de natura radicalului alchil la reducerea 2-hidroxiaril-alchil- cetonelor
Obiectivul general al lucrarii
Proiectul de fata are drept obiectiv general elaborarea unei metode originale de sinteza enantioselectiva a alcoolilor 2-hidroxibenzilici optic activi, 1, prin reducerea stereoselectiva, în faza solida, a 2-hidroxiaril-alchil-cetonelor corespunzatoare, 2 (Schema 1).

Schema 1
In principiu aceasta reactie poate fi realizata cu ajutorul unui reactiv de reducere optic activ obtinut prin modificarea hidroaluminatului de litiu la complexarea cu un aminoalcool care contine un stereocentru (atom de carbon asimetric) cu configuratia controlata. Astfel de alcooli pot fi obtinuti convenabil prin reducerea unor aminoacizi naturali. Utilizarea complexului LiAlH4-aminoalcool pentru reducerea enantioselectiva a unor aril- alchil-cetone (de tipul acetofenonei) a condus la enantioselectivitati cu totul modeste (de regula , valori e.e. <5%) foarte probabil ca urmare a interactiunii slabe, exclusiv prin forte fizice între substrat si reactivul de reducere chiral. Ideea originala a prezentului proiect consta în introducerea în substratul prochiral (aril-alchil-cetona) a unei grupari acide, OH, într-o pozitie convenabila, astfel încât sa formeze o covalenta cu atomul de aluminiu si sa reduca entropia ansamblului reactiv cu consecinte favorabile pentru enantioselectivitate.
H-RMN

IR nC=O 1712 cm
Schema 6
1.3. Reducerea compusului 1.1 cu LiAlH4 a fost realizata conform Schemei 5 utilizând 1.06 g (3,12mmoli) compus 1.1 si 0,5g (13.1 mmoli) LiAlH4în 20mL eter anhidru si 20mL THF. Dupa un timp de reactie de 4 ore prelucrarea standard (descompunere cu solutie 15% NaOH) extractie solidului cu THF-Et2O, spalare, uscare si evaporarea solventului a condus la N-benzil valinol cu un randament de 55%.
H-RMN

IR nOH = 3200-3400 cm
Schema 7
1.5. Prepararea reactivului de reducere optic activ a fost realizata prin amestecarea la 0oC, sub argon, a 85mg (0,44mmoli) N-benzilvalinol cu 28mg (0,44mmoli) LiAlH4 în 8,5 mL THF si agitarea amestecului timp de 1 ora la 0oC si înca 2 ore la temperatura camerei. Acest reactiv a fost apoi imediat utilizat pentru reducerile enantioselective asa cum se va arata mai departe.
Sinteza 2-hidroxifenil-alchil-cetonelor
2.1. Sinteza clorurii de izobutiril a fost realizata prin încalzirea la reflux a unui amestec format din 14g (0,16 moli) acid izobutiric si 23,6g (0,2moli) clorura de tionil timp de 30 minute. Clorura de izobutiril a fost obtinuta cu un randament de 70% (fractiunea cu p.f. 90-93oC).
2.2. Sinteza acetatului si izobutiratului de fenil
Acetatul de fenil a fost obtinut prin acetilarea fenolului cu anhidrida acetica. Din 23,5 (0,25 moli) fenol dizolvat în 160mL solutie NaOH 10% si 175 gheata si 32,5g (0,31 moli) anhidrida acetica, s-a obtînut, dupa o agitare viguroasa timp de 5 minute urmata de extractie cu tetraclorura de carbon, spalare, uscare si evaporarea solventului urmata de distilare, un produs cu p.f. 194-197oC si randament 78%.
Izobutiratul de fenil a fost obtinut prin încalzirea blânda a unui amestec format din 9,4g (0,1moli) fenol, 11,1g (0,1moli) clorura de izobutiril. Dupa prelucrarea standard si distilare s-a obtinut izobutiratul de fenil (p.f. 80oC, randament 70%).
2.3. Sinteza 2-hidroxiacetofenonei si 2-hidroxifenil-izopropilcetonei a fost realizata prin transpozitie Fries a esterilor fenolici corespunzatori.
2-Hidroxiacetofenona a fost obtinuta prin tratarea acetatului de fenil (7,71g, 0,051moli) cu 8,5g (0,064 moli) clorura de aluminiu anhidra si încalzirea amestecului, treptat (30minute) pâna la 110-120oC când începe degajarea de acid clorhidric. Temperatura este apoi ridicata pâna la 160-165oC si mentinuta timp de 3 ore. Prelucrarea implica descompunerea cu ghiata a clorurii de aluminiu în exces, separarea produsului uleios si antrenarea cu vapori pentru a separa izomerul 2-hidroxiacetofenona. Dupa extractie cu clorura de metilen, uscare si distilare s-a obtinut un produs cu p.f. 130oC, cu randament de 32%.
2-Hidroxifenil-izopropil-cetona a fost obtinuta printr-o procedura similara celei de mai sus pornind de la 13,5g (0,08moli) izobutirat de fenil, 12,5g (0,09moli) clorura de aluminiu si 14mL sulfura de carbon. Amestecul este încalzit blând , pe baie de apa a poi sulfura de carbon este îndepartata prin distilare si finalmente amestecul de reactie se încalzeste la 140-150oC timp de 3 ore. Dupa descompunerea clorurii de aluminiu, solutia este alcalinizata pentru a îndeparta prin extractie componentele nefenolice iar din solutia alcalina se obtine prin acidulare, un compus uleios care dupa uscare se supune distilarii, obtinându-se 2-hidroxifenilizopropil-cetona cu un randament de 33%.
Planul de activitate asumat prin prezentul proiect a fost îndeplinit integral.
Modelarea teoretica a echilibrelor configurationale a permis reducerea sarcinilor experimentale evitând variatia substituentilor la atomul de azot.
Este pusa clar în evidenta influenta substituentului din grupa acil asupra echilibrului conformational care determina stereoselectivitatea.
Coroborarea ideilor de introducere a grupei OH din pozitia orto a nucleului aromatic (care permite fixarea prin covalenta a substratului de reactivul optic activ) cu cresterea cerintelor sterice ale substituentului din gruparea acil (care infleuenteaza echilibrul conformational determinant de enantioselectivitate) a permis o crestere gradata a enantioselectivitatii de la 2% la 40%.
Rezultatele obtinute prezinta interes si sub aspectul general privind proiectarea unei reactii si a unui sistem stereochimic pentru care se poate prevedea enantioselectivitatea prin metode teoretice.
|