Spectroscopie atomica
9.1 Date empirice referitoare la spectrle atomice
Studiile experimentale
legate de absorbtia si emisia radiatiei electromagnetice de catre atomii
diferitelor elemente chimice au avut un rol fundamental in procesul de elucidare
treptata a structurii atomilor. Inregistrare 414j93e a radiatiei emisa de atomii
diferitelor elemente aflate in stare de vapori sau in stare gazoasa, a condus
la concluzia ca aceasta radiatie nu este continua, in sensul ca nu contine unde
electromagnetice cu toate lungimile de unda cuprinse intr-un anumit domeniu,
suficient de larg, ci consta din linii spectrale inguste, corespunzatoare unor
lungimi de unda ![]() ,
bine determinate (fig.1). S-a stabilit treptat ca fiecare element prezinta un spectru
propriu de linii, care se poate obtine prin excitarea atomilor elementului
respectiv intr-o descarcare electrica in gaze, ca de exemplu descarcarea in
arc.
,
bine determinate (fig.1). S-a stabilit treptat ca fiecare element prezinta un spectru
propriu de linii, care se poate obtine prin excitarea atomilor elementului
respectiv intr-o descarcare electrica in gaze, ca de exemplu descarcarea in
arc.


Trebuie subliniat ca o linie
spectrala cu lungimea de unda ![]() nu este riguros monocromatica, ci contine unde
electromagnetice de diferite lungimi de unda, gupate in jurul unei valori
nu este riguros monocromatica, ci contine unde
electromagnetice de diferite lungimi de unda, gupate in jurul unei valori ![]() pentru care intensitatea
pentru care intensitatea ![]() a liniei respective are valoarea maxima.
a liniei respective are valoarea maxima.
Experimentele arata ca
spectrele atomice sunt foarte complicate, si analiza lor impune efectuarea unor
masuratori laborioase privind lungimile de unda ![]() si respectiv intensitatile
si respectiv intensitatile ![]() ale diferitelor linii spectrale. In urma
efectuarii unor astfel de masuratori de catre mai multe colective de cercetare
din intreaga lume, s-a ajuns ca in a doua jumatate a secolului al XIX-lea sa se
dispuna de un material experimental suficient de mare cu privire la spectrele
de emisie si de absorbtie ale atomilor diferitelor elemente.
ale diferitelor linii spectrale. In urma
efectuarii unor astfel de masuratori de catre mai multe colective de cercetare
din intreaga lume, s-a ajuns ca in a doua jumatate a secolului al XIX-lea sa se
dispuna de un material experimental suficient de mare cu privire la spectrele
de emisie si de absorbtie ale atomilor diferitelor elemente.
Prin spectrul unei radiatii
se intelege ansamblul lungimilor de unda ![]() sau al frecventelor
sau al frecventelor ![]() ale undelor electromagnetice monocromatice care
alcatuiesc radiatia respectiva, cu precizarea intensitatilor corespunzatoare
fiecarei lungimi de unda.
ale undelor electromagnetice monocromatice care
alcatuiesc radiatia respectiva, cu precizarea intensitatilor corespunzatoare
fiecarei lungimi de unda.
Totalitatea undelor electromagnetice
monocromatice emise de o sursa oarecare si inregistrate astfel incat intre
sursa si instrumentul spectral utilizat se afla un mediu transparent, formeaza spectrul de emisie al sursei respective.
Spectrele de emisie pot fi continue
sau discontinue (discrete). Intr-un spectru continuu radiatia electromagnetica inregistrata de spectrometru contine
unde electromagnetice avand toate lungimile de unda cuprinse intr-un interval
larg de lungimi de unda, ca de exemplu radiatia emisa de un corp solid aflat in
stare de incandescenta (fig.2). Intr-un spectru discontinuu (sau discret - de
linii sau benzi) apar numai anumite lungimi de unda, sub forma de radiatie monocromatica, sau sub forma de
benzi mult mai inguste decat in cazul unui  spectru continuu.
spectru continuu.
Experimentele au aratat ca la trecerea unui fascicul de lumina alba printr-o substanta oarecare, aflata sub forma de vapori sau gaz, o parte din liniile spectrale prezente in spectrul de emisie al atomilor respectivi sunt absorbite.
Ansamblul lungimilor de unda
![]() ale radiatiilor monocromatice incidente,
absorbite total sau partial de catre mediul considerat, constituie spectrul de absorbtie al mediului
considerat.
ale radiatiilor monocromatice incidente,
absorbite total sau partial de catre mediul considerat, constituie spectrul de absorbtie al mediului
considerat.
Deosebit de important este faptul ca spectrele de emisie si respectiv de absorbtie caracterizeaza in mod univoc o specie de atomi sau molecule. Nu este posibil ca substante constituite din atomi sau molecule diferite sa prezinte spectre identice de absorbtie sau emisie. De aici rezulta ca prin cunoasterea in detaliu a spectrelor de emisie si respectiv absorbtie pentru fiecare specie de atomi sau molecule se permite analiza spectrala a compozitiei diferitelor substante, iar acest fapt ce prezinta o importanta practica deosebita,. Probabil ca urmarind aceasta latura aplicativa, s-au depus eforturi sustinute in scopul stabilirii proprietatilor spectrale de emisie si absorbtie ale atomilor diferitelor elemente.
Elementul cu atomul cel mai
simplu, hidrogenul, a fost intens studiat din punctul de vedere al spectrelor
de emisie si absorbtie. Initial cercetarile se limitau la inregistrarea
diferitelor linii spectrale, masurandu-se cat mai precis lungimile de unda ![]() si intensitatile
si intensitatile ![]() ale liniilor respective. Pana in anul 1885 nu
se intrevedea nici o baza experimentala care sa conduca la calculul cu ajutorul
unei formule a diferitelor lungimi de unda
ale liniilor respective. Pana in anul 1885 nu
se intrevedea nici o baza experimentala care sa conduca la calculul cu ajutorul
unei formule a diferitelor lungimi de unda ![]() .
.
In anul 1885 fizicianul
elvetian Johann Iakob Balmer (1825-1885) a reusit sa stabileasca o formula
empirica care a permis calculul lungimilor de unda ![]() pentru toate liniile spectrale al spectrului
de emisie al atomului de hidrogen, in domeniul vizibil (3800-7600 Å):
pentru toate liniile spectrale al spectrului
de emisie al atomului de hidrogen, in domeniul vizibil (3800-7600 Å):
![]() Å (9.1)
Å (9.1)
Daca numarul intreg ![]() ia valorile
ia valorile ![]() se obtin cu foarte buna aproximatie lungimile
de unda ale liniilor spectrale din spectrul de emisie, in domeniul vizibil, al
atomilor de hidrogen.
se obtin cu foarte buna aproximatie lungimile
de unda ale liniilor spectrale din spectrul de emisie, in domeniul vizibil, al
atomilor de hidrogen.
Rydberg a propus scrierea formulei (9.1) sub forma:
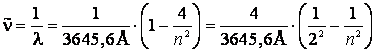 (9.2)
(9.2)
unde ![]() se numeste numar
de unda.
se numeste numar
de unda.
Introducand constanta lui Rydberg:
 (9.3)
(9.3)
formula (9.2) capata forma
 (9.4)
(9.4)
si este cunoscuta sub denumirea de formula lui Balmer.
Ansamblul liniilor spectrale
ale caror lungimi de unda (sau numere de unda) pot fi calculate cu ajutorul
unei formule adecvate, formeaza o serie
spectrala. Liniile spectrale ale caror lungimi de unda pot fi calculate
utilizand formula (9.4) pentru ![]() formeaza seria
Balmer a atomului de hidrogen.
formeaza seria
Balmer a atomului de hidrogen.
Mai tarziu au fost descoperite si alte serii spectrale ale atomului de hidrogen, in domeniile ultraviolet si infrarosu. Acestea au primit numele cercetatorilor care le-au identificat pentru prima data. S-a stabilit ca toate liniile spectrale ale seriilor atomului de hidrogen pot fi scrise sub forma:
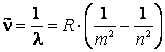 (9.5)
(9.5)
unde ![]() este un numar intreg ce ia o valoare data
pentru fiecare serie spectrala, astfel de exemplu pentru seria Balmer
este un numar intreg ce ia o valoare data
pentru fiecare serie spectrala, astfel de exemplu pentru seria Balmer ![]() .
.
Unei valori a lui ![]() ii corespunde o anumita serie spectrala, in
timp ce fiecare dintre valorile pe care le poate lua
ii corespunde o anumita serie spectrala, in
timp ce fiecare dintre valorile pe care le poate lua ![]() in interiorul unei serii spectrale precizate
defineste o linie spectrala in cadrul seriei respective. Pentru atomul de
hidrogen se cunosc urmatoarele serii spectrale, descoperite in anii indicati in
paranteze:
in interiorul unei serii spectrale precizate
defineste o linie spectrala in cadrul seriei respective. Pentru atomul de
hidrogen se cunosc urmatoarele serii spectrale, descoperite in anii indicati in
paranteze:
1. Seria Lyman (1905), situata in domeniul ultraviolet: ![]() ;
;
2. Seria Balmer (1885), situata in domeniul vizibil: ![]() ;
;
3. Seria Paschen (1908), in domeniul infrarosu: ![]() ;
;
4. Seria Bracket (1922), in domeniul infrarosu mediu: ![]() ;
;
5. Seria Pfund (1924), in domeniul infrarosu indepartat: ![]() ;
;
6. Seria Ritz ( ),
in infrarosu foarte indepartat: ![]() .
.
Aceste formule empirice, precum si bogatul material experimental privind spectrele diferitilor atomi, sunt fara indoiala de o inestimabila utilitate pentru studiul si interpretarea spectrelor atomice. Este clar insa ca structura interna a atomilor, care de fapt conditioneaza aceste spectre de linii, nu poate fi inteleasa pe baza datelor experimentale enuntate. Era necesara o idee fundamentala cu privire la mecanismul emisiei si respectiv absorbtiei de catre atomi, idee care sa permita obtinerea pe cale teoretica a formulei (9.5). Toate incercarile efectuate in acest sens, respectand cadrul fizicii clasice, au ramas fara rezultat.
Exemplul 1.
In spectrul atomului de hidrogen se cunosc trei linii spectrale (din aceeasi serie spectrala), care au lungimile de unda egale cu 97,26nm, 102,58nm si 121,57nm. Sa se determine, plecand de la aceste valori, lungimile de unda corespunzatoare altor trei linii spectrale dintr-o alta serie spectrala.
Rezolvare
Scriem (9.5) sub forma:
![]()
de unde se calculeaza ![]() ,
,
![]() si
si ![]() .
.
Pentru a identifica seria spectrala din care fac parte ![]() si
si ![]() calcula valorile expresiei
calcula valorile expresiei ![]() pentru diferite combinatii ale numerelor
intregi
pentru diferite combinatii ale numerelor
intregi ![]() si
si ![]() .
Pentru
.
Pentru ![]() si
si ![]() obtinem
obtinem ![]() .
.
Pentru ![]() si
si ![]() obtinem
obtinem ![]() .
.
Pentru ![]() si
si ![]() obtinem
obtinem ![]() .
.
Seria spectrala este deci seria lui Lyman ![]() ,
iar liniile
,
iar liniile ![]() si
si ![]() reprezinta, in aceasta ordine, primele trei
linii ale seriei, corespunzand valorilor lui
reprezinta, in aceasta ordine, primele trei
linii ale seriei, corespunzand valorilor lui ![]() egale cu 2, 3, si respectiv 4.
egale cu 2, 3, si respectiv 4.
Pentru a afla 3 linii
corespunzatoare din alta serie, consideram de exemplu seria lui Balmer ![]() ,
si luam pentru
,
si luam pentru ![]() valorile 3, 4, si respectiv 5. Scriind formula
lui Balmer pentru seria Lyman, respectiv seria Balmer si facand raportul
lungimilor de unda, obtinem:
valorile 3, 4, si respectiv 5. Scriind formula
lui Balmer pentru seria Lyman, respectiv seria Balmer si facand raportul
lungimilor de unda, obtinem:
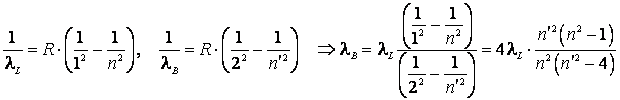 Luand
Luand ![]() si
si ![]() se obtine
se obtine ![]() .
.
Pentru ![]() si
si ![]() se obtine
se obtine ![]() .
.
Pentru ![]() si
si ![]() se obtine
se obtine ![]() .
.
Verifica calculele!
Exemplul 2
9.2 Teoria lui Bohr pentru atomii hidrogenoizi
9.2.1 Stabilitatea atomilor in cadrul electrodinamicii clasice
In anul 1911 fizicianul
englez Ernest Rutherford a inceput experimentele de imprastiere a particulelor ![]() pe foite metalice subtiri, care au condus la
clarificarea structurii atomului. Datele obtinute au confirmat asemanarea
dintre un atom si un sistem solar. Astfel, atomii sunt formati dintr-un nucleu
plasat in centrul atomului, in care este cuprinsa practic toata masa atomului.
Nucleul este incarcat cu sarcina electrica pozitiva, care intr-un atom neutru
este compensata de sarcina electrica negativa a electronilor, care poarta
fiecare o sarcina electrica negativa egala cu sarcina electrica elementara
pe foite metalice subtiri, care au condus la
clarificarea structurii atomului. Datele obtinute au confirmat asemanarea
dintre un atom si un sistem solar. Astfel, atomii sunt formati dintr-un nucleu
plasat in centrul atomului, in care este cuprinsa practic toata masa atomului.
Nucleul este incarcat cu sarcina electrica pozitiva, care intr-un atom neutru
este compensata de sarcina electrica negativa a electronilor, care poarta
fiecare o sarcina electrica negativa egala cu sarcina electrica elementara ![]() .
Electronii, in numar de
.
Electronii, in numar de ![]() (denumit numarul
de ordine al elementului din care face parte atomul), graviteaza in jurul
nucleului la fel cum planetele graviteaza in jurul Soarelui. Nu era insa clar
modul in care electronii graviteaza in jurul nucleului. Pe baza mecanicii
clasice, se impunea ca electronii sa se roteasca in jurul nucleului astfel
incat forta centrifuga sa fie echilibrata de forta coulombiana de atractie,
realizandu-se astfel un echilibru dinamic.
(denumit numarul
de ordine al elementului din care face parte atomul), graviteaza in jurul
nucleului la fel cum planetele graviteaza in jurul Soarelui. Nu era insa clar
modul in care electronii graviteaza in jurul nucleului. Pe baza mecanicii
clasice, se impunea ca electronii sa se roteasca in jurul nucleului astfel
incat forta centrifuga sa fie echilibrata de forta coulombiana de atractie,
realizandu-se astfel un echilibru dinamic.
Miscarea electronului in
jurul nucleului, fie ea circulara sau eliptica, conduce in mod obligatoriu la
existenta unei acceleratii ![]() pentru electron, fata de sistemul de referinta
legat de nucleu.
pentru electron, fata de sistemul de referinta
legat de nucleu.
Conform conceptelor
electrodinamicii clasice, orice purtator de sarcina electrica ![]() care se deplaseaza cu acceleratia
care se deplaseaza cu acceleratia ![]() constituie o sursa de radiatii
electromagnetice. Am aratat ca puterea radiatiei emise este data de formula :
constituie o sursa de radiatii
electromagnetice. Am aratat ca puterea radiatiei emise este data de formula :
![]() (9.6)
(9.6)
Conditia
de echilibru dinamic al electronului pe o orbita circulara de raza ![]() este data de relatia:
este data de relatia:
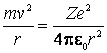 (9.7)
(9.7)
Energia cinetica necesara pentru ca electronul sa se deplaseze pe un cerc
de raza ![]() este:
este:
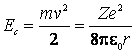 (9.8)
(9.8)
Acceleratia centripeta in miscarea circulara a electronului are expresia:
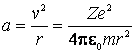 (9.9)
(9.9)
Introducand acceleratia din
(9.9) in (9.6) se obtine puterea radiatiei emise de electronul ce se roteste pe
un cerc de raza ![]() :
:
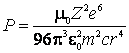 (9.10)
(9.10)
Energia electronului ar
trebui sa scada continuu ca urmare a generarii undelor electromagnetice de
putere ![]() .
Timpul
.
Timpul ![]() in care electronul isi pierde intreaga energie
in miscarea sa circulara poate fi calculat, intr-o prima aproximatie, dupa
formula:
in care electronul isi pierde intreaga energie
in miscarea sa circulara poate fi calculat, intr-o prima aproximatie, dupa
formula:
 (9.11)
(9.11)
In cazul atomului de hidrogen ![]() .
Introducand in (9.11) valorile constantelor
.
Introducand in (9.11) valorile constantelor ![]()
![]() se obtine:
se obtine:
![]()
Asadar, aplicand legile
electrodinamicii clasice in cazul atomului de hidrogen, ajungem la concluzii
care par absurde, fiind in contradictie totala cu datele experimentale.
Electronul ar trebui sa-si piarda intreaga sa energie intr-un timp ![]() ,
si sa se opreasca din miscarea sa orbitala. Fiind in repaus fata de nucleu,
electronul "va cadea" pe nucleu, si deci atomul nu mai exista.
,
si sa se opreasca din miscarea sa orbitala. Fiind in repaus fata de nucleu,
electronul "va cadea" pe nucleu, si deci atomul nu mai exista.
Datele experimentale arata insa ca atomii au o stabilitate extrem de mare in raport cu orice sistem macroscopic cunoscut.
Aceste rationamente ne conduc la concluzia certa ca in cadrul teoriei clasice nu putem ajunge la o descriere corecta a fenomenelor care au loc in atom.
9.2.2. Postulatele lui Bohr si cuantificarea energiei
Prima interpretare, satisfacatoare pentru acel timp, a fenomenelor la scara atomului, a fost data in anul 1913 de catre fizicianul danez Niels Henrik David Bohr (1885-1962). Cautand sa explice spectrele de linii ale atomilor de hidrogen observate experimental, Bohr a introdus doua postulate.
Postulatul intai afirma ca nu pot exista
decat acele orbite electronice pentru care momentul cinetic orbital al
electronului, in miscarea sa circulara in jurul nucleului, este un multiplu
intreg de ![]() ,
unde
,
unde ![]() iar
iar ![]() este constanta lui Planck:
este constanta lui Planck:
![]() (9.12)
(9.12)
unde ![]() este masa de repaus a electronului,
este masa de repaus a electronului, ![]() este viteza electronului pe orbita circulara
de raza
este viteza electronului pe orbita circulara
de raza ![]() ,
iar
,
iar ![]() este un numar natural, denumit numar cuantic principal.
este un numar natural, denumit numar cuantic principal.
Orbitele electronilor pentru care este satisfacuta conditia (9.12) se numesc orbite stationare, iar electronii care se deplaseaza pe aceste orbite nu pierd energie prin radiatie, desi poseda acceleratie centripeta. Astfel, Bohr contrazicea prin postulatul sau valabilitatea generala a electrodinamicii clasice, desi nu se cunostea motivul pentru care electronul nu emite energie prin radiatie, conform (9.6).
In continuare ne vom referi
numai la atomii hidrogenoizi, adica
acei atomi care contin pe ultimul nivel ocupat un singur electron, care se
roteste in jurul nucleului cu sarcina electrica ![]() .
Exemple de atomi hidrogenoizi:
.
Exemple de atomi hidrogenoizi: ![]() ionii de heliu
ionii de heliu ![]() ,
ionii de litiu
,
ionii de litiu ![]() etc.
etc.
Conditia de echilibru
dinamic pentru deplasarea electronului pe orbite circulare de raze ![]() este ca forta centrifuga sa fie egala in modul
si de sens contrar cu forta de atractie coulombiana dintre electron si nucleu:
este ca forta centrifuga sa fie egala in modul
si de sens contrar cu forta de atractie coulombiana dintre electron si nucleu:
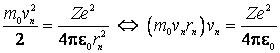 (9.13)
(9.13)
Inlocuind ![]() din (9.12) in (9.13), obtinem:
din (9.12) in (9.13), obtinem:
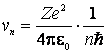 (9.14)
(9.14)
iar introducand ![]() din (9.14) in (9.12) obtinem:
din (9.14) in (9.12) obtinem:
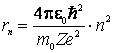 (9.15)
(9.15)
Din (9.14) se poate observa ca,
in cazul atomului de hidrogen ![]() ,
viteza pe prima orbita electronica reprezinta o fractiune din viteza luminii in
vid:
,
viteza pe prima orbita electronica reprezinta o fractiune din viteza luminii in
vid:

unde ![]() este o constanta universala, denimita constanta structurii fine. Intrucat
este o constanta universala, denimita constanta structurii fine. Intrucat ![]() nu poate fi considerata o viteza relativista,
iar vitezele pe orbitele superioare sunt mai mici decat
nu poate fi considerata o viteza relativista,
iar vitezele pe orbitele superioare sunt mai mici decat ![]() ,
se justifica folosirea formulelor clasice in teoria lui Bohr.
,
se justifica folosirea formulelor clasice in teoria lui Bohr.
Energia
totala a electronului aflat pe o orbita circulara de raza ![]() este:
este:
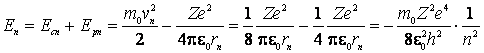 (9.16)
(9.16)
Semnul minus din fata energiei totale a atomilor hidrogenoizi semnifica faptul ca pentru indepartarea electronului de nucleu este necesar ca atomul sa primeasca energie din exterior.
Valoarea minima a energiei ![]() corespunde numarului cuantic principal
corespunde numarului cuantic principal ![]() .
Starea atomului de hidrogen de energie
.
Starea atomului de hidrogen de energie ![]() este stabila, fiind denumita si starea normala sau fundamentala. Daca
atomul primeste energie adecvata poate trece in diferite stari energetice
este stabila, fiind denumita si starea normala sau fundamentala. Daca
atomul primeste energie adecvata poate trece in diferite stari energetice ![]() ,
denumite stari excitate. Starile
excitate ale atomului nu sunt stabile, timpul lor de viata
,
denumite stari excitate. Starile
excitate ale atomului nu sunt stabile, timpul lor de viata ![]() fiind de ordinul
fiind de ordinul ![]() ,
dupa care atomul revine in starea fundamentala
,
dupa care atomul revine in starea fundamentala ![]() .
.
Din (9.16) se poate observa ca distanta
dintre doua nivele succesive scade atunci cand numarul cuantic principal ![]() creste:
creste:
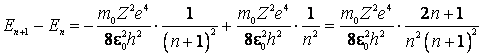 (9.17)
(9.17)
Pentru ![]() ,
astfel ca nivelele cu numerele cuantice cele mai mari practic se confunda intre
ele, si in aceasta zona energiile permise au o variatie aproape continua. In
fig.3 se reprezinta grafic, conform (9.16) si (9.17), nivelele de energie
permise intr-un atom de hidrogen intr-o scara a energiilor negative,
specificandu-se seriile si liniile spectrale ale hidrogenului.
,
astfel ca nivelele cu numerele cuantice cele mai mari practic se confunda intre
ele, si in aceasta zona energiile permise au o variatie aproape continua. In
fig.3 se reprezinta grafic, conform (9.16) si (9.17), nivelele de energie
permise intr-un atom de hidrogen intr-o scara a energiilor negative,
specificandu-se seriile si liniile spectrale ale hidrogenului.
In al doilea postulat, Bohr
stabileste ca in procesul de trecere a atomului dintr-o stare stationara de
energie ![]() intr-o alta stare stationara de energie
intr-o alta stare stationara de energie ![]() se emite (daca
se emite (daca ![]() )
un foton de energie:
)
un foton de energie:
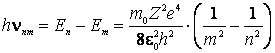 (9.18)
(9.18)
sau se absoarbe (daca ![]() )
un foton de energie:
)
un foton de energie:
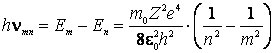 (9.18)'
(9.18)'
Daca inlocuim in (9.18) pe ![]() in functie de
in functie de ![]() dupa formula
dupa formula ![]() ,
pentru atomul de hidrogen
,
pentru atomul de hidrogen ![]() formula lui Bohr devine:
formula lui Bohr devine:
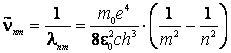 (9.19)
(9.19)


Identificand (9.5) cu (9.19) se obtine expresia teoretica a constantei lui Rydberg:
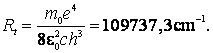 (9.20)
(9.20)
 Teoria lui Bohr fundamenteaza asadar formula empirica (9.5),
care este in concordanta cu datele experimentale referitoare la valorile
lungimilor de unda ale liniilor spectrale din spectrul atomilor de hidrogen.
Teoria lui Bohr fundamenteaza asadar formula empirica (9.5),
care este in concordanta cu datele experimentale referitoare la valorile
lungimilor de unda ale liniilor spectrale din spectrul atomilor de hidrogen.
Dupa cum constatam insa,
valoarea teoretica ![]() a constantei Rydberg este putin mai mare decat
valoarea experimentala care apare in formula lui Balmer (9.4). Aceasta
neconcordanta este din cauza ca pana acum s-a presupus numai miscarea
electronului in jurul nucleului, considerat in repaus. In realitate, atat
electronul, cat si nucleul se rotesc in jurul centrului lor de masa (fig.4).
a constantei Rydberg este putin mai mare decat
valoarea experimentala care apare in formula lui Balmer (9.4). Aceasta
neconcordanta este din cauza ca pana acum s-a presupus numai miscarea
electronului in jurul nucleului, considerat in repaus. In realitate, atat
electronul, cat si nucleul se rotesc in jurul centrului lor de masa (fig.4).
In aceasta situatie in primul postulat al lui Bohr va apare momentul cinetic total al sistemului:
![]() (9.21)
(9.21)
unde ![]() este masa de repaus a electronului,
este masa de repaus a electronului, ![]() este masa de repaus a nucleului, iar
este masa de repaus a nucleului, iar ![]() este viteza unghiulara, aceeasi atat pentru
electron, cat si pentru nucleu (protonul in cazul elementului hidrogen).
Pozitia centrului de masa al sistemului este data de relatiile:
este viteza unghiulara, aceeasi atat pentru
electron, cat si pentru nucleu (protonul in cazul elementului hidrogen).
Pozitia centrului de masa al sistemului este data de relatiile:
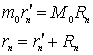 , (9.22)
, (9.22)
de unde se pot obtine simplu ![]() si
si ![]() in functie de
in functie de ![]() :
:
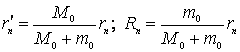 (9.23)
(9.23)
Inlocuind (9.23) in (9.21), obtinem:
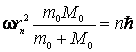 (9.24)
(9.24)
Conditia de echilibru se va scrie in acest caz sub forma:
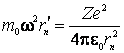 (9.25)
(9.25)
de unde inlocuind pe ![]() din (9.23), obtinem:
din (9.23), obtinem:
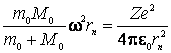 (9.26)
(9.26)
Introducand masa redusa a
sistemului electron-nucleu 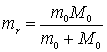 ,
relatiile (9.24) si (9.26) devin:
,
relatiile (9.24) si (9.26) devin:
 (9.27)
(9.27)
La fel cum am procedat, plecand de la postulatele lui Bohr, la deducerea expresiei energiei electronului si expresiei teoretice a constantei lui Rydberg in atomul de hidrogen, din (9.27) se obtine pentru atomii hidrogenoizi energia totala:
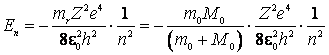 (9.28)
(9.28)
cat si expresia corectata a constantei lui Rydberg:
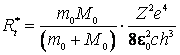 (9.28)
(9.28)
Pentru atomul de hidrogen ![]() si
si  ,
astfel ca valoarea constantei Rydberg va fi (9.20):
,
astfel ca valoarea constantei Rydberg va fi (9.20):
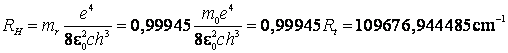 (9.29)
(9.29)
Aceasta formula conduce la valori in concordanta cu datele experimentale.
Din (9.28) se observa ca
valoarea constantei Rydberg depinde si de masa electronului ![]() ,
si de masa nucleului
,
si de masa nucleului ![]() .
Pe baza acestei dependente a fost descoperit, prin analiza spectrala, izotopul
hidrogenului numit deuteriu.
.
Pe baza acestei dependente a fost descoperit, prin analiza spectrala, izotopul
hidrogenului numit deuteriu.
Teoria lui Bohr a permis exprimarea constantei empirice a lui Rydberg prin constantele fundamentale cunoscute in fizica teoretica. Cu toate acestea, astazi teoria lui Bohr prezinta o importanta mai ales din punct de vedere didactic, datorita intuitivitatii sale. Intr-adevar, seriile spectrale ale atomului de hidrogen capata in teoria lui Bohr o interpretare deosebit de intuitiva (fig.5).
Din (9.5) reiese faptul ca in cadrul fiecarei serii spectrale exista o
lungime de unda maxima ![]() si o lungime de unda minima
si o lungime de unda minima ![]() ,
diferenta dintre acestea definind largimea
seriei spectrale. De exemplu, in cazul seriei Balmer, pentru
,
diferenta dintre acestea definind largimea
seriei spectrale. De exemplu, in cazul seriei Balmer, pentru ![]() se obtine
se obtine ![]() ,
iar pentru
,
iar pentru ![]() se obtine
se obtine ![]() .
Astfel, largimea seriei Balmer va fi:
.
Astfel, largimea seriei Balmer va fi:
![]() (9.30)
(9.30)
Cu toate succesele obtinute in cazul atomului de hidrogen, teoria lui Bohr prezinta o serie de neajunsuri fundamentale.
In primul rand, aceasta teorie are un caracter semiclasic, in sensul ca propune o cuantificare a momentului cinetic orbital, insa legile de miscare ale electronului in atom raman cele din mecanica clasica.
In al doilea rand, cu ajutorul teoriei lui Bohr se pot obtine informatii referitoare la lungimile de unda ale liniilor diferitelor serii spectrale, nu insa si despre intensitatile acestor linii spectrale.
In al treilea rand se constata ca teoria lui Bohr nu este adecvata in cazul atomilor cu mai multi electroni. Chiar in cazul atomilor de heliu, care contin numai doi electroni, aceasta teorie nu este aplicabila. Incercarile efectuate de alti fizicieni, in special de Arnold Sommerfeld (1868-1951) de a dezvolta teoria lui Bohr nu numai ca inlatura neajunsurile mentionate, dar le si accentueaza.
Exemplul 3
Cu izotopii hidrogenului
Exemplul 4
Cu efect Compton si teoria Bohr
9.2.3 Confirmarea experimentala a teoriei lui Bohr. Experimentul lui Frank si Hertz
9.3 Spectre de raze X
Fizicianul german Wilhelm Conrad Röntgen (1845-1923) a descoperit, in anul 1895, ca in urma ciocnirii unor electroni rapizi cu peretele de sticla al unui tub sau cu un anticatod plasat special in acest scop, apare o radiatie, inca necunoscuta, caracterizata printr-o putere de patrundere foarte mare. Fiind o radiatie necunoscuta, a fost numita radiatie X. Cercetarile au aratat ca radiatia Röntgen se propaga liniar in campuri electrice si magnetice, trece usor prin substante netransparente si produce innegrirea placilor fotografice. Cu cat tensiunea de accelerare a electronilor este mai mare, cu atat mai mare este puterea de patrundere sau duritatea radiatiilor rezultate. Intensitatea radiatiei X este proportionala cu numarul electronilor incidenti pe anticatod.
Datele experimentale au
confirmat natura electromagnetica a radiatie X. Faptul ca radiatia X este
neglijabila s-a explicat prin faptul ca lungimea lor de unda este foarte mica
(mai mica decat lungimea de unda a radiatiei din domeniul ultraviolet).
Indicele de refractie ![]() scade o data cu micsorarea lungimii de unda
scade o data cu micsorarea lungimii de unda ![]() ,
ajungand la valoarea
,
ajungand la valoarea ![]() pentru radiatia X, ceea ce explica propagarea
rectilinie a acestei radiatii prin diferite substante.
pentru radiatia X, ceea ce explica propagarea
rectilinie a acestei radiatii prin diferite substante.
Conform teoriei electromagnetice, purtatorii de sarcina electrica care se deplaseaza accelerat genereaza unde electromagnetice. Este evident ca electronii rapizi oprindu-se practic instantaneu in materialul anticatodului, vor suferi o acceleratie de franare puternica, devenind astfel surse de unde electromagnetice.
Radiatia X emisa de electronii care, patrunzand in anticatod sunt franati in campul creat de atomii anticatodului, are un spectru continuu si se numeste radiatie de franare (Bremsstrahlung in limba germana).
In fig.5 se indica schema
unui tub de raze X. Catodul incalzit emite electroni ca urmare a efectului de
emisie termoelectronica. Intre catod si anticatod se mentine o diferenta mare
de potential ![]() care accelereaza electronii spre anticatod.
Planul anticatodului face un unghi cu directia de miscare a electronilor, iar
radiatia X emisa iese in afara tubului vidat.
care accelereaza electronii spre anticatod.
Planul anticatodului face un unghi cu directia de miscare a electronilor, iar
radiatia X emisa iese in afara tubului vidat.


S-a aratat ca intensitatea
radiatiei electromagnetice generata de un purtator de sarcina electrica ce se
deplaseaza cu acceleratia ![]() este proportionala cu
este proportionala cu ![]() .
Cand un electron cu sarcina electrica
.
Cand un electron cu sarcina electrica ![]() si masa
si masa ![]() se apropie de un nucleu cu sarcina electrica
se apropie de un nucleu cu sarcina electrica ![]() ,
ia nastere o forta coulombiana
,
ia nastere o forta coulombiana 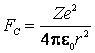 care
imprima electronului acceleratia
care
imprima electronului acceleratia  .
Intensitatea radiatiei X de franare va fi:
.
Intensitatea radiatiei X de franare va fi:
 (9.31)
(9.31)
Din (9.31) se poate observa
cum cresterea numarului de ordine ![]() al substantei din care este confectionat
anticatodul favorizeaza emisia radiatiei X cu spectru continuu.
al substantei din care este confectionat
anticatodul favorizeaza emisia radiatiei X cu spectru continuu.
Majoritatea electronilor care cad pe anticatod isi consuma energia ca urmare a unui numar foarte mare de ciocniri, si nu intr-un singur act de interactiune. Energia acestor electroni se transforma in caldura, conducand astfel la cresterea temperaturii anticatodului si la necesitatea de a se lua masuri speciale de disipare a caldurii (racire).
Numai un mic numar de electroni pierd cea mai mare parte a energiei acumulate prin accelerare intr-un singur act de franare, in campul nucleelor din atomii anticatodului. Aceasta energie pierduta intr-un singur act de ciocnire determina aparitia radiatiei X de franare.
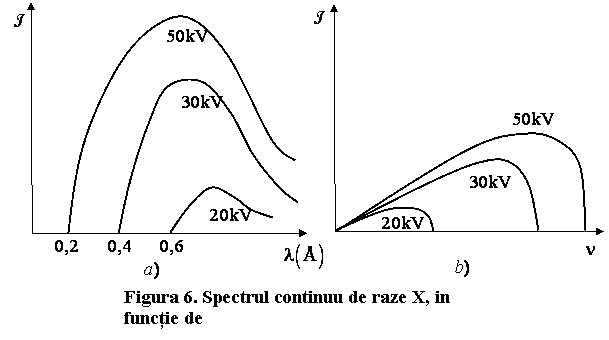
Remarcam ca generarea radiatiei X de franare este un fel de efect fotoelectric invers. In cazul efectului fotoelectric energia unui foton se transfera in energia unui electron, in timp ce in procesul de generare a radiatiei X de franare energia unui electron este transferata, total ori partial, in energia unui foton. De aici rezulta existenta unei limite nete a spectrului de raze X de franare spre lungimile de unda mai mici, respectiv spre frecvente inalte, concluzie confirmata de datele experimentale (fig.6a si 6b)

Energia cinetica acumulata de electron pana in momentul atingerii anticatodului este:
![]() (9.32)
(9.32)
Deoarece tensiunea de
accelerare ![]() este de ordinul
este de ordinul ![]() ,
iar lucrul mecanic de extractie pentru materialele anticatodului este de numai
cativa
,
iar lucrul mecanic de extractie pentru materialele anticatodului este de numai
cativa ![]() ,
se poate considera ca energia (9.32) este cheltuita pentru generarea unui foton
cu lungimea de unda minima
,
se poate considera ca energia (9.32) este cheltuita pentru generarea unui foton
cu lungimea de unda minima ![]() ,
respectiv frecventa maxima
,
respectiv frecventa maxima ![]() :
:
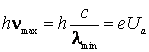 (9.33)
(9.33)
de unde
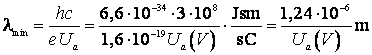 (9.34)
(9.34)
Formula (9.34) este in totala concordanta cu datele experimentale, furnizand la timpul respectiv cea mai precisa metoda experimentala pentru determinarea valorii constantei lui Planck.
Spectrul continuu (sau alb) al radiatiei X de franare se explica prin faptul ca nu toti electronii incidenti pe anticatod isi transfera in intregime energia cinetica initiala in fotoni.
Experimentele arata ca
lungimea de unda ![]() ,
respectiv frecventa
,
respectiv frecventa![]() din
spectrul continuu de radiatii X, nu depind de natura anticatodului. La
cresterea numarului de ordine
din
spectrul continuu de radiatii X, nu depind de natura anticatodului. La
cresterea numarului de ordine ![]() al anticatodului creste numai intensitatea
radiatiei X emise, conform (9.31).
al anticatodului creste numai intensitatea
radiatiei X emise, conform (9.31).
In general se foloseste o tensiune
de accelerare ![]() ,
ceea ce corespunde la o lungime de unda minima
,
ceea ce corespunde la o lungime de unda minima ![]() ,
respectiv o frecventa maxima
,
respectiv o frecventa maxima ![]() .
.
Experimental s-a constatat
ca spectrul continuu de radiatii X este insotit de un spectru discret, cu linii
separate intre ele si nete. In fig.7 este reprezentat cu aproximatie spectrul
de raze X care apare in urma bombardarii unui anticatod de molibden cu
electroni accelerati la o tensiune ![]() .
.
Spectrul de linii este caracteristic pentru elementul din care este confectionat anticatodul, si de aceea se numeste spectru caracteristic de raze X.
Particularitatea spectrelor carscteristice consta in faptul ca atomii fiecarui element chimic, indiferent de combinatia chimica in care se gasesc acestia, prezinta un spectru discret de raze X perfect determinat. In acest sens apare o deosebire esentiala intre spectrele optice ale atomilor si spectrele lor caracteristice de raze X. Spectrele optice ale atomilor depind de faptul daca atomii sunt liberi sau intr-o combinatie chimica oarecare. Aceasta deosebire rezulta din faptul ca spectrele optice sunt determinate de tranzitiile cuantice ale electronilor periferici, numiti si electroni de valenta. La formarea unei combinatii chimice intre atomi starile cuantice ale electronilor de valenta se modifica, influentand spectrele optice ale acestora.


Faptul ca spectrele caracteristice de raze X reprezinta proprietati individuale ale atomilor si nu se modifica la formarea de combinatii chimice intre atomi arata ca radiatia X caracteristica apare in urma unor procese care au loc in paturile interioare ale atomului, care nu sunt afectate de combinatia chimica respectiva.
In concluzie, spectrul caracteristic de raze X depinde in mod esential de natura anticatodului, aparand numai daca electronii incidenti depasesc o anumita energie specifica elementului chimic din care este construit anticatodul. Acest spectru este produs prin excitarea electronilor situati pe paturile electronice interioare ale atomilor, cele mai apropiate de nucleu.
In timp ce spectrele optice
se modifica sensibil prin trecerea de la un element la altul, spectrele de raze
X caracteristice ale tuturor elementelor sunt alcatuite dintr-un numar redus de
linii spectrale, care prezinta aproximativ aceeasi structura, indiferent de
elementul chimic la care se refera. Absenta periodicitatii in schimbarea
spectrelor de raze X la variatia numarului de ordine ![]() al
materialului anticatodului dovedeste faptul ca spectrele de raze X se formeaza
in paturile inferioare ale atomilor.
al
materialului anticatodului dovedeste faptul ca spectrele de raze X se formeaza
in paturile inferioare ale atomilor.
Daca unul din electronii
aflati pe patura ![]() este scos in afara atomului in urma ciocnirii
atomului cu un electron foarte rapid, atunci locul din patura
este scos in afara atomului in urma ciocnirii
atomului cu un electron foarte rapid, atunci locul din patura ![]() ramanand liber, va fi ocupat de unul din
electronii de pe paturile
ramanand liber, va fi ocupat de unul din
electronii de pe paturile ![]() In procesul acestor tranzitii apare radiatia X
caracteristica (fig.8).
In procesul acestor tranzitii apare radiatia X
caracteristica (fig.8).
Trecerea unui electron din
patura ![]() in patura K este insotita de ramanerea unui
loc liber in patura L, care va fi ocupat prin trecerea in patura L a unui
electron de pe paturile M, N, s.a.m.d.
in patura K este insotita de ramanerea unui
loc liber in patura L, care va fi ocupat prin trecerea in patura L a unui
electron de pe paturile M, N, s.a.m.d.
Radiatiile X caracteristice sunt
grupate in serii ce apartin unor domenii de frecvente, respectiv lungimi de
unda distincte. Toate liniile spectrale care rezulta ca urmare a trecerii
electronului de pe paturile L, M, N, pe patura ![]() ,
conform fig.8. Trecerea electronilor de pe paturile superioare M, N, O,. pe
pastura L conduce la formarea seriei L de raze X caracteristice s.a.m.d.
Aparitia seriei L (si a urmatoarelor serii L, M,.) nu este conditionata de
aparitia seriei K. Daca electronul incident pe anticatod nu are energia
necesara pentru scoaterea din atom a unui electron aflat pe patura L sau M etc.
,
conform fig.8. Trecerea electronilor de pe paturile superioare M, N, O,. pe
pastura L conduce la formarea seriei L de raze X caracteristice s.a.m.d.
Aparitia seriei L (si a urmatoarelor serii L, M,.) nu este conditionata de
aparitia seriei K. Daca electronul incident pe anticatod nu are energia
necesara pentru scoaterea din atom a unui electron aflat pe patura L sau M etc.


Conditia pentru aparitia radiatiei X caracteristice corespunzatoare seriei K este ca energia cinetica a electronului incident sa fie superioara energiei de legatura a electronului in patura K.
Fizicianul englez Henry
Moseley (1887-1915) a stabilit in anul 1913 o relatie simpla intre numerele de
unda ![]() ale liniilor spectrale de raze X caracteristice
si numarul de ordine
ale liniilor spectrale de raze X caracteristice
si numarul de ordine ![]() al elementului din care este construit
anticatodul:
al elementului din care este construit
anticatodul:
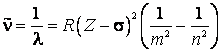 (9.35)
(9.35)
unde ![]() este constanta lui Rydberg, iar
este constanta lui Rydberg, iar ![]() este o constanta de ecranare. Pentru liniile
spectrale de tip
este o constanta de ecranare. Pentru liniile
spectrale de tip ![]() ,
,
![]() si
si ![]() ,
iar
,
iar ![]() se considera egala cu 1:
se considera egala cu 1:
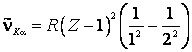 (9.36)
(9.36)
Aparitia termenului ![]() se datoreste ecranarii nucleului de sarcina
electrica
se datoreste ecranarii nucleului de sarcina
electrica ![]() de catre singurul electron care a mai ramas in
patura K dupa scoaterea celuilalt electron in urma ciocnirii atomului.
de catre singurul electron care a mai ramas in
patura K dupa scoaterea celuilalt electron in urma ciocnirii atomului.
Formula (9.36) poate fi scrisa si sub forma:
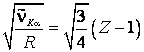 (9.37)
(9.37)
In general, legea lui Moseley (9.35) poate fi scrisa sub forma:
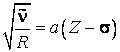 (9.38)
(9.38)
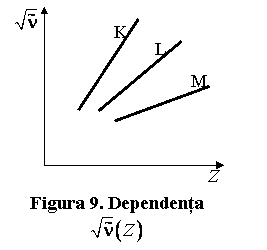 unde
unde ![]() si
si ![]() sunt constante ce caracterizeaza atat seria de
linii a radiatiei X, cat si elementul
din care este construit anticatodul. Dependenta liniara a marimii
sunt constante ce caracterizeaza atat seria de
linii a radiatiei X, cat si elementul
din care este construit anticatodul. Dependenta liniara a marimii ![]() de
de ![]() este verificata experimental (fig.9).
este verificata experimental (fig.9).
Legea lui Moseley a permis,
la timpul respectiv, masurarea numarului de ordine ![]() ,
contribuind astfel la dovedirea valabilitatii modelului nuclear al atomului si
a teoriei sistemului periodic al elementelor.
,
contribuind astfel la dovedirea valabilitatii modelului nuclear al atomului si
a teoriei sistemului periodic al elementelor.
Se constata ca dreptele lui Moseley nu prezinta o periodicitate compatibila cu cea din sistemul lui Mendeleev, ceea ce confirma ipoteza ca electronii interiori ai atomilor formeaza paturi analoage pentru toate elementele si ca numai proprietatile fizice si chimice, determinate de electronii periferici de valenta, prezinta periodicitate.
9.4 Difractia radiatiei X. Formula lui Bragg
In spectroscopia de raze X
se foloseste drept unitate de lungime pentru indicarea lungimii de unda ![]() unitatea X:
unitatea X:
![]()
Intrucat lungimile de unda ale radiatiilor X sunt foarte mici, de ordinul catorva unitati X, nu se pot utiliza pentru masurarea acestor lungimi de unda metodele optice obisnuite de difractie.
In anul 1912 fizicianul german Max von Laue (1879-1960) a sesizat ca structura periodica a cristalelor poate constitui o "retea de difractie" adecvata pentru studiul radiatiei X. Descoperirea difractiei radiatiei X prin cristale a condus la elaborarea metodelor de analiza röntgenografica a structurii cristaline a substantelor.
Mecanismul imprastierii
radiatiei X pe atomii cristalului este relativ simplu. In campul electric
variabil in timp al undei electromagnetice incidente de frecventa ![]() atomii devin dipoli electrici, cu momentul
electric de dipol variabil in timp cu frecventa
atomii devin dipoli electrici, cu momentul
electric de dipol variabil in timp cu frecventa ![]() .
Astfel, o parte din energia undei incidente este cheltuita pentru formarea dipolilor
electrici oscilanti si in consecinta intensitatea undei scade in mod
corespunzator. La randul lor insa, dipolii electrici oscilanti genereaza unde
electromagnetice de frecventa
.
Astfel, o parte din energia undei incidente este cheltuita pentru formarea dipolilor
electrici oscilanti si in consecinta intensitatea undei scade in mod
corespunzator. La randul lor insa, dipolii electrici oscilanti genereaza unde
electromagnetice de frecventa ![]() .
Aceste unde secundare se propaga practic in toate directiilecu exceptia
directiei axei dipolului oscilant. Daca unda incidenta pe sistemul de atomi din
cristal este nepolarizata, radiatia secundara este izotropa, propagandu-se
uniform in toate directiile. Fronturile undelor secundare emise de fiecare
dipol oscilant sunt sferice, si nu plane ca in cazul undelor incidente.
.
Aceste unde secundare se propaga practic in toate directiilecu exceptia
directiei axei dipolului oscilant. Daca unda incidenta pe sistemul de atomi din
cristal este nepolarizata, radiatia secundara este izotropa, propagandu-se
uniform in toate directiile. Fronturile undelor secundare emise de fiecare
dipol oscilant sunt sferice, si nu plane ca in cazul undelor incidente.
Asadar, procesul de difuzie
a radiatiei X consta in absorbtia de catre atomii cristalului a undelor plane
incidente si in emisia de unde sferice de frecventa ![]() ,
de catre fiecare atom sau centru difuzant.
,
de catre fiecare atom sau centru difuzant.
Un fascicul monocromatic de raze X este difuzat in interiorul cristalului in toate directiile. Datorita aranjarii periodice a atomilor in cristal, undele difractate de acestia pot produce interferenta, astfel ca pe anumite directii intensitatea undei este maxima, iar in alte directii este minima. Din fig.10 rezulta conditiile care se impun pentru ca intensitatea undei sa fie maxima.

Fasciculul paralel de raze X
trece prin apropierea atomului A din primul plan cristalin, si respectiv pe
langa atomul B din al doilea plan cristalin. Fiecare atom difuzeaza o parte din
fascicul in toate directiile. Interferenta constructiva, care conduce la
intensitatea maxima a radiatiei, are loc numai pentru razele difuzate paralel,
si pentru care diferenta de drum optic CB+BD este egala cu ![]() Daca
Daca ![]() este constanta retelei, mai precis distanta
dintre planele atomice considerate, din fig.10 rezulta:
este constanta retelei, mai precis distanta
dintre planele atomice considerate, din fig.10 rezulta:
![]() (9.39)
(9.39)
Astfel, pentru obtinerea unui maxim al intensitatii se impune conditia:
![]() (9.40)
(9.40)
cunoscuta sub numele de formula lui Bragg.
Din formula lui Bragg
rezulta ca daca asupra cristalului se trimite un fascicul de radiatie X de
diferite lungimi de unda, pe o directie determinata de unghiul ![]() se observa un maxim de intensitate pentru acea
lungime de unda care verifica relatia (9.40). Numarul intreg
se observa un maxim de intensitate pentru acea
lungime de unda care verifica relatia (9.40). Numarul intreg ![]() reprezinta ordinul
de difractie. Cunoscand lungimea de unda
reprezinta ordinul
de difractie. Cunoscand lungimea de unda ![]() a radiatiei incidente si masurand unghiul
a radiatiei incidente si masurand unghiul ![]() ,
din (9.40) se poate calcula distanta dintre planele cristaline.
,
din (9.40) se poate calcula distanta dintre planele cristaline.
O schema tipica a unui spectrometru de raze X care functioneaza dupa metoda lui Bragg este prezentata in fig.11.


Pentru cristale cu celula
elementara cubica, asa cum este sarea gema clorura de natriu) constanta retelei
poate fi calculata dupa cum urmeaza. O molecula gram de NaCl are masa de
58,454g, continand un numar de molecule egal cu numarul lui Avogadro ![]() ,
astfel ca numarul de ioni de
,
astfel ca numarul de ioni de ![]() si
si ![]() va fi
va fi ![]() .
In varfurilecubului elementar al cristalului de NaCl se afla ioni de
.
In varfurilecubului elementar al cristalului de NaCl se afla ioni de ![]() si
si ![]() .
Daca lungimeamuchiei celulei este
.
Daca lungimeamuchiei celulei este ![]() ,
volumul este
,
volumul este ![]() ,
iar volumul total al unei molecule-gram ce contine
,
iar volumul total al unei molecule-gram ce contine ![]() ioni va fi:
ioni va fi:
![]() (9.41)
(9.41)
La numitor apare 8 deoarece intr-un cristal cu retea cubica fiecare ion apartine la opt cuburi invecinate. Pe de alta parte, volumul unui mol de NaCl este:
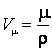 (9.42)
(9.42)
unde ![]() este densitatea cristalului. Din (9.42) si (9.41)
se obtine:
este densitatea cristalului. Din (9.42) si (9.41)
se obtine:
 (9.41)
(9.41)
Determinarea precisa a constantei
retelei si deci a lungimii de unda prin metoda Bragg depinde de precizia cu
care este cunoscut ![]() .
.
Exemplul 5
Daca tensiunea aplicata unui tub de raze X creste de la valoarea ![]() la valoarea
la valoarea ![]() ,
intervalul de lungimi de unda dintre radiatia
,
intervalul de lungimi de unda dintre radiatia ![]() si limita dinspre unde scurte creste de 3 ori.
Sa se determine numarul de ordine al elementului din care este confectionat
anticatodul tubului.
si limita dinspre unde scurte creste de 3 ori.
Sa se determine numarul de ordine al elementului din care este confectionat
anticatodul tubului.
Rezolvare
Din conditia problemei:
![]()
folosind (9.33) si (9.36), obtinem ecuatia:

de unde ![]()
Exemplul 6
Pentru un element cu numarul
de ordine ![]() frecventa unei anumite linii din spectrul
caracteristic de raze X al acestui element este
frecventa unei anumite linii din spectrul
caracteristic de raze X al acestui element este ![]() ,
iar pentru un element cu numarul de ordine
,
iar pentru un element cu numarul de ordine ![]() frecventa aceleasi linii este
frecventa aceleasi linii este ![]() .
Sa se determine frecventa acestei linii pentru un element cu numarul de ordine
.
Sa se determine frecventa acestei linii pentru un element cu numarul de ordine ![]() .
.
Rezolvare
Se particularizeaza legea
lui Moseley (9.35) pentru trei elemente. Deoarece expresia  este identica pentru cele trei elemente,
apartinand aceleasi linii spectrale, eliminam aceasta expresie din sistemul celor trei ecuatii. Din sistemul
celor doua ecuatii care rezulta eliminam
este identica pentru cele trei elemente,
apartinand aceleasi linii spectrale, eliminam aceasta expresie din sistemul celor trei ecuatii. Din sistemul
celor doua ecuatii care rezulta eliminam ![]() ,
obtinand in final:
,
obtinand in final:
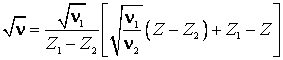
|